Angiotensin II reseptor uttrykk og forhold til Helicobacter pylori
-infection i magen av den mongolske hamsteren
Abstract
Bakgrunn
rollen av renin-angiotensin-systemet i mage fysiologi og sykdom har hittil vært tynt utforsket. Det første målet med studien var å undersøke grunnlinjen tilstedeværelse og plassering av angiotensin II-reseptorer (AT1R og AT2R) i magen av den mongolske hamsteren. Et annet mål var å belyse hvorvidt nærværet av Helicobacter pylori-infeksjon
er assosiert med endringer i ekspresjonen av disse reseptorene. Metoder
H. pylori
-negativ og H. pylori-
smittet (stamme SS1 eller TN2GF4) mannlige mongolske ørkenrotte ble undersøkt. Magesekkene ble undersøkt ved seks eller 12 måneder etter inokulering ved anvendelse av immunhistokjemi, western blot og mikroskopisk morfometri.
Resultater
AT1R og AT2R ble plassert i en rekke celler i gerbil gastriske vegg, blant annet en subpopulasjon av endokrine celler i antrum slimhinnen og betennelsesceller infiltrere H. pylori
-infected mager. Gerbils infisert med SS1 belastningen viste en signifikant økt antrum AT1R protein uttrykk og et økt antall infiltrere polymorfonukleære leukocytter (PMN) ved 12 måneder. Den AT1R proteinekspresjon korrelert med antallet av PMNs og antral ekspresjon av myeloperoxydase.
Konklusjoner
angiotensin II-reseptorer er tilstede i en rekke celler i den gastriske vegg i mongolske ørkenrotte. Resultatene indikerer en påvirkning avhengig av H. pylori
belastning på gastrisk AT1R uttrykk og et forhold mellom gastrisk AT1R ekspresjon og slimhinne PMN infiltrering.
Bakgrunn
rolle av renin-angiotensin-systemet (RAS) i mage fysiologi og sykdoms har hittil blitt tynt utforsket. Noen studier har rapportert effektene av angiotensin II (Ang II) på slimhinnene blodstrøm, magesyre og glatt muskelkontraksjon [1-3]. Andre har implisert påvirkning av RAS i stress-indusert gastrisk skade og iskemi /reperfusjon skade på mageslimhinnen [4, 5].
Klassiske endokrine karakter av RAS er godt kjent for sine virkninger på hemodynamiske regulering og kroppsvæske homeostase. Mindre er kjent om konsekvensanalyse av vev baserte lokale RAS som har vært vist i en rekke organer, f.eks hjernen, bukspyttkjertel, spiserør og tykktarm [6-8]. Interstitiell produksjon av Ang II kan oppstå etter lokal produksjon av angiotensinogen (AGT), ACE og renin, eller gjennom alternative reaksjonsveier inkludert spaltning av sirkulerende AGT av andre lokalt uttrykt enzymer, så som cathepsin D og chymase [9]. Ang II fungerer hovedsakelig gjennom to reseptorer, betegnet Ang II type 1 reseptor (AT1R) og Ang II type 2 reseptor (AT2R). Følgelig kartlegging av uttrykk og plassering av Ang II-reseptorer er av stor betydning for å lete potensiell Ang II-signalisering i forskjellige fysiologiske og patologiske innstillinger. I de senere år RAS har blitt vist å være involvert i forskjellige patologiske tilstander slik som inflammasjon, sårheling og karsinogenese [10, 11]. Epidemiologiske studier har også vist sammenheng mellom RAS relatert gen polymorfisme (SNP) og utvikling av magesår og magekreft [12, 13]. Men assosiasjoner mellom vev uttrykk av Ang II-reseptorer og Helicobacter pylori
infeksjon har ikke blitt rapportert. Potensialet for RAS å modulere lokale betennelsesreaksjoner gjør det av interesse å undersøke dens forhold til veldefinerte gastritt fremkalt av H. pylori
.
I denne studien undersøkte vi uttrykket av Ang II-reseptorer i infisert og H. pylori
-infected mongolsk hamsteren. Denne dyremodell er interessant fordi det lett kan bli infisert med H. pylori
, noe som gir en kronisk aktiv inflammasjon med patologiske forandringer som etterligner de fleste av de lesjoner funnet i mennesker, inkludert magesår, gastrisk intestinal metaplasi og en magekreft lignende bildet [14]. Enten H. pylori
infeksjon alene forårsaker magekreft i mongolske ørkenrotter er fortsatt under debatt [15]., En første Hensikten med studien var å undersøke grunnlinjen tilstedeværelse og plassering av AT1R og AT2R i magen av mongolsk hamsteren. Et annet mål var å belyse hvorvidt tilstedeværelsen av H. pylori
infeksjon er assosiert med endringer i uttrykket av disse reseptorene.
Metoder
Dyr
Forsøkene ble godkjent av etikkomiteen av eksperimenter på dyr, Universitetet i Gøteborg. Tretti spesifikke patogen gratis (SPF) mannlige mongolske ørkenrotte (Charles River, Uppsala, Sverige), sju uker gamle, ble brukt. De ble tilfeldig delt inn i tre grupper av lik størrelse, som består av en kontrollgruppe og to grupper som skulle være infisert med H. pylori
. Fem dyr ble holdt i hvert bur og rommet ble regulert med hensyn til temperatur (18-22 ° C), fuktighet (ca. 55%) og lys /mørke-cyklus (12 /12h). De ørkenrotte hadde fri tilgang til mat (2016F, Harlan Tek. Lab, Blackthorn, England) og drikkevann. De fikk en uke med akklimatisering før vaksinasjonen.
Bakteriestammer og vaksinasjon
To forskjellige H. pylori
stammer ble brukt for vaksinasjon, den TN2GF4 belastningen [16] og Sydney belastningen 1 (SS1) [ ,,,0],17]. Begge stammer er kjent for å forårsake en kronisk aktiv inflammasjon i ørkenrotte gastrisk antrum og korporal mucosa. Bakteriene ble dyrket på Columbia plater. Disse kulturer ble så anvendt for å inokulere 500 ml Brucella buljong som inneholdt 5% nyfødt kalveserum, 10 ug /ml vancomycin og 5 ug /ml trimetoprim. Kolbene ble inkubert i 24 timer under mikro aerobe betingelser ved 37 ° C. Bakteriene ble undersøkt ved fasekontrastmikroskopi før den ble administrert til dyrene. De ørkenrotter ble infisert med 0,5 ml av bakteriesuspensjonen eller Brucella kjøttkraft bare (kontroller) ved hjelp av en foringsnål. Levedyktige tellinger ble gjort i suspensjon for å fastslå den faktiske smittsomme doser, som var 7 × 10
7 enheter og 4 × 10 7 enheter for henholdsvis SS1 og TN2GF4,.
Tid kurs og ofrer
etter en 24-timers faste perioden med fri tilgang til drikkevann, ble fem dyr fra hver gruppe ofret seks eller 12 måneder etter vaksinasjon. Dyrene ble bedøvet ved intraperitoneal injeksjon av medetomodin (0,5 mg /kg) og ketamin (75 mg /kg). Et midtlinje-laparotomi ble utført, og magene ble fjernet og åpnet langs den store kurvatur. Den ene halvdelen ble anvendt for dyrking, og prøver ble samlet inn fra den andre halvdel for histologiske analyser og western blot analyse. Dyrene ble avlivet ved hjertepunktur innsnitt. Histopatologiske funn og bakteriologisk status har vært rapportert tidligere [14].
Immunohistochemistry Bedrifter Den fulle vegg prøver (antrum og korpus) ble samlet umiddelbart etter åpningen av magen, fast i Histofix (Histolab produkter AB, Göteborg, Sverige ) ved romtemperatur (RT) over natten og deretter skylt i PBS i 24 timer. Prøvene ble deretter dehydrert, i parafin, skåret i 5-ul
tykke seksjoner og montert på glassplater. Før immunohistocemical farging ble snittene deparaffinized og kokt i sitronsyrebuffer (0,01 M, pH 6,0, 10 min). Den Immunocruz TM Farging System (Santa Cruz Biotechnology, Santa Cruz, CA, USA) ble brukt for immunhistokjemi protokollen. Etter inhibering av endogen peroksidase-aktivitet, ble ikke-spesifikk binding av sekundære antistoffer blokkert ved inkubasjon med normalt geiteserum i 30 minutter ved romtemperatur. Den følgende to polyklonale primære antistoffer, fortynninger og inkubasjonstider ble deretter anvendt: kanin-anti-AT1R (N-10, Santa Cruz Biotech, 1: 100 i PBS, 2 timer ved RT) og kanin-anti-AT2R (H-143, Santa Cruz Biotech, 1: 100 i PBS, 2 timer ved RT). Etter inkubasjon med primære antistoffer ble snittene vasket tre ganger i PBS og probet med et biotinylert sekundært antistoff; komplekset ble påvist ved anvendelse av pepperrot-peroksidase (HRP) -streptavidin og fargen ble utviklet ved bruk av 3,3'-diaminobenzidin (DAB).
En uventet sterk farging av celler med et typisk utseende av endokrine celler ble bemerket etter immunhistokjemisk farging med dette peroksidase basert metode. Immunoflourescens merking ble gjort for ytterligere å utelukke muligheten for at dette fargingen var et resultat av endogent biotin, av endogen peroksidase aktivitet eller av uspesifikk binding av den sekundære antistoff. Den følgende protokoll ble benyttet: etter koking i sitronsyrebuffer, ble ikke-spesifikk binding av sekundære antistoffer blokkert ved inkubasjon med normalt geiteserum (sc-2043, Santa Cruz Biotech) i 30 minutter ved RT. Seksjoner ble inkubert med primære antistoffer som ovenfor. Objektglassene ble deretter vasket tre ganger i PBS og probet med et sekundært antistoff ifølge Alexa Flour 488 konjugert geit-anti-kanin-IgG (A-11034, Molecular Probes Inc., Eugene, OR, USA), fortynnet 1: 400 i PBS i 1 time ved RT. Objektglassene ble deretter vasket tre ganger i PBS og montert med fluorescens monteringsmedium (DakoCytomation, Glostrup, Danmark), hvoretter Bildene ble tatt med et fluorescens mikroskop. For å bekrefte beliggenheten av AT1R i endokrine celler, var dobbelt farging utført ved anvendelse av den ovenfor beskrevne peroksidase-basert protokoll for AT1R og den ovenfor beskrevne immunoflorescens merking protokoll for et primært antistoff rettet mot Kromogranin A (C-20, Santa Cruz Biotech, 1: 100 i PBS, 2 timer ved RT). Ikke-spesifikk binding av det sekundære antistoff (Alexa Mel 568-konjugert esel anti-geit IgG, A-11057, Molecular Probes Inc., 1: 800 i PBS, 1 time ved romtemperatur) ble blokkert ved inkubasjon med normal esel serum (sc-2044 Santa Cruz Biotech). Preabsorpion med et overskudd (5 x) blokkerer peptid (sc-1173P, Santa Cruz Biotech) ble utført som en kontroll for spesifisiteten til AT1R antistoff, mens det primære antistoff ble utelatt for AT2R.
Gerbil AT1R og AT2R ha > 90% aminosyre-sekvensidentitet homologi med humant, rotte og mus Ang II-reseptorer [18, 19]. I ørkenrotte, som i rotter og mus, er det to AT1R subtyper (AT1aR og AT1bR) som blir kodet av forskjellige gener, men med 95% aminosyresekvenshomologi. Disse reseptor-subtyper er kjent for å være lokalisert forskjellig og regulert, men har en lik affinitet for Ang II. På grunn av høy aminosyre-sekvens-homologi mellom gerbil AT1aR og AT1bR, antok vi lik bindende affinitet til AT1R subtyper for AT1R antistoff som brukes i den foreliggende undersøkelse. Videre er de antistoffene som anvendes for farging av Ang II-reseptorer er fastsatt av produsenten i mus, rotter og mennesker. Derfor, for å bekrefte spesifisiteten av disse antistoffene i ørkenrotte, ble seksjoner fra parafin innebygd blokker av normal hamsteren og menneske binyrene farget som ovenfor (bortsett fra at begge primære antistoffer ble fortynnet 1:50 i PBS) og fordelingsmønstre for Ang II reseptor-antistoffer ble studert. Adrenal fordelings studiene viste at anti-AT1R antistoff overveiende farget adrenale kortikale celler i zona glomerulosa (farging av kapselen som omgir kjertel, ble vaskulære glattmuskelceller (VSMCs) og endotelceller også nevnt) i både gerbil og humane seksjoner. Den anti-AT2R antistoff farget binyremargen celler og celler i zona glomerulosa i hamsteren og menneskelig binyrene (farging av VSMCs og endotelceller ble også bemerket ved hjelp av denne antistoff). Disse resultatene er enig med tidligere rapporterte studier [20], og den sterke likheten av fargemønstre i hamsteren og den menneskelige adrenal kjertel støtte en generell nytten av antistoffene i hamsteren vev.
Western blot
Etter åpning av magen, fulle tykkelse antral vegg prøver ble umiddelbart samlet, frosset i flytende nitrogen og lagret ved -70 ° C. Prøvene ble homogenisert på is (Polytron PT-MR 2100, Kinematica, Sveits) i buffer A (10% glycerol, 20 mM Tris-HCL pH 7,3, 100 mM NaCl, 2 mM fenylmetylsulfonylfluorid, 2 mM EDTA, 2 nM EGTA , 10 mM natrium-ortovanadat, 10 ug /ml leupeptin og 10 pg /ml aprotinin) [21] og sentrifugert ved 30000 g i 30 min ved 4 ° C. Pelletene ble resuspendert i buffer B (1% NP-40 [Sigma-Aldrich, Stockholm, Sverige] i buffer A) og omrørt ved 4 ° C i 1 time før sentrifugering ved 30 000 g i 30 minutter ved 4 ° C. Supernatantene ble analysert for protein-innhold ved metoden til Bradford [21] og lagret ved -70 ° C inntil videre analyse. Prøver ble fortynnet i SDS-buffer og oppvarmet ved 70 ° C i 10 min før de ble lastet på en NuPage 10% BisTris gel (Invitrogen, Carlsbad, CA, USA). Ett kjørefelt var lastet med prestained molekyl standarder vekt (SeeBlue ™, Invitrogen AB, Lidingö, Sverige), og helcellelysater av PC-12 (for AT1R, sc-2250, Santa Cruz Biotech), HEP G2 (for AT2R; SC- 2227, Santa Cruz Biotech) og HL60 (for myeloperoksidase (MPO), ble 12-354, Upstate Lake Placid, NY, USA) anvendt som positive kontroller. Polyvinyldifluoride membraner (Amersham, Buckinghamshire, UK) ble inkubert med polyklonale kanin antistoffer rettet mot AT1R (N-10, Santa Cruz Biotech), AT2R (H-143, Santa Cruz Biotech) eller MPO (07-496, Upstate). Et alkalisk fosfatase-konjugert geite-anti-kanin-antistoff (sc-2007, Santa Cruz Biotech for AT1R og AT2R antistoffer, og IgG 12-448, Upstate, for MPO-antistoff) og CDP-Star substrat (Tropix, Bedford, MA, USA ) ble anvendt for å identifisere immunoreaktive proteiner ved kjemiluminescens. Bilder ble tatt til fange av en avkjølt CCD-kamera (LAS-1000, Fujifilm, Tokyo, Japan). Og semi kvantifisering ble gjort ved å sammenligne prøvene til positive kontroller bruker Gauge 3.3-programvaren (Fujifilm, Tokyo, Japan)
Mikroskopisk morfometri
Vevsprøver fra antrum veggen ble løst i Histofix (Histolab Products AB) og innebygd i parafin. Fire-ul
tykke seksjoner ble montert på kodede glass og rutinemessig farget med hematoksylin /eosin (H & E). Graden av mucosal infiltrasjon av mononukleære og polymorfonukleære leukocytter ble studert i lysmikroskop. Lamina propria vil ha en tendens til å øke i volum som følge av innstrømning av inflammatoriske celler. Derfor er den relative volumet av lamina propria ble bedømt ved morfometri å reflektere infiltrasjon av både mono-nukleære og polymorfonukleære leukocytter. Dette ble utført av H.F.H. i et lysmikroskop, med en 10 x 10-kvadratisk rutenett satt inn i okularet og et x 25 objektiv. Ved hjelp av punkt tellemetoden [22], ble volumet tettheten av lamina propria bestemt og uttrykt i prosent av slimhinnene (i dette tilfelle definert som området mellom slimhinneoverflaten og bunnen av kjertler). Slimhinne volumet er her definert som epithelial lag + lamina propria. Slimhinnene infiltrasjon av polymorfonukleære leukocytter (PMN) ble vurdert ved å P.H. i et lysmikroskop, med en 10 × 10-kvadratisk rutenett satt inn i okularet, en × 50 oljeneddyppingsobjektivet objektiv (N.A. 1,4) og en olje nedsenking topplinse av kondensatoren (N.A. 1.4). PMN ble identifisert som grovt runde celler i lamina propria med en mørk farget multilobulated eller bilobulated kjernen. Antallet PMN i en kvadratisk del av mukosa ble bestemt, som var det totale antall ruter over lamina propria; antall PMN er uttrykt per 1 mm 2 lamina propria. Telle startet fra bunnen av kjertler og avsluttet etter vurdering av ett til syv komp ranker av slimhinnene, som resulterer i et minimum på 0,077 mm 2lamina propria analysert angitt i del. Systematisk prøvetaking med tilfeldig start ble brukt for valg av områder som skal studeres i begge analysene. Områder med lymfoide follikler ble ikke inkludert.
Statistisk analyse
Kruskal-Wallis test og Mann-Whitney U-test vurderes betydning i forskjellene av protein uttrykk mellom kontroll, TN2GF4-smittet og SS1-smittet grupper. Mann-Whitney U-test vurderes betydning forskjeller i slimhinnene infiltrasjon av betennelsesceller mellom TN2GF4-infiserte og SS1-infiserte ørkenrotte. Et lineært forhold mellom AT1R-protein og PMN, og en lineær relasjon mellom AT1R og ln (MPO) i antral mucosa, ble testet med Pearson korrelasjon. Alle testene ble tosidige, og statistisk signifikans ble satt til p < 0,05. Alle de statistiske analysene ble utført ved hjelp av SPSS, versjon 15.0 (SPSS Inc. Chicago, Illinois).
Resultater
Lokalisering av AT1R og AT2R protein
immunreaktivitet til AT1R og AT2R proteinene ble observert i alle gerbil eksemplarer som er undersøkt, og ingen farging ble observert i kontrollseksjoner. Den AT1R antistoffet generelt induserte en mer distinkt farging enn den AT2R antistoff.
Flere vevsområder i både corpus og antrum, uavhengig av nærvær eller fravær av H. pylori-infeksjon
, oppviste immunreaktiviteten til begge de Ang II reseptorsubtyper (se tabell 1 for en oversikt over de resultater og figur 1 for representative seksjoner. se også tilleggsfiler 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 og 15 for bilder med høy oppløsning). Således ble immunreaktivitet til både AT1R og AT2R funnet i endotelceller i fartøyer som befinner seg i lamina propria, submucosa (figur 1B) og muscularis propria, så vel som i glatte muskelceller av muscularis slimhinner og muscularis propria (figur 1C og 1G) og i noen mesenchymale celler lokalisert i lamina propria og submucosa. Svak farging av begge reseptorer ble også bemerket, hovedsakelig i basal del av de fleste epitelceller. Tydelig farging av egenutført nevrale strukturer ble ikke observert. Immunoreaktivitets bare å AT1R ble observert i de vaskulære glatte muskelceller av fartøy i submucosa, muskularis propria og serosa av både corpus og antrum deler av magen (figur 1A og 1G). Interessant nok en sterk immunfarging for AT1R dukket opp i et delsett av celler i hovedsak i bunnen av antrum kjertler. Disse cellene viste en typisk celle endokrine utseende, dvs. at de var ganske små, med cellelegemene i nærheten av den basalmembran; en smal streng av cytoplasma ble observert i noen tilfeller (figur 1G, 1H og 1i). Slike AT1R flekker ble ikke funnet i endokrine-lignende celler i oxyntic slimhinnen. Double farging for AT1R og for den pan-endokrine markør Kromogranin A [23] bekreftet plasseringen av AT1R i en undergruppe av endokrine celler i hamsteren antrum slimhinnen (Figur 1M og 1N) .table en lokalisering av AT1R og AT2R protein i mage vegg av den mongolske hamsteren
Tissue Kammer
Cell type
AT1R
AT2R
Slimhinner
epitel
fleste epitelceller
+ hovedsakelig i basale deler
+ hovedsakelig i basale deler
Små epitelceller i bunnen av kjertler
+++ i noen endokrine lignende celler i antrum
ingen
lamina propria
blodkar
+ i endotelet
+ i endotelet
Nerve strukturer
ingen
no
mesenchymalceller
++ i enkelte celler,
++ i leukocytter i H. pylori
-infected
+ i enkelte celler,
++ i leukocytter i H. pylori
-infected
muskularis slimhinner
Glatte muskelceller
++
+
submucosa
blodkar
+ i endotelet,
++ i VSMCs
+ i endotelet;
no i VSMCs
Nerve strukturer
ingen
ingen
mesenchymalceller
++ i enkelte celler,
++ i leukocytter i H. pylori
-infected
+ i noen celler,
++ i leukocytter i H. pylori
-infected
muskularis propria
glatte muskelceller
++
+
blodkar
+ i endotel;
++ i VSMCs
+ i endotelet;
no i VSMCs
Nerve strukturer
n.o.
n.o.
serosa
blodkar
n.o. i endotelet,
++ i VSMCs
ingen
no: ikke observert (eller uspesifikke) immunoreaktivitets
+: svak immunoreaktivitets men med tydelig plassering
++: lett gjenkjennelige immunoreaktivitets
+ ++: sterk immunoreaktivitets
VSMCs: vaskulære glatte muskelceller
Figur 1 demonstrere immunhistokjemiske plasseringen av AT1R og AT2R i magen av den mongolske hamsteren. A-F viser seksjoner fra antrum regionen en SS1-smittet hamsteren, 12 måneder etter vaksinasjon. A) Vaskulære glattmuskelceller (VSMC) i en arterie som ligger i serosa flekken positiv for AT1R protein (grønn farge). B) Endotelceller (end) og uidentifiserte mesenchymale celler (m) ligger i submucosa viser immunoreaktivitets for AT2R protein. C) Glatte muskelceller i muskellaget av muscularis propria flekken positivt for AT2R protein. D) En negativ kontroll (sammenhengende til den delen i A) preabsorbert med blokkering peptid for AT1R antistoff, som viser gul autofluorescence fra erytrocytter. E & F) Negative kontroller for AT2R antistoff, sammenhengende til avsnittene i B & C, henholdsvis. G, H viser seksjoner fra den antral-regionen i et kontrolldyr 6 måneder etter inokulering og delen i (I) er fra en TN2GF4-infisert gerbil, 12 måneder etter inokulering. Sterk farging for AT1R ble funnet i celler med et typisk utseende av endokrine celler (e). Muskularis slimhinner (mm), muskularis propria (mp) og vaskulære glatte muskelceller (VSMC) også farget positivt for AT1R. En peroksydase basert metode (brun farge) ble anvendt for farging av AT1R i G, H og immunfluorescens (grønn farge) ble anvendt for farging av AT1R i (I). J, K og L) sammenhengende seksjoner fra antrum regionen en TN2GF4-smittet hamsteren, 6 måneder etter vaksinasjonen. J) farging for AT1R (grønn farge) viser aggregater av leukocytter (leu) uttrykker AT1R protein. K) En negativ kontroll til seksjonen i J, som viser gul autofluorescence fra erytrocytter. L) Den påfølgende avsnitt til avsnitt i K, rutinemessig farget med H & E, som bekrefter at aggregatene er leukocytter. M og N viser dobbel immunofarging for AT1R (brun farge i M) og for det pan-endokrine markør Kromogranin A (rød farge i N) av en antrum-delen av et kontrolldyr. Den hvite pilen i M og N punkter på en celle i bunnen av en antrum kjertel som farget positivt for både AT1R og Kromogranin A. Flere av kromogranin A positive celler ikke ble immunopositive å AT1R. Seksjon O demonstrerer nøytrofile (PMN) i antrum slimhinnene i en SS1-smittet hamsteren, 12 måneder etter vaksinasjonen.
Intensitet og distribusjon av immunoreaktivitets beskrevet ovenfor ikke synes å være forskjellig mellom H. pylori
-negativ og H. pylori
-infected dyr eller mellom dyrene avlivet på seks eller 12 måneder etter vaksinasjon. Imidlertid ble en åpenbar forskjell bemerket mellom H. pylori
-negative og H. pylori
-infected dyr: i motsetning til i uinfiserte ørkenrotte, deler av både antrum og corpus av infiserte dyr viste en overflod av betennelsesceller i lamina propria med immunreaktiviteten til både AT1R og AT2R. I en av de TN2GF4-infiserte dyr avlivet seks måneder, ble aggregater av inflammatoriske celler også sett i muscularis propria (fig 1J, 1K og 1L). Ingen åpenbare forskjeller i fargemønstre eller intensitet ble sett mellom dyr infisert med TN2GF4 belastning eller SS1 belastning, eller mellom dyr ofret på seks eller 12 måneder etter vaksinasjonen.
Kvantifisering av AT1R og AT2R protein og forhold til betennelsesceller
på grunn av den tilsvarende immunhistokjemiske utseendet av angiotensin II-reseptorer i corpus og antrum (med unntak av AT1R uttrykke subpopulasjon av endokrine celler nevnt ovenfor) på begge seks og 12 måneder, ble kvantitative vurderinger begrenset til antrum prøver ved 12 måneder etter inokulering .
Både AT1R og AT2R proteiner ble identifisert ved western-blotting i alle prøvene (figur 2). Etter 12 måneder med infeksjon, det AT1R protein uttrykk var betydelig høyere i SS1-infiserte dyr enn i kontrollene på den tiden (figur 3). ble ingen signifikante forskjeller i AT2R protein uttrykk mellom de ulike gruppene av ørkenrotte (ikke vist). Figur 2 Eksempler bilde av de vestlige blotter. Topplate: immunreaktivitet mot AT1R på 41 kDa i PC-12 cellelysat (positiv kontroll) og i antrum full-vegg prøver. Bunnplate: immunreaktivitet mot AT2R indikerer et svakt bånd på 44 kDa i Hep G2 (positiv kontroll) og band i antrum full-vegg prøver
Figur 3 Boxplot viser AT1R protein uttrykk 12 måneder etter vaksinasjon i ørkenrotte infisert med H. pylori. stammer TN2GF4 og SS1 og kontroller. Den AT1R protein uttrykk var betydelig høyere i SS1-infiserte dyr sammenlignet med kontrollene (Kruskal-Wallis test og Mann-Whitney U test). Proteinnivåer er presentert som optisk tetthet (OD). Medianverdiene er angitt med tverrgående linje innenfor boksen, det interkvartile området ved den vertikale utstrekning av boksen og det totale tilbudet av værhår.
Gitt at H. pylori
-infected dyr viste en overflod av AT1R uttrykke inflammatoriske celler i deres mageslimhinne og en økt antral AT1R ekspresjon, ble en kvantitativ analyse av inflammatoriske celler i slimhinnen gjort for å vurdere om oppregulering av AT1R protein i SS1-infiserte ørkenrotter var knyttet til slimhinne infiltrasjon av inflammatoriske celler.
graden av slimhinnene infiltrasjon av både mononukleære og polymorfonukleære leukocytter (reflekteres av volumet tetthet av lamina propria) ikke skiller mellom SS1-smittede og TN2GF4-infiserte ørkenrotte. Imidlertid mucosal infiltrasjon av polymorfonukleære leukocytter (PMN) var signifikant høyere i SS1-infiserte dyr enn i TN2GF4-infiserte dyr 12 måneder etter inokulering (Tabell 2). De PMN i H. pylori
-infected slimhinnen besto nesten utelukkende av nøytrofile (figur 1o); bare noen få eosinofil og ingen basofile celler kunne identifiseres i microscope.Table 2 Kvantitativ analyse av betennelsesceller i hamsteren antrum slimhinnen etter 12 måneder med Helicobacter pylori
infeksjon
|
Kontroll
TN2GF4
SS1
slimhinnene infiltrasjon av mononukleære og polymorfonukleære leukocytter (reflekteres av volumet tetthet (%) av lamina propria)
26,7 ± 2,4
47,1 ± 2,2
41,3 ± 2,4
slimhinnene infiltrasjon av polymorfonukleære leukocytter (PMN /mm2 lamina propria)
198 ± 37
1892 ± 169
4166 ± 275 * *
Verdier er gjennomsnitt ± standard feil av gjennomsnittet
** p <.; 0,01, SS1 versus TN2GF4. Mann-Whitney U-test
En lineær sammenheng (r = 0,75, p < 0,01) ble sett mellom AT1R protein uttrykk i antrum og antall polymorfonukleære leukocytter i antrum slimhinnen etter 12 måneder med H. pylori
infeksjon (figur 4). Dette forholdet ble støttet av den logaritmiske sammenheng mellom antral ekspresjon av AT1R og ekspresjon av myeloperoksidase (r = 0,58, p < 0,05) (figur 5). Myeloperoksidase (MPO) er et enzym som er rikelig uttrykt i nøytrofiler og i mindre grad i monocytter og visse typer av makrofager [24]. Derfor vev nivåer av MPO tjente som proteinmarkører nøytrofil infiltrasjon i denne studien. Hvis uteliggeren verdien merket med en trekant i figur 5 er ekskludert fra analysen (ikke vist i en egen figur) forholdet mellom AT1R og MPO blir merkbart sterkere (r = 0,86 og p < 0,01). Figur 4 Forholdet mellom AT1R uttrykk i antrum og antall polymorphnuclear leukocytter (PMN) i antrum slimhinnen etter 12 måneder med H. pylori-infeksjon.
Figur 5. Forholdet mellom AT1R uttrykk og myeloperoxidase (MPO) uttrykk i antrum slimhinnen etter 12 måneder med H. pylori-infeksjon. Hvis uteliggeren verdien merket med en trekant er ekskludert fra analysen (ikke vist) forholdet mellom AT1R og MPO blir merkbart sterkere (r = 0,86 og p < 0,01).
Diskusjon
studien utforsket baseline nærvær og plassering av angiotensin II-reseptorer i antral og korporal vegg av mongolske ørkenrotte og viste at AT1R og AT2R ble uttrykt ved en rekke celler. Et funn av spesiell interesse var at en undergruppe av endokrine celler i antrum slimhinnen viste en markant uttrykk for AT1R. Gyldigheten av immunhistokjemisk fremgangsmåte som anvendes i den foreliggende undersøkelse ble bekreftet på forskjellige måter. De Ang II reseptor-antistoffer ble påvist ved anvendelse av to forskjellige teknikker, og spesifisiteten av de primære antistoffer som brukes både for western blotting og immunhistokjemi ble kontrollert ved å sammenligne fargemønstre i gerbil med de av human adrenal kjertel og ved preabsorption med blokkerende peptid ( AT1R).
den allesteds nærværende distribusjon av Ang II-reseptorer i maven rapporteres her er i overensstemmelse med det som er rapportert tidligere i tykktarmen [7]. Autoradiografi av rottemagesekken har også indikert at AT1R, og lavt antall AT2R, er til stede i alle lag av magesekken [4]. Men den nøyaktige plasseringen av AT1R og AT2R i magen har foreløpig bare blitt sparsomt utforsket. Matsuo et al
. brukte immunhistokjemi for å finne AT1R i menneskelig antrum og fant det i vaskulære glatte muskelceller (VSMCs), mesenchymale celler og glatte muskelceller i muskel lag av slimhinnen og muskularis propria [25]. Videre Bregonzio et al
.
| 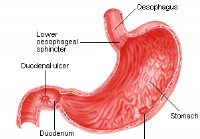 Peptiske sår
Hva er et magesår? Et magesår er en lesjon eller sår på den beskyttende slimhinnen i magen (der det kalles magesår) eller tolvfingertarmen. Leger definerer det ofte som et slimhinnebrudd større enn 3
Peptiske sår
Hva er et magesår? Et magesår er en lesjon eller sår på den beskyttende slimhinnen i magen (der det kalles magesår) eller tolvfingertarmen. Leger definerer det ofte som et slimhinnebrudd større enn 3
 Hva er Helicobacter Pylori-infeksjon?
Helicobacter pylori (H. pylori) er en korketrekkerformet bakterie som ble identifisert i 1982 som en hovedårsak til magesår og kronisk gastritt, tilstander som tidligere ble antatt skyldes stress og d
Hva er Helicobacter Pylori-infeksjon?
Helicobacter pylori (H. pylori) er en korketrekkerformet bakterie som ble identifisert i 1982 som en hovedårsak til magesår og kronisk gastritt, tilstander som tidligere ble antatt skyldes stress og d
 SCD Frittata (enkel og rask)
Når livet gir deg sitroner, lag limonade... ikke sant? Hva med en SCD-frittata. Jeg prøvde å hjelpe til med å redde miljøet ved å bare ta én papirpose i kassen (glemte de gjenbrukbare). Da posefyren
SCD Frittata (enkel og rask)
Når livet gir deg sitroner, lag limonade... ikke sant? Hva med en SCD-frittata. Jeg prøvde å hjelpe til med å redde miljøet ved å bare ta én papirpose i kassen (glemte de gjenbrukbare). Da posefyren