Serum trekløver faktor 3 er et lovende ikke-invasiv biomarkør for magekreft screening: En monosentriske kohortstudie i Kina
Abstract
Bakgrunn
søken etter bedre ikke-invasive biomarkører for magekreft fortsatt pågår. Vi undersøkte prediktiv kraft av serum trekløverfaktor (TFF) nivå som biomarkører for magekreft i sammenligning med pepsinogen (PG) test.
Metoder
Pasienter med magekreft, kronisk atrofisk gastritt (CAG) eller kronisk ikke- atrofisk gastritt (CNAG), og friske mennesker ble rekruttert. Serumkonsentrasjonen av TFFs, PG I, og PG II, så vel som tilstedeværelse av antistoffer mot Helicobacter pylori
, ble målt ved hjelp av enzymbundet immunosorbentanalyse (ELISA). Mottaker operasjonelle egenskaper (ROC) ble brukt til å sammenligne de prediktive krefter de utvalgte faktorer.
Resultater
serumkonsentrasjonen av TFF1, TFF2, og TFF3 i kontrollgruppene var betydelig lavere enn de i magekreft gruppe med unntak av TFF2 som var forhøyet i CAG. Arealet under ROC-kurven for TFF3 var større enn for de PG-I /II-forhold (0,81 vs. 0,78). TFF3 hadde også en betydelig høyere prediktiv kraft for å skille magekreft enn PG test (odds ratio: 10,33 vs 2,57). Videre, ved å kombinere serum TFF3 og PG-tester for magekreft hadde bedre forutsigbar kraft enn enten alene. Konklusjoner
Serum TFF3 kan være en bedre prediktor for magekreft enn PG-testen, mens den kombinerte testing av serum og PG TFF3 ytterligere kan forbedre effekten av magekreft screening.
nøkkelord
mage~~POS=TRUNC kreft~~POS=HEADCOMP Diagnose Serum trekløverfaktorer pepsinogen Bakgrunn
mage~~POS=TRUNC kreft~~POS=HEADCOMP er den nest hyppigste årsaken til kreftdød. Omtrent en million nye tilfeller av magekreft er diagnostisert årlig over hele verden [1]. I de fleste land, inkludert Kina, er magekreft vanligvis oppdaget på et avansert stadium når prognosen er dårlig. I Japan har et omfattende screeningprogrammet med photofluorography og endoskopi lyktes i å diagnostisere de fleste av magekreft på tidligere stadier, noe som har ført til en nedgang i forbindelse dødelighet [2-4] 40-60%. Imidlertid er utbredt endoskopi screening for tiden ikke tilgjengelig i Kina. Derfor er forhåndsvalg av høyrisikopersoner med en enkel og effektiv ikke-invasiv biomarkør, før endoskopisk undersøkelse, er foreslått som en fornuftig strategi for magekreft massescreening.
Serum pepsinogen (PG) testing, et aktuell metode for magekreft screening, har fordelen av å være enkel og rimelig. Det har blitt brukt som en del av stor-skala screening in Japan. Men på grunn av bevisets stilling, PG test ennå ikke er anbefalt for populasjonsbasert screening [5, 6]. Videre, mens en kombinasjon av PG og serum Helicobacter pylori
(HP) antistofftesting er blitt rapportert å være bedre enn PG testing alene for å forutsi magekreftrisiko, har denne fremgangsmåte også ennå ikke nådd et nivå hvor den kan brukes direkte til skjermen for magekreft [7].
trekløverfaktor (TFF) familie består av tre termostabile og protease-motstandsdyktig proteiner, TFF1, TFF2, og TFF3 [8]. Disse proteiner er antatt å spille en sentral rolle i slimhinne beskyttelse mot skader [9]. Deres onkogene potensial har også blitt rapportert å være assosiert med celleproliferasjon, apoptose, migrering og invasjon og angiogenese [10-16]. Ekspresjonen av disse peptidene i mage-tarmkanalen skjer i en vevs- og cellespesifikk måte. TFF1 og TFF2 er hovedsakelig uttrykt i mageslimhinnen [17], mens TFF3 uttrykkes i slimceller i tarmen og også ved lavere nivåer i andre organer som bryst, spyttkjertel, luftveier, og hypothalamus [18-22]. Nylig er serumnivået av TFFs i kreftpasienter, inkludert de med magekreft, har blitt rapportert å være økt, og derfor kan være nyttige biomarkører for screening [23-27].
I vår studie har vi undersøkt serumnivåene av TFFs hos pasienter med magekreft. Effekten av serumnivåer av TFFs som biomarkører for magekreft ble videre analysert i forhold til PG testing.
Metoder
Fag
Sytti-to pasienter med magekreft som gjennomgikk behandling fra januar 2012 til oktober 2012 på Institutt for Gastrointestinal kirurgi ved Ningbo Medical Center of Lihuili sykehus ble rekruttert til studien. Serumprøver ble oppnådd før behandling. Clinicopathological data inkludert TNM stadium av svulster og histologiske typen, ifølge Lauren klassifisering, ble også samlet inn. Seksti pasienter med kronisk atrofisk gastritt (CAG) og 27 pasienter med kroniske ikke-atrofisk gastritt (CNAG) ble også rekruttert fra Department of Gastrointestinal Endos fra mars 2012 til juli 2012. CAG og CNAG ble diagnostisert av endoskopisk pathohistology, hvor CAG ble definert som et tap av gastrisk kjertelceller eller de erstattes av intestinal og fibrøst vev i antrum eller corpus av fundus ved biopsi. Serumprøver av 37 friske mennesker, som rapporterte ingen historie av øvre gastrointestinale forstyrrelser, ble innhentet fra helsesjekk Center of Lihuili Hospital fra juli 2012 til oktober 2012. Forsøkspersonene ble ekskludert dersom de presenteres med alvorlig komorbiditet inkludert lever-, nyre-, hjerte, og hematologisk sykdom, eller hadde tidligere gjennomgått øvre gastrointestinal kirurgi eller vagotomy. Skriftlig informert samtykke ble innhentet fra alle deltakerne i samsvar med Helsinkideklarasjonen. Godkjenning fra forskningsetiske komité for Lihuili Hospital ble også oppnådd.
Immunanalyser for TFFs, pepsinogen I, pepsinogen II, og Anti-HP IgG
Serum samlet inn fra fastende pasienter med magekreft, CAG og CNAG, eller sunt kontroller ble lagret ved -80 ° C inntil analyse. Serum TFFs, pepsinogen I, pepsinogen II, og anti-HP-immunglobulin (Ig) G-nivåer ble målt ved hjelp av enzymbundet immunosorbentanalyse (ELISA).
Spesifikt er serumnivået av TFF1, TFF2, og TFF3 ble målt ved anvendelse av kommersielle ELISA pakkene er kjøpt fra USCN Life Science (Wuhan, Kina) og utført i henhold til produsentens instruksjoner. Kort sagt ble rensede polyklonale antistoffer belagt på en 96-brønners mikrotiterplater. Deretter 100 ul analysebuffer, som en negativ kontroll, serumprøver eller fortynninger av den aktuelle humane TFF standard, ble satt til de respektive brønner og platene ble inkubert i 2 timer ved 37 ° C. Platene ble deretter vasket og den passende fortynnede biotin-merkede TFF polyklonalt antistoff ble tilsatt til hver brønn. Etter inkubasjon i 1 time ved 37 ° C ble platene vasket og fortynnet streptavidin konjugert til pepperrotperoksidase ble tilsatt til hver brønn. Etter inkubering i ytterligere 30 minutter ved 37 ° C ble platene vasket, og tetrametylbenzidin (TMB) oppløsning ble tilsatt i 20 minutter ved 37 ° C. Til slutt ble stoppløsning tilsatt til hver brønn, og absorbansen ved 450 nm ble målt. Konsentrasjonene av humane TFFs i prøvene ble deretter beregnet fra arbeidsstandardkurven. Analyse sensitiviteter for TFF1, TFF2, og TFF3 var 44, 13,5 og 52 pg /ml.
Serumkonsentrasjonen av PG I og PG II ble målt ved kjemiluminescerende enzym immunoassay kit fra Biohit Plc (Helsinki, Finland). Serumet PG status ble ansett positive (PG +) for å forutsi magekreft når serum PG jeg nivået var ≤ 70 ng /ml og PG I /II-forholdet var ≤ 3.
HP infeksjon ble diagnostisert ved påvisning av serum HP IgG antistoff ved hjelp av et kommersielt enzym immunoassay kit (Biohit Plc).
statistisk analyse
All statistisk analyse ble utført ved hjelp Graphpad Prism 5.01 (La Jolla, CA, USA). Kontinuerlige data for pasienter og kontroller ble først sjekket for å bekrefte om de var nær en normalfordeling, og deretter statistisk analysert ved t-test for normalfordelinger eller ved Mann-Whitney test for ikke-normalfordelinger. En to-sidig P-verdi av < 0,05 ble ansett som statistisk signifikant. Mottakeren opererer karakteristiske (ROC) kurver og området under disse kurvene (AUC) ble beregnet å sammenligne prediktive krefter utvalgte faktorer.
Resultater
baseline karakteristikker av pasienter og kontroller
Grunnlags kjennetegn ved studien fag er vist i Tabell 1. gjennomsnitts~~POS=TRUNC alderen~~POS=HEADCOMP på de 72 pasienter med magekreft var 61,7 ± 1,4 år (mann /kvinne ratio = 1,23), og at av de 61 CAG-pasienter var 56,7 ± 1,4 år (mann /kvinne ratio = 0,91), og dermed var det en 5-års aldersforskjell mellom de to gruppene. Gjennomsnittsalderen for CNAG pasienter var 48,1 ± 2,8 år, og det av friske personer var 56,7 ± 2,8 år, dermed CNAG gruppen var 8,6 år yngre enn den sunne group.Table 1 baseline og HP smittestatus, serum PG test av magekreft og kontroller
mage~~POS=TRUNC kreft~~POS=HEADCOMP (n = 72)
CAG (n = 61)
CNAG (n = 27)
Sunn kontroll ( n = 37)
Alder (år, gjennomsnitt ± SD)
61,7 ± 1.4ζ
56,7 ± 1,4
48,1 ± 2,8
56,7 ± 2,8
Mann /Kvinne ratio
1.23
0,91
0,5
1,31
Histologisk typen
Tarm typen
25 (34,7%)
Diffus typen
47 (65,3%)
TNM stadium
Tidlig magekreft
16 (22,2%)
Avansert magekreft
56 (77,8%)
HP smittestatus
HP positive
48 (66,7%)
30 (49,2%)
14 (51,8%)
18 (48%) pg test pg I (ng /ml)
76,91 ± 4,78 *
72,02 ± 5.48
79,64 ± 5,74
84,52 ± 4,44 pg II (ng /ml)
25,10 ± 2,35 **
19,44 ± 1,27
18.27 ± 1.93
14.39 ± 1.12
PG I /II-forhold
3,91 ± 0.29ξ
3,99 ± 0,24
5,84 ± 0,72
7,18 ± 0,69
ζ: Ingen forskjell mellom magekreft og sunn gruppen (P
= 0,08); magekreft vs CAG P = 0,0179; magekreft vs CNAG, P < 0.001 product: *: Ingen forskjell mellom kreft gruppe og CAG, CNAG og sunn gruppe
**:.. Magekreft vs. CAG, P
= 0,0459; magekreft vs. CNAG, P
= 0,0927; Magekreft vs. sunn, P
= 0,002
ξ. Magekreft vs. CAG, P
= 0,8485; magekreft vs. CNAG, P
= 0,0038; magekreft vs. sunn, P
< 0,0001.
I magekreft gruppen, 16 (22,2%) av pasientene hadde tidlig stadium magekreft (stadium 0, IA og IB), mens 56 (77,8%) av pasientene hadde avansert magekreft. Ifølge Lauren klassifisering, 47 (65,3%) pasienter med diffus presentert typen magekreft, mens den andre 25 (34,7%) viste tarmtypen. HP smittestatus var svært tett med en HP + utvalg av 48 til 66,7% på tvers av grupper. Serumnivåer av PG Jeg var heller ikke signifikant forskjellig mellom pasienter med magekreft og friske kontroller. Serumnivåene til PG II, var imidlertid signifikant høyere i magekreft gruppen enn de som er i den friske gruppe. PG I /II-forhold i magekreft gruppen var signifikant lavere enn for kontroller med unntak av CAG tilfellene (tabell 1).
Serumkonsentrasjonen av TFFs
serumkonsentrasjonen av TFF1, TFF2, og TFF3 Hos pasienter med magekreft, CAG og CNAG, og i de sunne grupper, er vist i Figur 1. Hos pasienter med magekreft, var gjennomsnittlig serum TFF1 konsentrasjonen var 1,30 ± 0,15 ng /ml (95% CI [1,01, 1,59] ), mens i CAG, CNAG, og den friske gruppen var det 1,07 ± 0,14 ng /ml (95% CI [0,77, 1,35]), 0,70 ± 0,08 ng /ml (95% CI [0,53, 0,87]), og 0,72 ± 0,07 ng /ml (95% CI [0,58, 0,86]), henholdsvis. Ytterligere statistisk analyse viste at den midlere serum TFF1 nivå i magekreft var signifikant høyere enn de i begge CNAG (P
= 0,0075) og friske gruppe (P
= 0,0045) hos pasienter, men det var ikke signifikant forskjellig fra at i CAG (P
= 0,1332). Gjennomsnittlig serum TFF2 konsentrasjonen hos pasienter med magekreft var 1,08 ± 0,07 ng /ml (95% CI [0,93, 1,23]), som var betydelig høyere enn i CAG (0,86 ± 0,07 ng /ml, 95% CI [0,71, 1,00], P
= 0,034), CNAG (0,64 ± 0,08 ng /ml, 95% CI [0,47, 0,81], P
= 0,0011), og sunne (0,63 ± 0,05 ng /ml, 95% KI [0,53, 0,74], P
< 0,0001) gruppe. Den midlere TFF3 serumnivået i magekreftpasienter var også signifikant høyere enn i de andre gruppene. Faktisk, var gjennomsnittlig serum TFF3 konsentrasjonen hos pasienter med magekreft var 50,95 ± 2,31 ng /ml (95% KI [46.35, 55.55]), mens i CAG, CNAG og sunne gruppene var det 31,41 ± 1,34 ng /ml (95% KI [28.74, 34.09], P
< 0,0001), 32,30 ± 2,09 ng /ml (95% KI [28.00, 36.59], P
< 0,0001) og 30,67 ± 2,20 ng /ml (95% KI [26.22, 35.13], P
< 0,0001), henholdsvis. Figur 1 Konsentrasjon av serum TFFs målt ved hjelp av ELISA. Konsentrasjon av serum TFFs hos pasienter med magekreft var betydelig høyere enn de andre kontrollgrupper.
ROC analyse av serum TFF og PG test som indikatorer på magekreft
ROC analyse ble utført for å evaluere nøyaktigheten av serumkonsentrasjonen av TFFs og forholdet PG i /II for diagnose av magekreft. Arealet under kurven for TFF1, TFF2, TFF3, og PG-I /II-forholdet var 0,67 (95% CI [0,56, 0,77]), 0,74 (95% CI [0,65, 0,83]), 0,81 (95% CI [ ,,,0],0,72, 0,89]) og 0,78 (95% CI [0,69, 0,87]), henholdsvis (figur 2A). Således ROC-kurver indikerte en høyere nøyaktighet observert for TFF3 når sammenlignet med den for forholdet PG I /II. I motsetning til CAG, arealet under kurven for TFFs viste signifikant lavere verdier når sammenlignet med den for forholdet PG I /II (figur 2B). Figur 2 ROC kurver for konsentrasjonen av serum TFFs og PG I /II-forhold til å diagnostisere magekreft eller CAG. (A) ROC-kurver for konsentrasjonen av serum TFFs for å diagnostisere magekreft, sammenlignet med PG-I /II-forhold. Arealet under kurven for serum TFF1, TFF2, TFF3 og PG-I /II-forholdet var 0,67, 0,74, 0,81 og 0,78, respektivt. Resultatene viste at serum TFF3 har større prediktiv kraft for magekreft enn PG-I /II-forhold. (B) ROC kurver for konsentrasjonen av serum TFFs og PG I /ratio II diagnose CAG. Arealet under kurven for TFF1, TFF2, TFF3 og PG-I /II-forholdet var 0,63, 0,61, 0,53 og 0,76, respektivt. Resultatene presenteres som PG I /II-forholdet er et åpenbart bedre markør for CAG deteksjon enn alle serum TFFs.
Cutoff-verdier for TFF1, TFF2, og TFF3 beregnet ved ROC, var 1,0 ng /ml, 0,7 ng /ml og 42,0 ng /ml, henholdsvis. Sensitiviteten og spesifisiteten TFF1 var 58,33% og 72,97%, henholdsvis, og odds ratio var 3,78. Sensitiviteten og spesifisiteten TFF2 var 65,28% og 70,27%, henholdsvis, og odds ratio var 4,44. Sensitiviteten og spesifisiteten TFF3 var 66,67% og 83,78%, henholdsvis odds ratio var 10.33. Sensitivitet og spesifisitet av PG + var 37,5% og 81,08%, henholdsvis, og odds ratio var 2,57. Disse data tyder på at serumkonsentrasjonen av TFFs, spesielt TFF3 er signifikant assosiert med magekreft som demonstrert ved signifikant høyere odds ratio enn det som er bestemt for PG test (tabell 2) .table 2 Sammenligning av sensitivitet og spesifisitet av serum TFFs og PG test for magekreft
Kriterier
Sensitivitet
spesifisitet
Odds ratio
PG test (+)
37.50%
81,08%
2,57
TFF3 (≥42ng /ml)
66,67%
83,78%
10,33
TFF2 (≥0.7 ng /ml)
65,28%
70,27 %
4,44
TFF1 (≥1.0 ng /ml)
58,33%
72,97%
3,78
Effekt av HP infeksjon på ROCer av serum TFFs
for ytterligere å evaluere prediktiv kraft TFFs og PG i /II, magekreft og sunne gruppene ble videre inndelt i henhold til HP positivitet og deretter ble utført ROC analyse. AUC for HP positive mage kreftpasienter var signifikant større for TFF3 (0,83, 95% CI [0,73, 0,94]) og PG I /II ratio (0,86, 95% CI [0,74, 0,98]) enn for enten TFF1 eller TFF2 (Figur 3A). I motsetning til dette, var AUC for HP negativ gruppe var noe mindre enn for HP positiv. AUC for TFF3, TFF2, og PG I /II-forholdet var veldig nær ved 0,77, 0,75 og 0,72, henholdsvis (figur 3B). Disse resultatene indikerer at TFF3 er en litt bedre markør enn PG-I /II-forholdet for detektering av magekreft uavhengig av HP infeksjonsstatus. Figur 3 For HP +/- pasienter, ROC kurver av serum TFFs og PG I /II-forhold. (A) For HP-positive pasienter, arealet under kurven for serum TFF1, TFF2, TFF3 og PG I /II-forholdet var 0,67, 0,72, 0,83 og 0,86, henholdsvis. Serum TFF3 og PG I /II-forholdet viste en god ROC kurve. (B) For HP negative pasienter, arealet under kurven for serum TFF1, TFF2, TFF3 og PG I /II-forholdet var 0,64, 0,75, 0,77 og 0,72 kroner.
Effekt av sammenslåing måling av serum TFF3 og PG test for magekreft bestemmelse
Vi neste analysert nøyaktigheten av å bruke både konsentrasjonen av TFF3 og PG test for påvisning av magekreft. I henhold til kriteriene for PG +, ble 24 av de 72 pasientene gastriske detektert av PG-testen. Imidlertid, når serum TFF3 testen ble tilsatt, 54 av de 72 magekreftpasienter med magekreft ble påvist, det vil si en ekstra 30 pasienter med magekreft som ikke ble identifisert ved PG-testen alene ble plukket opp av serumet TFF3 test . Tvert imot, 6 pasienter med magekreft som ikke ble oppdaget av serum TFF3 var positive med PG test. Således, selv om følsomheten av de kombinerte tester økes til 75%, ble spesifisiteten redusert.
Forholdet mellom serum TFFs og histologiske typer og stadier av TNM magekreft
Konsentrasjonene av serum TFFs ble sammenlignet med histologiske typer og TNM stadier av magekreft for å undersøke deres innflytelse på magekreft utvikling og progresjon. Konsentrasjonen av serum TFF1 var ikke signifikant forskjellig mellom ulike histologiske typer eller TNM etapper. Konsentrasjonen av serum TFF2, var signifikant lavere hos pasienter med tarm type enn diffuse typen magekreft (0,87 ± 0,07 vs 1,19 ± 0,10, P
= 0,0373), men det var ikke forskjellig mellom tidlige og avanserte stadier av magekreft. Konsentrasjonen av serum TFF3 hos pasienter med tarmtypen magekreft var signifikant lavere enn i diffus type (43,87 ± 2,74 vs 54,72 ± 3,10, P = 0,0242
), det ble også redusert hos pasienter med tidlig magekreft enn hos dem avansert magekreft (42,50 ± 3,32 vs 53,36 ± 2,74, P
= 0,0497) (figur 4). Som en kontroll, PG I /II-forhold var ikke signifikant forskjellig i enten ulike histologiske typer eller TNM stadier av magekreft. Figur 4 Fordeling av serum TFF3 i differensiert eller udifferensiert, tidlig eller avansert magekreft. Konsentrasjonen av serum TFF3 i pasienter med differensiert magekreft var signifikant lavere enn i udifferensiert gruppe (P
= 0,0273). Serum TFF3 nivå hos pasienter med tidlig magekreft var også betydelig lavere enn i avansert magekreft (P
= 0,0497). Resultatene viste at konsentrasjonen av serum TFF3 har korrelert med histologiske type og TNM stadier av magekreft.
Diskusjon
Magekreft er en av de mest vanlige ondartede sykdommer. Det er vanligvis oppdaget på et avansert stadium hvor prognosen er dårlig, og overlevelse er lav. For å redusere sykdomsrelatert dødelighet og bedre overlevelse, er bedre biomarkører nødvendig for screening og tidlig oppdagelse av magekreft. Den pepsinogen test har vært brukt for magekreft screening i Japan [28, 29] og har nylig begynt å bli brukt i Kina. Følsomheten av pepsinogen testen har blitt rapportert å være i området 45-77% med spesifisitet som strekker seg 68-87% [30-32]. I denne studien, følsomheten av pepsinogen testen var 37,5%, mens spesifisitet var 81,1%, og odds ratio var 2,57. Den relativt lavere følsomhet av pepsinogen test i vårt studium, sammenlignet med den rapporterte rekkevidde, kan være forbundet med bruk av ulike PG immunoassay kit. Iijimas K et al. [33] har tidligere rapportert at serum PG I nivå bestemmes ved hjelp av GastroPenal test (Biohit Plc) var dobbelt så høy som de oppdages med den japanske kit, selv om PG analyser med begge settene var i stand til å identifisere signifikante sammenhenger mellom PG konsentrasjon og mage kreft. I tillegg kan våre resultater blir påvirket av høyere rate av diffuse typen mage kreft i våre studie rekrutter. Faktisk har serum PG II nivåer er rapportert å være økt hos pasienter med diffuse typen kreft [34]. Kort sagt, virker det som PG test for magekreft er lett påvirket av ulike faktorer og derfor ikke oppfyller de ideelle kriteriene for screening.
Kaise M et al. [35] var den første til å rapportere at serumnivåer TFFs, spesielt TFF3, er betydelig knyttet til tilstedeværelsen av magekreft. I vår kohort, serumkonsentrasjonen av TFFs viste signifikant høyere odds ratio enn pepsinogen test. Av de tre TFFs, den beste biomarkør var serum TFF3 som hadde en sensitivitet på 66,67%, en spesifisitet på 83,78%, og en odds ratio på 10,33.
Komparativ analyse av pepsinogen test- og serum TFF konsentrasjoner for screening av magekreft ytterligere belyse deres respektive prediktiv kraft. Vi fant at 48 (66,7%) av de 72 pasienter med magekreft, var negative for den pepsinogen testen, mens serumet TFF3 konkluderte med et ytterligere 30, følsomheten for å kombinere resultatene av serum TFF3 og pepsinogen testene var 75%, noe som var bedre enn for enten tester alene.
i HP positive pasienter, AUC for serum TFF3 var svært nær det av PG i /II ratio (0,83 vs 0,86). I HP negative fag, men AUC for serum TFF3 var litt større enn for PG I /II ratio (0,77 vs 0,72). Serum TFFs og PG tester er begge basert på histologiske endringer i den gastriske slimhinne fra atrofisk gastritt. I denne studien ble HP infeksjon bestemt ved å måle serum anti-HP IgG-nivåer. Imidlertid er anti-HP-IgG-nivåer rapportert å avta når atrofisk gastritt har utvidet til det meste av fundus-området i magen etter langvarig HP-infeksjon [36]. Dermed kan HP positive pasienter i denne studien omfatter pasienter med magekreft og ikke-kreft personer med samme grad av alvorlighetsgraden av atrofisk gastritt. Deretter, er det vanskelig å screene for magekreft ved hjelp av atrofisk gastritt relaterte markører i denne sammenheng. Faktisk, prediktiv kraft av HP smittestatus var mindre enn for enten serum TFF3 eller PG test.
Vi vurderte også forholdet mellom TFF3 og histologisk type og stadium i magekreft. Vi fant at serumkonsentrasjonen av TFF2 og TFF3 hos pasienter med tarm typen magekreft var lavere enn hos pasienter med diffuse typen. Verken serum TFF1 eller forholdet PG I /II var signifikant assosiert med enten den histologiske type eller TNM stadium. Muller et al. [37] har tidligere rapportert en meget signifikant korrelasjon mellom TFF1 uttrykk og at av pepsinogen II, en markør for mage differensiering, i adenokarsinom i ventrikkel vev. Det var imidlertid ingen signifikant sammenheng mellom TFF1 uttrykk og histologisk type magekreft. Tilsvarende har TFF1 knockout mus vist seg å utvikle både mage adenomer og karsinomer [38]. Videre TFF1 har vist seg å være markert nedregulert i human magekreft [39]. Disse observasjonene kan forklare til en viss grad hvorfor serum TFF1 og forholdet PG I /II ikke var relatert med histologiske typer og TNM stadier i magekreft. Med hensyn til TFF2 har spasmolytisk polypeptid (TFF2) -expressing metaplasi (SPEM) ofte blitt observert i mageslimhinnen rundt magekreft og TFF2 er rapportert å være nedregulert (83,3%) i primær magekreft [40]. Dermed lavere nivå av serum TFF2 hos pasienter med tarm typen magekreft kan reflektere utskifting av SPEM med intestinal metaplasi. I kontrast, har TFF3 blitt rapportert å være oppregulert i de fleste maligne svulster inkludert primær magekreft [23-27]. Videre har uttrykket blitt korrelert med en svært aggressiv fenotype og dårlig prognose [41]. Im et al. videre funnet at TFF3 uttrykket er høyere hos pasienter med udifferensiert typen magekreft, og at det signifikant korrelert med fremskredne stadier [39]. Dermed er resultatene fra vår undersøkelse er svært i tråd med disse rapportene. Imidlertid, i henhold til histopathogenesis av magekreft, fordi TFF3 er sterkt uttrykt av slimceller i det normale tarm og i tarmmetaplastiske epitelet i magen, høy ekspresjon av TFF3 ville være forventet i differensialtypen og tarmtypen magekreft. Videre undersøkelser er derfor nødvendig for å forklare disse motstridende fenomener. Spesielt, har andre studier har nylig rapportert at serum TFF3 er økt i pasienter med lungecancer, endometrial cancer, og prostatakreft, og at TFF3 er uttrykt i vev av disse kreftformene [24, 26, 27]. Dermed kan forhøyede serum TFF3 nivåer ikke være spesifikk for magekreft. Derfor opprinnelsen til høye serum TFFs også behov for videre undersøkelse.
En begrensning med denne studien er partisk prøvetaking på grunn av sin innmelding av fagene fra en klinisk rekke sykehus tilfeller blandet med friske personer fra helsesjekk sentrum av et sykehus snarere enn en populasjonsbasert kohort. Antallet studiesaker var også begrenset. Følgelig er ytterligere befolkningsbaserte studier eller store kliniske kohortstudier nødvendig for å bekrefte den sterke prediktiv kraft av serum TFF3 samt at den er sammen med PG test, og derved identifisere muligheten for serum TFF3 som en ikke-endoskopisk biomarkør i populasjonsbasert screening for magekreft.
Konklusjoner
å vurdere sin bruk som potensielle biomarkører for populasjonsbasert screening, utforsket vi prediktiv kraft av serum TFFs sammenlignet med den til PG test for påvisning av magekreft . Vi har funnet at for det første er konsentrasjonen av serum TFF3 kan være en bedre biomarkør av magekreft enn PG-testen. For det andre, kan kombinasjonen testing av serum PG og TFF3 forbedre effektiviteten av magekreft screening. For det tredje har serum TFF3 nivå en tilknytning til differensiering type og TNM stadium i magekreft. Våre funn støtter derfor serum TFF3 konsentrasjon som biomarkør for magekreft screening
Forkortelser
TFFs.
Serum trekløverfaktorer
PG:
pepsinogen
CAG:
Kronisk atrofisk gastritt
CNAG:
Kronisk ikke-atrofisk gastritt
HP:
Helicobacter pylori
Ig:
immunoglobulin
ELISA:
Enzyme-linked immunosorbent analysen
TMB:
tetrametylbenzidin
PG +: pg positiv
ROC:
Receiver Operating Characteristic
bilder AUC. areal under disse kurvene
bilder Erklæringer
Takk
studien ble støttet av Young Ningbo Fremragende Helse Talenter Fund, Ningbo Natural Science Foundation (NO. 2012A610212), Vitenskaps Innovation Team Project of Ningbo (NO. 2013B82010) og klinisk Scientific Research Foundation of Zhejiang Medical Association (NO. 2013ZYC-A65).
Forfattere 'originale legges filer for Images Nedenfor er linker til forfatternes opprinnelige legges filer for bilder. 12876_2013_1108_MOESM1_ESM.tif Forfatteroriginalfilen for figur 1 12876_2013_1108_MOESM2_ESM.tif Forfatteroriginalfilen for figur 2 12876_2013_1108_MOESM3_ESM.tif Forfatteroriginalfilen for figur 3 12876_2013_1108_MOESM4_ESM.tif Forfatteroriginalfilen for figur 4 Konkurrerende interesser
Forfatterne erklærer at de har ingen konkurrerende interesser. bidrag
Forfatternes
ZH designet studiet og skrev avisen. QZ og HD deltatt i skrivingen av papiret. XZ, HL, LW og DW oppnådde prøvene og analysert dataene. Alle skapere som er godkjent av den endelige manuskriptet før innsending. Alle forfattere lese og godkjent den endelige manuskriptet.
 Hva er forholdet mellom inntak av fermentert mat, tarmmikrobiota og helse?
Helsefordelene til fermentert mat har blitt anerkjent i århundrer og stammer fra tilstedeværelsen av levende mikroorganismer og de fermenteringsassosierte modifikasjonene til matproduktets ingrediense
Hva er forholdet mellom inntak av fermentert mat, tarmmikrobiota og helse?
Helsefordelene til fermentert mat har blitt anerkjent i århundrer og stammer fra tilstedeværelsen av levende mikroorganismer og de fermenteringsassosierte modifikasjonene til matproduktets ingrediense
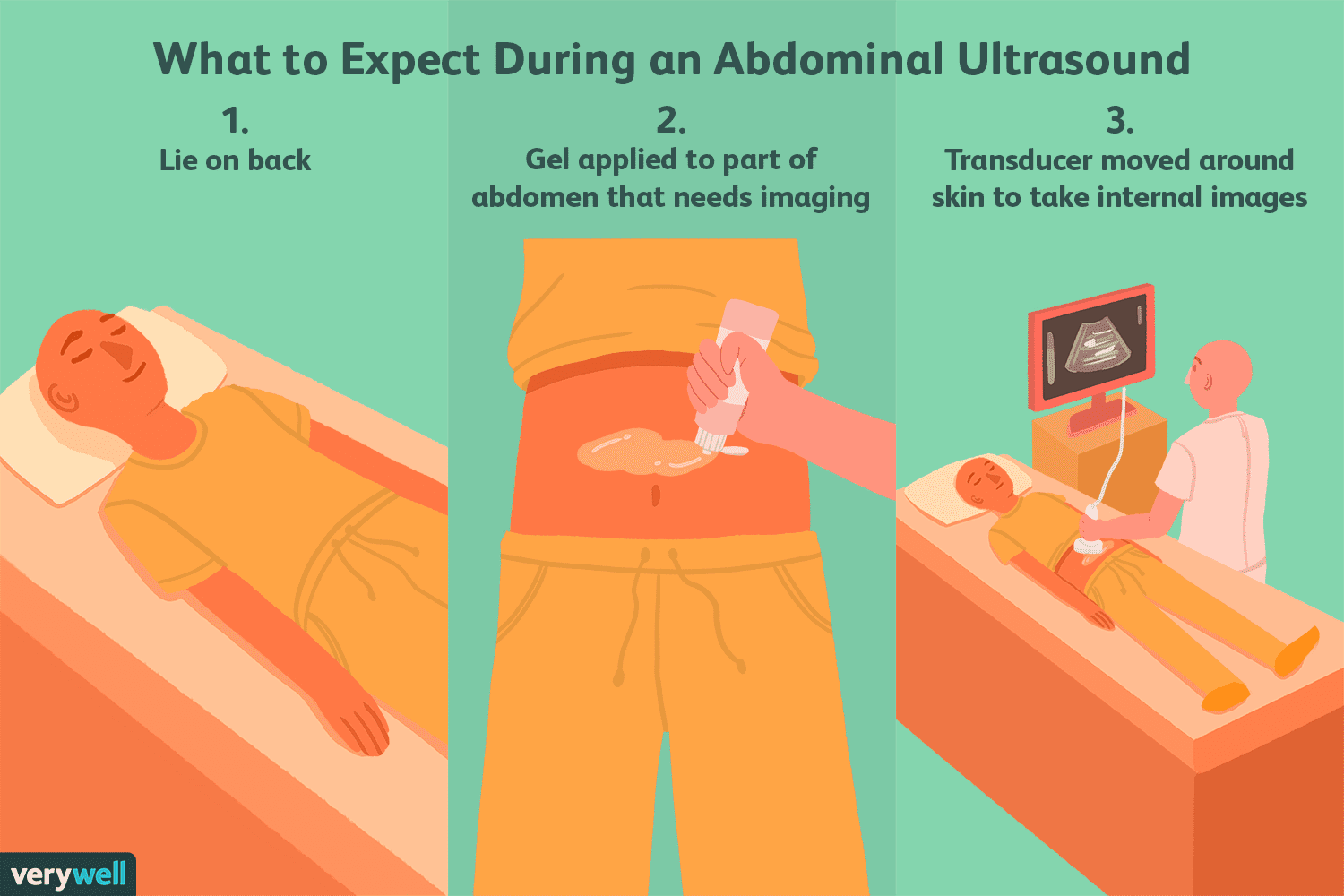 Hva er en abdominal ultralyd?
En abdominal ultralyd (eller sonografi) er en ikke-invasiv måte å se organene i bukhulen på. I motsetning til andre typer medisinske avbildningstester, bruker ikke ultralyd ioniserende stråling. I ste
Hva er en abdominal ultralyd?
En abdominal ultralyd (eller sonografi) er en ikke-invasiv måte å se organene i bukhulen på. I motsetning til andre typer medisinske avbildningstester, bruker ikke ultralyd ioniserende stråling. I ste
 SCD Intro Diet Kyllingsuppe:Hvordan lage den riktig og hvorfor du bør spise den!
Intro Diet Kyllingsuppe er den grunnleggende delen av SCD Intro Diet. Jeg ønsket å sette sammen dette innlegget for å hjelpe deg i gang med introdietten. Det meste av dette materialet er direkte fra e
SCD Intro Diet Kyllingsuppe:Hvordan lage den riktig og hvorfor du bør spise den!
Intro Diet Kyllingsuppe er den grunnleggende delen av SCD Intro Diet. Jeg ønsket å sette sammen dette innlegget for å hjelpe deg i gang med introdietten. Det meste av dette materialet er direkte fra e