MiR-146a rs2910164 G /C polymorfisme og magekreft mottakelighet: en meta-analyse
Abstract
Bakgrunn
Bevis har vist at enkeltnukleotidpolymorfi ligger i pre-miRNA eller modne mikroRNA kan endre ulike biologiske prosesser og påvirke behandlingen av kreftutvikling. Publiserte resultater om sammenhengen mellom MIR-146a rs2910164 G /C polymorfisme og human magekreft mottakelighet er mangelfulle. Målet med denne studien var å få en mer presis effekt av foreningen mellom MIR-146a rs2910164 polymorfisme og mage risiko ved meta-analyse.
Metoder
Kvalifiserte genetiske assosiasjonsstudier ble søkt fra PubMed, Web of Knowledge og kinesisk biomedisin Database på menneske. Kvantitative data syntese ble gjennomført for sammenslutninger av MIR-146a rs2910164 G /C polymorfisme med mottakelighet for magekreft.
Resultater
ni utvalgte studier som inkluderte totalt 3,885 mage kreftpasienter og 5,396 kontroller ble identifisert i nåtiden meta-analyse. Den samlede eller indikert en mulig sammenheng mellom rs2910164 polymorfisme og GC men virkningen var ikke statistisk signifikant (GG vs. CG /CC: OR = 1,076, 95% CI 0,925 til 1,251, p = 0,342). Når stratifisering for befolkningen, viste resultatet at Mir-146a rs2910164 GG genotype var assosiert med økt magekreftrisiko blant kinesere i recessive modell (GG vs. CG /CC: OR = 1,171, 95% KI 1,050 til 1,306, p = 0,005) . Dessuten ble ingen signifikant forskjell funnet i kjønn, røyking, plassering, metastasering av lymfeknute og Lauren klassifisering.
Konklusjoner
stede meta-analyse antyder en økt risiko mellom MIR-146a rs2910164 GG genotype og magekreft mottakelighet Chinese basert på publiserte litteraturen.
nøkkelord
mikroRNA-146a Mage neoplasmer Polymorphism Meta-analyse Bakgrunn
Magekreft kreft~~POS=HEADCOMP (GC) er fortsatt en av de vanligste årsakene til kreft-relaterte dødsfall verden over til tross for en generell nedgang i forekomst i løpet av de siste 10 årene [1], [2]. Det er generelt akseptert at enkelte genetisk mottakelighet har en viktig rolle i patogenesen av svulsten inkludert GC.
MicroRNAs (mirnas /MIR) er endogene 18-24 nukleotid ikke-kodende RNA som kunne regulere genekspresjon og sekvensielt regulere ulike biologiske prosesser [3 ], [4]. Funksjonell karakterisering av noen microRNAs i kreft initiering og progresjon indikerer at de kan spille en viktigere rolle i patogenesen av kreft hos mennesker [5], [6]. Forholdet mellom miRNA og kreft har blitt grundig studert siden 2002, har den første demonstrasjonen av en kobling mellom miRNA gener og kreft [7].
Studier vist at polymorfismer i pre-miRNA eller Eldre mikroRNA kan endre ulike biologiske prosesser ved påvirke uttrykket og /eller target utvalg av microRNAs [8], [9]. I løpet av det siste tiåret, en rekke studier identifisert genetiske varianter i forløperen eller modne miRNA sekvens av MIR-146a rs2910164 (G > C), som er rapportert å være assosiert med brystkreft og leverkreft [10], [11].
En rekke studier ble publisert for å beskrive sammenhengen mellom MIR-146a rs2910164 G /C polymorfisme og kreftrisiko i de siste årene. En meta-analyse rapportert av Lian et al. [10] konkluderte med at CC homozygot av rs2910164 kan bidra til brystkreft mottakelighet blant europeere. En annen meta-analyse viste at det er ingen signifikant korrelasjon mellom har-MIR-146a rs2910164 polymorfisme og risiko for brystkreft [12]. En stor meta-analyse i 2013 ikke klarte å finne noen signifikant sammenheng mellom rs2910164 polymorfisme og risiko for brystkreft [13]. Basert på systematisk gjennomgang, Chen et al. [14] rapporterte at kvaliteten på bevisene var lav for rs2910164 SNP genetisk tilknytning til lungekreft. Flere metaanalyser samlet sammenhengen mellom rs2910164 polymorfisme og kreftrisiko generelt [15], [16]. Noen meta-analyse rapporterte rs2910164 polymorfisme og gastrointestinal kreft mottakelighet [17] -. [19]
Men publiserte data på sammenhengen mellom MIR-146a rs2910164 G /C polymorfisme og human magekreft mottakelighet er inkonsekvent og mangelfulle. Derfor utførte vi den nåværende meta-analyse for å kvantitativt anslå sammenslutning av MIR-146a G /C SNP med magekreft risiko.
Metoder
Litteratur søkestrategi
Elektroniske databaser inkludert PubMed, Web of Knowledge og kinesisk biomedisin Database (CBM) ble søkt etter relevante studier utført på menneske frem til juli 2014. følgende søkeord ble brukt: 'mage "eller" mage "," svulst "OR" carcinoma "OR" kreft "OR" svulst "OR" adenokarsinom "og" Mir-146a OR "miRNA-146a" OR "mikroRNA-146a" OR "har-MIR-146a". For ytterligere å identifisere potensielt relevante studier ble referanselistene til artiklene som er identifisert i det første søket også skannet manuelt. Vi direkte kontaktet forfatterne for relaterte data som var tilgjengelig i den originale publikasjoner
inklusjons- og eksklusjonskriterier
studier ble vurdert kvalifisert hvis de møtte alle av følgende kriterier: (1). Utforske sammenhengen mellom MIR-146a polymorfisme og menneskelig GC risiko, (2) utforming som kasus-kontrollstudier (3) identifisering av magekrefttilfeller ble bekreftet histologisk eller patologisk. Studiene ble ekskludert på grunnlag av en av følgende årsaker: (1) ikke tilstrekkelige data rapportert, (2) artikler av bokstaver, anmeldelser, kasusrapporter, konferanse abstracts, ledere eller ekspertuttalelser. Hvis serie studier av den samme befolkningen fra den samme forskergruppen ble publisert, ble bare den største serien valgt.
Data utvinning
siste sett med artikler ble vurdert uavhengig av to korrekturlesere (Zhong Xu og Lingling Zhang) i henhold til inklusjonskriteriene nevnt ovenfor. Uenighet ble løst ved diskusjon. Følgende informasjon ble hentet fra hver rapport. Første forfatter, årstall, studiepopulasjonen, etnisitet, antall GC saker og kontroller, hyppighet av genotyper, og genotyping metode
Statistisk analyse
Hardy-Weinberg likevekt (HWE) status ble undersøkt ved Pearsons godhet-of-fit χ
2 test i hver studie (P
< 0,05 ble ansett som betydelig ubalanse i kontrollgruppen). Styrken i sammenhengen mellom GC og Mir-146a rs2910164 polymorfisme ble vurdert ved å beregne odds ratio (OR) med 95% konfidensintervall (KI). De sammenslåtte Ors ble hentet fra kombinasjon av enkelt-studier ved homozygot sammenligning (GG vs. CC), heterozygot sammenligning (CG vs. CC), dominant og recessive modeller (CG /GG vs. CC, og GG vs. CG /CC), allel sammenligning (G vs. C), respektivt. Analysen av heterogenitet mellom studiene ble bestemt ved hjelp av Cochrane Q test og jeg
2-test (P
< 0,10 eller jeg
2 > 50% ble ansett som et tegn på statistisk heterogenitet) [20]. Da var det ingen signifikant heterogenitet eksisterende blant studiene, ble den samlede ORS estimat av hver studie beregnet av fast-effekt-modell. Ellers ble det tilfeldig effekt modell ansatt. Subgruppeanalyser ble fordelt etter studiet karakteristiske hvis det var nok rapporter. Sensitivitetsanalyse ble utført ved å slette en enkelt studie hver gang for å undersøke påvirkning av individuelle datasett på de samlede ORS. Publikasjonsskjevhet ble vurdert ved hjelp av metoder for Begg er trakt plott og Egger test (P
< 0,05 ble ansett som representativ for statistisk signifikant publikasjonsskjevhet) [21], [22]. Statistiske analyser utført ved hjelp av programvaren Stata12.0 (Stata Corpotion, College Station, Texas).
Resultater
Studier utvalg og egenskaper ved de inkluderte studiene, En totalt 288 artikler ble identifisert fra PubMed, ISI og CBM database. Flytdiagrammet oppsummerer litteraturgjennomgang prosessen som vist i Figur 1. I alt ni studier med 3,885 GC saker og 5,396 kontroller ble til slutt samlet for nåværende meta-analyse [23] - [31]. Det som kjennetegner disse studiene er listet i tabell 1. Blant dem ble syv studier utført i Asia (inkludert pasienter fra Kina, Japan og Korea), to studier i Europa (inkludert pasienter fra Hellas, Tyskland, Litauen og Latvia). Artikkel av Okubo et al. [32] ble ekskludert på grunn av dobbeltarbeid med en annen studie [23]. Alle de inkluderte artiklene var sykehusbaserte case-kontrollstudier. Fordelingen av genotyper i kontrollene av alle ni studier var i samsvar med HWE. Figur 1 Flytskjema for studier inkludering og ekskludering.
Tabell 1 Kjennetegn på studier som inngår i meta-analysen
Førsteforfatter
År
Sted
genotyping metode
No. av tilfellene
No. av kontroller Book Cases
Controls
PHWEfor control
CC
CG
GG
CC
CG
GG
Okubo
2010
Japan
PCR-RFLP
552
697
236
243
73
254
322
121
0.2776
Zeng
2010
China
PCR-RFLP
304
304
89
153
62
119
132
53
0.1223
Hishida
2011
Japan
PCR-CTPP
583
1637
230
271
82
633
775
229
0.7381
Zhou F
2012
 Tarmmikrobiom knyttet til atferdsproblemer hos barn
Barn med atferdsproblemer kan ha forskjellige sammensetninger i tarmmikrobiomet, med foreldre som spiller en viktig rolle i hvor markante forskjellene var, annet enn maten de gir, en ny studie antyder
Tarmmikrobiom knyttet til atferdsproblemer hos barn
Barn med atferdsproblemer kan ha forskjellige sammensetninger i tarmmikrobiomet, med foreldre som spiller en viktig rolle i hvor markante forskjellene var, annet enn maten de gir, en ny studie antyder
 Hvordan bli kvitt hikke raskt
Hva er hikke? En kvinne som drikker fra motsatt kant av glasset kan redusere hikken. Kilde:Getty Images Hovedmuskelen som hjelper lungene dine med å utvide og trekke seg sammen for å puste, er m
Hvordan bli kvitt hikke raskt
Hva er hikke? En kvinne som drikker fra motsatt kant av glasset kan redusere hikken. Kilde:Getty Images Hovedmuskelen som hjelper lungene dine med å utvide og trekke seg sammen for å puste, er m
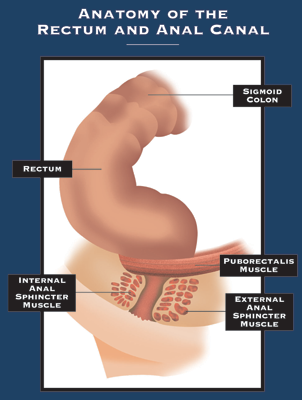 Analfistler
Hva er en analfistel? En fistel er en unormal forbindelse mellom to organer eller to vevsoverflater. En analfistel (fistel-i-ano) er en forbindelse mellom analkanalen og huden. For å forstå årsaken,
Analfistler
Hva er en analfistel? En fistel er en unormal forbindelse mellom to organer eller to vevsoverflater. En analfistel (fistel-i-ano) er en forbindelse mellom analkanalen og huden. For å forstå årsaken,