Induksjon av kromosom ustabilitet og magekreft ved å endre uttrykket mønster av mitotiske sjekkpunkt gener hos mus eksponert for areca-mutter
Abstract
Bakgrunn
Det er sterke indikasjoner for en årsakssammenheng mellom areca-mutter forbruk og kreft. I Meghalaya, India, er det mangfoldet av areca mutteren brukt som rå og ubehandlet form hvis kjemiske sammensetning og farmakologiske tiltak er rapportert. Men vi vet lite på den første bane er involvert i areca-mutter forbundet karsinogenese, siden det er vanskelig å vurdere dens virkning på genetiske endringer uten innblanding av andre sammensatte faktorer. Derfor ble foreliggende undersøkelse foretatt på mus for å verifisere evnen til rå areca-mutteren (RAN) for å indusere kreft og for å overvåke ekspresjon av visse gener som er involvert i kreftutvikling. Denne studien var ikke ment å isolere eventuelle aktive ingredienser fra RAN og å se sin handling.
Metoder
Tre grupper av mus (n = 25 i hver) ble tatt og brukt på ulike tidspunkter for ulike eksperimentell analyse . De tre andre grupper av mus (n = 15 i hver) ble vurdert for tumorfremkallelse studier. I hvert sett, ble to grupper administrert RAN-ekstrakt ad libitum
i drikkevannet med eller uten kalk. Ekspresjon av visse gener ble bestemt ved konvensjonell RT-PCR og immunblotting. Musene ble gitt hele RAN-ekstrakt med og uten kalk for å etterligne konsum stil av RAN. Search Results
Histologisk utarbeidelse av magen vev avslørt som kjørte indusert magekreft. En gradvis økning i hyppigheten av bråmoden anaphase og aneuploide celler ble observert i benmargceller med en større økning følgende RAN + kalk administeration. Nivåer av p53, Bax, Securin Hotell og p65
i spiserøret og magen celler ble hevet i løpet av tidlige dager av RAN eksponering mens de forskjellige mitotisk sjekkpunkt proteiner ble nedregulert. Apoptotisk celledød ble påvist i ikke-kreft magen celler, men ikke i tumorceller som viste overekspresjon av Bax Hotell og fravær av PARP
.
Konklusjon
studien antydet (a) RAN induserer magekreft, men tilstedeværelsen av kalk fremmes høyere celletransformasjon og derved utvikles kreft tidligere, (b) forstyrrelser i komponenter av kromosom segregering maskineri kan være involvert i den opprinnelige prosess med karsinogenisitet og (c) viktigheten av tidlig utviklet anaphase som et screening-markør for identifisering av mitotiske sjekkpunkt defekter i tidlige dager.
nøkkelord
kromosom ustabilitet mitotiske sjekkpunkt gener Securin
apoptose bakgrunns
Esophageal plateepitelkarsinom (ESCC) og mage kreft er de vanligste kreftformene i India, med høyest forekomsten av ESCC å være i nord-østlige statene i India [1]. Det er sterke indikasjoner for en årsakssammenheng mellom areca-mutter eller quid tyggevaner og disse kreftformene. Flere studier på forskjellige dyrearter har vist positive induksjon av tumorer i både målet (kinn-posen, spiserør og mage) og ikke-target (lunge og lever) vev når arecolin (ARC) eller areca-mutter ekstrakt ble administrert ved forskjellige midler slike som oral intubasjon [2], blandet med dietten [3], og kinn-bandsjering [4]. Derfor virker det som metabolsk aktivering av alkaloider er nødvendig for den endelige konvertering til den ultimate kreftfremkallende, som er sterkt preget av fysiologiske forhold og tilstedeværelsen av visse faktorer [5]. Rapporter har antydet generasjon av reaktive oksygenforbindelser (ROS) fra areca-mutter ingredienser under alkaliske betingelser [6, 7]. På grunn av tilstedeværelsen av kalk i betel-pund preparat, areca-mutter tyggere 'spytt endrer vanligvis fra nøytral til alkalisk tilstand som kan være ideell for generering av ROS [7]. Nair et al. [6] har også bemerket at i tillegg ARC, kan auto-oksidasjon av Areca-mutter polyfenoler generere H
2o 2 og superoxide radikaler ved alkalisk pH.
I delstaten Meghalaya, India, variasjonen av areca mutter, lokalt kalt "Kwai ', blir brukt som umoden og ubehandlet rå form, som har høyere innhold av alkaloider, polyfenoler og tanniner i forhold til den tørkede formen [8]. Betel-pund brukt i Meghalaya inneholder rå areca mutteren (RAN), lime lime og liten del av Betel-blad uten tobakk og andre bestanddeler. Her folk svelge hele pund etter å tygge i stedet for å spytte det ut noe som kan være en viktig faktor for ESCC og magekreft. Nylig, 40% esophageal kreft prøver fra pasienter med Meghalaya tilstand som bare har RAN-chewing vane viste sletting av mikro markører D9S1748 og D9S1749, som ligger nær ekson 1β av CDKN2A /ARF
genet på 9p21. Arrangøren hypermethylation av CDKN2A
genet var betydelig høyere i prøvene med vane å RAN-tygging alene enn de som har for vane å bruke både RAN og tobakk [9]. Til nå vet vi ikke mye på den første veien innebærer i betel-nøtt forbundet kreftutvikling i spiserøret og magen. Det er også vanskelig å vurdere virkningene av rent og hovedsakelig areca-mutter-indusert genetiske endringer i menneskers uten innblanding av andre sammensatte faktorer som tobakk tygge eller røyking, alkoholbruk, ulike typer ikke-vegeterian mat etc. Videre tilstedeværelse av kalk gjør en alkalisk tilstand som ikke er ideelt for in vitro
cellekultur og derfor effekten av areca-mutter kan ikke testes i cellekultursystemer. I lys av disse, ble den foreliggende studie utført på mus for å verifisere evnen til RAN-ekstrakt med eller uten kalk, for å fremkalle kreft og samtidig beregne uttrykket mønster av visse gener som spiller en viktig rolle i den opprinnelige prosess med karsinogenese.
kjemisk sammensetning og farmakologiske virkninger av areca mutteren er blitt rapportert og anmeldt av flere arbeidere [10, 11]. Flere dyrestudier har bekreftet at areca-mutter produkter og betel spesifikke nitrosaminer, har evnen til å indusere neoplastiske endringer i forsøksdyr [11]. Betydelig bevis tyder på at Areca-nut-alkaloider, hovedsakelig arecolin (ARC) er de viktigste faktorene i BN-toksisitet [11]. Det ble vist at ARC kan indusere DNA-skader i musebenmargceller [12] og slike DNA-skader kan reduseres når ARC administreres sammen med N-acetyl-L-cystein [13]. Derfor er det verdt å nevne at den foreliggende undersøkelse ikke er beregnet for å isolere eventuelle aktive ingredienser fra RAN og å se sin handling. Målet med studien var å identifisere den første reaksjonsveien er involvert i RAN forbundet karsinogenese i mus og derfor mus ble gitt hele RAN-ekstrakt med og uten kalk for å etterligne forbruket vane å menneske.
Flere gener, slik som p53 , p65, Securin
og mange andre, er kjent for å være vanligvis overuttrykt i kreftutvikling [14-16]. Videre er genetisk ustabilitet også forbundet med kromosom ustabilitet (CIN) som fører til Aneuploidy, et kjennetegn på kreft. Slike Aneuploidy kan lette tumorigenesis gjennom tap av tumor suppressor gen-funksjon. Det har blitt observert at den delvis tap av mitotisk sjekkpunkt kontroll fører til CIN i humane kreftceller [17, 18]. Derfor, i denne studien, vurderte vi uttrykket mønster av p53, p65, Securin Hotell og flere mitotiske og spindelenheten sjekkpunkt gener på forskjellige tidspunkter. Vi observerte at RAN kan indusere magekreft ved perturbing komponentene i kromosom segregering maskiner.
Metoder
Utarbeidelse av ekstrakter
Etter beskytningen fiber strøk fra ubehandlet rå og umoden areca mutteren (RAN), 100 g av RAN ble malt og suspendert i 125 ml destillert vann og blandet grundig for å gi en glatt pasta for fremstilling av en vandig ekstrakt av RAN. Etter 24 timer ble massen omrørt i 3 timer ved 37 ° C, og det vandige ekstraktet ble oppsamlet ved sentrifugering. Denne ekstraksjon prosedyre ble gjentatt nok en gang ved å tilsette 125 ml vann til residuet. Begge ekstrakter ble slått sammen, tilsvarende 100 g RAN i 250 ml destillert vann, filtrert og frosset ved - 80 ° C. Filtratet ble lyofilisert i et Secfroid Lyolab BII frysetørrer (Danmark). Det lyofiliserte massen ble holdt ved 4 ° C inntil bruk. Ekstraktet inneholdt 0,9 g /100 g vann-uttrekk materialet
. Dyr vedlikehold og behandling
sveitsiske albino mus (25-30 g), 2-3 måneder gammel ble opprettholdt i laboratoriet i samfunnet bur i et rom med kontrollert temperatur (20 ± 2 ° C) og kontrollert belysning (12 timer lys, 12 timer mørke). Standard muse diett (NMC Oil Mills Ltd, Pune, India) og vann ad libitum
ble brukt i alle forsøk. Forsøkene ble utført i samsvar med institusjonens retningslinjer og godkjent av våre "institusjonelle standarder for Animal Care og Bruk" Board.
I Set-en, tre grupper av mus (n = 25 i hver) ble tatt som ble brukt ved forskjellige tidspunkter for ulike eksperimentell analyse. I Set-to, tre grupper av mus (n = 15 i hver) ble vurdert for tumorfremkallelse studier. Figur 1 gir en skjematisk oversikt over den totale forsøksprotokoll som ble vurdert i denne studien. I hvert sett, ble en gruppe behandlet med enkel drikkevann ansett for å være ubehandlet, mens to grupper ble administrert RAN trekke ut ad libitum
i drikkevannet med eller uten kalk (pH 9,8). Det ble anslått at hver mus forbrukes 1 mg ekstrakt pr dag. En slik oral administeration ble fortsatt i 60 dager, hvoretter dosen ble økt fra 1 mg til 2 mg pr dag til 120 dager. På samme måte, hver 60. dag senere dosen ble økt med 1 mg per dag forbruk. Figur 1. Flytskjema for eksperimentell design for analyse av rå areca-mutter mediert Carcinogenesis i mus. RAN- rå areca-mutter; d- dager.
Utarbeidelse av metafaser og scoring av kromosomavvik
For meta forberedelse, ble benmargceller (BMC) samlet inn fra to mus per punkt fra ubehandlede, 15 og 30 dager etter behandlede gruppen og tre mus per punkt for resten. I de behandlede grupper, ble BMC oppsamlet etter 15, 30, 60, 120 og 180 dagers behandling. BMC ble også samlet inn fra de to mus som har mage tumor. BMC ble oppsamlet etter 2 timer kolkisinbehandlingen (15 mg /kg). Dyrene ble avlivet ved cervikal dislokasjon. Lårben ble dissekert ut og BMC ble spylt ut ved å injisere 2 ml 0,075 M KCl forvarmet til 37 ° C. Celler ble behandlet i hypoton løsning i 15 minutter og fiksert i eddiksyre og metanol (1: 3). Glass ble fremstilt ved flammetørkemetode, beiset i 5% Giemsa i 5 minutter og montert i syntetisk medium. Bilder av metafase spreads ble tatt under Zeiss Axioskop mikroskop (Tyskland).
For kromosom studie ble lysbildene kodet tilfeldig og minst 100 godt spredt meta plater ble valgt for studien fra hver mus. Vi utførte kromosomtall på metafase spredning. Kromosomavvik ble scoret som isochromatid pauser og kromatid pauser. Se Utvidet Eksperimentelle metoder for detaljer i tilleggsfiler. 1: Opplysning informasjon
immunoblotting
Celler fra benmarg, spiserør (ved å skrape indre lag) og magen (ved å skrape indre delen) ble vasket to ganger med PBS (fosfat bufret saltvann), og ble lysert i radioimmuno-utfelling buffer (0,1% SDS, 2 mM EDTA, 1% NP-40, 1% natriumdeoksycholat, 50 mM natriumfluorid og 100 U /ml aprotinin). Etter 30 min inkubering på is, ble cellelysatene ble sentrifugert i 15 minutter ved 4 ° C, og mengden av protein ble bestemt ved anvendelse av bicinchoninic syre proteinanalyse. Lik mengde av protein (40 ug) fra hver prøve ble applisert i hver brønn; lik belastning ble ytterligere bekreftet ved immunoblotting med aktin antistoffer. Prøvene ble lagt i Novex Tris-Glycine 4-20% stigning gels og elektroforese ble utført i NuPAGE elektroforese system (Invitrogen, USA). Proteiner ble overført til en polyvinylidendifluorid (PVDF) membran (Sigma) etter standard protokoll. Membranene ble undersøkt med en 1: 1000 fortynning av et mus monoklonalt antistoff mot p53 plakater (PAb 240, ab-26; Abcam, USA), Bax plakater (6A7, ab5714, Abcam, USA), Securin
(DCS-280, ab3305, Abcam, USA), β-actin plakater (AC-15; ab6276, Abcam, USA) og kanin polyklonale antistoff mot NF-κβ P65 plakater (ab31481; BCAM, USA). Blottene ble vasket 3 ganger i 10 minutter hver i TBST-buffer pH 7,6 (1 M Tris-Cl, 5 M NaCl og 0,05% Tween 20) og inkubert med sekundært antistoff (alkalisk fosfatase konjugert anti-mus IgG eller alkalisk fosfatase konjugert antikanin IgG 1: 2000; Abcam, USA) i 1 time ved romtemperatur. Etter omfattende vasking ble blotten nedsenket i 4 ml substrat løsning av BCIP /NBT (Bangalore Genei, India). Tilstrekkelig farging ble oppnådd i løpet av 15 min. Hver immunoblotting ble utført i tre mus per-punkt.
Histopatologisk evaluering
magen vev ble samlet inn fra ubehandlet kontroll og fra to Ran + kalkbehandlede mus med tumor. I et annet sett, ble magen vev også samlet inn fra ubehandlet, så vel som fra de grupper som ble behandlet i 300 dager med RAN-ekstrakt med og uten kalk. Tre mus ble valgt tilfeldig fra hver gruppe. Disse musene ikke har noen indikasjon på svulst eksternt. Vevssnitt (5-7 um) ble bearbeidet for histologisk seksjonering i henhold til standardprotokollen [19], og farget med hematoksylin og eosin [20]. Seksjonene ble deretter observert under et lysmikroskop og fotografert (Carl Zeiss, Tyskland).
RNA ekstraksjon og konvensjonell RT-PCR analyse
Cellene ble samlet inn ved å skrape det indre laget av spiserøret og magesekken fra ubehandlet kontroll, løp og løp + lime behandlet mus (tre mus per punkt). Benmargceller ble samlet fra femur ben av musen. Total RNA ble isolert med Trizol og deretter renset ved anvendelse av RNeasy Mini Kit (Qiagen) ifølge produsentens protokoll. Revers transkripsjon ble utført med 1 pg av total RNA fra hver prøve ved anvendelse Quantiscript revers transkriptase, Quantiscript RT-buffer og RT primer-blanding av QuantiTect Reverse Transcription kit (Qiagen GmbH, Hilden, Tyskland) i henhold til produsentens protokoll. Forsterkning av cDNA ble gjennomført i 20 ul løsning som inneholder 2 ul cDNA, 10 pmol primer par for aurora A, aurora B, Mad2, Bub1 og GAPDH (for primer sekvenser, se tilleggsfiler 1: Opplysning informasjon) henholdsvis, og 10 mL av RT qPCR Master mix (Qiagen GmbH, Hilden, Tyskland). PCR bestod av innledende denaturering ved 94 ° C i 5 minutter, fulgt av 30 reaksjonssykler (30 sekunder ved 94 ° C, 30 sekunder ved 60 ° C, og 30 sekunder ved 72 ° C) og en avsluttende syklus ved 72 ° C i 10 min. GAPDH ble benyttet som intern kontroll. Alle PCR-produktene ble elektroforetisk separert på etidiumbromid-farget agarosegel og visualisert med UV-lys.
Strømningscytometrisk analyse av celler
musebenmargceller og cellene samlet ved å skrape det indre lag av spiserør og mage av begge ubehandlet og behandlet i 260 dager med RAN med eller uten kalk ble fiksert med 70% etanol. Magen tumorceller ble også samlet inn og fikset. De fikserte cellene ble vasket i PBS og resuspendert i 500 ul av propidiumjodid-løsning (50 ug /ml propidiumjodid, 0,2 mg /ml RNase) i 1 time ved romtemperatur i mørke. 10.000 celler ble anskaffet for hver prøve og analysert med FACS Calibur (Becton Dickinson). Cellquest Pro-programvare ble anvendt for å kvantifisere cellesyklus avdelinger for å beregne prosentandelen av celler fordelt i de forskjellige cellesyklusfaser.
Annexin V merkings studier
apoptotisk celledød ble evaluert ved bruk av annexinV-fluorescein-isotiocyanat-metoden i magetumorcellene og også i det indre lag av celler av magesekken og spiserøret av ubehandlet og RAN med og uten kalk behandlede mus etter 260 dager med kontinuerlig administeration. Cellepelleten ble resuspendert i PBS. Cellene ble farget med propidiumjodid og Annexin-V-FITC bruker BD PharmingenTM Annexin V: FITC apoptose Detection Kit (BD-Pharmingen biovitenskap, San Diego, CA) som per produsentens anvisninger. I korthet, etter oppsamling og vasking to ganger med PBS, ble cellene resuspendert i bindingsbuffer (500 ul). FITC-Annexin V-(5 ul) ble tilsatt til cellene, etterfulgt av tilsetning av 5 ul PI i henhold til protokollen. Prøvene ble så inkubert i 15 minutter i mørket ved romtemperatur og utsatt for strømningscytometri evaluering.
Statistisk analyse
Verdier blir uttrykt som gjennomsnitt ± SEM eller middelverdi ± SEM for kontroll og eksperimentelle prøver og statistisk analyse ble utført av Student t-test med GraphPad Prism programvare 5.1. Verdiene ble ansett statistisk signifikant, dersom p-verdien var 0,05 eller mindre.
Resultater
Generelle observasjoner
Ut av femten mus, to mus utviklet magekreft etter 220 og 256 dager med fôring av RAN pakke med kalk (Figur 2A a og b). Ingen svulst ble utviklet i mus enten ubehandlet eller gis med RAN bare. Histologisk seksjon tydelig differensiert mellom normal (figur 2A c) og tumorous magen (figur 2A d-f). Men histologisk utarbeidelse av magen vev ble også laget av tre tilsynelatende normale jakt mus tilfeldig utvalgt fra denne gruppen etter 300 dager med fôring med RAN-ekstrakt med og uten kalk. Både RAN med og uten kalk vist sin evne til å fremkalle kreft i magesekken. To av tre mus behandlet med bare RAN viste premalign trinn (dysplasi), mens alle de tre mus behandlet med RAN + kalk viste karsinom (figur 2B). Figur 2 dissekert mus og histopatologi av både normal og svulstvev i magen etter behandling med RAN med og uten kalk. A. dissekert mus med (a) normal mage og (b) tumorous magen indikert med en pil. Histopatologi av normal (c) og tumor mage (d, e og f), som indusert ved RAN ekstrakt med kalk. Pilene indikerer sårdannelse svulst i (d) og tumor kjempeceller i (e og f). Forstørrelsen er indisert enten 10X eller 40X. B. Histopatologi av normal og tumorous magen av mus etter løp og løp + kalk behandling for 300 dager. I alle paneler, "Normal" indikerer mus uten tumor, "dysplasi" indikerer mus med forstadier mage vev. "Carcinoma" indikerer mus med tumorous magen. Dysplasi viser anisokaryosis (variasjon i størrelse på kjerner) og anisocytosis (variasjon i størrelse av celler). Forstørrelsen er indisert enten 10X, 40X og 100X.
Studert på metafase sprer
For å avgjøre om kontinuerlig administeration av RAN ekstrakt (fra 15 til 180 dager) med eller uten kalk har noen effekt på kromosomer, studerte vi metafase spreads etter 2 timers behandling med kolkisin, i benmargsprøver. Data viste en gradvis økning i mitotiske tall med tidlig atskilt søsterkromatider (figur 3A og C) både i løp og løp + kalk administreres mus, mot ingen i ubehandlede mus. Det er også klart fra studien at RAN + kalk administreres mus benmarg viste signifikant høyere frekvens av slike veslevoksen anaphase enn bare kjørte administrert (figur 3A). Etter 180 dagers kontinuerlig administeration av RAN + kalk, 34,4% tidlig utviklet anaphase sammenlignet med 18,4% (p = 0,002) i RAN-administrert mus BMC ble sett. Figur 3 Karyotype analyse av genomisk ustabilitet i benmargsceller fra mus etter eksponering for RAN ekstrakt med (RAN + L) eller uten kalk (RAN). (A) Prosent av metafaser med for tidlig søster-kromatid separasjon. To mus per punkt for ubehandlet, 15 og 30 dager med behandlede gruppen og tre mus per punkt for resten. Minst 100 meta ble avsluttet til hver mus. (B) Normal metafase spredning fra musebenmargceller. (C) Prematur søster-kromatid separasjon fra mus eksponert for RAN. Parentes viser søster kromatider liggende separert i mitotiske tall som viser fenotypen. (D og E) metafase spredning viste 37 og 38 kromosomer, henholdsvis. (F, G og H) metafase spredning viste mer enn 60 kromosomer. (I) viste mer enn 80 kromosomer.
Vi telles antall kromosomer i metafase sprer å forstå betydningen av bråmoden anaphases i forhold til kromosom stabilitet. De ubehandlede mus har en stabil (2n = 40) karyotype (figur 3B) og viste ingen aneuploide celler. Vi gjorde observere lave frekvens av aneuploide celler (figur 3D-I, tabell 1) i RAN-administrert, med og uten kalk, i 120 dager, og det ble bemerket at frekvensen av aneuploide celler ble øket gradvis. Den midlere frekvens (13,8%) av aneuploide celler ble bedømt i både magesekken tumorbærende mus. Samlet, hyppigheten av aneuploide celler var mer følgende RAN + kalk administeration enn RAN alene (tabell 1) .table en kromosom analyse av musebenmargceller etter eksponering for RAN pakke med eller uten kalk
Behandling mønster
Behandling dager
Total spredning scoret
kromosom nr.
Aneuploidy
prematur søster
37
38
39
40
41
42
> 60
% (Mean)
kromatid separasjon%
Ubehandlet
0
110
110
0
0
104
104
0
0
RAN
120
105
en
1 103
1,9
17,5
120
2
1
2
115
4,1
18,7
105
1 2
102
2,8 (2,9)
18,3 (18,2)
RAN + kalk
100
2
2
1 95
5.0
31,7
105
2
2
3
98
6,6
28,6
110
3
2
1 103
1 6,4 (6,0)
28,3 (29,5)
p = 0.015a
RAN
180
101
1 2
1 97
3,9
18,0
124
2
2
1 119
4,0
17,7
114
3
2
1 108
5,3 (4,4)
19,4 (18.4)
RAN + kalk
112
3
3
3
103
8,0
32,6
105
2
2
1
98
1 1
6,6
34,9
110
4
2
101
2
1 8,2 (7,6)
35,6 (34,4)
p = 0.002a
RAN + kalk
220
232
6
9
12
194
7
2
2
16,4
8,2 product: (med avansert tumor)
256
234
5
4
7
208
5
2
3
11,1 (13,8)
7,1 (7,6)
en statistisk signifikant i paret t-test; tosidige p-verdi ble vist.
kromosomavvik ble scoret hovedsakelig som kromatid pauser. ble observert svært lav forekomst av isochromatid pauser og ingen utveksling avvik ble funnet. Hyppigheten av kromatid pauser og avvikende metafaser ble økt gradvis fra 60 til 180 dager med RAN-administeration med eller uten kalk. Hyppigheten av avvik var mer følgende RAN + kalk administeration enn RAN alene. Frekvensen av aberrasjoner var mer i både avanserte magetumorbærende mus. (For aberrasjon detaljer, se tilleggsfiler 1: Tilleggsopplysninger).
Redusert uttrykk for mitotiske og spindel sjekkpunkt gener i Ran-behandlede mus
I lys av de ovennevnte studiene undersøkte vi uttrykket av AuroraA, AuroraB, MAD2 Hotell og Bub1
gener i benmarg, esophageal og magen celler av de musene som var ubehandlet eller administreres RAN ekstrakt med og uten kalk for 120, 180 og 260 dager. konvensjonelle resultater RT-PCR (figur 4) viste at cellene samlet fra spiserør og mage viste for det meste under-ekspresjon av disse genene i forhold til ubehandlet en og en slik under-ekspresjon var konsekvent og vesentlig i RAN + kalk administrert mus. Men den uttrykk for alle disse genene i BMC ikke endre på noen vesentlig måte, bortsett fra over-uttrykk for Mad2 Hotell og Bub1
ble notert i BMC muse samlet etter 260 dager med administeration. Figur 4 Øvre pult Uttrykk av mitotiske sjekkpunkt gener i mus benmarg (BM), spiserør og mageceller etter eksponering med RAN pakke med eller uten kalk for 120, 180 og 260 dager. Lavere pult Kvantitativ densitometrisk analyse av uttrykket profilen til mitotiske sjekkpunkt gener mRNA nivå i spiserøret og magen celler etter 260 dager med eksponering ble vist. Verdiene er gjennomsnitt ± SEM av tre uavhengige eksperimenter. Verdiene er normalisert til GAPDH respektive verdier. * P < 0,05; ** P < 0,01; *** P < 0,001. Signifikant forskjellig sammenlignet med negativ /positiv kontroll (som bestemmes av paret t-test).
Analyse av over-uttrykket av gener gjennom immunoblottingforsøk
Nivåer av p53, p65, Bax Hotell og Securin
i BMC fra mus etter administeration av RAN trekke med eller uten kalk for 60, 90 og 180 dager, og de spiserør og mage etter 180 dager med fôring ble undersøkt ved immunblotting. Nivåer av disse proteinene ble også testet fra cellene innsamlet vev-messig fra de ubehandlede mus. Resultatene tyder på at uttrykket av p53, p65, Bax Hotell og Securin
er forhøyet betydelig i alle vev i Ran administrert mus. En slik forbedring var signifikant høyere i RAN + kalk enn i bare kjørte administrert mus (figur 5). Figur 5 Upper pult Representant western blotting påvisning av p65, p53, securin, Bax og β-aktin i mus benmarg (BM), spiserør og mageceller etter eksponering med RAN pakke med eller uten kalk. For BM ble celler samlet opp etter 60, 120 og 180 dager, mens den for spiserør og mage, cellene ble samlet opp først etter 180 dager etter eksponering. p-aktin ble brukt som lasting kontroll. Lavere pult Kvantitativ densitometrisk analyse av nivået av proteiner med de ovennevnte gener i benmarg, ble spiserør og mage celler etter 180 dager etter eksponering er vist. Verdiene er gjennomsnitt ± SD av tre uavhengige eksperimenter. Verdiene er normalisert til respektive p-aktin-verdier. * P < 0,05; ** P < 0,01 Signifikant forskjellig sammenlignet med negativ /positiv kontroll (som bestemmes av paret t-test).
Strømningscytometrisk studier av cellesyklus og påvisning av apoptotiske celler ved dobbel farging og immunoblotting
Strømningscytometrisk analyse av DNA-innhold i benmargen , spiserør og mage celler fra mus oppsamlet etter 260 dager med RAN + kalk administrering (figur 6A), viste at det var en økning i G1 faseceller både i benmarg og spiserøret i forhold til ubehandlet kontroll. Imidlertid, i magen, ble prosentandelen av celler i sub-G1 fase økes, noe som kan tilbakeføres på grunn av apoptotisk celledød. For å bekrefte dette, ble dual farging med annexinV og PI utført. Dataene i figur 5B indikerer økt positiv farging med Annexin V-i kvadrant 2 og 3 i magen celler, men ikke i spiserøret celler av RAN + kalk administrert mus. Figur 6 Analyse av cellesyklus og apoptose i mus behandlet med RAN med lime (A) Analyse av cellesyklus etter 260 dager med eksponering med RAN pakke med kalk i benmargen, spiserør og magesekk celler av mus og også fra mage kreftceller. (B) Representative cytogrammene av Annexin V versus PI fluorescensstyrkene som bestemmes av flowcytometrisk analyse i mus spiserør og magesekk celler etter 260 dager med eksponering med RAN med kalk og fra mage kreftceller. Innenfor en cytogram, kvadrant 1 og 2 representerer tidlige og sene apoptotiske celler, respektivt; kvadrant 3, levedyktige celler; kvadrant 4, døde celler. (C) Western blotting for apoptotiske markører i normale (ubehandlet) og tumor magen celler. β-actin ble brukt som lasting kontroll.
Interessant flowcytometrisk analyse av kreftceller hentet fra mus som er utviklet svulst i magen etter 220 og 256 dager med kontinuerlig administeration av RAN og lime, viste betydelig reduksjon i G1-celler med en samtidig økning i sub-G1-celler (Figur 6A). Dual flekker indikerer at sub-G1-celler er stort sett nekrotiske døde celler (kvadrant 4) (Figur 6b). Betydelig høyere nivå av p53 Hotell og Bax
proteiner ble observert i tumor enn normalt magen celler (figur 6C). Imidlertid ble PARP
funnet å være fraværende i både tumorcellene i magen selv om PARP
og dets 29 kD spaltet produkt var til stede i normale mage prøver (figur 6C).
Diskusjon
Liggende studien ble gjennomført for å se om ad libitum
administeration av RAN pakke med eller uten kalk i drikkevannet kan indusere spiserøret eller magekreft i mus, og hvis den gjør det, hva innledende prosesser er involvert. I denne studien ble musene gitt hele RAN-ekstrakt med og uten kalk for å etterligne humant konsum stil RAN. Videre, dosen ble økt med jevne mellomrom når det skjer til menneske. Våre resultater viste at både RAN med og uten kalk fremkalle magekreft, selv om det skal bemerkes at tilstedeværelsen av kalk med RAN fremmet høyere celletransformasjon og derved utvikles magekreft tidligere enn RAN alene. Det ser ut til at kreften ble indusert i magen på grunn av den større eksponering dens foring måtte RAN mens spiserøret foring ble utsatt bare kort under drikking RAN blandet vann.
Det er vist tidligere at en alkalisk pH-verdi er ideell for å generere ROS ved autooksidasjon av areca-mutter polyfenoler [6, 7]. Det ble også vist at catechin fraksjon av areca-mutter ekstrakt aktivt genererer ROS ved alkalisk pH-verdi som induserer DNA-skade in vitro product: [21, 22]. Alle forfattere lese og godkjent den endelige manuskriptet.
 Forskere henter ut et fullstendig menneskelig genom fra en tusenvis av år gammel "tyggegummi"
Det virker som tyggegummi ikke er en ny trend! Forskere har funnet tyggegummi som er 5, 700 år gammel, og det har gitt ledetråder om gammelt DNA. En studie med funnene ble publisert i tidsskriftet Na
Forskere henter ut et fullstendig menneskelig genom fra en tusenvis av år gammel "tyggegummi"
Det virker som tyggegummi ikke er en ny trend! Forskere har funnet tyggegummi som er 5, 700 år gammel, og det har gitt ledetråder om gammelt DNA. En studie med funnene ble publisert i tidsskriftet Na
 Hva er SpyGlass Cholangioscopy?
Hva er kolangioskopi? SpyGlass kolangioskopi er en nylig utviklet teknikk for visualisering av gallegangene. Kolangioskopi er en prosedyre der et fleksibelt rør, kalt et endoskop, lar legen visu
Hva er SpyGlass Cholangioscopy?
Hva er kolangioskopi? SpyGlass kolangioskopi er en nylig utviklet teknikk for visualisering av gallegangene. Kolangioskopi er en prosedyre der et fleksibelt rør, kalt et endoskop, lar legen visu
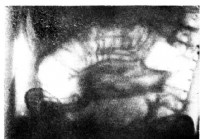 Anamnese av tarminvaginasjoner - Diagnose av akutt abdomen
Statistikk for alle forfattere, bortsett fra VA Krasins statistikk, inkluderer bl.a. mer enn 100 saker. Leykhtenstern også akutte sykdommer, direkte predshestvovavsh med intestinal til implementering
Anamnese av tarminvaginasjoner - Diagnose av akutt abdomen
Statistikk for alle forfattere, bortsett fra VA Krasins statistikk, inkluderer bl.a. mer enn 100 saker. Leykhtenstern også akutte sykdommer, direkte predshestvovavsh med intestinal til implementering