Bakgrunn
Den kolinerge anti-inflammatorisk veien er en endogen mekanisme som det autonome nervesystemet demper makrofagaktivering via nikotin acetylkolin reseptorer (nAChR). Dette konseptet har imidlertid ikke blitt vist på cellenivå i intakt vev. For å oppnå dette, har vi studert effekten av nikotin på aktivering av resident makrofager i en mus magen forberedelse ved hjelp av kalsium bildebehandling.
Kalsium transienter ([Ca 2 +] i) bosatt makrofager ble registrert i en mus magen preparat som inneholder myentericus plexus og muskellagene ved Fluo-4. Aktivering av makrofager ble oppnådd ved fokal drag administrering av ATP. Effektene av nikotin på aktivering av makrofager ble evaluert og den nAChR involverte ble farmakologisk karakterisert. Nærheten av kolinerge nerver til makrofager ble kvantifisert ved konfokalmikroskopi. Uttrykk for β2 og α7 nAChR ble evaluert av β2 immunhistokjemi og fluoroforen-merket α-bungarotoxin Resultater I 83% av makrofager kolinerge åreknuter nervefibrene ble oppdaget på avstander. ≪ 900nm. ATP-indusert [Ca 2 +] jeg øker signifikant hemmet i 65% eller 55% av makrofager med 100 uM eller 10 uM nikotin, henholdsvis. Denne hemmende effekten ble reversert av β2 nAChR foretrakk antagonist dihydro-β-eryhtroidine men ikke av hexamethonium (ikke-selektive nAChR-antagonist), mekamylamin (α3β4 nAChR-foretrukne antagonist), α-bungarotoxin eller methyllycaconitine (begge α7 nAChR-foretrukne antagonist ). Makrofager i magen uttrykke β2 men ikke α7 nAChR på proteinnivå, mens de i tarmen uttrykke både reseptorsubenheter. Denne studien er den første i Citation. Nemethova A, Michel K, Gomez-Pinilla PJ, Boeckxstaens GE, Schemann M (2013 ) Nikotin demper Aktivering av Tissue Resident Makrofager i Mouse magen gjennom β2 Nikotin Acetylkolin Receptor. PLoS ONE 8 (11): e79264. doi: 10,1371 /journal.pone.0079264 Redaktør: Yvette Tache, University of California, Los Angeles, USA mottatt: 10. juni, 2013, Godkjent: 26 september 2013; Publisert: 01.11.2013 Copyright: © 2013 Nemethova et al. Dette er en åpen-tilgang artikkelen distribueres under betingelsene i Creative Commons Attribution License, som tillater ubegrenset bruk, distribusjon og reproduksjon i ethvert medium, forutsatt den opprinnelige forfatteren og kilden krediteres Finansiering:. Dette arbeidet ble støttet av en bevilgning fra EU 7. rammeprogram (ipodd), ved Deutsche Forschungsgemeinschaft Sche267 /9-1 til MS; av en bevilgning fra Forskningsstiftelsen Flandern (FWO, Odyssevs og Hercules program) til GEB, og etter en FWO postdoktorstipend til PJG. Finansiører hadde ingen rolle i studiedesign, datainnsamling og analyse, beslutning om å publisere, eller utarbeidelse av manuskriptet Konkurrerende interesser:.. Forfatterne har erklært at ingen konkurrerende interesser eksisterer Innledning i 2000, Tracey og kolleger vist at elektrisk stimulering av nervus vagus gir en potent anti-inflammatorisk innspill til milten. I en musemodell av sepsis, vagusnervestimulering (VNS) resulterte i redusert pro-inflammatorisk cytokin produksjon, en effekt avhengig av α7 nikotiniske acetylkolinreseptorer (nAChR) [1,2]. Denne såkalte "kolinerge anti-inflammatoriske bane" (CAIP) opererer gjennom adrenerge nerver milt gjør synaptiske-lignende kontakt med p2-adrenerg reseptor-uttrykkende milt-T-celler. Etterfølgende frigjøring av acetylkolin (ACh) fra disse T-cellene er ansvarlig for den anti-inflammatorisk effekt formodentlig ved å samhandle med α7nAChR-uttrykker makrofager [1,2]. I 2005, forutsatt at vi bevis for at CAIP også modulerer tarmimmunsystemet. I en musemodell av postoperativ ileus, viste vi at VNS redusert intestinal manipulasjon-indusert betennelse i tynntarmen, en gunstig effekt avhengig av α7 nAChR men uavhengig av milten [3,4]. Disse dataene tyder på at tarmen immunsystem er heller direkte modulert av vagale nerveender og /eller enteriske nerveceller. Som bosatt tarmmakrofager er de viktigste aktørene utløsende denne betennelsesreaksjon [5], disse cellene representerer den mest sannsynlige målet for CAIP. In vitro studier ved bruk av isolerte peritoneale makrofager, har perifere mononukleære blodcelle-avledede makrofager eller makrofagcellelinjer faktisk rikelig demonstrert at acetylkolin og nikotin redusere cytokinproduksjon [1-3,6,7] og øke fagocytose [6]. Likevel er det tvilsomt i hvilken grad deres fenotype virkelig minner om de fastboende makrofager berørt av enteriske nerveceller, særlig ettersom reseptor uttrykk i makrofager kan være opp- eller nedregulert som de har blitt isolert fra sitt naturlige miljø. Derfor bestemte vi oss for å utvikle en teknikk som ville tillate oss å studere effekten av nikotin på aktivering av resident makrofager i sitt naturlige miljø. Som makrofager aktiveres av ATP, en velkjent faresignal for immunceller [8,9], viser en økning i intracellulær Ca 2+, lever Ca 2+ avbildning ble valgt for å studere hørende makrofager i intakt flat ark mus mage preparater. Dette tillot oss å sammenligne ATP fremkalt Ca 2 + transienter ([Ca 2 +] i) i makrofager som ligger i de glatte muskellagene før og etter påføring av nikotin. Vi videre brukte flere antagonister med kjente preferanser for bestemte nAChR underenheter for å gi ytterligere mekanistiske innsikt i rollene som nikotin reseptor uttrykker makrofager for CAIP i tarmen. Disse farmakologiske funn ble bekreftet ved immunhistokjemi. Til slutt, analyserte vi andelen bosatt makrofager som er i umiddelbar nærhet av kolinerge nervefibre. Etikk erklæringen Alle mus arbeidet ble gjennomført i henhold til de tyske retningslinjene for dyr omsorg og velferd (Deutsches Tierschutzgesetz) og godkjent av den bayerske stats etisk komité (Regierung Oberbayern, som fungerer som institusjon og bruk komité for Technische Universität München) i henhold til § 4 og § 11 Deutsches Tierschutzgesetz under referansenummeret 32 -568-2. Vevsprøver menn 12-16 uker gammel C57BL /6 mus (Charles River, Sulzfeld, Tyskland) ble drept ved halshugging. Magen ble høstet i iskald Krebs buffer som inneholder (i mm) 117 NaCl, 4,7 KCl, 1,2 MgCl 2 6 H 2o, 1,2 NaH 2PO 4, 25 NaHCO 3, 2,5 CaCl 2 2 H 2o og 11 glukose og justert til pH 7,4. Magen ble åpnet langs den store kurvatur og vasket med iskald Krebs. Under mikroskopisk undersøkelse, ble magen låst ned på en Sylgard parabol og slimhinnene og submucosa ble forsiktig fjernet. Under disseksjon ble vevet kontinuerlig perfusert med iskald Krebs-løsning for å sikre levedyktigheten av vevet. Bare den fremre eller bakre halvdel av magen ble festet på en liten Sylgard ring med en sentral åpning på 100 x 200 mm 2. Flate ark mus mage preparater var inkubert i modifisert Krebs oppløsning (117 NaCl, 4,7 KCl, 1,2 MgCl 2 6 H 2o, 1,2 NaH 2PO 4, 20 NaHCO 3, 2,5 CaCl 2 2 H 2o og 11 glukose) inneholdende 30 uM av den fluorescerende kalsiumindikator Fluo 4-acetoksymetyl (AM) (Invitrogen) og 1,25 mM probenecid (Sigma-Aldrich, Schnelldorf, Tyskland) i 2 timer ved romtemperatur i mørke og gasset med carbogen (95% O 2-5% CO 2). Den Sylgard ringen ble montert i opptakskammeret med serosale side av magesekken som vender mot bunnen av kammeret. Kammeret var koblet til perfusjon system for å muliggjøre kontinuerlig perfusjon med karbogen-gassbehandlet Krebs-oppløsning ved romtemperatur. En utvaskingsperiode på 1,5 timer var tillatt før starten av forsøket. Vevet kammeret ble montert på en invertert epifluorescence mikroskop (Zeiss Axio Observer A1, Carl Zeiss, Jena, Tyskland) er utstyrt med en høyhastighets monokrom kamera (Zeiss AxioCam HSM) og programvare (Zeiss Axio Vision 4,8) for innsamling og analyse. Fluo-4 var spent ved hjelp av en blå lysdiode (LED) Luxeon III (3W, 470nm dominant bølgelengde, Philips LumiLed, Phillips, Hambur, Tyskland) ble og Fluo-4 signaler oppdages med et filter kube F26-514 Bright Line FITC BP (eksitasjon: HC475 /35, dichroic: 499, utslipp: HC530 /43, AHF ANALYSEN, Tübingen, Tyskland) ved hjelp av X20 objektiv (A-Plan, NA = 0,25, Zeiss). Systemet målte relative endringer i fluorescens (Δ F /F) for Fluo-4 overvåke endringer i intracellulær kalsium ([Ca 2 +] i). Ca 2+ transienter ble registrert utgangs 3 s før lokal administrering av ATP til en total på 14,5 s med en bildefrekvens på 2 Hz og eksponeringstid på 200 ms. Vi brukte ATP som et verktøy for makrofagaktivering, siden det er et faresignal frigis lokalt på stedet av inflammasjon [8,9], og siden ATP er kjent for å indusere cytokin sekresjon fra makrofager via økning av [Ca 2 +] i [10-12]. ATP (Sigma-Aldrich) og nikotin (Sigma-Aldrich) ble lokalt påført ved press utstøting fra to mikropipetter med varighet på 200 ms og 10 sek, henholdsvis. Posisjonen til mikropipetter sørget for at den utstøtte volumene er dekket identiske vev regioner. De mikropipetter ble fylt med 1 mM ATP og 100 mikrometer eller 10 mm nikotin oppløst i Krebs løsning som inneholder 1,25 mM probenecid. Ifølge tidligere publiserte kalibreringskurver, regner vi med at noen stoff som påføres ved press utstøting pulser vil bli utvannet med ca 01:10 når den når vevet [13]. Lokal forvaltning av ATP og nikotin tillatt måling av svar på flere områder (typisk 4-5) i det samme vev. Posisjonen av regionene i vevet ble dokumentert ved hjelp av koordinatsystemet vist på mobil mikroskop trinnet. Effekten av nikotin på ATP induserte kalsium transienter ble igjen undersøkt i de samme områdene etter tilsetning av forskjellige nAChR-antagonister. Etter registrering av responsene, ble makrofager visualisert ved vital inkubasjon av vev med allofykocyanin (APC)-merket rotte anti-mus anti-F4 /80-antistoff (1: 250, eBioscience, Frankfurt, Tyskland) i 1 time, ved romtemperatur i mørket og gasset med carbogen. Vevet ble vasket i 15 minutter. Mikroskopet scenen ble omplassert for å finne de områdene hvor vi spilt inn fra. Bilder av merkede makrofager ble anskaffet ved hjelp rød Z-LED P4 (3,5 W) eksitasjon kilde (625 nm dominant bølgelengde, Seoul Semiconductor) og filter kube F46-006 ET filtersett (eksitasjon: ET 620/60, dichroic: 660, utslipp: ET700 /75, AHF ANALYSEN, Tübingen, Tyskland). Den overlapping av Fluo-4 signaler og bilder av F4 /80 positive makrofagen tillatt oss å analysere svarene i enkelte makrofager. Å etikett vev bosatt makrofager, vi brukte først vital merking protokoll beskrevet ovenfor. Vevet ble deretter fiksert over natten ved romtemperatur i en oppløsning inneholdende 4% formaldehyd og 0,2% pikrinsyre i 0,1 M fosfatbuffer, vasket 3 x 10 minutter i fosfatbuffer og til slutt inkubert i 1 time i en oppløsning inneholdende 0,5% Triton X- 100, 0,1% NaN 3, 4% hesteserum oppløst i PBS (alt fra Sigma-Aldrich). Å merke kolinerge varicosities, ble vevet inkubert over natten i blokkeringsoppløsning inneholdende geite-anti-vesikulært acetylkolin transportør (VAChT; 1: 1000; Merck-Millipore, Darmstadt, Tyskland). Vevene ble vasket 3 x 10 min i PBS og inkubert i 1,5 til 2 timer i blokkeringsoppløsning inneholdende Cy3-merket anti-geit-antistoff (1: 500; Dianova, Hamburg, Tyskland). Vevene ble vasket 3 x 10 minutter i PBS og montert i anti-fade stoff (20% PBS /NaN 3, 80% glycerol) på poly-L-lysin-belagte objektglass og dekkglass for visning. for å markere β2 nAChR i vev bosatt makrofager, slimhinner fritt mage hele mount preparater fra villtype og P2 nAChR knock-out [14] mus ble løst i 10 min i iskald PBS løsning som inneholder 4% paraformaldehyde (PFA) . Vevene ble deretter vasket 2 x 10 min i PBS og inkubert i 2 timer i PBS inneholdende 1% protease-fri Albumin Bovine Fraksjon V-albumin (BSA; Serva, Heidelberg, Tyskland) og 10% normalt esel serum (NDS, Jackson Immunoresearch, Pennsylvania, USA). Vevene ble inkubert i 36 timer med PBS inneholdende 1% BSA, 5% NDS, rotte-anti-muse-F4 /80 (1: 500; klone BM8, BioLegend, San Diego, USA) og kanin-anti-mus β2 nAChR (1: 200, Santa Cruz Biotechnology, Heidelberg, Tyskland). Vevene ble vasket 3 x 10 min i PBS og inkubert i 1 time i PBS inneholdende 1% BSA, 5% NDS, Alexa Fluor® 647-merket geit-anti-rotte-antistoff (1: 1000; Jackson Immunoresearch, Pennsylvania, USA), og Cy3-merket esel-anti-kanin-antistoff (1: 1000; Chemicon, Millipore, Billerica, USA). Vev ble vasket 3 x 10 minutter i PBS og montert i slow-fade reagens (Invitrogen, Life Technologies, Gent, Belgia) på poly-L-lysin-belagte lysbilder og coverslipped for viewing.To etiketten α7nAChR i vev bosatt makrofager, en stykke mus mage og ileum ble underkastet vital merking ved hjelp av Cy5-merkede α-bungarotoxin (Invitrogen) ved 0,1 ug /ml i RPMI 1640 medium (Lonza, Basel, Sveits) ved 4 ° C i 15 minutter [4]. Vevene ble deretter fiksert i PBS inneholdende 4% PFA. Mukosa og submucosa ble fjernet og vev ble inkubert i 2 timer i blokkeringsløsning inneholdende 1% BSA. Vevene ble deretter inkubert i 60 timer i blokkeringsløsning inneholdende rotte-anti-muse-F4 /80 (klon BM8, BioLegend), etterfulgt av 3 x 10 min vaskinger i PBS og inkubert i 1 time i PBS inneholdende 1% BSA og Cy3-merkede anti-rotte-antistoff (1: 1000; Jackson Immunoresearch, Pennsylvania, USA). Til slutt ble vevene vasket 3 x 10 minutter i PBS og montert i slow-fade stoff på poly-L-lysin-belagte lysbilder og coverslipped for visning. bilder ble ervervet ved hjelp av en LSM 510 (Carl Zeiss) konfokalmikroskop med Plan-Neofluar x40 /1.3 Olje DIC og Plan Apochromat x63 /1.4 Oil DIC mål. Laserbølgelengder på 543 nm og 633 nm ble anvendt for eksitasjon av fluoroforer Cy3 og APC eller Cy5, respektivt. Cy3 og APC eller Cy5 signaler ble oppdaget ved hjelp av filter setter BP 565-615 IR og BP 650-710 IR, hhv. Bilde stabler for kvantitativ analyse ved hjelp av x63 objektiv ble skannet med en XY oppløsning på 1024 × 1024 som dekket et område på 95,5 × 95,5 mikrometer 2. Den første og siste optiske skiver ble tatt ved toppen og bunnen av den ytre overflate av en makrofag. Den optiske dybde av hver skive var 900 nm. To påfølgende skiver lappes for 500 nm. Vanligvis var mellom 9 og 16 skiver generert noe som resulterer i en skanning dybde på 3.2-6.0 mikrometer som inneholder mellom 1-3 makrofager og VAChT positive fibre kryssende makrofager. Bildestakker ble analysert ved hjelp av Image J Pro. Bilder av p2 og α7 nAChR-merket makrofager ble tatt ved hjelp av x63 objektiv og skannet med en XY oppløsning på 1024 × 1024 som dekket et område på 95,5 × 95,5 mikrometer 2. Den optiske dybden av bildene var 900 nm. Hvis du vil blokkere aksjonspotensial forplantning i nevroner, ble tetrodotoxin (Biotrend, Köln, Tyskland) lagt til perfusert Krebs løsning på en mikrometer. For farmakologiske karakteriseringen, ble følgende nikotin blokkere tilsatt til Krebs-oppløsning perfusert vevet: 200 uM hexamethonium (Sigma-Aldrich), 100 uM mekamylamin (Sigma-Aldrich), 10 uM dihydro-β-erythroidine (DHBE; Sigma-Aldrich) , 100 nM, 3 uM og 10 uM α-bungarotoxin (ABGT, Tocris) og 10 nM og 100 nM methyllycaconitine (MLA, Tocris). Hexamethonium, mekamylamin og DHBE ble testet i konsentrasjoner som var i stand til å avskaffe nikotin hurtig eksitatorisk postsynaptisk potensialer i marsvin myenterisk nerveceller [15] sikret bruk av 10 nM og 100 nM MLA er basert på konsentrasjonen henholdsvis brukt til å blokkere α7 subenhet som inneholder nAChR [16], og som brukes til å hemme IL-6-sekresjon fra isolerte peritoneale makrofager [3]. analyse og datastatistikker og De maksimale relative endringer i fluorescens (Δ F /F) som reaksjon på ATP administrasjon ble uttrykt som% økning over basal fluorescens før ATP administrasjon. De statistiske analysene ble utført med Sigma Plot 9.0 (Systat Software Inc, Erkrath, Tyskland). Data er presentert som whisker tomter med median og 25 th og 75 th persentiler samt 10 th og 90 th persentiler. Ikke normalfordelte parede data ble analysert ved Wilcoxon signert rank test. Forskjeller ble vurdert som statistisk signifikant på P Resultater Spatial forholdet mellom vev bosatt makrofager og kolinerge varicosities i mus magen Vi brukte konfokalmikroskopi å vurdere nærhet mellom F4 /80-positive makrofager og VAChT-positive åreknuter kolinerge nervefibre i mus magesekken (figur 1A). Detaljert analyse viste at 83% av de 41 makrofager studert befinner seg innen 900 nm til minst en åreknuter kolinerge nervefiber (figur 1B-C). Microejection av ATP induserte en sterk, rask utbruddet [Ca 2 +] i forbimakrofager som nådde sitt høydepunkt 8-10 sek etter at søknaden fulgte av en langsom tilbakevending til baseline [Ca 2 +] i nivåer (Figur 2A og Movie S1). Siden det var ikke alltid full gjenoppretting til basislinjenivåer i løpet av registreringsperioden, den maksimale [Ca 2 +] i signalet ble brukt for analyse av alle forsøk. Ingen tachyphylaxis ble observert ettersom den maksimale amplitude av [Ca 2 +] i signal som respons på en andre ATP administrasjon og 10 minutter etter den første, ikke var forskjellig fra den opprinnelige maksimale respons (figur 2B). effekt av nikotin på [Ca 2 +] i signaler i vev bosatt makrofager for å studere effekten av nikotin på ATP fremkalt [Ca 2 +] i signaler vi microejected nikotin i 10 sek og umiddelbart re-installert ATP på samme region. En rasjonelt å bruke nikotin som selektiv, ikke-degradert nAChR agonist var å etterligne nikotin reseptor aktivering av frigjøring av acetylkolin fra kolinerge nevroner. Analysere endringer i [Ca 2 +] i i alle makrofager avslørte at nikotin betydelig redusert ATP fremkalt [Ca 2 +] I signaler (figur 2D og F). En mer detaljert analyse av effektene av nikotin på ATP-indusert [Ca 2 +] i transienter avdekket tre bestander av makrofager (figur 2D-G). Nikotin 10 og 100 mikrometer svekket ATP-fremkalt [Ca 2 +] i signaler i 55% og 65% av makrofager, henholdsvis. Den [Ca 2 +] I-signal forble uforandret i 36% og 28% av makrofager etter påføring av 10 uM og 100 uM nikotin, henholdsvis. I en liten undergruppe, 10 og 100 um nikotin forsterket ATP-fremkalt [Ca 2 +] i respons (9% og 7% av makrofager, henholdsvis). For å unngå skjevhet videre analyse er basert på nikotin effekter på alle makrofager uavhengig av om ATP indusert [Ca 2 +] i signalet ble redusert, økt eller uendret. rolle av nevroner i nikotin fremkalt demping av makrofagaktivering Nikotin aktiverer direkte enteriske nerveceller og vi adressert muligheten for at aktivering av like ved myentericus nevroner bidratt til svekket [Ca 2 +] i responser i makrofager. Vi fant ingen bevis for en slik indirekte hemmende sti fordi demping av ATP-fremkalt [Ca 2 +] i signal av nikotin forble i nærvær av tetrodotoxin (figur 2C). Det er bemerkelsesverdig skjønt at andelen av disse makrofager der nikotin ikke endre ATP fremkalt [Ca 2 +] I signalene ble dramatisk redusert (28% versus 6%). På samme tid, makrofager hvori nikotin inhiberte eller potensierte ATP fremkalt [Ca 2 +] I signaler øket fra 65% til 71% og fra 7% til 23%, henholdsvis. aktiveringen av makrofager ved ATP og hemming av ATP-reaksjon ved 100 uM nikotin var pålitelig registreres i hver av de 21 preparatene som er vist på figur 2F. Dette tillot oss å utføre antagonister studier uten behov for å fornyet studium den inhiberende respons i disse makrofager behandlet med antagonistene. Videre vi dermed redusert antall opptaksperioder til et nivå som ikke kompromisser signalstyrke og garanterte reproduserbare ATP svar. For å studere de nAChR-subenheter som er involvert i den inhiberende effekt av nikotin, testet vi fem forskjellige blokkere med kjente subenhet preferanser [17] (figur 3). Den hemmende effekten av nikotin på ATP-fremkalt [Ca 2 +] I responser var uforandret i nærvær av den ikke-selektive ganglie-nAChR antagonist hexamethonium de α3β4 nAChR-foretrukne antagonist mekamylamin eller α7 nAChR-foretrukne antagonister α-bungarotoxin og methyllycaconitine (figur 3A). Men β2 nAChR-foretrukne antagonist di-hydro-β-eryhtroidine reversert den hemmende effekten av nikotin på ATP-fremkalt [Ca 2 +] i responser i makrofager (Figur 3B). Selv om vi brukte ABGT i konsentrasjoner som er beskrevet å pålitelig blokkere α7 nAChR i nevroner og isolerte alveolære makrofager [18], ble vi bekymret for at det kan være ute av stand til å motvirke den hemmende effekten av nikotin på grunn av ugunstige konkurranse ved bindingssetet. Men dette synes lite sannsynlig fordi selv ved konsentrasjoner på 3 mikrometer og 10 mikrometer ABGT var ikke i stand til å reversere den hemmende effekten av nikotin på ATP fremkalt [Ca 2 +] I svar (figur 3A). ABGT gjorde heller ikke reversere demping fremkalt av 10 mm nikotin (Figur 3C). Merking av β2 men ikke α7 nAChR i vev bosatt makrofager For å gi ytterligere bevis for involvering av β2 nAChR men ikke fra α7 nAChR i den hemmende effekten av nikotin på ATP-fremkalt [Ca 2 +] i responser, immunhistokjemiske merking av B2 nAChR og vital merking av α7 nAChR av ABGT i resident makrofager av mage muskularis ble utført (figur 4). Flertallet av resident makrofager av mage muscularis ble p2 nAChR-immunreaktivt (figur 4A) som understøtter den observerte antagonistisk effekt av DHBE på nikotin hemming av ATP-responser. Den anvendte antistoffet for p2 nAChR er bestemt på grunn av fraværet av ß2 nAChR immunreaktivitet i en β2 nAChR knockout mus (figur 4B). Vital merking av α7 nAChR ved ABGT avslørte fravær av α7 nAChR i vev bosatt i makrofager mus magesekken (figur 4C), i motsetning til dette ble intestinale makrofager merket ved ABGT (figur 4D). Mangelen på α7 nAChR i magen muskularis bosatt makrofager bekreftet fravær av antagonisme av α7 nAChR-foretrukne blokkere ABGT og MLA på den hemmende effekten av nikotin på ATP fremkalt [Ca 2 +] I respons i disse cellene. Diskusjoner til dags dato har effekten av nikotin undersøkt kun i isolerte makrofager eller makrofagcellelinjer. Her har vi utviklet en in vitro Vårt kriterium som brukes for å definere nærhet mellom makrofager og kolinerge nervefibrene (900 nm distanse) er enig med begrepet extrasynaptic kommunikasjon . I henhold til dette konseptet en diffusjon basert volum overføring kan skje ved 100 nm for å um avstander mellom kilde og mål-[19]. Vi antar at de fleste, om ikke alle, kolinerge nerver i umiddelbar nærhet til makrofager stammer fra myentericus nervecellelegemer basert på vår forrige observasjon at vagale fibrene ikke kontakt tarm bosatt makrofager [3], er dette også støttes av funnene at mage vagal efferente fibre nesten utelukkende avsluttes i ente ganglia [20], hvor de aktiverer de fleste myentericus nevroner gjennom nikotinreseptorene [15]. CAIP representerer et fysiologisk system for å kontrollere makrofagaktivering under betennelsestilstander. Den anti-inflammatorisk effekt av CAIP aktivering har vist in vivo Likevel velger vi for en nokså konservativ tolkning av våre data, og konkluderer med at β2 nAChR er kritisk involvert i nikotin inhibering av makrofag-aktivitet, selv om det er sannsynlig at ved den konsentrasjon som anvendt i vårt studium DHBE fortrinnsvis blokker α4β2 nAChR. Våre forberedelser er ideell for å ta i fremtidige studier mulige bidrag α7β2 nAChR ved å undersøke effekten av nikotin i vev bosatt makrofager fra α7 nAChR, B2 nAChR og α7β2 nAChR doble knock-out mus. Lignende strategier bør brukes til å studere betydningen av en α4β2 nAChR. Det er viktig å merke seg at antagonistisk virkning av DHBE er ikke selektiv for makrofager som DHBE, som hexamethonium og mekamylamin, også blokkerer nikotin synapser i mage myentericus nevroner [15]. Likevel må de nikotiniske reseptorer på makrofager har andre egenskaper enn de i enteriske neuroner siden hverken hexamethonium eller mekamylamin rever nikotin induserte dempningen av ATP-fremkalte responser i makrofager. Hexamethonium og mekamylamin utøve sine handlinger ved å tette porene av nikotin kanal [23-25]. Deres manglende evne til å reversere nikotin hemming av makrofager kan foreslå eksistensen av en atypisk nAChR i makrofager. Faktisk opptak av Ca 2+ transienter i respons til nikotin administrering avslørte økes [Ca 2 +] i i bare 13% av makrofager (6 av 45 makrofager; data ikke vist). Denne populasjonen er mye mindre at andelen av makrofager i hvilken nikotin modulerte ATP-fremkalt [Ca 2 +] i. Rikelig bevis tyder på at α7 nAChR spiller en avgjørende rolle i nikotin-indusert reduksjon i makrofag cytokin produksjon [2,3,6,26]. Tidligere har vi faktisk vist at nikotin ikke klarte å redusere TNF-α produksjon i peritoneale makrofager i α7 nAChR knockout-mus [6], mens anti-inflammatorisk effekt i tynntarmen av nervus vagus stimulering i vår modell av postoperativ ileus er tapt i disse KO-mus [4]. I den foreliggende studien, men effekten av nikotin på ATP-indusert makrofagaktivering ble ikke blokkert av α7 nAChR foretrakk blokkere ABGT og MLA, argumenterer mot involvering av α7 nAChR. Dette er videre støttet av manglende merking av mage muskularis makrofager etter α7 nAChR-foretrukne α-bungarotoxin. I tarmen, men gjorde vi observere α-bungarotoxin positive merket muskularis makrofager [4 og denne studien], indikerer regionsspesifikke forskjeller i fenotype av disse immunceller. Selv om den tilsynelatende mangelen på ABGT-sensitive α7 nAChR i vår studie synes motstridende til våre tidligere funn, vi er ganske sikre på at disse dataene er ikke på grunn av manglende evne ABGT å konkurrere om bindingssetet som den samme konsentrasjonen som brukes i studien blokker nevronale α7 nAChR i hjernen og i
Konklusjon
situ
påvisning av en inhibering av makrofag-aktivering av nikotin som tyder på funksjonell signalering mellom kolinerge neuroner og makrofager i magen. Dataene tyder på at β2 subenhet av nAChR er kritisk involvert i nikotin-indusert hemming av disse bosatt makrofager
Metoder
Kalsium avbildning
Immunohistochemistry
Konfokalmikroskopi og bildeanalyse
Farmakologi
< 0,05. N
tallene gitt i parentes indikerer antall makrofager /vev studert, det vil si et resultat basert på opptak av 20 makrofager i 5 vev (lik 5 dyr) er presentert som (20/5).
Reproduserbarhet av ATP fremkalt [Ca 2 +] i signaler i vev bosatt makrofager
farmakologisk karakterisering av den hemmende effekten av nikotin på vev hørende makrofager
modell av mus mage muskler myentericus plexus forberedelse til å studere effekten av nikotin på vev bosatt makrofager i sitt naturlige miljø. Denne studien er derfor den første som viser at nikotin hemmer direkte aktivering av vev bosatt makrofager gjennom β2 subenheten inneholder nAChR og dermed gir grunnlag for funksjonell signalering mellom kolinerge nevroner og makrofager i tarmen. Vår konklusjon er støttet av flere linjer av bevis. For det første, ATP fremkalt [Ca 2 +] I transienter i makrofager er betydelig redusert med nikotin selv i nærvær av nerveblokker tetrodotoksin. Dernest ble den nikotin-induserte dempningen av ATP-responser i makrofager reverseres ved DHBE, men ikke ved hexamethonium, mekamylamin, ABGT eller MLA. De farmakologiske funn ble støttet av demonstrasjon av p2-positiv, men ABGT-negative nAChR subenheter på mage makrofager. For det tredje er de fleste makrofager var i direkte nærhet av åreknuter kolinerge nervefibre. Ligner nærhet av makrofager til nervefibrene ble observert i rottetarm muskularis [3].
av vagusnervestimulering i musemodeller av sepsis og postoperativ ileus [2,3] og in vitro
av nikotin administrasjon til isolerte , lipopolysakkarid stimulert makrofager [1-4,21]. I denne studien fant vi at nikotin redusert ATP-indusert økning i intracellulær Ca 2 + i resident makrofager i magen. Interessant nok var denne effekten reverseres av β2 nAChR-underenheten og foretrakk antagonist DHBE noe som tyder på involvering av denne underenhet i den nikotin-mediert modulering av de innebygde makrofager. Denne observasjonen er i overensstemmelse med våre tidligere funn at DHBE reversert nikotin-fremkalt hemning av tumornekrosefaktor-α (TNF-α) frigivelse og økt fagocytose i isolerte peritoneale makrofager [6]. I linje, cytokin-produksjon av humane neuroblastom-cellelinje stabilt transfektert med α4β2 nAChR blir betydelig redusert ved nikotin forbehandling [22]. Selv om disse data antyder at α4β2 nAChR kan formidle effekten av nikotin på ATP-indusert økning i intracellulær Ca 2 +, indikerer nyere bevis på at p2 subenheter kan også sette sammen med andre a-subenheter, inkludert α7 subenheter. En fersk publikasjon diskutere elektrofysiologiske egenskapene til α7β2 nAChR uttrykt i humane epiteliale cellelinjer, viste at lave konsentrasjoner av DHBE antagonized α7β2 nAChR men ikke α7 nAChR [16]. Disse og andre data på den farmakologiske profilen til DHBE ville foreslå at DHBE er en svært selektiv antagonist av B2 nAChR men ikke pålitelig diskriminere mellom ulike menigheter α3, α4 eller α7 med β2. Imidlertid vil vår immunhistokjemiske og vital merking av mage bosatt makrofager ikke favorisere involvering av α7 nAChR fordi mage makrofager ikke ble merket av ABGT men uttrykte β2 nAChR subenheten.
 Prebiotika vs. probiotika vs. postbiotika - Hva er forskjellen?
Fordøyelseskanalen din inneholder mikrobiota. Dette er potensielt gode og skadelige bakterier, virus, sopp og protozoer. For å være så sunn som mulig, trenger du en balanse mellom de to typene mikrobi
Prebiotika vs. probiotika vs. postbiotika - Hva er forskjellen?
Fordøyelseskanalen din inneholder mikrobiota. Dette er potensielt gode og skadelige bakterier, virus, sopp og protozoer. For å være så sunn som mulig, trenger du en balanse mellom de to typene mikrobi
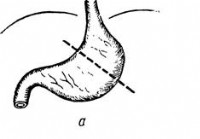 Vridninger av abdominale organer - Diagnose av akutt abdomen
Vridninger av abdominale organer (unntatt tarmer) GENERELLE KOMMENTARER Vridninger av abdominale organer er ganske ofte en årsak til akutt kirurgisk inngrep, da de forårsaker fremveksten av en rekke
Vridninger av abdominale organer - Diagnose av akutt abdomen
Vridninger av abdominale organer (unntatt tarmer) GENERELLE KOMMENTARER Vridninger av abdominale organer er ganske ofte en årsak til akutt kirurgisk inngrep, da de forårsaker fremveksten av en rekke
 Divertikulitt 101
Divertikulitt (uttales di-ver-tic-u-LIE-tis) er en tilstand som kan forårsake alvorlige magesmerter, kvalme, feber og en merkbar endring i avføringsvanene dine. Men hva er denne tilstanden med merkeli
Divertikulitt 101
Divertikulitt (uttales di-ver-tic-u-LIE-tis) er en tilstand som kan forårsake alvorlige magesmerter, kvalme, feber og en merkbar endring i avføringsvanene dine. Men hva er denne tilstanden med merkeli