gástrica humana e significado clínico da longa não-codificante RNA HNF1A-AS1
no cancro gástrico humano da arte abstracta
Fundo
Evidências crescentes tem demonstrado que longos RNAs não-codificantes (lncRNAs) desempenham um papel essencial na ocorrência e desenvolvimento de cancros humanos, incluindo cancro gástrico (GC). No entanto, o significado funcional e clínico de lncRNAs ainda são pouco conhecidos.
Métodos
Neste estudo, a expressão de lncRNA HNF1A RNA antisense 1 (HNF1A-AS1
) foi examinado pela primeira vez pela análise lncRNAs microarray em 6 GC tecidos, e, em seguida, foi adicionalmente verificado por em tempo real quantitativa de transcrição reversa PCR (qRT-PCR) tanto em 3 linhas celulares de GC e 161 casos de tecidos de CG. Também avaliaram a associação entre HNF1A-AS1
expressão e clínico-patológicas características de pacientes com GC.
Resultados
resultados da análise lncRNAs microarray exibiu que HNF1A-AS1
foi regulada negativamente em tecidos GCs (alteração média dobra 2,06 , p
< 0,05), o qual foi adicionalmente confirmada por qRT-PCR. Os resultados de qRT-PCR mostrou que a expressão de HNF1A-AS1
não só foi regulada negativamente em três linhas de células de GC (AGS, BGC-823, e MKN-45) em relação ao que numa linha celular epitelial da mucosa gástrica normal ( GES-1), mas também diminuiu nos tecidos do GC em relação ao que em tecidos não-neoplásicas adjacentes emparelhados (baixa expressão, de 94 161; taxa de expressão baixo, 58,38%). Além disso, baixa-AS1 HNF1A
expressão estava relacionado com o tamanho do tumor /diâmetro (p = 0,005
, análise multivariada), os níveis de antigénio carcinoembrionário soro (CEA), e antigénio de carbohidrato 19-9 (CA19-9), e expressão RRM1 em amostras de tecido (p = 0,028
, p = 0,009
, e p = 0,006
, respectivamente).
Conclusões
Tomados em conjunto, os nossos dados indicam que lncRNA HNF1A-AS1
pode ser um regulador de GC, e, portanto, pode ter potencial como um romance biomarcador e alvo de tratamento para este tipo de câncer.
Palavras-chave
lncRNA O câncer gástrico HNF1A-AS1
Fundo biomarcador
o câncer gástrico (GC) é um dos cancros mais comuns e podem ocorrer em qualquer parte do estômago humano. Estes tumores são frequentemente maligna e tem a capacidade para invadir tecido perineural [1]. Os dados do último levantamento anual global têm mostrado que há quase 1 milhão de novos casos e 740.000 mortes por esse tipo de câncer por ano em todo o mundo. A incidência de GC na China é maior do que na maioria dos países do mundo, com mais de 400.000 novos casos por ano e cerca de 300.000 mortes. Estudos têm mostrado que, se esta doença podem ser diagnosticados numa fase precoce, o prognóstico pode ser bem conseguido por meio de ressecção cirúrgica completa do tecido do tumor primário [2]. Infelizmente, os pacientes com GC mostram alguns sintomas nos estágios iniciais da doença eo diagnóstico é geralmente difícil. A taxa de sobrevida em 5 anos de GC em estágios avançados permanece pobre e é teimoso em cerca de 30% [3]. biomarcadores do cancro permitir cancro a ser diagnosticado e podem servir como alvos terapêuticos, como também pode ser usada para explorar a patogénese da doença; Portanto, a identificação de biomarcadores de cancro, seria de grande valor.
RNAs não-codificantes longas (lncRNAs) são RNAs não-codificantes superior a 200 nucleótidos [4]. Estes RNAs não codificam proteínas e são os principais componentes do transcriptoma humano [5]. Emergentes evidências indicam que lncRNAs são importantes moléculas reguladoras cujas funções principais estão relacionados com a modulação de redes de expressão gênica [6]. Muitas destas redes estão intimamente associados com o desenvolvimento e progressão de cancro [6-9]. Os dados de diferentes grupos determinaram que as alterações na expressão de lncRNAs estão relacionadas com a patogénese de diversas cancros humanos. Descobertas recentes a partir de Wang et al., Song et al., e Shao et al. têm demonstrado que as alterações nos perfis de expressão lncRNAs estão ligados a carcinogénese do cancro gástrico e progressão e que lncRNAs poderia ser usado como biomarcadores precoces ou como alvos para o tratamento de GC [10-12].
A fim de identificar a expressão anormal de lncRNAs relacionadas com tumores e aqueles com valores potenciais lncRNAs como biomarcadores, neste estudo, a análise do perfil de microarray lncRNAs expressão foi realizada em tecido de seis GC e os seus tecidos gástricos não neoplásicas adjacentes emparelhados. LncRNA HNF1A um ARN anti-sentido (HNF1A-AS1
) foi um dos lncRNAs que foram identificados para ser regulada negativamente nos tecidos GC pela análise de microarray. HNF1A-AS1
, um gene-exão único a banda 12q24.31 do cromossomo 12, é um lncRNA bidirecional de 2455 nucleotídeos [13]. O local de início da transcrição deste lncRNA é muito próximo ao do gene hepática nuclear fator 1 alfa (HNF1A
; local de início da HNF1A-AS1
é de aproximadamente 5 kb a jusante da HNF1A
) [13]. Para o nosso conhecimento, a expressão de HNF1A-AS1
em tecidos GC permanece não declarada. Portanto, neste trabalho, foram determinados os níveis de HNF1A-AS1
expressão em 3 linhas celulares GC e em 161 casos de tecidos GC e seus tecidos gástricos não neoplásicas adjacentes emparelhados. Também foi investigada a possível associação entre a expressão de HNF1A-AS1 Comprar e características clínico-patológicas de pacientes com GC. Nossos dados mostram o potencial deste lncRNA como um novo biomarcador e uma meta de tratamento para GC.
Métodos
amostras de tecido e coleta de dados clínicos
Cento e sessenta e uma amostras de tecido fresco emparelhado (tecido GC e não tecidos -neoplastic recolhidos 5 cm da borda do câncer) foram obtidos a partir de Fuzhou Hospital Geral, Fujian, China, em 2014 e 2015. Todas as amostras foram obtidas imediatamente após a operação cirúrgica e preservado em RNAlater (Qiagen, Alemanha) a -80 ° C até à sua utilização. As amostras de soro utilizadas para a detecção dos biomarcadores tumorais soro e amostras de tecidos embebidos em parafina usados para a detecção dos marcadores imuno-histoquímicos foram também recolhidas a partir dos mesmos doentes. Cada amostra de tecido foi diagnosticado histopatologicamente e confirmado por, pelo menos, dois patologistas. As normas para tumor-nódulo-metástase (TNM) estágio e grau histológico estiveram de acordo com as orientações da União Internacional Contra o Câncer (UICC; 5th Ed) e da National Comprehensive Cancer Network (NCCN) Diretrizes da Prática Clínica em Oncologia (V. 1,2011), respectivamente. Nenhum dos pacientes receberam tratamento antes da ressecção. Declaração
Ética
consentimento informado foi obtido de todos os participantes individuais incluídos no estudo, e este estudo foi aprovado pelo Comitê de Fuzhou Hospital Geral de Ética.
Microarray lncRNAs os ensaio
lncRNAs microarrays utilizados neste estudo foram o humano lncRNAs Microarray V3.0 (Arraystar Inc., MD, EUA), que era composto de lncRNAs e ARNm a partir do genoma humano. ensaio de microarray lncRNAs ea análise dos dados foram realizados por Kangchen Bio-tech (Xangai, China) com base nas instruções do fabricante.
celular cultura
AGS, linhas celulares GC BGC-823, e MKN-45 e normais humanos gástricas linha de células epiteliais (GES-1) foram obtidos a partir da coleção de American Type Culture, Manassas, VA, Xangai Instituto de Bioquímica e Biologia celular, da Academia chinesa de Ciências, em Xangai, China, Cancer Japanese Bank Research e Instituto do Câncer Pequim ( Pequim, China), respectivamente. As células foram cultivadas em meio F12, RP1640, ou meio DMEM (Invitrogen, Grand Island, NY, EUA), todos dos quais continha 10% de soro fetal de bovino, numa incubadora a 37 ° C com 5% de CO
2.
extração de RNA total e qRT-PCR
Os ARNs totais foram isolados a partir de ambos os tecidos e células em cultura usando o reagente TRIzol (Invitrogen). A transcrição reversa foi então realizada utilizando um kit de transcrição reversa (Promega) em conformidade com as instruções do fabricante. Em tempo real transcrição reversa quantitativa PCR (qRT-PCR) foi realizada usando o kit de mistura SYBR Green (Promega, Madison, WI, EUA) em um Primeiro Passo em tempo real do sistema de PCR (ABI, Grand Island, NY, EUA) . Os iniciadores para 18s e HNF1A-AS1
qPCR foram como se segue: (directo) 5'-TCAAGAAATGGTGGCTAT-3 'e (inverso) 5'-GCTCTGAGACTGGCTGAA-3' para HNF1A-AS1
; (Para a frente) 5'-AGAAACGGCTACCACATCCA-3 'e (reverso) 5'-CACCAGACTTGCCCTCCA-3' para 18s. As condições de PCR foram as seguintes: fase 1, 95 ° C durante 10 min; fase 2, 40 ciclos a 95 ° C durante 15 s, 57 ° C durante 1 min; fase 3 (fase de dissociação), 95 ° C durante 15 s, 60 ° C durante 15 s, 95 ° C durante 15 segundos. O limiar de ciclo gravado (TC) valores incluía tanto
HNF1A-AS1 e 18 s; este último serviu como um controlo. O nível de HNF1A-AS1
expressão foi obtido usando o método ΔCt. valores ΔCt mais elevados indicaram menor HNF1A-AS1
expressão. Os resultados foram obtidos a partir de três experiências independentes e expressos como a média ± desvio padrão (SD).
Medição de AFP, CA-125, CEA, e CA19-9 concentrações no soro de pacientes com GC
As concentrações de alfa-fetoproteína (AFP), antigénio carcinoembrionário (CEA), antigénio do cancro 125 (CA-125), e antigénio de carbohidrato 19-9 (CA19-9) foram detectados no soro de todos os 161 casos deste grupo pacientes usando o Kit quantitativa para marcador tumoral (Protein Chip-quimiluminescência) (HealthDigit, Huzhou, China) com o ChipReader Sistema de HD-2001A (HealthDigit). Neste estudo, os valores de referência normais para pessoas saudáveis foram < 20,0 ng /ml, < 5,0 ng /ml, < 35,0 U /ml e < 35,0 U /ml para a AFP, CEA, CA-125, e CA19 -9, respectivamente.
IHC
Utilizou-se imuno-histoquímica (IHC) em secções embebidas em parafina para determinar a expressão de factor de crescimento endotelial vascular (VEGF), receptor do factor de crescimento epidérmico humano 2 (C-erbB-2 ou HER2 ), timidilato sintase (TS), o cancro da mama 1 (BRCA1), reparo de excisão grupo de acesso a complementação 1 (ERCC1), o antígeno Ki67 (Ki67), e subunidade ribonucleótido-redutase M1 (RRM1), sinaptofisina (SYN), moléculas de adesão celular neuronal (CD56) e cromogranina A (CGA); 150 casos de as amostras de tecido embebidas em parafina de esta pacientes do grupo estavam disponíveis para o ensaio de IHQ. O IHC foi realizada por patologistas de acordo com as instruções dos fabricantes. Os anticorpos e outros reagentes para IHQ utilizados neste trabalho foram adquiridos de Maixin (Fujian, China) e ZSGB-BIO (Pequim, China). Com a excepção de Ki67, a intensidade da coloração foi classificada de 0 a 4, com 0 sendo nenhuma coloração; 1, menos do que 25% de células positivas; 2, 25 a 50% de células positivas; 3, 51 a 75% de células positivas; e 4, > 76% de células positivas. Para Ki67, as notas foram diretamente julgado como o percentual positivo para a expressão Ki67. As lâminas foram classificadas em pelo menos dois patologistas.
Análise estatística Programa Estatístico para Ciências Sociais (SPSS) 16.0 (SPSS, Chicago, IL, EUA) e GraphPad Prism 5.0 (GraphPad Software, La Jolla, CA, EUA
) foram utilizados para todas as análises estatísticas. One-way análise de variância (ANOVA), o teste rank-sum, eo teste t de Student of the foram os principais métodos estatísticos utilizados neste trabalho, a p Art < 0,05 foi considerado estatisticamente significativo.
Resultados exposições análise lncRNAs microarray que HNF1A-AS1
expressão é regulada negativamente em tecidos GCs
Como mostrado na Fig. 1, os resultados da análise do perfil de expressão de microarray lncRNAs obtido a partir de tecidos de seis GC e os seus tecidos gástricos não neoplásicas exibiram adjacentes emparelhados que HNF1A-AS1
expressão foi regulada negativamente em todos os seis tecidos GC (alteração média dobra 2,06, p
< 0,05), o que indica que este lncRNA pode ter o potencial para ser um dos lncRNAs relacionadas com tumores. Assim, esperamos que escolheu para análise posterior. FIG. 1 HNF1A-AS1
foi downexpressed em seis tecidos identificados por análise de GC lncRNAs microarray. 84C, 83C, 87C, 78C, 97C e 90C indicou seis tecidos GC (84, 83, 87, 78, 97 e 90 foram os seis casos de vários tecidos, C
cancro); 83N, 87N, 90N, 78N, 97N e 84N indicou os seis de tecidos que emparelhadas adjacentes não neoplásicas gástricas (N
tecidos gástricos não neoplásicas). A análise de agrupamento com base nos resultados de microarray exibiu essa expressão HNF1A-AS1
em tecidos GC foi regulada negativamente em comparação com a de tecidos gástricos não neoplásicas emparelhados (alteração média vezes 2,06, p Art < 0,05)
qRT- verificação PCR confirma ainda que HNF1A-AS1
expressão é regulada negativamente em linhas de células de GC e tecidos
Nós primeiro investigaram a expressão de lncRNA HNF1A-AS1
em três linhas de células GC: AGS, BGC-823, e MKN -45. Ao utilizar qRT-PCR, confirmou-se que a expressão de HNF1A-AS1
foi significativamente diminuído em todos os três linhas de células de GC em relação ao que em células epiteliais gástricas normais (células GES-1; AGS, p
< 0,0001; BGC-823, p
< 0,05; MKN-45, p
< 0,05; Fig. 2). Também examinamos HNF1A-AS1
expressão em amostras de tecido de GC e emparelhado amostras de tecido não-neoplásicas adjacentes. Os nossos resultados mostraram que HNF1A-AS1
foi regulada negativamente em 58,38% (94/161) dos tecidos do GC em relação ao que nos tecidos não-neoplásicas (p
< 0,01, Fig. 3). Tomados em conjunto, estes dados indicam que HNF1A-AS1
é regulada negativamente em GC humano. FIG. 2 Diminuição da expressão de HNF1A-AS1
em células de GC em relação ao que, em células epiteliais gástricas normais. qRT-PCR foi utilizado para comparar a expressão de HNF1A-AS1
em BGC-823, MKN-45, e as células AGS GC com a das células GES-1 não neoplásicas. Os dados apresentados são de três experiências independentes e expressos como a média ± DP. Asteriscos
indicam valores com uma diferença estatisticamente significativa em relação ao valor em células GES-1. * P Art < 0,05, p **** Art < 0,0001. câncer gástrico GC
, qRT-PCR
quantitativa PCR em tempo real, SD
desvio padrão
Fig. 3 Expressão de HNF1A-AS1
nos tecidos gástricos neoplásicas e não neoplásicas. A expressão de HNF1A-AS1
em tecidos GC foi comparada com a de tecidos não-neoplásicas adjacentes (n = 161
, ** p
< 0,01). T
tecidos GC, N
tecidos não-neoplásicas. Os dados apresentados são de três experiências independentes e expressos como a média ± DP (ΔCt valor). câncer gástrico GC
, SD
desvio padrão
Associação de expressão HNF1A-AS1
com características clínico-patológicas de pacientes com GC
para avaliar o significado clínico da HNF1A-AS1
, analisamos a relação entre a sua expressão e características clinicopatológicas de pacientes com GC. Como mostrado nas Tabelas 1 e 2, a análise univariada exibiu que a expressão de HNF1A-AS1
foi associada com tumores de tamanho /diâmetro (p = 0,002
), invasão profundidade (T fases, p = 0,032
), metástase linfática (estágios N, P
= 0,006), invasão venosa (p
= 0,001) e invasão perineural (PNI, p
= 0,014). No entanto, após o controle afectar factores incluindo a idade, o sexo, a localização do tumor, o tamanho do tumor /diâmetro, diferenciação, invasão (fase T), metástases linfáticas (n fases), invasão venosa, e PNI, a análise multivariada ainda confirmado que o tamanho do tumor persistiu ser significativamente correlacionada à expressão HNF1A-AS1 (p
= 0,005), o que significava que os pacientes com o tamanho do tumor ≥ 5 cm tinham níveis mais baixos de HNF1A-AS1. Estes dados sugerem que HNF1A-AS1
podem desempenhar papéis durante a ocorrência e progressão do câncer e pode ser um novo biomarcador de cancer.Table gástrica 1 Associação de expressão HNF1A-AS1 (ΔCt) com características clinicopatológicas dos pacientes
Características
No. de caso (%)
Média ± SD
p
valor
Idade (anos)
0,119
≥60
82 (50,9 )
16,17 ± 2,90 Art < 60
79 (49,1)
15,47 ± 2,71
Sexo
0,688
Masculino
123 (76,4)
15,78 ± 2,88
Feminino
local 38 (23,6)
15,99 ± 2,66
Tumor
0,560
Seios ventrículos
57 (35,4)
16,06 ± 3,13
Cardia
33 (20,5)
15,87 ± 3,04
Corpora ventrículos
45 (28,0)
15,92 ± 2,50
Outros
26 (16,1)
15,11 ± 2,36
diâmetro (cm)
0,002
≥5
73 (45,3)
16,59 ± 2,8 Art < 5
88 (54,7)
15,2 ± 2,70
Diferenciação
0,396
Bem Página 2 (1.2)
16,15 ± 0,71
Moderado
34 (21,1)
15,24 ± 2,66
Pobre
125 (77,7 )
15,98 ± 2,87
Invasion
0,032
T1
13 (8.1)
16,13 ± 1,95
T2
14 (8,7)
14.09 ± 2,24
T3
16 (9,9)
14,85 ± 3,71
T4
118 (73,3)
16,13 ± 2,76
linfática metástase
0,006
N0
38 (23,6)
14,74 ± 2,77
N1-3
123 (76,4)
16,16 ± 2,76
invasão venosa
0,001
Ausente
86 (53,4)
15,14 ± 2,58
Apresente
75 (46,6)
16,61 ± 2,90
invasão perineural (PNI)
0,014
Ausente
89 (55,3)
15,34 ± 2,77
Apresente
72 (44,7)
16,43 ± 2,79
CEA
0,028
normal
130 (80,7 )
15,59 ± 2,74
alta
31 (19,3)
16,83 ± 2,97
CA19-9
0,009
normal
140 (87,0)
15,60 ± 2,70
alta
21 (13,0)
17,32 ± 3,22
AFP News 0,936
normal
150 (93,2)
15,82 ± 2,80
alta
11 (6,8)
15,89 ± 3,25
CA-125
0,494
normal
154 (95,7)
15,79 ± 2,84
alta
7 (4,3 )
16,55 ± 2,33 valores
em itálico são significativos a p Art < 0,05
Tabela 2 Comparação dos valores p
obtidos a partir de análise uni e multivariada da associação de expressão HNF1A-AS1 (ΔCt) com características clinicopatológicas dos pacientes
Características
univariada
multivariada
p valor
p
valor
Idade (anos)
0,119
0,197
Sexo
0,688
0,174
Diâmetro (cm)
0,002
0,005
Diferenciação
0,396
0,603
Invasion
0,032
0,580
linfática metástase
0,006
0,235
venoso invasão
0,001
0,057
invasão perineural (PNI)
0,014
0,192
Tumor de localização
0,560
0,342
valores em itálico são significativos a p Art < 0,05
Associação de expressão HNF1A-AS1
com soro ou imuno-histoquímica de marcadores de GC
AS1-HNF1A
expressão em tecidos GC foi associada com dois marcadores séricos de tumores do aparelho digestivo, CEA (p
= 0,028) e CA19-9 (p
= 0,009), mas não houve associação significativa com outro câncer do trato marcador sérico AFP digestivo ou com o CA125 marcador de tumor epitelial (Tabela 1). A expressão de HNF1A-AS1
em amostras de tumor, também foi significativamente correlacionada com um marcadores imunoistoquímicos de câncer, RRM1 (p
= 0,006), mas não com VEGF, C-erbB-2, TS, BRCA1, ERCC1, Ki67, CD56, Syn, ou CgA (Tabela 3) .table Association 3 de expressão HNF1A-AS1 (ΔCt) com características immunohisochemical de tecido GC
características
No. de caso (%)
Média ± SD
p
valor
VEGF
0,809
0
15 (10,0)
15,27 ± 3,69
1 | 22 (14,7)
15,57 ± 2,92 Página 2
33 (22,0)
15,83 ± 2,72 Sims 3
59 (39,3)
15,94 ± 2,54 4
21 (14,0)
16,39 ± 3,32
C-erbB-2
0,312
0
129 (86,0)
15,70 ± 2,84
1 | 5 (3,3)
16,37 ± 2,96 Página 2 página 4 (2.7)
15,77 ± 1,01 Sims 3
12 (8,0)
17,30 ± 3.21
TS
0,543
0
22 (14,7)
16,41 ± 2,45
1 | 53 (35,3)
15,99 ± 2,97 Página 2
52 (34,7)
15,33 ± 2,73 Sims 3
21 (14,0)
16,25 ± 3,34 4
2 (1.3)
15,92 ± 1,82
BRCA1
0.893
0
10 (6,7)
16,59 ± 1,83
1 | 31 (20,7)
16,07 ± 2,91 Página 2
73 (48,6)
15,78 ± 2,57 Sims 3
34 (22,7)
15,61 ± 3,57 4
2 (1.3)
15,77 ± 5,01
ERCC1
0,585
0
19 (12,7)
15,81 ± 2,39
1 | 22 (14,7)
16,51 ± 3,61 Página 2
44 (29,3)
15,96 ± 2,85 Sims 3
41 (27,3)
15,85 ± 3,05 4
24 (16,0)
15,11 ± 2,02
RRM1
0,006
0
81 ( 54,0)
15,79 ± 2,41
1 | 10 (6,7)
13,27 ± 4,11 Página 2
17 (11,3)
15,51 ± 3,08 Sims 3
35 (23,3)
16,98 ± 2,93 4
7 (4.7)
15,48 ± 2,67
Ki67
0,328
1 | 14 (9,3)
16,54 ± 1.67 Página 2
35 (23,3)
16,44 ± 2,79 Sims 3
57 (38,0)
15,48 ± 2,97 4
44 (29,4)
15.66 ± 3,02
Syn
0,463
0
128 (85,3)
15,99 ± 2,95
1 | 16 (10,7)
15,15 ± 2,17 Página 2
3 (2,0)
13,98 ± 0,87 Sims 3 Sims 3 (2.0)
15,59 ± 3,06
CD56
0,364
0
137 (91,4)
15,94 ± 2,86
1 | 9 (6.0)
15,66 ± 3,09 Página 2 Página 2 (1.3)
12,72 ± 0,84 Sims 3 Página 2 (1.3)
14,22 ± 0,97
CgA
0.980
0
141 (94,0)
15,87 ± 2,91
1 | 7 (4.7)
15,69 ± 1,83 Página 2 Página 2 (1,3)
15,63 ± 3,26 valores
em itálico são significativos a p Art < 0,05
Discussão
Diversas linhas de evidência demonstraram que mudanças na expressão de lncRNAs desempenham papéis importantes na carcinogênese e desenvolvimento de câncer [14, 15] e que a expressão alterada de lncRNA é conhecido por ser significativamente associada com várias características clinicopatológicas de tumores humanos, tais como metástases em linfonodos, estadiamento TNM, metástases à distância, e o grau de diferenciação dos tecidos. Por exemplo, a diminuição da expressão da transcrição gástrica associada a cancro 1 (GACAT1
) está significativamente associado com a metástase, invasão e diferenciação de tecidos em pacientes com GC [16]. Além disso, a expressão elevada da caixa homeo (HOX) transcrito de ARN anti-sentido (HOTAIR
), um ARN não codificante intergénica longa, está associado com o grau de carcinoma do endométrio (CE), metástase, invasão de profundidade do miométrio, e mais pobre global sobrevivência [17]. Finalmente, a baixa expressão de HMlincRNA717
em GC está associado a metástases distal e invasão do venosa e do sistema nervoso [12]. Todos estes resultados são a prova das funções importantes da lncRNAs em carcinogénese e de o valor potencial na sua aplicação clínica.
Neste estudo, determinou-se que o nível de expressão de HNF1A-AS1
em três linhas de células de cancro gástrico foi significativamente diminuída em relação ao que, em células epiteliais gástricas normais. Mais importante, foi regulada negativamente em 58,38% de amostras de tecido de cancro gástrico em relação àquela em tecidos não-neoplásicas adjacentes. Os resultados de Yang et al. mostram que esta lncRNA foi regulada em adenocarcinoma esofágico (EAC) [13]. Carcinogénese e progressão do cancro é um processo complexo que patológica é mediada por redes de expressão de genes. ocorrência de câncer em diferentes órgãos ou tecidos pode ser regulamentada por níveis diferencialmente expressos dos mesmos genes ou as mesmas lncRNAs [18, 19]. Isto pode explicar porque HNF1A-AS1
apresenta perfis de expressão divergentes em diferentes tipos de células cancerosas. Outras investigações pode ser necessária para revelar o mecanismo molecular preciso para estas diferenças
É bem sabido que a invasão e metástases de cancro frequentemente ocorre através de três vias comuns:. Linfonodo metástases, viajar através da vasculatura, e sementeira local e crescimento. PNI é um meio adicional de invasão que é geralmente correlacionada com a recorrência local. Porque recorrência local está intimamente associada com mau prognóstico, a identificação de pacientes com alto risco de PNI tem grande significado clínico.
O prognóstico ea sobrevida dos pacientes com GC também podem ser afetados pelo tamanho do tumor, que está relacionado com o seu tempo de crescimento. tumores menores apresentam menos infracção para o estômago do que os tumores maiores. Além disso, o aumento da profundidade de invasão por tumores maiores aumenta a probabilidade de que o sistema linfático seja ultrapassado. Aumentando metástases nos linfonodos permite que o cancro a crescer mais facilmente e resulta em mau prognóstico.
Ambos CA19-9 e CEA são marcadores tumorais bem conhecidos que são normalmente regulados positivamente em amostras de soro ou de tecidos a partir de pacientes com tumores malignos primários do início ou o tracto digestivo. RRM1 é um dos três conhecido ribonucleótido-redutase humana com as funções de regulação da proliferação de células cancerosas através de mediar a síntese de ADN e de reparação, e a detecção da expressão de RRM1 em tecidos GC por IHC foi identificado ter significado prognóstico em pacientes com GC [ ,,,0],20].
Conclusões
Em resumo, analisou-se a associação do nível de expressão de HNF1A-AS1
com as características clínico-patológicas de pacientes com GC. Os nossos resultados mostraram que a expressão de HNF1A-AS1
foi significativamente regulada negativamente em ambos os tecidos e linhas celulares de GC. Além disso, a expressão diminuída foi associada com tumores de tamanho /diâmetro e níveis de soro de CEA, CA19-9, e tecido RRM1. Estes resultados indicam que HNF1A-AS1
podem estar envolvidos na supressão da ocorrência de cancro gástrico e desenvolvimento e que tem o potencial de servir como um alvo novo tratamento e biomarcador para a avaliação da gravidade da doença em pacientes com GC. Porque o tamanho da amostra deste estudo foi relativamente pequeno, uma verificação posterior pode ser necessário para confirmar verdadeiro valor clínico do HNF1A-AS1
.
Declarações
Agradecimentos
Este trabalho foi financiado pela Fundação equipe de Inovação de Fuzhou Hospital Geral de Lie Wang (2014CXTD04); a Fundação de Pós-Doutorado de Fuzhou General Hospital (43853) para Yuan Dang; a National Science Foundation Natural da China (Grant No. 81.372.788), a Fundação de Medicina Scientific Research Key of Nanjing Comando Militar (No. 11Z032), ea Fundação de Ciência Natural da província de Fujian (No. 2014J01427) para Qiaojia Huang; . E The Medical Foundation Scientific Innovation of Nanjing Comando Militar (No. 2013-MS122) para Yinghao Yu
artigo Abrir AccessThis é distribuído sob os termos da Licença Internacional 4.0 Creative Commons Attribution (http: //. Creativecommons org /licenças /por /4. 0 /), que permite uso irrestrito, distribuição e reprodução em qualquer meio, desde que você dê crédito apropriado ao autor original (s) e da fonte, fornecer um link para o Creative Commons License, e indicar se as alterações foram feitas. A renúncia Creative Commons Public Domain Dedication (http:. //Creativecommons org /publicdomain /zero /1. 0 /) aplica-se aos dados disponibilizados neste artigo, salvo indicação em contrário
concorrentes. interesses
os autores declaram que não têm interesses conflitantes. contribuições
dos autores
YD realizada a análise experiências e dados. FL guiada algumas experiências. XO, KW, e YL participou em amostras coletadas. YY guiada do tecido embebido em parafina fixado em formalina recolhido e ensaio de imuno-histoquímica. LW e YW guiada principais amostras frescas recolhidos. LW também contribuiu para o maior apoio financeiro. QH projetou o estudo. QH e YD escreveu o manuscrito. Todos os autores leram e aprovaram o manuscrito final.
 Preocupado com a eliminação de gases após uma refeição? Os probióticos podem ajudar!
Definitivamente, há verdade na música infantil “Feijão, feijão, a fruta musical. Quanto mais você come, mais você come!” Gases e inchaço são sintomas digestivos comuns que afetam até 20% dos americano
Preocupado com a eliminação de gases após uma refeição? Os probióticos podem ajudar!
Definitivamente, há verdade na música infantil “Feijão, feijão, a fruta musical. Quanto mais você come, mais você come!” Gases e inchaço são sintomas digestivos comuns que afetam até 20% dos americano
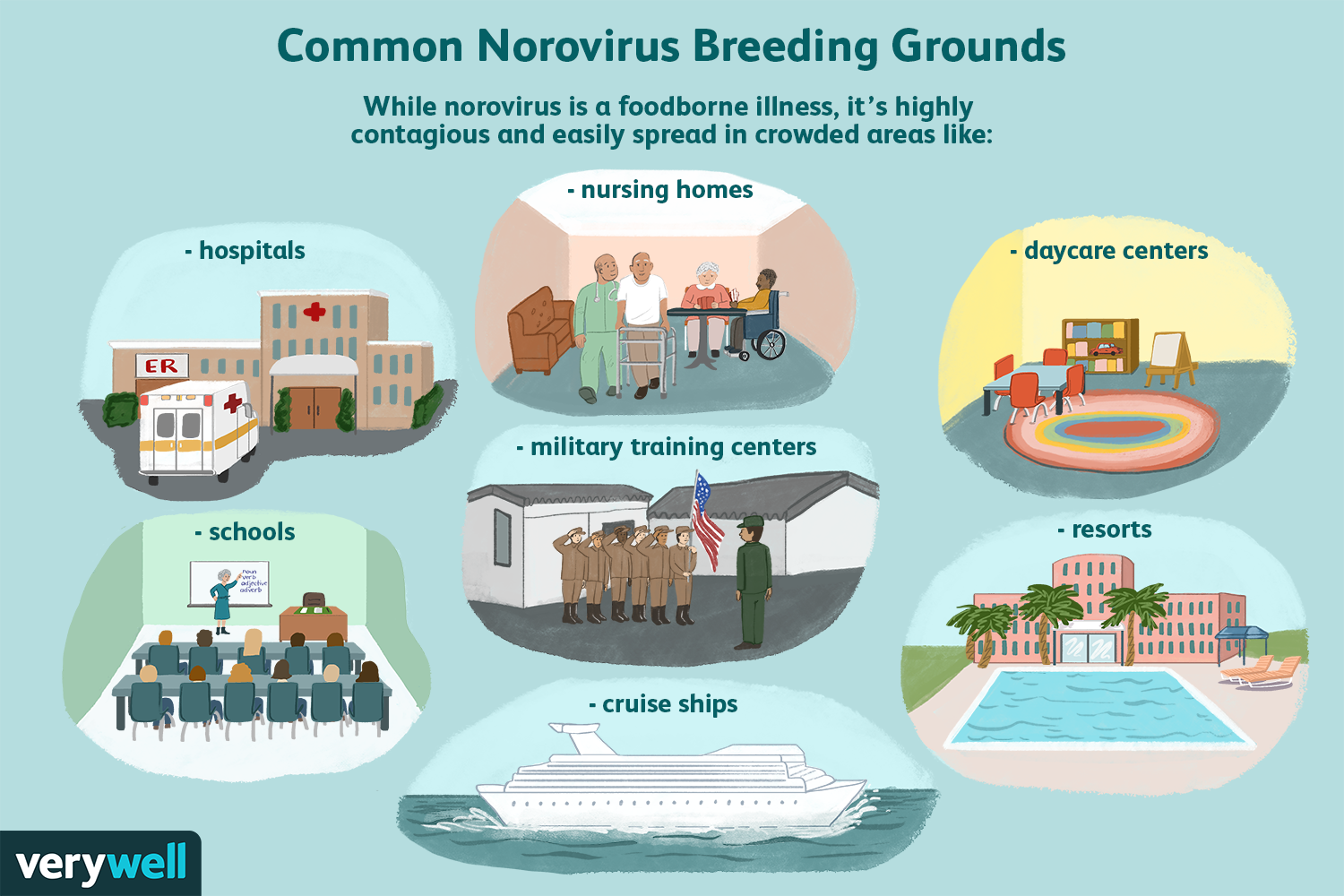 O que é norovírus?
Norovírus é a causa número um de gastroenterite (gripe estomacal) nos Estados Unidos. É um vírus altamente contagioso que causa inflamação no estômago e intestinos. Isso leva a sintomas como cólicas a
O que é norovírus?
Norovírus é a causa número um de gastroenterite (gripe estomacal) nos Estados Unidos. É um vírus altamente contagioso que causa inflamação no estômago e intestinos. Isso leva a sintomas como cólicas a
 Anorexia Nervosa
Centro de Anorexia Nervosa Apresentação de slides de fotos de transtornos alimentares Resoluções para comer melhor Aprimore a apresentação de slides de imunidade Comentários do paciente:Anorexia Nervo
Anorexia Nervosa
Centro de Anorexia Nervosa Apresentação de slides de fotos de transtornos alimentares Resoluções para comer melhor Aprimore a apresentação de slides de imunidade Comentários do paciente:Anorexia Nervo