Абстрактный
Фон Методы Результаты Выводы Финансирование:. Это исследование была поддержана исследовательских грантов от шведского исследовательского совета и пищеварительных исследовательского центра заболеваний, Тегеранского университета медицинских наук. DN была частично поддержана стипендией из Каролинского института (KID-декабрь 2008 года). Доноры не играет никакой роли в дизайн исследования, сбора и анализа данных, решение о публикации или подготовки рукописи Введение Результаты Обсуждение <. BR> <р> Окончательный диагноз атрофии через эндоскопии и гистологического обследования требует инвазивного клинического вмешательства. Даже гистологическое исследование, которое рассматривается в качестве золотого стандарта может быть подвержены ошибкам из-за пятнистый характер атрофии и ограничение числа биопсий. Большинство заявленных особенностей для серологического диагноза фундальном атрофии составляет 0,9 или более. Для расчета оптимального уровня сократить точку, мы считали ложной положительной фракции составляет менее 10% Как и наши результаты, высокая распространенность H. Pylori Этика заявление Исследуемая популяция Статистический анализ
<р> Чтобы установить оптимальные значения для обрезания серологический диагноз фундальном атрофии в зоне высокого риска для пищевода плоскоклеточный рак и рак желудка с высокой распространенностью хеликобактерной
( H. пилори)
в Северном Иране, мы провели эндоскопию -х изучение на основе проверки.
<р> Мы измерили сывороточные pepsinogens I (PGI) и II (PGII), гастрина 17 (G-17), а также антитела против целом H , пилори
или цитотоксин-ассоциированный ген А (CagA) антиген среди 309 последовательных пациентов в двух крупных клиниках эндоскопии на северо-востоке Ирана. Обновление системы Сидней был использован в качестве стандарта гистологии золота. Площади под кривыми (ППК), оптимальная отрезных и прогнозных значений были рассчитаны для сыворотки биомаркеров против гистологии
<р> 309 человек были приняты на работу (средний возраст: 63,5 лет, 59,5% женщин). , 84,5% были H. пилори положительный
и 77,5% были CagA позитивными. 21 фундальный атрофия и 101 nonatrophic пангастрит был поставлен диагноз. Наилучшие значения обрезания в фундальном оценки атрофии были рассчитаны на ОПИ и ЛТ, 56 мкг /л (чувствительность: 61,9%, специфичность: 94,8%) и /соотношение PGII PGI &л; 5 (чувствительность: 75,0%, специфичность: 91,0%). Сыворотка G-17 &л; 2,6 пмоль /л или G-17 > 40 пмоль /л составила 81% чувствительным и 73,3% специфичность для диагностики фундальный атрофию. При концентрации среза 11,8 мкг /л, PGII показал 84,2% чувствительность и 45,4% специфичность различать nonatrophic пангастрит. Исключение nonatrophic пангастрит повысить диагностическую способность соотношения PGI /PGII (от AUC = 0,66 до 0,90), но не влияет на АУК ОПИ. После того, как ограничение образцов исследования для пациентов с PGII &ЛТ; 11.8, чувствительность с помощью ОПИ &лт; 56 для определения фундальный атрофию увеличилась до 83,3% (95% ДИ 51.6-97.9) и его специфичность снизилась до 88,8% (95% ДИ 80.8-94.3).
<р> Среди пациентов клиники эндоскопии, PGII является чувствительным маркером для расширения nonatrophic гастрита в сторону корпуса. PGI является стабильной биомаркеров в оценке фундальном атрофии и имеет такую же точность соотношения PGI /PGII к среди населения с преобладанием nonatrophic пангастрит
<р> Образец цитирования:. Nasrollahzadeh D, Aghcheli K, Сотудех M, Shakeri R, Перссон EC, Ислами F, и др. (2011) Точность и Cut-Off Значения Pepsinogens I, II и гастрин 17 для диагностики желудочных фундальный атрофии: Влияние гастрита. PLoS ONE 6 (10): e26957. DOI: 10.1371 /journal.pone.0026957
<р> Редактор: Hana Algul, Мюнхенский технический университет, Германия
<р> Поступило: 15 апреля 2011 года; Принято: 7 октября 2011 года; Опубликовано: 31 октября, 2011
<р> Copyright: © 2011 Nasrollahzadeh и др. Это статья с открытым доступом распространяется в соответствии с условиями лицензии Creative Commons Attribution, которая позволяет неограниченное использование, распространение и воспроизведение на любом носителе, при условии, что оригинальный автор и источник кредитуются
<р> Конкурирующие интересы:.. Авторы заявили, что не существует никаких конкурирующих интересов
<р> Хронический атрофический гастрит является предшественником не-кардии рака желудка [1] и возможный фактор риска для пищеводного плоскоклеточного рака (ККОН). [2] гистологической оценкой образцов желудочной биопсии является стандартным способом выявления атрофии, однако в больших эпидемиологических исследований измерения сывороточных биомаркеров, таких как pepsinogens I, II и гастрина-17 были использованы в качестве альтернативного метода диагностики. [3] Пепсиноген I (PGI) производится в фундального желез и пропорционально уменьшается с прогрессированием фундальном атрофии. Пепсиноген II (PGII) синтезируется в большей части слизистой оболочки желудка и части двенадцатиперстной кишки и не проявляет систематическом с фундальном или антральном атрофии, [4], хотя снижение PGI к PGII соотношение (ОПИ /PGII) было показано, значения для обнаружения фундальном атрофии. [5] Гастрин синтезируется в antroduodenal G-клеток и его сочетание с pepsinogens было предложено в качестве маркера для оценки атрофии [6], но результаты предыдущих исследований, не согласуются с гастрина изменения с фундальном атрофии.
<Р> Helicobacter Pylori (H. пилори)
инфекции является ключевым фактором, определяющим в развитии фундальном атрофии, [7], которая также влияет на секрецию пепсиногена и гастрина. [8] Модели H. Pylori
индуцированная гастрит и его результаты отличаются среди населения. В большинстве инфицированных людей в развитых странах воспаление ограничивается антральном с минимальным участием в деянии и выхода кислоты остается нормальной или повышенной. [9] В отличие от этого, в некоторых популяциях, H
. пилори
индуцированная гастрит часто простирается от антрума к своду и приводит к пангастрит [10], который предлагается в качестве одного из шагов в прогрессии от H
. пилори
индуцированная гастрит с фундальном атрофии и рака желудка. [11] Несколько значений среза были применены при определении фундальный атрофию среди различных групп населения. [12] Мы предполагаем, что распространенность отмеченных nonatrophic pangastrits в исследуемой популяции может влияют на точность стрельбы и отсечных значения pepsinogens при оценке атрофии. Восточная часть провинции Голестан в Прикаспийские Иран имеет одни из самых высоких показателей заболеваемости ККОН во всем мире [13], [14], [15], [16] вместе с высоким уровнем распространенности инфекции с цитотоксин-ассоциированный ген Положительный (CagA + ) штаммов H. пилори
(неопубликованные данные), а также высокие желудочные заболеваемость раком. [15] Цель настоящего исследования состояла в том, чтобы оценить обоснованность серологического диагноза фундальном атрофии путем изучения уровней PGI, PGII, соотношение PGI /PGII и G-17 против золотого стандарта гистологии, а также определить влияние nonatrophic пангастрит на точность сывороточных биомаркеров у пациентов, которые посетили два крупных эндоскопии клиники в восточной провинции Голестан.
<р> в течение периода исследования, 329 пациентов в возрасте 50 лет и старше посетили эндоскопии клиники. Диспепсия стало основной причиной для проведения гастроскопии. Для 20 пациентов, пробы крови были недоступны из-за отсутствия согласия, поэтому эти пациенты были исключены. Средний возраст (SD) из включенных субъектов был 63,5 (9,1) с диапазоном от 50 до 90 лет, и 184 (59,5%) участников были женщины.
<Р> Адекватный отбор проб ткани была достигнута в 98 % и 2% имели неоптимальное массу для патологического диагноза. Oxyntic слизистой оболочке присутствовал в 93,6% в деянии биопсий. Фундальный атрофия наблюдалась у 21 (6,8%) пациентов, среди которых 19 также показали наличие кишечной метаплазии. В общей сложности 101 пациентов были диагностированы как с nonatrophic пангастрит. В общей сложности 261 (84,5%), 22 (7,1%) и 26 (8,4%) пациентов были отнесены к категории H. пилори
+, H. пилори
- и неизвестный H. Pylori
статус. Каппа (95% ДИ) статистические данные по соглашению между количественным и качественным методом H. Pylori
оценка была 0,6 (0,5-0,7). CagA + предметы (77,5%) были значительно моложе CagA- пациентов (62,8 против 65,7 лет) (р = 0,02). CagA + пропорции между умеренной и обозначенному фундальном атрофии и антрального гастрита приведены на рисунке 1.
<р> В общей сложности 75 субъектов (24,3%) когда-либо были табачные пользователей. После регулировки для гистологии диагностики фундальном атрофии, не было никакого существенного влияния возраста (выше в процентах от ниже медианы) и употребления табака на ОПИ, PGII, соотношение /PGII PGI и уровни G-17. Субъектов мужского пола, более вероятно, имеют более высокий уровень PGI (среднее различие: 26,3, 95% ДИ: 5.4-47.2). Там не было никаких статистических различий между мужчинами и женщинами на уровне PGII (средняя разница: 0,78, 95% ДИ: -3.5 -5.1) и уровень гастрина (средняя разница: -3.7, 95% ДИ: -9.9-2.5). Доля H. пилори
положительный был 86,4% и 87% для мужчин и женщин, соответственно (р = 0,89). CagA был положительным среди 77,6% женщин и 77,2% мужчин (р = 0,9). Уровни PGI, PGII, соотношение PGI /PGII, G-17 и H. пилори
, статус CagA суммированы в таблице 1.
<р> Максимум J было достигнуто при PGI (С *) = 56 мкг /л (J = 0,55), а также при PGI /PGII (с *) = 5 (J = 0,68). Максимальная J для G-17 была достигнута в двух точках; G-17 = 2,6 пмоль /л и G-17 = 40 пмоль /л. Соответствующие параметры точности теста и комбинации тестов приведены в таблице 2. Соотношение использования PPI и H. пилори
инфекция не отличались между категориями G-17, которые были получены с помощью G-17 отрезных точек, однако продолжительность PPI использования среди тех, с G-17 >. 40 пмоль /л была значительно больше (таблица 3)
<р> Диагностическая точность PGI, соотношение PGI /PGII, PGII и G-17, чтобы дифференцировать nonatrophic пангастрит и фундальный атрофии приведены в таблице 2. потенцирование PGI, PGII и G-17 в различении nonatrophic пангастрит происходит независимо друг от друга от фундальном атрофии исключения. Наоборот, когда мы оценивали фундальную атрофию, АУК соотношение ОПИ /PGII увеличилось с 0,83 (0.73-0.93) до 0.90 (0.80-0.99) после исключения nonatrophic пангастрит. При оценке nonatrophic пангастрит, рабочая характеристика (ROC) кривой приемник показал дифференциальное диагностическое преимущество PGII над PGI и G-17 (рисунок 2). АУК для PGII было больше, чем для PGI (Х 2 (1, N: 308) = 24,9, р ≪ 0,0001) и G-17 (Х 2 (1, N: 308) = 15,1, р = 0,0001), соответственно. АУК для PGII предсказать nonatrophic пангастрит было больше, чем для антрального гастрита (0,45 [95% ДИ 0.40-0.50]; Х 2 = 20,7; P ≪ 0,0001) и антрального атрофия (0,49 [0.45-0.54]; Х 2 = 14,2; р = 0,0002). После того, как ограничение образцов исследования для пациентов с PGII и ЛТ; 11.8, чувствительности с использованием ОПИ &лт;. 56 для определения фундальный атрофию увеличилась до 83,3% (95% ДИ 51.6-97.9) и его специфичность снизилась до 88,8% (95% ДИ 80.8-94.3)
<р> Тесты на равенство PAUCs для ОПИ и соотношения PGI /PGII на FPF равной 0,05 (р = 0,95), 0,1 (р = 0,73), 0,15 (р = 0,58) и 0,20 (р = 0,56) не показали никакой разницы. Эмпирические PAUC для соотношения PGI и PGI /PGII в FPF &ЛТ; 0,20 0,06 и 0,07 соответственно (р = 0,74). После деления фундальный субъектов атрофические до умеренной и промаркирован, мы наблюдали увеличение AUCs (95% ДИ) для PGI от 0.69 (0.48-0.90) для умеренной атрофии до 0.93 (0.84-1.00) для отмеченного фундальном атрофии.
<Р> Текущее использование PPI было сообщено 147 (47,6%) больных с медианной (диапазон межквартильного) продолжительностью 12 (1-24) месяцев. ИЦП используют значительно повышенные уровни в сыворотке крови PGI (средняя разница: 38,9, 95% ДИ: 19.2-58.7) и G-17 (средняя разница: 6,7, 95% ДИ: 0.6-12.8). Исключение текущих пользователей PPI незначительно повышена чувствительность (SEN) и АУК PGI (Sen: 81,8%, AUC: 0,88) и соотношения PGI /PGII (Sen: 91%, AUC: 0,90)
. <Р> Исход интереса и метод лабораторной оценки различаются в зависимости исследований, направленных на оценку диагностической способности pepsinogens. Когда скрининг рака желудка постановленное, PGI &л; 70 мкг /л и /соотношение PGII PGI &л; 3, измеренный методом радиоиммуноанализа, часто применялся в качестве порогового значения для определения населения, подверженного риску в исследованиях, проведенных в Японии [17] рассчитали среза. значения для PGI в нашем исследовании был в близком расстоянии с отчетами среди пациентов с диспепсией в европейских странах [18]. Наш результат на аналогичной способности соотношения PGI /PGII и PGI уже сообщалось ранее, [19], но большинство исследований показали превосходную способность объединенной PGI и PGI /соотношение PGII [20] или /соотношение PGII PGI в одиночку. [5 ], [18], [21] Одним из объяснений этого наблюдается равное способность может быть высокая доля пациентов с мультифокальной гастрита среди наших учебных предметов. PGII было предложено в качестве маркера для всех видов гастрита, [22], [23], и мы показали, что PGII вели себя как маркер для nonatrophic пангастрит индифферентно к исключению фундальном атрофии. В результате, в нашей популяции с высокой распространенностью пангастрит, диагностическая способность соотношения PGI /PGII поделили между фундальном атрофии и мультифокальной гастрита, который привел к ослаблению PGI /PGII точности оценки атрофии. Еще одним свидетельством нестабильности соотношения /PGII PGI над PGI пришли из последующих исследований H
. пилори
искоренение. После того, как H. Pylori
искоренении, PGI выступал в качестве вышестоящего предсказателя для секреции слизистой оболочки желудка, чем соотношение PGI /PGII [24], отчасти из-за увеличения соотношения /PGII PGI после H. Pylori
ликвидация [25], которая отражается уменьшение PGII после относительно заживления воспаления. Этот факт позволяет предположить, что PGI и PGII являются маркерами двух различных стадиях развития фундальном атрофии. Значительные изменения в сыворотке крови PGI происходит после установления умеренного и отмеченного фундальном атрофии в то время как PGII чувствителен к расширению воспаления в сторону корпуса и мониторов ранее гистологических изменений. Недавнее исследование оценило эти маркеры в отдельности и сообщили более высокий риск рака желудка по сравнению с отношением. [26] Некоторые исследования смотрели на ассоциацию между pepsinogens и топографии гастрита [27], [28], [29], [30 ]. Среди этих исследований, которые использовали соотношение PGII или PGI /PGII, либо отсутствие ассоциации [31], или наличие ассоциации с пангастрит сообщили по сравнению с мозолистого-избавлены гастрита [32], [33], [34]. Ни одно из этих исследований не было предложено значение среза для PGII отличить пангастрит, дополнительно исключение фундальном атрофии не всегда был среди критериев определения пангастрит. После исключения фундальном атрофии группы из пангастрит, наши данные свидетельствуют о том, что PGII контролирует конкретно расширение воспаления из антрального к своду по той причине, что его точность была значительно ниже для мозолистого-избавлены гастрита. Поскольку пангастрит может играть определенную роль при язвенной болезни желудка, атрофия желудка и рак желудка, мы также предложили значение отсечки 11,8 мкг /л с 85,5% NPV. Клиническое использование этого маркера ограничена из-за его низкой PPV, но это может быть полезно для применения в комбинации с другими маркерами в многоступенчатых программ скрининга, однако предполагается, что PGII &л; 9,47 мкг /л [35] или четверть уменьшение в уровне PGII [36] может быть использован в качестве маркера для H. Pylori
искоренение. Кроме того, используя пороговое значение PGII в дополнение к PGI может помочь сделать более однородную группу для эпидемиологических исследований атрофии ассоциации с другими заболеваниями желудочно-кишечного тракта. В консистенцией с исследованием среди H. Pylori
инфицированных субъектов [37] мы не наблюдали дискриминационный способность PGI, PGII и гастрина для антрального ограниченным атрофии или гастрит. Несмотря на регулирующей роли гастрина в кислотной секреции, в обратном с нашими результатами и более раннем исследовании, [6] большинство проверочных исследований сообщили недостаточную способность гастрина [5], [18], [22] в фундальном оценки атрофии. Одно из возможных объяснений может быть существование более чем одной точки отсечки для G-17 особенно в присутствии H. пилори
инфекции. По нашим данным, G-17 &GТ; 40 пмоль /л отличает группу фундальном атрофии, в которой G-клеток и их отрицательной кислотно-обратной связи остались нетронутыми и реагировать на PPI, в то время как G-17 &л; 2,6 пмоль /л дискриминируются те атрофические желудки снижается антральная популяция G-клеток, поврежденных кислоты обратной связи, и не реагировать на PPI. Однако использование PPI и H
. пилори
инфекции в нашем исследовании образца были распространены и способствовали гиперсекреции гастрина, таким образом, мы не наблюдали существенных различий в их пропорциях среди категорий с высокими и низкими значениями отсечки.
<Р> По сравнению с PGI , соотношение /PGII PGI показали более высокую чувствительность и PPV. Поскольку гистологическое исследование с ограниченным количеством биопсий не является чувствительным референтный тест, мы считаем, что это сравнение не доказан. Низкая распространенность фундальном атрофии также способствовало низкой PPV испытаний. Комбинация G-17 и PGI увеличили клиническую обоснованность в фундальном оценки атрофии путем улучшения PPV.
инфекции сообщили обследования населения на основе и случай-контроль исследования из Северо-западного Ирана [38] [39]. Кроме того, с помощью двух серологических методов плюс гистологическое исследование может привести к обнаруживать более высокий уровень текущих и прошлых H. пилори
инфекции в нашем исследовании. Среди H. Pylori
факторы вирулентности, CagA антиген вызывает больше иммунный ответ. [40] Мы наблюдали четкую зависимость доза-реакция между CagA серопозитивностью и тяжести антрального гастрита, который подтвердил концепцию вирулентности CagA антигена. Удельный вес CagA серопозитивностью среди фундального больных атрофии не отличались от остальных предметов. Однако после исключения отмеченные фундальный атрофию, мы наблюдали значительное более высокое CagA серопозитивности среди фундальном атрофии, сравнивающего группу без гастрита и атрофии. Аналогичная картина сообщалось в большом исследовании когорты населения на основе которой предложил зазор инфекции в присутствии отмеченного фундальном атрофии [41] наши результаты поддержали эту гипотезу.
<Р> Мы не наблюдали повышение уровня пепсиногена среди курящих мужчин. Некоторые исследования показали, что курение увеличивает ОПИ и PGII уровень, [42] и другие исследования показали, что связь между курением и пепсиногена исчезли, когда только H. Были проанализированы Pylori
серопозитивных субъектов. [43], [44] Из-за низкого числа H. Pylori
отрицательные люди, нам не удалось оценить изменения уровня пепсиногена в этих группах.
<р> Отсутствие реферальной фильтра и высокий процент донорства крови среди последовательных участников являются сильными сторонами данного исследования. Один из экспертов эндоскопист проводили экспертизу на основе протокола, который предварительно разработанных помогло уменьшить изменение локализации биопсии. Кроме того, один эксперт патологоанатом рассмотрел слайды и снизили вариации между наблюдателями для контрольного теста. Скромный размер выборки является одним из ограничений исследования. Тем не менее, это было достаточно, чтобы гарантировать, что расчетное значение отсечки соответствует требованиям к минимальному FPF. Кроме того, поскольку наше исследование эндоскопии комната на основе, то вполне вероятно, что показания к эндоскопии, которые были в основном симптомы диспепсии, привели к выбору конкретной группы в данном исследовании. Поскольку большинство людей с хроническим гастритом или атрофии полностью бессимптомно, любая обобщаемость к общей популяции должно быть сделано с осторожностью.
<Р> В заключение, мы оценивали точность сывороточного PGI, PGII, G-17 и CagA антитела в оценка фундальном атрофии среди эндоскопии пациентов в районе с высокой распространенностью CagA + H. пилори
инфекции и рак верхней гастроэзофагеальной. PGI &л; 56 мкг /л, PGI /PGII &л; 5, G-17 меньше, чем 2,8 или более чем 40 пмоль /л были оптимальные значения отсечки, чтобы отличить фундальный атрофию в этой группе населения. Соотношение PGI и PGI /PGII показал одинаковую точность в фундальном диагностики атрофии. PGI и PGII определены различные этапы развития желудочной атрофии и становления. PGII > 11,8 мкг /л был маркером для nonatrophic пангастрит, в то время как PGI &л; 56 мкг /л отличает создание фундальном атрофии нечувствительной к появлению пангастрит. Клиническое использование предлагаемого значения среза для PGII, как представляется, ограничено из-за его низкой PPV, но это может быть полезно для применения в комбинации с другими маркерами в многоступенчатых программ скрининга. Эти результаты должны быть воспроизведены в исследованиях с большим размером выборки и конструкции на основе населения.
Материалы и методы исследования
<р> Исследование было одобрено этическим комитетом исследовательский центр Пищеварительная Болезнь Тегеранского университета медицинских наук, Иран и благонадежности совета Стокгольм Региональный этике, Швеции и у всех пациентов было получено письменное согласие форма информированного.
<р> Это исследование зачислены все диспепсические пациентов старше 50 лет, посещающие две основные эндоскопии клиники Shohada больницы и Атрак клиники, которые расположены в городе Gonbad, самый большой город в восточной части Гулистан провинции, а также специализированных клиник для верхних желудочно-кишечных заболеваний в этой области в период с апреля 2007 и августе 2008 года последовательно. Эти две клиники являются единственными клиники со специалистами гастроэнтерологии в восточной части Гулистан. Спектр пациентов варьировал от лиц с легкой до тяжелой желудочно-кишечные симптомы. У больных с историей злокачественных опухолей были исключены. были взяты пять мл крови после голодания в течение ночи, и в сыворотке крови аликвоты хранили при -80 ° С. Информация о табаке, антацида и ингибиторов протонной помпы (ИПП) использование регистрировалось квалифицированным специалистом в ходе интервью лицом к лицу. История использования PPI в течение недели перед эндоскопии рассматривалась в качестве текущего использования. Когда-либо потребление табака регулярно в течение по крайней мере 6 месяцев была определена как пользователь.
гистологии
<р> эндоскопии были выполнены одним гастроэнтеролога (К.А.) в соответствии со стандартным протоколом. Пять биопсии были взяты из середины Антрум большую кривизну, в середине задней стенки антрума, incisura angularis, в середине корпуса большой кривизны, и в середине мозолистого задней стенки. Разделы парафиновых блоков были окрашены гематоксилином и эозином (H &Amp; E) и Гимза пятна, и были переданы в лаборатории научно-исследовательский центр заболеваний пищеварительной системы для гистологического исследования
<р> Все слайды патологии были изучены одним опытным патологоанатомом (. MS), используя гистологические критерии обновленной Сиднейской системы. [45] достаточность каждого образца для гистологического исследования, типа железистой слизистой оболочки, а также наличие H. пилори
были записаны. Воспаление, кишечная метаплазия и атрофия оценивались и оцениваются как легкие, умеренные или отмечены. Пациенты с умеренной или выраженной атрофии были объединены и классифицированы как атрофический группы и тех, кто с легкой или нет атрофии были сгруппированы как не-атрофические. Если один или оба из биопсий из антрального или incisura были атрофический и корпусная биопсий не являлись атрофический, пациент был диагностирован как с антрального атрофии. Если один или оба из биопсий из корпуса были сайты, атрофические и другие биопсии были не-атрофические, больной был поставлен диагноз фундальном атрофии. Когда один или несколько биопсий из антрального /incisura angularis и одного или обоих биопсий из корпуса были атрофический, мультифокальной атрофии был упомянут в качестве диагноза. Одни и те же определения, были использованы для описания градация и анатомическое распределение гастрита. Если один или несколько биопсий из корпуса и, по меньшей мере, одна биопсия из антрального отдела /incisura angularis показали умеренную или тяжелую гастрит без атрофии, картина была признана nonatrophic пангастрит.
Серологические анализы
<р> Сыворотка PGI, PGII и G-17 были измерены, слеп к результатам гистологии, используя твердофазный иммуноферментный анализ (ELISA) (Biohit, Финляндия) в шведском институте борьбы с инфекционными заболеваниями (SMI). Коэффициенты вариации для ОПИ и PGII, используя пул смешанной сыворотки от здоровых субъектов, составили 7% и 14%, соответственно. H. Pylori
серологические оценивали количественно и качественно, измерения клеточной поверхности антитела с ELISA (IgA /IgG, Biohit, Финляндия) и Вестерн-блот-анализов (Helico Пятно 2.1, MP Biomedicals Asia Pacific Ltd, Сингапур), соответственно. Пациенты были рассмотрены H. пилори
положительным, если один или несколько из их биопсий показали наличие H. пилори
независимо от их результатов серологических. Они также были рассмотрены H. пилори
положительным, если все биопсий были отрицательными, но оба серологических тестов оказались положительными. Они были рассмотрены H. пилори
отрицательным, когда серологические тесты и результаты гистологии были отрицательными. Если результаты двух серологических тестов были непоследовательны и Гистологически был отрицательным, статус пациента был записан как неизвестное для H. пилори.
CagA считали положительным, в соответствии с инструкциями изготовителя.
<р> Гистологическое исследование использовали в качестве эталона для диагностики атрофии. Кривые оперативных характеристик приемника (ROC) были построены с использованием различных комбинаций чувствительности и специфичности, и были рассчитаны площади под кривыми (ППК) и их 95% доверительный интервал (ДИ). Линейная регрессия была использована для оценки влияния ковариат (возраст, пол, табак и текущее использование PPI) на уровнях pepsinogens среди не-атрофические субъектов. Частичная ППК (PAUC) определяли при различных ложноположительными фракции (FPF) баллов. [46] Youden индекс (J) рассчитывали выбрать оптимальное пороговое значение (С *), который подтвердил диагноз фундальном атрофии или пангастрит с FPF≤ 20% -30%. Stata /IC 11.0 (StataCorp LP, США) использовали для статистических расчетов.
Выражение признательности
<р> Мы хотели бы поблагодарить Атрака персонал клиники и лаборатории патологии пищеварительных заболеваний Центра исследований, Тегеранского университета с особое признание г-жи Safora Коре, г-жа Бита Мохаммади, и г-н Али Мохаммади.
 Изжога:симптомы и лечение
Вторник тако, и все довольны; все, кроме тебя. Хотя вы можете любить тако, вы просто знаете жгучую боль, которую вы испытаете в ту минуту, когда поднесете эту острую пищу к губам. Вы также знаете, что
Изжога:симптомы и лечение
Вторник тако, и все довольны; все, кроме тебя. Хотя вы можете любить тако, вы просто знаете жгучую боль, которую вы испытаете в ту минуту, когда поднесете эту острую пищу к губам. Вы также знаете, что
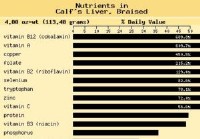 Рецепт SCD:стейк из печени с лимоном и перцем
В последние пару месяцев меня все больше интересуют мясные субпродукты. Я хотел бы, чтобы со временем я мог полагаться на качество продуктов, которые я ем, чтобы получать все необходимые мне витамины
Рецепт SCD:стейк из печени с лимоном и перцем
В последние пару месяцев меня все больше интересуют мясные субпродукты. Я хотел бы, чтобы со временем я мог полагаться на качество продуктов, которые я ем, чтобы получать все необходимые мне витамины
 Синдром Золлингера-Эллисона
Синдром Золлингера-Эллисона (ЗЭС) — это редкое заболевание, которое вызывает образование одной или нескольких опухолей в поджелудочной железе или верхней части тонкой кишки, называемой двенадцатиперст
Синдром Золлингера-Эллисона
Синдром Золлингера-Эллисона (ЗЭС) — это редкое заболевание, которое вызывает образование одной или нескольких опухолей в поджелудочной железе или верхней части тонкой кишки, называемой двенадцатиперст