Оценка прохождения Lactobacillus gasseri
K7 и бифидобактерий из желудка в кишечник с помощью одной модели реактора
Аннотация
Справочная информация
пробиотические бактерии, как полагают, играют важную роль в пищеварительной системе и, следовательно, имеют чтобы выжить переход от желудка к кишечника. Недавно был разработан новый подход к имитации переход от желудка к кишечника в одном биореакторе. Преимущество этой автоматизированной одной системы реактора была возможность протестировать влияние кислоты, солей желчных кислот и панкреатина.
Lactobacillus gasseri
К7 представляет собой штамм, выделенный из фекалии новорожденных с свойствами делает штамм интересной для производства сыра. В этом исследовании одна реакторная система была использована для оценки выживаемости L. gasseri
K7 и отдельные бифидобактерии из нашей коллекции через желудок кишечника прохода.
Результаты первичного скрининга для кислотного сопротивления в подкисленной культуре СМИ показали низкую переносимость Bifidobacterium Dentium
для этого условия, указывающей низкую выживаемость при прохождении. Аналогичные результаты были достигнуты с Б. лонгум
подвида. infantis
в то время как B. animalis
подвида. Лактис
имели высокую выживаемость.
Эти первоначальные результаты были подтверждены в биореакторе модели желудочно-кишечного прохода. B. animalis
подвид. Лактис
был самый высокий уровень выживаемости (10%) достигая примерно 5 × 10
6 КОЕ мл -1 по сравнению с другими испытываемых бифидобактерий штаммов, которые были снижены на коэффициент до 10 6 , Lactobacillus gasseri
K7 был менее устойчив, чем B. animalis
подвида. Лактис
но выживали при концентрации клеток примерно в 1000 раз выше, чем у других бифидобактерий.
Заключение
В данном исследовании мы смогли показать, что L. gasseri
K7 имел высокий уровень выживаемости в stomach- кишечник проход. Сравнивая результаты с предыдущим исследованием в поросятам мы смогли подтвердить надежность нашего моделирования. Из протестированных штаммов бифидобактерий, только B. animalis
подвида. Лактис
показал приемлемое выживание для успешного прохождения в системе моделирования.
фона
Пробиотики, бактерии, особенно молочной кислоты оказывают благотворное воздействие на здоровье потребителей как это было предложено в 1907 году [1]. Считалось, что бактерии в основном под контролем инфекций, вызванных кишечными патогенами и регулируемой toxoaemia, тем самым улучшая здоровье и влияние на смертность. В то же время было известно, что некоторые из положительных эффектов на здоровье потребителей являются улучшение баланса микрофлоры в кишечнике, стимуляция иммунной системы, а также пособничество организму бороться с патогенными микроорганизмами [2]. Большая часть интерес был сосредоточен на использовании штаммов Lactobacillus родов
и Bifidobacterium
, даже если есть и другие бактерии с пробиотических эффектами, например, некоторые пропионибактерии.
Вышеуказанные свойства являются также основой для микроорганизм быть обозначенным пробиотик. Существуют различные определения во всем мире, но они похожи по содержанию. Одним из критериев для пробиотического штамма является его устойчивость к кислотности желудочного и растворов в желудочно-кишечном тракте человека [3]. Поэтому важно, чтобы оценить сопротивление потенциального пробиотического штамма к кислотным и желудочной среды в кишечнике.
Из-за высокой стоимости и этических, а также правила техники безопасности для клинических исследований, скрининга выживаемости легче имитировать в пробирке
. Простой тест является инкубирование бактериальных клеток в кислой или желчные растворах солей в течение определенного периода, и подсчитывают количество выживших клеток. На следующем этапе, моделирование осуществляется в перемешиваемых колбах, комбинируя кислотность и желудочные растворов с последующей оценки выживших клеток в течение всего моделирования. Это более реалистичным тиражирование условий в [4] кишечнике. Еще одна система, имитатор человека кишечную микробную экосистему (Семей), состоит из 5 до 6 последовательно соединенных рН контролируемых биореакторах [5-7]. Установка является довольно сложным и требует абсолютных анаэробные условия. Кроме того, поглощение метаболитов и воды не смоделированы. Это был преодолен с помощью диализных мембран, как описано в Марто и др
. [8].
В последнее время новая система с использованием одного биореактор был разработан для изучения желудка-кишечника проход [9]. Система позволила рН должен быть изменен внутри одного реактора и был адаптирован к временам удерживания в различных областях желудочно-кишечного прохода.
Lactobacillus gasseri
K7 недавно был выделен из фекалии новорожденных [10]. Она производит бактериоцин, который активен против Clostridium
зр. и их споры. L. gasseri
принадлежит к так называемой "ацидофильных" -группы и несколько независимых исследований определили эти штаммы как жители кожи и кишечника [11-13]. В предыдущих экспериментах уже было показано в пробирке
что L. gasseri
K7 выжили в кислой среде и с 0,3% солей желчных кислот [10]. Эти данные делают штамм интересен как возможный пробиотик.
В этом исследовании, единую систему биореактора, основанную на работе Sumeri и др
. [9] был использован для оценки выживаемости Lactobacillus gasseri
K7 и восемь Bifidobacterium
штаммов из нашей коллекции. Мы имели возможность сравнить результаты для L. gasseri
K7 с исследования, проведенного в поросят [14], что позволило оценку корреляции между исследованием в пробирке
с результатами в естественных условиях
экспериментов .
время удерживания и рН, используемые в данном исследовании, были основаны на данных из литературы. Существует несколько способов для измерения рН в кишечнике [15]. В таблице 1 приведены значения рН в различных отделах кишечника, как измерено с помощью капсулы Heidelberg [16, 17]. Время удержания может быть вычислен либо с помощью маркерных веществ (химических) или с помощью Радиотелеметрия капсул, таких как капсулы Heidelberg
[18]. Тем не менее, капсулы, как правило, имеют более длительные сроки хранения, чем химических маркеров. В таблице 2 перечислены некоторые из времен удерживания найденных в литературе [4, 5, 19-24] значения .table 1 рН в желудочно-кишечном тракте человека, измеренная с Гейдельберг
капсулы.
<й>
Желудок
Двенадцатиперстная кишка
тощая кишка
Ileum
проксимальная
медиальной
Дистальный
рН
1,4 **
6,22 *
6.4 **
7.1 **
7.4 **
* Fallingborg и др
. 1994 [16]
** Fallingborg и др
. 1998 [17]
Таблица 2 Время удерживания в тонкой кишке цитируемой в литературе.
Время Retention
Source
Замечания
1-4 ч
Хуан и Адамс 2004 [21]
4.25 час
Van Den Driessche и др
. 2000 [24]
желудка и тонкой кишки
4 ч
Mojaverian 1996 [22]
6 ч
Пико и Lacroix 2004 [4]
Выбранные максимальное время моделирования <бр> 7.5 ч
Fallingborg и др
. 1990 [20]
детей
8 ч
Fallingborg и др
. 1989 [19]
8 ч
Alander и др
. 1998 [5]
Моделирование в Shime реактора
6-10 ч
Thews и др
. 1991 [23]
На основании данных, найденных в литературе и работе Sumeri и др
. [9] процесс ферментации был создан, как описано в материалах и методах, и показана на рисунке 1. Рисунок 1 Параметры желудочно-кишечного канала моделирования в течение 7 ч.
Результаты
кислотостойкость скрининговые
цель начальной серии испытаний было получить обзор кислотостойкость восьми штаммов бифидобактерий. На рисунках 2, 3 и 4 показывают выживание этих штаммов с использованием контурные графики, сделанные с Sigmaplot. Бифидобактерии Dentium
(рисунок 3) показал наименьшее сопротивление кислоты. Между рН 4,0 и рН 2,0 не было никакой разницы в выживаемости и концентрация клеток сократилось более чем на 7 журнала в течение 40 минут. Bifidobacterium animalis
подвид. Лактис
был более устойчив до 40 мин при рН 2,0, но затем снизился примерно на 3 бревна при инкубации в течение 120 минут (рисунок 4). При рН от 2,5 до 3,0 снижение составило менее 1 журнала через 120 минут. Рисунок 2 Acid сопротивление трех штаммов Лонгум Bifidobacterium. Ось Х: Время (мин); Y-ось: рН; КОЕ войти показаны в цвете (шкала справа от графиков). Числа в бактериальных имен являются числа штаммов в FAM-базе данных АПН.
Рисунок 3 кислотостойкость Bifidobacterium Dentium, Б. Лонгум подвида. infantis и В. adolescentis. Ось Х: Время (мин); Y-ось: рН; КОЕ войти показаны в цвете (шкала справа от графиков). Числа в бактериальных имен являются числа штаммов в FAM-базе данных АПН.
Рисунок 4 кислотостойкость Bifidobacterium Breve и B. animalis подвида. Лактис. Ось Х: Время (мин); Y-ось: рН; КОЕ войти показаны в цвете (шкала справа от графиков). Числа в бактериальных имен являются числа штаммов в FAM-базе данных АПН.
Все остальные протестированные Bifidobacterium
штаммы (B. Лонгум, Б. BREVE, Б. лонгум
подвид. Infantis и B. adolescentis
) показал аналогичный, но другой рисунок из B. animalis
подвида. Лактис
(Рисунки 2, 3 и 4). У них был короткий промежуток времени выживания ниже рН 2,5 и сохранились в большем количестве выше рН 3,5.
С целью разработки метода для имитации GI в биореакторе, последующее испытание было сделано с одним штаммом. Для того, чтобы наблюдать влияние матрицы пищевых продуктов, концентрированная B. Лонгум
подвид. infantis
ресуспендировали в обезжиренном молоке перед заражением в кислых растворах. Как показано в правой колонке на фиг.5, молоко оказывает непосредственное влияние на выживание штамма. РН от 3,0 до 3,5 бактерии выживали в течение 120 мин с уменьшением бревна 2. При рН ниже 3,0 выживаемость снизилась примерно до бревна 5. Уменьшение выживаемости ниже рН 3,0 был быстрым, но регулярным в течение долгого времени. При рН 3,5 и выше, штамм был устойчив в течение по крайней мере 120 минут. Рисунок 5 Сравнение кислотной резистентности Bifidobacterium лонгум подвида. infantis 14390 суспендировали в NaCl или обезжиренного молока. Слева: бифидобактерии ресуспендировали в NaCl, право: Бифидобактерии ресуспендировали в молоке. Ось Х: Время (мин); Y-ось: рН; КОЕ войти показаны в цвете (шкала справа от графиков). Числа в бактериальных имен являются числа штаммов в FAM-базе данных АПН.
Левой колонке на рисунке 5 показана та же штамма без добавления обезжиренного молока. При рН выше 3,5, не было никакого влияния на выживаемость бактерий. Тем не менее, ниже рН 3,5 выживаемость уменьшается в зависимости от продолжительности инкубации. Между рН 3,0 и 3,5 штамм уже сократилось примерно войти 5. После 30-минутной инкубации, было почти линейное уменьшение выживаемости при уменьшении рН от 3,0 до 2,5.
Моделирование в биореакторе
Большинство систем, описанных в литература состоит из нескольких реакционных сосудах, например, Shime [6]. Другие исследования использовали иммобилизованные клетки с тремя реакторами [25], или системы диализной [8]. Основываясь на работе Sumeri и др
. [9] и собранные данные об условиях, в кишечном проходе мы смогли ограничить моделирование в один сосуд. Вместе с данными скрининга кислотостойкость, выбор возможного исходного рН и бульона композиции в имитатора может быть выбран. Полученные параметры моделирования показаны на рисунке 1 и описано в Материалы и методы секции. В ходе экспериментальной стадии данного исследования, Sumeri и др
. [9] разработали аналогичную систему для оценки Lactobacillus
Sp. в симуляции желудка-кишечника прохода.
Пакет программного обеспечения "Лукулл" был отличным инструментом для контроля рН и процесс в соответствии с разработанным моделирования. Выбор среды в биореакторе была упрощена путем выбора соответствующей ростовой среды для штаммов, дополненный с обезжиренным молоком, функционирующий в качестве моделируемого пищевой матрицы. Затем смесь подкисляют до исходного рН добавлением и дополненной ферментными растворами, как описано в материалах и методах. Расчеты проводились последовательно, один за день. Результаты показаны на рисунке 6. Штаммы, используемые для моделирования, приведены в таблице 3 (только бифидобактерии Dentium
был исключен) и стандартизировали к ОП <суб> 650 1.5 перед посевом. Рисунок 6 Разработка 7 штаммов Bifidobacterium во время желудочно-кишечного пассажа моделирования в течение 7 часов. Пунктирная линия показывает время добавления солей желчных кислот и панкреатического сока. Числа в бактериальных имен являются числа штаммов в FAM-базе данных АПН.
Таблица 3 Штаммы, испытанные в моделировании.
Имя
Идентификационный номер коллекции штамма ALP
Bifidobacterium adolescentis
FAM-14377
Bifidobacterium бревисом
FAM-14398
Bifidobacterium лонгум
подвид. infantis
FAM-14390
Bifidobacterium animalis
подвида. Лактис
FAM-14403
Bifidobacterium Dentium
FAM-14396
Bifidobacterium Лонгум
FAM-14382, -14383, -14406
Lactobacillus gasseri
K7
FAM-14459
Bifidobacterium adolescentis
высевали, как описано выше, при начальной концентрации 10 7 КОЕ мл -1 и уменьшается почти линейно до уровня ниже 10 4 КОЕ мл -1 через 5 часов. B. бревисом
и B. лонгум
штаммов имели начальную концентрацию от 10 до 7 и 10 8 КОЕ мл -1 и уменьшается до уровня ниже 10 2 КОЕ мл -1 в течение первых 30 минут. B. animalis
подвид. Лактис
14403 сохранились до приблизительно 15% от начального среднего КОЕ 5 × 10 8 КОЕ мл -1. Был быстрое снижение выживаемости B. лонгум
подвида. infantis
в течение первых 30 мин. Затем выживание уменьшилось лишь медленно от 10 5 до 10 4 КОЕ мл -1.
В более поздней фазе, Lactobacillus gasseri
K7 был включен в исследование, так как несколько проектов были запущены в это время в нашем институте с этим штаммом. Lactobacillus gasseri
K7 высевали на 2,2 × 10 7 КОЕ мл -1 и после 7 ч моделирования концентрации 10 5 КОЕ мл -1 живых клеток все еще присутствует в культуральные среды (рис 7, кривая на 250 мл предварительной культуры). Самое высокое снижение выживаемости было в течение первых 2-х часов и началось сразу же после добавления желудочного солей сока и желчи. В течение этого времени произошло сокращение живых клеток от журнала 2. В течение остального времени моделирования, было только сокращение журнала 1 из живых клеток. Рисунок 7 Сравнение влияния 100 мл предварительной культуры лактобацилл gasseri К7 250 мл предварительной культуры. Предварительную культуру собирали центрифугированием и ресуспендировали в физиологическом растворе хлорида натрия для достижения OD600 1,5. Желудок-кишечного пассажа моделирование инкубировали с использованием скорректированного раствора и инкубируют в течение 7 часов. Пунктирная линия показывает добавление солей желчных кислот и панкреатического сока. Кривые представляют собой среднее значение по двукратному эксперименту.
При подготовке посевного материала Л. gasseri
К7 в объеме культуры 100 мл также оценивали. Результаты экспериментов приведены на рисунке 7. 250 мл культуры снижение живых клеток было около 2 бревна, тогда как снижение с 100 мл культуры только LOG 1 в течение всего времени инкубации. Тем не менее, через 2 ч после добавления солей желчных кислот и панкреатического сока, уменьшение числа клеток была одинаковой для обоих томов.
Обсуждение
При уборке культуры после заданного времени инкубации, фазы роста каждого бактериального штамма может быть отличается, так как все они имеют разную динамику роста. Для того, чтобы получить клетки, примерно на той же стадии роста, предварительные эксперименты были выполнены (данные не показаны). Время инкубации 15 ч для предварительной культуры была пригодна для всех протестированных штаммов кроме Bifidobacterium лонгум
подвида. infantis
которой необходимо инкубировать в течение всего 12 ч.
Кислотный толерантность по скринингу (Рисунки 2, 3 и 4) проводили для оценки влияния рН независимо от других условий. Бифидобактерии Dentium
был очень чувствительным к кислоте, и, следовательно, возможно, не выжить при прохождении через желудок. Штамм, следовательно, не включены в модельных экспериментах. Б.М. Лонгум
штаммы (Рисунок 2) не дают гораздо лучшие результаты, чем B. Dentium
(рисунок 3). Тем не менее, близко к рН 4 они были более устойчивы, чем B. Dentium
.
Б. Лонгум
подвид. infantis
является одним из первых видов заселить кишечник человека вскоре после рождения [26]. На основе экспериментов в этом исследовании, однако, испытуемый Б. лонгум
подвид. infantis
штамм будет только в состоянии пройти желудок младенца в больших количествах, если время перехода в кислой среде желудка был очень коротким. Выживание выбранного штамма в тестируемой среде была слишком низкой для успешного прохождения в больших количествах. Когда штамм ресуспендировали в обезжиренном молоке, выживаемость увеличилась (рисунок 5). Это может быть признаком того, что человеческое молоко помогает B. Лонгум
подвид. infantis
штаммов пройти желудок кишечника проход с на более высокой скорости выживания.
Защитные эффекты молочных белков в пищеварительной системе уже описаны в литературе [27]. Защита с молочными белками также было показано в данном исследовании (рисунок 5). С соответствующей матрицей или даже носителем, пробиотические бактерии могли безопасно пройти через желудок в кишечник, чтобы достигнуть их места действия.
B. adolescentis
штаммы, населяющие кишечник человека в более позднем возрасте, была несколько выше, чем сопротивление B. лонгум
подвида. infantis
что может объяснить снижение последнего в ходе прогресса человеческого младенца к взрослой жизни [26].
Наиболее интересный штамм B. animalis
подвид. Лактис
, который был наименее чувствительным штаммом в нашем исследовании. Этот рН-устойчивый штамм обладает большим потенциалом для использования в пищевых продуктах в качестве пробиотических добавки, так как большего числа бактериальных клеток выдержит проход. Тем не менее, чтобы использовать этот штамм в качестве пробиотика, дальнейшие исследования должны быть выполнены для достижения пробиотического статуса в соответствии с определением Klaenhammer [3].
В нашем исследовании, проглатывания пищевой матрицы моделировали в начальной среда подкисленного молока и ростовой среды. Добавленное моделируемый раствор желудка и кислорода во время фазы желудка увеличивало стресс. Во время прохождения моделируемой в тонкую кишку кислород был заменен азотом и среду нейтрализуют до рН 6,3. Добавление раствора панкреатических и желчных солей завершили проход в тонкой кишке. Это, в пробирке
система не учитывает, что в пищеварении в естественных условиях
, ферменты активируются и инактивированные и другие вещества, например, соли желчных кислот поглощаемые. Sumeri и др
. [9] нашел частичное решение, чтобы обойти эту проблему. Они разводили содержимое реактора со специально разработанным для разбавления среды. Другая возможность для осаждения солей желчных кислот в конце моделирования тонкой кишки, чтобы имитировать энтерогепатическую цепь. Это может быть выполнено с ионами кальция [28-30]. Удаление солей желчных кислот будет лучше моделировать среду толстой кишки и может даже позволить бифидобактерии разрастаться.
В нашем исследовании, оставшиеся соли желчных кислот и панкреатический сок в моделировании привело к дополнительным нагрузкам на бактерии, которые, вероятно, изменили истинные характеристики штаммов в естественных условиях
.
Стартовое КОЕ в моделировании варьировалось в пределах одного журнала КОЕ даже если регулировка OD <югу> 650 инокулята ранее протестированной с animalis Bifidobacterium
подвида. Лактис
и Bifidobacterium лонгум
подвид. infantis
штаммов. Бифидобактерий, используемые в данном исследовании, показали тенденцию к образованию кластеров, которые могут привести к уменьшению КОЕ (визуальные наблюдения, данные не показаны). В другом исследовании, формирование кластеров может быть связано с уменьшением рН во время роста [31]. Эти кластеры, как правило, считается одной из колоний на пластине. На рисунке 6
показывает результаты моделирования прохождения желудка-кишечника более 7 часов из семи протестированных штаммов Bifidobacterium
. Концентрация живых клеток бифидобактерий уменьшилось сразу после инкубации в связи с низким значением рН (рН 3,0). Тем не менее, B. animalis
подвид. Лактис
оставалась стабильной. Это подтвердили результаты предыдущих экспериментов, описанных выше (рисунок 4). Это сопротивление может быть продлен до солей желчных кислот и панкреатический сок хотя и подсчетов клеток B. animalis
подвида. Lactis
уменьшилось на 85% от исходного значения (рисунок 6). По сравнению с другими штаммами, используемых в данном исследовании, однако, это снижение было практически не заметно.
Все Б. лонгум
и B. BREVE
штаммы очень быстро умер в начале моделирования и были ниже обнаружения предел способа нанесения покрытия в течение нескольких часов (рисунок 6), который следовало ожидать из результатов эксперимента скрининга выше (фиг.2 и 4).
с другой стороны, Б. лонгум
подвид. infantis
14390 быстро снижалась в начале моделирования, но после добавления панкреатических солей сока и желчи и изменения в анаэробной среде, скорость восстановления уменьшается. Наше исследование показывает, что этот штамм хорошо приспособлен к условиям в кишечнике, но должен поступать в организм в больших количествах, чтобы выжить в условиях в желудке (кислород, низкий уровень рН). Как уже упоминалось выше, Б. лонгум
подвид. infantis
штаммы относятся к первой группе бактерий, населяющих кишечник младенцев [26].
В отличие от Б. лонгум
подвида. infantis
, Б. adolescentis
уменьшилась почти линейно в течение 7 ч моделирования. Там не было обнаружено прерывание, когда условия в ферментере изменились. На основе экспериментов для скрининга кислоты толерантности, этот результат был неожиданным.
Тем не менее, это может быть связано с условиями тестирования, где соль желчной кислоты и желудочного сока концентрации оставались на исходном уровне, а не разводили, как они были бы в
естественных условиях. В будущем эксперименте, следует оценить, является ли разработан метод разбавления Sumeri и др
. [9] будет стабилизировать количество клеток из B. adolescentis
в течение 6-часового периода моделирования в кишечнике.
В нашем исследовании мы также оценили желудочно-кишечное прохождение Lactobacillus gasseri
K7. Штамм уже оценивали на выживание в естественных условиях
в поросятам [14]. Таким образом, можно было сравнить наши в пробирке
результаты с данными естественных условиях
экспериментов в области.
Bogovic др
. [14] кормили поросят в течение 14 дней с 5 * 10 10 КОЕ день -1 Л. gasseri
K7. Это привело к приблизительно. 7 * 10 4 КОЕ г -1 в фекалиях в течение периода кормления. Следует принимать во внимание, что концентрация бактерий разводили до того, как в конце концов прибыл в желудочно-кишечного прохода. В грубом приближении, мы подсчитали, что около 1% прибыли в проход. Это позволило нам сравнить результаты этого исследования поросенка с концом нашего моделирования.
Как показано на рисунке 5, Л. gasseri
K7 имел концентрацию клеток примерно 5 * 10 4 КОЕ мл -1 после 7-часового периода моделирования (с предварительной культуры 250 мл), которая аналогична концентрации в фекалиях поросят. Это наводит на мысль о том, что имитационная модель используется в данном исследовании, может быть полезным инструментом для оценки последствий прохождения в модели в лабораторных условиях с использованием
до дорогих в естественных условиях модели
. Модель может быть дополнительно оптимизирована за счет разбавления солей желчных кислот и панкреатический сок, как описано Sumeri др
. [9]. Для имитации активации и дезактивации ферментов подходящий метод до сих пор не найдено.
Когда только 100 мл среды использовали для инокуляции L. gasseri
K7, культура пережила моделирование лучше (рисунок 7). Оба тома имели аналогичный первоначальный подсчет клеток. Оба тома были привиты по 1 мл. Таким образом, культура с объемом 250 мл, в более ранней стадии роста, чем в 100 мл культуры. Эти результаты были признаком фазы роста зависимости от культуры в период стресса.
Заключение
В данном исследовании мы смогли показать, что система, чтобы имитировать желудок кишечника проход, разработанный Sumeri и др <бр>. [9] был пригоден для оценки выживаемости 8 штаммов Bifidobacterium
и Lactobacillus gasseri
K7, даже если мы не симулировать удаление желудочного солей сока и желчи. Для L. gasseri
K7 мы смогли сравнить результаты с исследования в естественных условиях на
поросятам и получили аналогичные результаты.
Единой системы реактора, представленный здесь, позволяет более прямое определение идеальной фазы роста для любого возможного пробиотического штамма, который требуется, чтобы пройти желудок кишечник проход, чем если бы оно должно было быть выполнено с другими системами с трудной установкой.
исследование также показало, что все испытанные штаммы Bifidobacterium
, за исключением B. animalis
подвид. Lactis
, потребует защитных средств, чтобы выжить при прохождении через желудок-кишечник в больших количествах. Это может быть сделано с использованием соответствующей пищевой матрицы или инкапсулирование клеток.
Методы
Бактериальные штаммы
Все штаммы бифидобактерий были выбраны из коллекции деформации Agroscope Liebefeld-Posieux ALP-исследовательской станции Швейцарии, выделяют из ALP человеческие источники. Lactobacillus gasseri
K7 возникла из ZIM коллекции промышленных микроорганизмов Университета Любляны, Биотехнический факультета (ZIM 105) [10], а также был депонирован в коллекции штамма ALP. Исследуемые штаммы и их идентификационные номера коллекции штамма ALP приведены в таблице 3. Все штаммы бифидобактерий являются собственностью ALP.
СМИ и условия роста
Для предварительных культур, 1 мл замороженных консервирует штаммов были засевают в 250 мл Wilkins-Chalgren бульона (WC CM0643, Oxoid, Hampshire, UK), дополненной 9 г л -1 дополнительного лактозы моногидрата (бифидобактерий) или De Man-Рогоза-Sharpe (MRS; Biolife, Милан, Италия) средний (Lactobacillus gasseri
K7) [32]. Для L
. gasseri K7, проба с 100 мл предварительной культуры также была проведена. Все штаммы, кроме Bifidobacterium Лонгум
подвида. infantis
, инкубировали при 37 ° С в течение 15 часов в анаэробных условиях. Bifidobacterium лонгум
подвид. infantis
инкубировали в течение 12 ч, так как он был очень чувствительным к длительный инкубационный период. Предварительные культуры центрифугировали в течение 15 мин при 3500 оборотах в минуту и гранулы ресуспендировали в 10 мл фосфатно-буферного раствора, физиологического хлорида натрия (PBS).
Определение ячейки подсчета
Подсчет клеток определяли с помощью 10-кратного серийное разведение культуры в физиологическом солевом растворе. Две самые высокие разведения были затем высевают на MRS агар (Biolife, Milano, Италия) с использованием спиральной Plater (IUL инструменты, Барселона, Испания) и оценивали с помощью автоматического счетчика колоний с соответствующим программным обеспечением (IUL Instruments, Барселона, Испания).
Скрининг на кислотостойкость
для кислотостойкость скрининга концентрированной суспензии клеток из предварительной культуры не пипеткой в 20 мл PBS, пока в ОП <суб было достигнуто> 650 1.0. 4 мл этой клеточной суспензии затем высевали в 16 мл буфера цитрата-HCl (три-Na-Citratex2 Н <югу> 2O 7,35 г и 250 мл дистиллированной Н <суб> 2O, адаптированный к соответствующему рН с помощью 1 М HCl) при значениях рН 2.0, 2.5, 3.0, 3.5 и 4.0. Инкубирование проводят при 37 ° С и образцы брали каждые 30 мин в течение 120 мин. 1 мл образцов смешивали с 9 мл 0,25 М фосфатного буфера при рН 7,0 на первой стадии серии разведений. Для испытания на стойкость к действию кислот в пищевой матрицы, то же самое количество предварительной культуры, используемое выше (с поправкой на значение OD <суб> 650 1.0) пипеткой в 20 мл UHT обезжиренным молоком. 4 мл этой суспензии клеток в молоке, инокулировали в 16 мл буфера цитрата-HCl. Все химикаты были приобретены у Merck (Дармштадт, Германия). Данные для экспериментов скрининга визуализировали в изополей с помощью программного обеспечения Sigmaplot 11.0 (Systat Software Inc., Chicago IL, США).
Моделирование в биореакторе
Все растворы свежеприготовленной для каждого эксперимента. Имитационное раствор желудок был изготовлен из 50 мг пепсина свиньи слизистой оболочки желудка (Sigma-Aldrich P7012, Букс, Швейцария) в 20 мл 0,1 М HCl. Для моделируемой панкреатического сока 2 г панкреатина (Sigma-Aldrich P7545) растворяли в 50 мл 0,02 М фосфатного буфера при рН 7,5. Симуляция раствор солей желчных кислот была сделана из 7,5 г бычьей желчи (Sigma-Aldrich B3883) доводят до 50 мл дистиллированной H <> 2O к югу. Бульон для моделирования был либо 1 л WC или MRS бульон с 29,41 г citratex2 три-натрия H <югу> 2О. Добавили в ходе тестирования выживаемости в пищевой матрицы, 500 мл пастеризованного обезжиренного молока и рН доводили до 3,0 с помощью 5 М HCl незадолго до моделирования. 1 мкл среды добавляли в биореактор (NewMBR Mini, NewMBR, Швейцария), предварительно стерилизованной водой (121 ° C, 20 мин), и нагревают до 37 ° С. Во время моделирования желудка, аэрация была реализована. Процесс ферментации контролируется и регистрируется с помощью встроенного программного обеспечения для управления процессом Лукулл (Biospectra, шлирен, Швейцария). Концентрированный клеточную суспензию из предварительной культуры с помощью пипетки в 40 мл PBS с ОП <суб> 650 1.5. Незадолго до инокуляции суспензии 40 мл клеток, в 20 мл имитированной раствора желудка добавляли в среду (1 л) в биореакторе. РН доводили с помощью 2 M NaOH.
Шестьдесят минут после инокуляции клеток, кислород был заменен азотом с получением анаэробной атмосфере.
 Потеря кишечного эпителиального барьера, ответственного за MIS-C, связанный с COVID-19, у детей,
Потеря кишечного эпителиального барьера, ответственного за MIS-C, связанный с COVID-19, у детей,
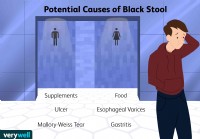 Каковы причины черного стула?
Каковы причины черного стула?
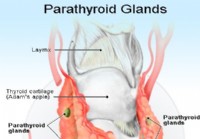 Гиперкальциемия (повышенный уровень кальция)
Гиперкальциемия (повышенный уровень кальция)
 Диагностика открытых повреждений живота - Диагностика острого живота
Диагностика открытых повреждений живота - Диагностика острого живота
 Когда вам нужна госпитализация по поводу язвенного колита?
Когда вам нужна госпитализация по поводу язвенного колита?
 Как упаковать добавки для поездки
Как упаковать добавки для поездки
 Как лечат перфоративную язву двенадцатиперстной кишки?
Как лечат прободную язву двенадцатиперстной кишки? Язвы можно лечить с помощью хирургической процедуры, называемой заклеиванием сальника. Сальниковая заплата хирургическая процедура для лечения
Как лечат перфоративную язву двенадцатиперстной кишки?
Как лечат прободную язву двенадцатиперстной кишки? Язвы можно лечить с помощью хирургической процедуры, называемой заклеиванием сальника. Сальниковая заплата хирургическая процедура для лечения
 Зачем делать колоноскопию?
Колоректальный рак остается второй по значимости причиной смерти от рака в США и распространен во всех расовых и этнических группах. Цифры колоректального рака пугают: По данным Американского онколог
Зачем делать колоноскопию?
Колоректальный рак остается второй по значимости причиной смерти от рака в США и распространен во всех расовых и этнических группах. Цифры колоректального рака пугают: По данным Американского онколог
 Барбекю, полезное для кишечника:кебаб из говядины с соусом чимичурри
В преддверии Дня поминовения я думал о том, как отпраздновать неофициальное открытие сезона барбекю. В конце концов, ничто так не говорит о лете, как день, проведенный на свежем воздухе с семьей и дру
Барбекю, полезное для кишечника:кебаб из говядины с соусом чимичурри
В преддверии Дня поминовения я думал о том, как отпраздновать неофициальное открытие сезона барбекю. В конце концов, ничто так не говорит о лете, как день, проведенный на свежем воздухе с семьей и дру