Влияние интерлейкины-1 на пролиферацию эпителиальных клеток желудка в культуре
Аннотация
Справочная информация
хеликобактерной
является основным фактором риска для развития не кардиального рака желудка. Увеличение пролиферации слизистой оболочки желудка является характерной чертой H. Pylori
инфекции. Слизистые interkeukin-1β производство увеличивается в H. Pylori
инфекции и IL-1 генотипов, ассоциированных с повышенной провоспалительных активности являются факторами риска для развития рака желудка. Эффект IL-1 на пролиферацию эпителиальных клеток желудка было изучено в данном исследовании.
Методы
AGS клетки культивировали с IL-1. Синтез ДНК оценочный с помощью [
3 H] тимидина и общего числа жизнеспособных клеток путем МТТ.
Результаты
IL-1 дозозависимо увеличение синтеза ДНК и клеточных чисел. Усиленной пролиферации была блокирована антагонистом рецептора интерлейкина-1. Добавление нейтрализующих антител к GM-CSF снижается IL-1β-стимулированную пролиферацию на 31 ± 4%. GM-CSF в одиночку значительно стимулировал пролиферацию. Добавление или нейтрализации IL-8 не имели никакого влияния на базальную или IL-1β-стимулированных пролиферации. Ингибитор тирозинкиназы генистеин полностью блокировали IL-1-стимулированной пролиферации и торможение внеклеточного сигнала, связанных с киназы с PD 98059 ингибируется IL-1β стимулировали пролиферацию на 58 ± 5%.
Выводы
IL-1 стимулирует пролиферацию эпителиальных клеток желудка. АУТОКРИННОЙ стимуляция GM-CSF способствует этому пролиферативный ответ. Передача сигналов с помощью активности тирозинкиназы имеет важное значение для митогенном ответ на IL-1. Внеклеточного связанные сигнал киназы участвует в, но не является необходимым для передачи сигнала. IL-1β может внести свой вклад в гиперпролиферация видели в H. pylori-
инфицированной слизистой оболочки желудка, а также принимать участие в канцерогенного процесса.
Фон
хеликобактерной
, как полагают, является основным этиологическим фактором развитие не-кардии аденокарциномы желудка. Крупномасштабные эпидемиологические исследования подтвердили сильную связь между H. Pylori
инфекции и как рак [1-3] и ранее гистологической стадии, атрофии и кишечной метаплазии [4, 5]; оба из которых увеличивают риск последующего неопластической трансформации. Модели на животных также продемонстрировали важность H. Pylori
в желудочном канцерогенезе [6, 7]. Увеличение скорости пролиферации слизистой оболочки желудка типичны для хеликобактерной
инфекции [8-11], а также гиперпролиферацию в желудочно-кишечный тракт, как представляется, является маркером для последующего злокачественного изменения [12]. Причиной увеличения скорости распространения не ясна, но увеличение темпов снижения к нормальному с зазором инфекции [8, 13]. Хотя hypeprproliferation характерно в естественных условиях,
исследования тестирования эффектов хеликобактерной
или ее продукты в пробирке
показали противоречивые результаты, как с повышенной [14, 15] и уменьшалась [16-18] пролиферации сообщили. Вполне возможно, что другие компоненты воспалительной реакции типичные антихеликобактерной
зараженную слизистую оболочку может быть, по крайней мере частично ответственным за рулем повышенную пролиферацию клеток.
Плюрипотентные провоспалительного цитокина интерлейкина-1β играет центральную роль в патогенез H. Pylori
воспаление слизистых оболочек, индуцированного. IL-1β экспрессию гена и продуцирование белка увеличены в H. Pylori
инфекции и уменьшить с успешной ликвидации [19, 20]. Присутствие IL-1 генотипа полиморфизма, связанного с повышенной IL-1 производства было связано со значительным увеличением риска развития рака желудка и предраковых поражений [21, 22]. Интерлейкин-1β является мощным ингибитором секреции желудочной кислоты и Высказывается гипотеза, что усиленный ИЛ-1β реакция изменяет топографию желудка инфекции и, таким образом, способствует воспаление и последующей атрофией желудка [23 корпуса, 24]. Возможность того, что IL-1 приводит в себя увеличение пролиферации эпителиальных клеток желудка не была полностью исследована. Переделка желудка пролиферации IL-1 может способствовать канцерогенного процесса, в дополнение к воздействию на секрецию кислоты. Поэтому прямые эффекты IL-1 β на желудочную пролиферации эпителиальной были оценены.
Митоген-активируемой протеинкиназы (МАРК) каскады хорошо охарактеризованные путей трансдукции сигналов от поверхности клетки к ядру. Семейство включает в себя различные подгруппы; внеклеточной связанных киназ (ERKs), C-июнь NH 2-концевые киназ (JNKs) и р38 МАРК [25]. В ERKs активируются различные внеклеточные раздражители, и опосредуют про-пролиферативные эффекты ряда гормонов и факторов роста [26, 27]. Активации фосфорилирования протеинкиназы двойной специфичностью (МАР-киназы-киназы (MAPKK)), (также известный как МЕК), это позволяет в свою очередь, активировать семейство серин-треонин протеинкиназы, известный как ERKs. В ERKs в свою очередь, фосфорилирует многочисленные клеточные белки, включая факторы транскрипции и, таким образом, играют центральную роль в распространении митогенных сигналов. Соответственно роль МАР-киназы пути в опосредовании ответов на IL-1 был оценен.
Методы
Культура клеток
Человеческий AGS желудочной линии клеток карциномы был приобретен у Европейской коллекции культур клеток животных (Портон Даун, Великобритания). Клетки выращивали в монослойной культуре в среде RPMI 1640, дополненной 100 мкг /мл пенициллина, 100 мкг /мл стрептомицина, 100 мкг /мл гентамицина, 2,5 мкг /мл amphoteracin В и 10% эмбриональной телячьей сыворотки. Клетки выращивали в 75 см 2 флаконах для культуры ткани при температуре 37 ° С в атмосфере 5% CO <югу> 2 и 95% воздуха и пассировать каждые 5-7 дней.
Исследования пролиферации
[ 3Н] тимидина. Клетки выращивали в среде, содержащей 10% фетальной телячьей сыворотки, высевали в 24-луночные планшеты при 10 5 клеток /лунку и позволяли закрепляться в течение ночи. После промывания не содержащей сыворотки среды, клетки инкубировали в среде без сыворотки, содержащей 0,2 мМ немеченого тимидина в течение 24 ч в присутствии возрастающих концентраций IL-1, IL-8 или GM-CSF. Синтез ДНК оценивали путем измерения [ 3H] тимидина в трихлоруксусной кислоты (ТСА) осаждаемый материал [28]. [ 3H] тимидина (0,1 мкКи /мл, 10 Ки /ммоль) добавляют за 2 ч до окончания периода лечения 24 часа. Клетки промывали дважды бессывороточной средой для удаления неинкорпорированную [ 3H] тимидина, и ДНК осаждали с 5% ТСА при температуре 4 ° С в течение 15 минут. Осадок затем дважды промывали 95% этанолом, растворяли в 1 мл NaOH, и анализировали с помощью жидкостного сцинтилляционного счетчика. Результаты выражены в виде процента управления нестимулированных [ 3H] тимидина (среднее ± стандартное отклонение) 4-6 различных экспериментов, каждый из которых проводили в трех повторностях. Для обнаружения ингибирования роста клетки инкубировали либо специфического ингибитора МЕК PD 98059 (25 мкМ) [29], IL-1, антагонист рецептора (500 нг /мл) [30] или нейтрализующие антитела, анти-GM-CSF (5 мкг /мл) или анти-IL-8 (10 мкг /мл). Ингибиторы или антитела были добавлены 30 минут до цитокинами.
Клеточного роста
Всего количества живых клеток оценивали с помощью модифицированного МТТ (3- [4,5-диметилтиазол-2-ил-] -2,5-дифенил анализ tetrazolim бромид) [31]. Клетки высевали в 24-луночные планшеты в среде, содержащей 10% фетальной телячьей сыворотки. После присоединения в течение ночи, среду заменяли на 1% фетальной телячьей сывороткой среды и добавляли возрастающие концентрации IL-1. Клетки культивировали в течение 48 ч, а затем среду удаляли и свежей средой RPMI 1640, содержащей 0,5 нг /мл МТТ добавляли. Клетки инкубировали при 37 ° С в течение 3-х часов. Затем среду удаляли и 0,04 М HCl в изопропаноле добавляли для экстракции восстановленного формазанового продукта. Полученная оптическая плотность при 550 нм была определена.
Химикаты и реагенты
рекомбинантный человеческий IL-1 и IL-8 были приобретены у Sigma (Poole, UK), рекомбинантного человеческого GM-CSF и антагониста рецептора IL-1, анти-GM-CSF и анти-IL-8 были из R и D систем (Abingdon, Великобритания). PD 95059 был из Calbiochem (Ноттингем, Великобритания). RPMI 1640, был от Gibco BRL (Paisley, UK), и все другие реагенты от Sigma. Концентрации ингибиторов, используемых были взяты из данных производителей и опубликованных данных. Способность 500 нг /мл IL-1ra упразднить 10 нг /мл IL-1-стимуляцию секреции IL-8 в клетках AGS была подтверждена. Эффективность анти-GM-CSF в концентрации 5 мкг /мл антитела упразднить GM-CSF (1 нг /мл), индуцированной пролиферации АГС клеток было подтверждено.
Статистика
стимулированной цитокином результаты, где по сравнению с контрольными клетками нестимулируемых на той же 24-луночного планшета. Данные сравнивались с помощью одностороннего анализа вариантов и Т-тест Стьюдента для определения статистической значимости. Каждый эксперимент, как выполняется в трех экземплярах на 4-6 раз. Результаты выражены в виде среднего значения ± стандартное отклонение. Различия с P значений &л; 0,05 считались значимыми.
Результаты Влияние IL-1 на [3Н] тимидина
интерлейкин-1β вызвало дозозависимое увеличение синтеза ДНК как измерено тимидина. Как показано на рисунке 1, значительное раздражение наблюдали при 1-100 нг /мл IL-1 β. Максимальная стимуляция 52 ± 6% выше контроля наблюдали при концентрации 10 нг /мл. Чем выше доза 100 мг /мл был немного менее эффективно стимулирует пролиферацию. Рисунок 1 Влияние IL-1 на [3H] тимидина в желудочных эпителиальных клеток AGS клетки обрабатывали возрастающими концентрациями IL-1 в течение 24 часов и синтеза ДНК, оцененных [3H] тимидина. Результаты выражены в виде средних значений ± стандартное отклонение. * P &
л; 0,01 по сравнению с контролем
Влияние IL-1 на количество клеток
Увеличение синтеза ДНК IL-1 был переведен на абсолютное увеличение количества жизнеспособных клеток. Как показано на рисунке 2, IL-1β увеличение числа клеток в зависимости от дозы зависит аналогично воздействию на [ 3Н] тимидина. Максимальная стимуляция снова видно в концентрации 10 нг /мл IL-1 β, который произвел -ное увеличение общего числа клеток 22 ± 5%. Рисунок 2 Влияние IL-1 на количество клеток желудочных эпителиальных клеток клетки обрабатывали возрастающими концентрациями IL-1 в течение 48 часов и общего числа жизнеспособных клеток, оцененных в МТТ-анализе. Результаты выражены в виде средних значений ± стандартное отклонение. * P &
л; 0,01 по сравнению с контролем
воздействию цитокина ингибирования или антагонизм рецепторов на IL-1 β стимуляция пролиферации
Предварительная обработка клеток с антагониста рецептора интерлейкина-1 отменило стимулирующие эффекты IL-1 на [ 3 Н] тимидина (рисунок 3). Предыдущие исследования показали, что IL-1β может активировать эпителиальных клеток желудка, в том числе клетки AGS, секретируют другие цитокины, особенно интерлейкин-8 и фактор, стимулирующий колонии гранулоцитов-макрофагов (GM-CSF) [31, 32]. Поэтому дальнейшие исследования были проведены для оценки, если Стимулирующие действия IL-1 были опосредованы либо из этих двух цитокинов. не Нейтрализация антител либо IL-8 или GM-CSF оказывает никакого влияния на нестимулированных [ 3Н] тимидина. Нейтрализация IL-8 не оказывает влияния на рост IL-1-stimuated но анти-GM-CSF антитела восстановленного IL-1β-стимулированных пролиферации на 31 ± 4% (P &
л; 0,01) (рисунок 3). Рисунок 3 Влияние цитокина ингибирования на IL-1 β стимуляции [3H] тимидина в эпителиальных клеток желудка AGS клетки обрабатывали 10 нг /мл IL-1β в течение 24 часов плюс антагонизмом либо интерлейкин-1 (IL-1ra 500 нг /мл), нейтрализующие анти-IL-8 антитела (10 мкг /мл) или нейтрализующие анти-GM-CSF антитела (5 мкг /мл). Синтез ДНК оценивали с помощью [3H] тимидина. Результаты выражены в виде средних значений ± стандартное отклонение. * P &
л; 0,01 по сравнению с IL-1 стимуляции в отсутствие ингибитора.
Эффекты GM-CSF на пролиферацию
С учетом результатов, полученных с антителом анти-GM-SCF, непосредственный рост-стимулирующего действия ГМ-КСФ Обследовано. GM-CSF, имели мощный рост стимулирующее действие на AGS клетках: значительное усиление [ 3H] тимидина было замечено при всех концентрациях (0,001-100 нг /мл) GM-CSF. Сам GM-CSF оказался более мощным стимулятором, чем IL-1; максимальная стимуляция 108 ± 17% выше контроля был замечен с 100 нг /мл GM-CSF (Рисунок 4). Ингибирующее действие анти-GM-CSF антитела была подтверждена отменой роста стимулирующего действия 1 нг /мл GM-CSF, (данные не показаны). Предыдущие исследования показали, что высвобождение ИЛ-1β-стимулированных GM-CSF, в аналогичных условиях в AGS клетках составляет приблизительно 10-20 пг /лунку /24 часа [32]. Для подтверждения результатов, полученных с антителом анти-IL-8, [ 3H] тимидина измеряли в ответ на IL-8. Ни один усиление пролиферации не наблюдалось при любой концентрации IL-8 (0,001-100 нг /мл) (данные не показаны). В аналогичных условиях IL-1β-стимулированных высвобождение IL-8 составляет приблизительно 3000 пг /лунку /24 часа [31]. Рисунок 4 Влияние GM-CSF на пролиферацию эпителиальных клеток желудка. Клетки AGS обрабатывали возрастающими концентрациями GM-CSF в течение 24 часов. пролиферации клеток оценивали с помощью [3H] тимидина. Результаты выражены в виде средних значений ± стандартное отклонение. * P &
л; 0,05, ** P &
л; 0,01 по сравнению с контролем
Механизм IL-1 β-стимуляции пролиферации клеток
Удельное ингибиторы генистеин, которое ингибирует тирозин киназ и PD 98059, которое ингибирует МАР-киназы киназы (МЕК), и, таким образом, ингибирует ERK-пути, были используется для оценки возможных внутриклеточные пути, опосредующие эффекты IL-1. Для того чтобы исследовать влияние ИЛ-1β, отличающиеся от потребностей GM-CSF, эти эксперименты проводили в присутствии анти-GM-CSF нейтрализующих антител. Как показано на рисунке 5, ни генистеин, ни PD 98059 изменили нестимулируемых [ 3Н] тимидина. Генистеин полностью отменили IL-1-стимуляцию пролиферации. Ингибирование МЕК с PD 98059 уменьшенный IL-1β-стимулированную пролиферацию на 58 ± 5% (P &
лт; 0,01) (рисунок 5), но не полностью отменить роста стимулирующее действие IL-1. Дальнейшее увеличение до надрегиональных максимальная концентрация PD 98050 не далее ингибировать IL-1β-стимулированную пролиферацию (данные не показаны). Рисунок 5. Влияние ингибирования тирозинкиназы и МЕК активностью на ИЛ-1β-стимулированных желудка пролиферации эпителиальных клеток. AGS клетки обрабатывали 10 нг /мл IL-1 β в течение 24 часов в присутствии ингибитора тирозинкиназы генистеин (100 мкМ) или ингибитор МЕК PD 98059 (25 мкМ). Пролиферацию оценивали с помощью [3H] тимидина. Исследования проводились в присутствии анти-GM-CSF антитела (5 мкг /мл). Результаты выражены в виде средних значений ± стандартное отклонение. * P &
л; 0,01 по сравнению с контролем
Обсуждение
Данное исследование показало, что IL-1β повышенную пролиферацию клеток AGS. Этот эффект был отменен с помощью антагониста рецептора, рекомендуемом опосредовано через рецептор интерлейкина-1. ИЛ-1β стимулировало как [ 3 Н] тимидина, как мера стимуляции ДНК синтетического скорости, а также общего количества клеток, как измерено в анализе МТТ. Это свидетельствует о том, что стимуляция синтеза ДНК IL-1 переводится в реальное увеличение количества клеток.
Порцию стимулирующее действие IL-1, как представляется, косвенным. Нейтрализация GM-CSF в средствах массовой информации привело к значительному снижению IL-1β-стимулированных пролиферации. Клетки AGS, как известно, секретируют GM-CSF в ответ на IL-1 [32]. Сам GM-CSF был мощным стимулятором пролиферации клеток. Таким образом, представляется вероятным, что часть роста Стимулирующие действия IL-1 обусловлены аутокринным промежуточного действия GM-CSF. Существуют ограниченные предыдущие данные, согласно которым GM-CSF стимулирует пролиферацию не-кроветворных клеток; Диппольд и др
показали, что экзогенный GM-CSF стимулирует рост двух из двух культур, полученных из желудка карцином и двух из девяти панкреатических линий клеток карциномы [33, 34]. Тем не менее, в отличие от нынешнего исследования, аутокринная производство GM-CSF было не обнаружено.
Желудочные эпителиальные клетки также не производят IL-8 в ответ на IL-1 [31]. Однако в этой модельной системе, IL-8 в одиночку не было про-пролиферативное действие и нейтрализации IL-8 не влияет на стимулирующее действие IL-1. Поэтому маловероятно, что IL-8 имеет аутокринную роль в росте-стимулирующее действие IL-1. Вполне возможно, что другие цитокины, вырабатываемые эпителиальных клеток желудка в ответ на IL-1, Н. Pylori или
другие воспалительные инсульты могут также играть роль в качестве аутокринных или паракриновых медиаторов роста. Недавно было сообщено, что другой С-Х-С хемокина, GRO /CINC-1, который также повышалась в H. Pylori
инфекции стимулировал пролиферацию в крысиных эпителиальных клеток желудка [35]. Роль этих других потенциальных аутокринных посредников заслуживает дальнейшего изучения.
Результаты исследований ингибиторов убедительно свидетельствуют, что активность тирозинкиназы имеет важное значение для роста, способствующего действие IL-1 в клетках AGS. Ингибитор тирозинкиназы генистеин отменила стимулирующее действие IL-1. IL-1β известно, активирует множество внутриклеточных сигнальных путей [31, 36-39], но в нынешней ситуации, как представляется, абсолютное требование для передачи сигналов через тирозинкиназы, последующей активации рецептора на.
Митогеном -активированную белок каскад представляет собой хорошо охарактеризованный путь опосредует клеточного роста стимулирующими действия многих факторов роста и гормонов. Ингибирование ERK пути, с ингибитором МЕК PD 98059, который предотвращает активацию ERKs фосфорилированием, оказали значительное ингибирующее действие против стимулирующего действия IL-1. Это говорит о том, что активация ERK пути играет важную роль в опосредовании росте стимулирующим действия IL-1. Активация MAP киназы каскады, включая p42 и p44 ERK путей и p46JNK и p55JNK с-Jun NH <подразделам> 2-концевых киназ с помощью IL-1 была продемонстрирована у крыс эпителиальных клеток желудка [41, 42], но функциональное значение из этих путей не рассматривалась. Активация ERKs и JNKs подавлялась генистеин [41], в соответствии с выводом текущего исследования, которые лежат ниже по течению MAPKs тирозин активности IL-1β-индуцированной сигнализации. Однако в текущем исследовании PD 98059 не полностью отменить стимулирующее действие IL-1, предполагая, что альтернативные пути, активированный последующий на активность тирозинкиназы, также играют определенную роль в передаче сигналов пролиферативного ответа на IL-1. Дальнейшие исследования ведутся в настоящее время, чтобы изучить их.
Есть в наличии противоречивые данные, касающиеся прямого воздействия IL-1 на желудочную эпителиальной пролиферации. Несмотря на то, текущем исследовании и исследовании Fan и др
использованием стимулированного лейкоцитарной кондиционированной среды показали повышенную пролиферацию клеток человека линии AGS [14], другие показали ингибирование сыворотки, TGF- и EGF-стимулированной пролиферации в RGM1 крысы эпителиальных клеток желудка с помощью IL-1 [41, 42]. Томинага и др
показали, что предварительная обработка RGM1 клеток с IL-1, в течение 6 часов заторможенных пролиферации в течение 24 часов, но ингибирующее действие было потеряно в течение 48 часов, [41]. Причины этих расхождений не ясны. Они могут отражать внутренние различия между клеточными линиями, различия в активации и вовлечением паракриновых путей, способствующих росту, вариабельность видов, эффект специфического для определенных факторов роста, или лежащих в основе различий в биологии клеточных линий, полученных от рака (AGS), или нормальный ткань (RGM1). Исследования, демонстрирующие ингибирование пролиферации с помощью IL-1 β проводили в присутствии сильных стимулов, способствующих росту (в сыворотке крови или удельные концентрации фактора роста в культуральной среде), вист текущие исследования проводились в бессывороточной или 1% сыворотки сред , Вполне возможно, что многочисленные сигнальные пути, активированные IL-1, оказывают различное влияние на пролиферацию, доминирующий эффект в зависимости от комплексных взаимосвязей стимулов и путей передачи сигналов в различных условиях. Провоспалительных цитокинов, таких как IL-1 и TNF-a активировать различные сигнальные пути с расходящимися результатами и различных временных курсах в желудочном эндокринных и париетальных клеток [37, 38, 43-46]. Дальнейшие исследования ведутся изучение конкретных функций различных сигнальных путей в эпителиальных клеток желудка в различных условиях.
Есть в настоящее время сильные эпидемиологические данные, связывающие H. Pylori с услугой рака желудка. Канцерогенного процесса, как представляется, включают ряд шагов: H. Pylori
индуцированная воспаление прогрессирует и приводит к атрофии, кишечной метаплазии, дисплазии и в конечном итоге рака [47]. Точно так же H. Pylori
инфекции у монгольских песчанок легко вызывает атрофию желудка и рак [6]. В то время как желудочный канцерогенез, несомненно, является многофакторный процесс, включающий патогенные бактериальные и принимающие факторы, включая статус HLA, диеты и антиоксидантного статуса [47, 48], то ясно, что увеличение желудка пролиферацию эпителия, особенно при относительно увеличилась по сравнению с апоптозом, является важным часть пути [49, 50]. Увеличение желудка пролиферации эпителия является типичным H. Pylori
инфекции; это доказуемо на всех этапах инфекции и искоренения инфекции снижает пролиферацию. Увеличение пролиферации является важным маркером повышенного риска желудочно-кишечного тракта аденокарциномы [12]. Механизмы увеличения пролиферации не совсем понятны. В пробирке исследования
тестирования культур H. Pylori или
составных частей дали противоречивые результаты в различных системах, с различными типами клеток и бактериальных штаммов. Прямая стимуляция эпителия желудка пролиферации хеликобактерной
сообщалось некоторыми авторами [14, 15], в то время как либо нейтральные эффекты [15] или увеличение апоптоза и снижение пролиферации было зарегистрировано другими [16-18]. Вентилятор и др
сообщили, что кондиционированной среды или от H. пилори или
митоген активированных лимфоцитов непосредственно стимулировали пролиферацию клеток AGS [14], предполагая, что воспалительная реакция может быть частично ответственным за повышение эпителиальной пролиферации. производство IL-1β повышается в хеликобактерной
инфекции и этот цитокин рассматривается как центральное место в регуляции про-воспалительной реакции в хеликобактерной
инфекции.
IL-1β является глубоким ингибитором секреции желудочной кислоты в естественных условиях
[51] и в изолированных париетальных клеток [37, 38]. Генетические полиморфизмы кластера генов IL-1 вызывает повышенную активность транскрипции связаны с повышенным риском развития предраковых и раковых гистологических изменений в H. Pylori
инфекции [21, 22]. Общая гипотеза, объясняющая это наблюдение было то, что расширение ИЛ-1β производства как следствие на хеликобактерной инфекции
отвечает за большую подавление секреции кислоты, что в свою очередь позволяет более колонизацию кислотно-секретирующих слизистой оболочки тела [24]. Это больше колонизация провоцирует дальнейшее воспаление, что в конечном итоге приводит к потере специализированной кислотно-секреторной эпителия (атрофия) и далее потенцирует порочный круг увеличения воспаления и уменьшенную секрецию кислоты [52]. Желудочный атрофии значительно предрасполагает к раку [3]. Считается, что атрофия в сочетании с медиаторы, высвобождаемые при воспалении, таких как свободные радикалы кислорода и оксида азота, диеты, состояния антиоксидантной и, возможно, бактериального роста и генерации нитрозаминов в ахлоргидрия желудка [53] продвигать гистологические изменения, вызывают mutageneisis и привод приводит к раку.
альтернатива, но не исключают друг друга, гипотеза состоит в том, что повышенная цитокиновый ответ непосредственно усиливает пролиферацию эпителиальных клеток и сама предрасполагает к раку, в дополнение к воздействию на секрецию кислоты. Повышенный оборот клеток этого гиперпролиферативных ответ будет сама сделать слизистую оболочку более уязвимой к мутагенных эффектов свободных радикалов и других токсических продуктов, образующихся в ахлоргидрия воспаленной желудка.
В другом месте в желудочно-кишечном тракте, IL-1β было показано, чтобы стимулировать [ 3Н] тимидина и увеличение числа клеток, культивируемых человека ободочной субэпителиальных миофибробластов, которые, как полагают, значение в ремоделирования слизистой оболочки при воспалении [54]. В про-пролиферативные эффекты IL-1 в желудочно-кишечном тракте, заслуживают дальнейшего изучения, учитывая важность этого цитокина в регуляции воспалительной реакции слизистых оболочек.
Выводы
Результаты данного исследования позволяют предположить, что IL-1β и GM-CSF может непосредственно стимулировать пролиферацию желудочного эпителия. Это может объяснить пролиферативные ответы на условные лимфоцитах средах, демонстрируемых Fan и др
[14]. Усовершенствованная эпителиальной пролиферации за счет IL-1 может способствовать повышенному риску развития рака желудка и предраковых поражений в H. Pylori
-infected лиц со специфическими IL-1β аллелей, связанных с более высоким уровнем производства. IL-1β стимулирует пролиферацию путем активации рецептора опосредованного тирозин киназы. Вниз по течению сигнализации включает ERK-зависимые и -независимый пути.
Дальнейшие исследования будут необходимы для выяснения механизмов, участвующих в IL-1-стимуляции пролиферации эпителия желудка, а также данные, коррелирующие IL-1 генотип, IL-1β продуцирования белка и эпителиальной пролиферации в естественных условиях
Они будут хвалить текущего исследования и дальнейшего углубления понимания хеликобактерной
канцерогенеза желудка, индуцированного
Список сокращений
EGF:..
эпидермального фактор роста
ЭРК:
внеклеточной киназы связанных сигналов
GM-CSF:
гранулоцитов-макрофагов колониестимулирующий фактор <бр>
IL: интерлейкин
JNK:
C-Jun NH <суб> 2-концевая киназа
MAP:
митоген активированный протеин
MTT - 3- [4:
5-диметилтиазол-2-ил] -2,5-дифенил tetrazolim бромид
TCA:
трихлоруксусной кислоты
TGF-α:.
трансформирующий фактор роста альфа
<бр> Объявления
авторов оригинальные представленные файлы для изображений изображения Ниже приведены ссылки на авторов оригинальных представленных файлов для изображений. 'Исходный файл для фигурного 1 12876_2001_21_MOESM2_ESM.pdf Авторского 12876_2001_21_MOESM1_ESM.pdf авторов исходного файла для фигурного 2 12876_2001_21_MOESM3_ESM.pdf Авторского исходного файла для фигурного 3 12876_2001_21_MOESM4_ESM.pdf авторов исходного файла для фигурного 4 исходного файла 12876_2001_21_MOESM5_ESM.pdf Авторского на рисунке 5 Конкурирующие интересы
Никто не заявлены.
 Синдром повышенной кишечной проницаемости не только страшен, но и чрезвычайно опасен для вашего здоровья
Хотя это изображение является карикатурой, эта статья относится к опасным состояниям внутри тел как мужчин, так и женщин … и это обсуждение также применимо, даже если у вас вообще нет проблем с пищева
Синдром повышенной кишечной проницаемости не только страшен, но и чрезвычайно опасен для вашего здоровья
Хотя это изображение является карикатурой, эта статья относится к опасным состояниям внутри тел как мужчин, так и женщин … и это обсуждение также применимо, даже если у вас вообще нет проблем с пищева
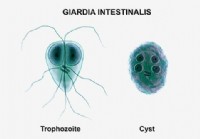 Лямблиоз (Giardia Lamblia)
Что такое лямблиоз? Лямблиоз — это паразитарная инфекция тонкого кишечника. Лямблиоз (gee-ar-die-a-sis с мягкой буквой G) – это инфекция тонкого кишечника, вызываемая паразитом Giardia duodenalis. ,
Лямблиоз (Giardia Lamblia)
Что такое лямблиоз? Лямблиоз — это паразитарная инфекция тонкого кишечника. Лямблиоз (gee-ar-die-a-sis с мягкой буквой G) – это инфекция тонкого кишечника, вызываемая паразитом Giardia duodenalis. ,
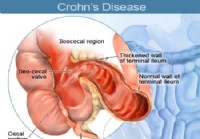 Часто задаваемые вопросы о болезни Крона
Что такое воспалительное заболевание кишечника и болезнь Крона (ВЗК)? Изображение болезни Крона Воспалительное заболевание кишечника (ВЗК) подразделяют на два заболевания:1) болезнь Крона и 2) язвен
Часто задаваемые вопросы о болезни Крона
Что такое воспалительное заболевание кишечника и болезнь Крона (ВЗК)? Изображение болезни Крона Воспалительное заболевание кишечника (ВЗК) подразделяют на два заболевания:1) болезнь Крона и 2) язвен