Effekt av Interlukin-1β på spredning av mage epitelceller i kultur
Abstract
Bakgrunn
Helicobacter pylori
er den viktigste risikofaktoren for utvikling av ikke-Cardia magekreft. Økt spredning av mageslimhinnen er en funksjon av H. pylori
infeksjon. Slimhinne interkeukin-1β produksjonen økes i H. pylori
infeksjon og IL-1B genotyper forbundet med økt pro-inflammatorisk aktivitet er risikofaktorer for utvikling av magekreft. Effekten av IL-1β på gastrisk epitelcelleproliferasjon har blitt undersøkt i denne undersøkelsen.
Methods
AGS-celler ble dyrket med IL-1β. DNA-syntese ble assed etter [
3H] tymidin inkorporering og totale levedyktige celler ved MTT-analyse.
Resultater
IL-1β avhengig av dose økt DNA syntese og celle tall. Den forbedrede proliferasjon ble blokkert av interleukin-1-reseptorantagonist. Tilsetning av nøytraliserende antistoff til GM-CSF redusert IL-1β-stimulert proliferasjon med 31 ± 4%. GM-CSF alene signifikant stimulert proliferasjon. Tilsetning eller nøytralisering av IL-8 ikke hadde noen effekt på basal eller IL-1β-stimulert proliferasjon. Tyrosinkinaseinhibitoren genistein fullstendig blokkerte IL-1β-stimulert proliferasjon og inhibisjon av den ekstracellulære signal relatert kinasereaksjonsveien med PD 98059 hemmet IL-1β stimulert proliferasjon av 58 ± 5%.
Konklusjoner
IL-1β stimulerer proliferasjon i mage epitelceller. Autokrin stimulering av GM-CSF bidrar til denne proliferativ respons. Signale via tyrosin-kinase-aktivitet er avgjørende for den mitogene respons til IL-1β. Det ekstracellulære signal relatert kinasereaksjonsveien er involvert i, men ikke vesentlig for nedstrøms signalering. IL-1β kan bidra til hyper sett i H. pylori-
infisert mageslimhinnen, og være involvert i kreftfremkallende prosessen.
Bakgrunn
Helicobacter pylori
antas å være den viktigste årsaksfaktoren i utvikling av ikke-Cardia gastrisk adenokarsinom. Store epidemiologiske studier har bekreftet en sterk sammenheng mellom H. pylori
infeksjon og både kreft [1-3] og tidligere histologiske etapper, atrofi og intestinal metaplasi [4, 5]; som begge øker risikoen for senere neoplastisk transformasjon. Dyremodeller har også vist betydningen av H. pylori i mage-
karsinogenese [6, 7]. Økt forekomst av spredning av gastrisk mucosa er typisk i H. pylori-infeksjon
[8-11], og hyperproliferasjon i mage-tarmkanalen synes å være en markør for senere maligne forandring [12]. Årsaken til økt forekomst av spredning er ikke klart, men de økte prisene reduseres til det normale med klaring av infeksjonen [8, 13]. Selv hypeprproliferation er typisk in vivo,
studier teste effekten av H. pylori
eller dets produkter in vitro
har vist motstridende resultater, med både forbedret [14, 15] og redusert [16-18] spredning rapportert. Det er mulig at andre komponenter av den inflammatoriske respons som er typisk for H. pylori
infisert mucosa kan være i det minste delvis ansvarlig for å drive øket celleproliferasjon.
Pluripotent pro-inflammatorisk cytokin interleukin-1β har en sentral rolle i patogenesen av H. pylori
-indusert slimhinnebetennelse. IL-1β genekspresjon og proteinproduksjon er økt i H. pylori
infeksjon og redusere med vellykket utrydding [19, 20]. Tilstedeværelsen av IL-1β genotype polymorfisme forbundet med øket IL-1β-produksjon har vært forbundet med en betydelig økning i risiko for magekreft og forstadier til kreft [21, 22]. Interleukin-1β er en potent inhibitor av magesyresekresjon, og det er en hypotese at den forbedrede IL-1β reaksjon endrer topografien av gastrisk infeksjon og således fremmer betennelse og påfølgende atrofi av mage corpus [23, 24]. Muligheten for at IL-1B selv driver økt spredning av mage epitelceller er ikke ferdig etterforsket. Endring av gastrisk proliferasjon av IL-1β kan bidra til den kreftfremkallende prosessen, i tillegg til virkninger på syresekresjon. Derfor de direkte effektene av IL-1β på gastrisk epitelproliferasjon har blitt vurdert.
Mitogen-aktivert protein kinase (MAPK) kaskader er godt karakterisert trasé transduse signaler fra celleoverflaten til kjernen. Familien omfatter forskjellige undergrupper; ekstracellulære signalrelatert kinaser (ERK), c-Jun NH 2-terminal kinaser (JNKs) og p38 MAPK [25]. De ERK aktiveres ved hjelp av en rekke forskjellige ekstracellulære stimuli, og formidler de pro-proliferative virkninger av en rekke hormoner og vekstfaktorer [26, 27]. Aktivering ved fosforylering av en dobbel spesifisitet proteinkinase (MAP kinase kinase (MAPKK)), (også kjent som MEK), gjør det mulig i sin tur å aktivere en familie av serin-treonin proteinkinaser, kjent som ERK. De ERKs i sin tur fosforylere mange cellulære proteiner inkludert transkripsjonsfaktorer og dermed ha en sentral rolle i utbredelsen av mitogene signaler. Følgelig rollen til MAP-kinase vei i formidling svarene til IL-1β er vurdert.
Metoder
Cell kultur
menneskelige AGS gastrisk karsinom cellelinje ble kjøpt fra European Collection av Animal cellekulturer (Porton Down, UK). Celler ble dyrket i monolagskultur i RPMI 1640 medium supplementert med 100 ug /ml penicillin, 100 ug /ml streptomycin, 100 ug /ml gentamicin, 2,5 ug /ml amphoteracin B og 10% føtalt kalveserum. Celler ble dyrket i 75 cm 2 vevsdyrkingskolber ved 37 ° C i en atmosfære av 5% CO 2 og 95% luft og passeres hver 5-7 dager.
Formerinasanalyse studier product: [ 3H] tymidin inkorporering. Celler ble dyrket i medium inneholdende 10% føtalt kalveserum, sådd ut i 24-brønners plater ved 10 5-celler /brønn og fikk feste seg over natten. Etter vasking med serumfritt medium, ble cellene inkubert i serumfritt medium inneholdende 0,2 mM umerket tymidin i 24 timer i nærvær av økende konsentrasjoner av IL-1β, IL-8 eller GM-CSF. DNA-syntese ble vurdert ved måling av [ 3H] tymidin inkorporering i trikloreddiksyre (TCA) utfellbart materiale [28]. [ 3H] tymidin (0,1 pCi /ml, 10 Ci /mmol) ble tilsatt 2 timer før slutten av en 24 timers behandlingsperiode. Cellene ble vasket to ganger med serumfritt medium for å fjerne ikke-inkorporerte [ 3H] tymidin, og DNA ble utfelt med 5% TCA ved 4 ° C i 15 minutter. Bunnfallet ble deretter vasket to ganger med 95% etanol, oppløst i 1 ml NaOH og analysert ved væskescintillasjonstelling. Resultatene er uttrykt som prosent kontroll ustimulert [ 3H] tymidininkorporering (gjennomsnitt ± SD) på 4-6 forskjellige eksperimenter, hvert utført in triplo. For påvisning av veksthemming ble celler inkubert med enten den spesifikke MEK-inhibitor PD 98059 (25 uM) [29], IL-1 reseptorantagonist (500 ng /ml) [30] eller nøytraliserende antistoffer, anti-GM-CSF (5 ug /ml) eller anti-IL-8 (10 ug /ml). Inhibitorer eller antistoffer ble tilsatt 30 minutter før cytokiner.
Cellevekst
Total levedyktige celler ble bestemt ved en modifisert MTT (3- [4,5-dimetyltiazol-2-yl] -2,5-difenyl tetrazolim bromid assay) [31]. Celler ble sådd ut i 24-brønners plater i medium inneholdende 10% føtalt kalveserum. Etter festing over natten, ble mediet forandret til 1% føtalt kalveserum-supplert medium og økende konsentrasjoner av IL-1β ble tilsatt. Celler ble dyrket i 48 timer, og deretter ble mediet fjernet og friskt RPMI 1640 medium inneholdende 0,5 ng /ml MTT ble tilsatt. Celler ble inkubert ved 37 ° C i 3 timer. Mediet ble deretter fjernet, og 0,04 M HCl i isopropanol ble tilsatt for å ekstrahere det reduserte formazanprodukt. Den resulterende optiske tetthet ved 550 nm ble bestemt.
Kjemikalier og reagenser
Rekombinant human IL-1β og IL-8 ble innkjøpt fra Sigma (Poole, UK), rekombinant, human GM-CSF og IL-1 reseptor-antagonist, anti-GM-CSF og anti-IL-8 var fra R og D Systems (Abingdon, Storbritannia). PD 95059 var fra Calbiochem (Nottingham, UK). RPMI 1640 var fra Gibco BRL (Paisley, UK) og alle andre reagenser var fra Sigma. Konsentrasjoner av hemmere som brukes er hentet fra produsentenes data og publiserte data. Evnen til 500 ng /ml IL-1RA å avskaffe 10 ng /ml IL-1β-stimulering av IL-8-sekresjon i AGS-celler ble bekreftet. Effekten av anti-GM-CSF ved 5 ug /ml antistoff for å avskaffe GM-CSF (1 ng /ml) indusert AGS celleproliferasjon ble bekreftet.
Statistikker og cytokin-stimulert resultater der sammenlignet med kontroll ustimulerte celler på den samme 24-brønners plate. Data ble sammenlignet med en-veis analyse av varians og t-test for å bestemme statistisk signifikans. Hvert eksperiment utføres i triplikat på 4-6 ganger. Resultatene er uttrykt som gjennomsnitt ± standardavvik. Forskjeller med P verdier av < 0,05 ble betraktet som signifikant.
Resultater
Effekt av IL-1β på [3H] tymidininkorporering
Interleukin-1β forårsaket en doseavhengig økning i DNA-syntese målt ved tymidininkorporering. Som vist i figur 1, ble signifikant stimulering sett med 1-100 ng /ml IL-1β. Den maksimale stimulering av 52 ± 6% over kontroll ble observert med 10 ng /ml. Den høyere dose på 100 mg /ml var noe mindre effektive i å stimulere proliferasjon. Figur 1. Effekt av IL-1β på [3H] tymidin inkorporering i gastriske epitel-AGS-celler Celler ble behandlet med økende konsentrasjoner av IL-1β i 24 timer og DNA-syntese vurdert ved [3H] tymidininkorporering. Resultatene uttrykt som middelverdier ± standardavvik. * P
< 0,01 vs. kontroll
Effekt av IL-1β på celle nummer
økning i DNA-syntesen av IL-1β ble oversatt til en absolutt økning i levedyktige celler. Som vist i figur 2, IL-1β økt celleantall på en doseavhengig måte i likhet med effektene på [ 3H] tymidininkorporering. Den maksimale stimulering ble igjen observert ved 10 ng /ml IL-1β, som produserte en 22 ± 5% økning i den totale celleantall. Figur 2 Effekt av IL-1β på celleantall av gastriske epitel-celler Celler ble behandlet med økende konsentrasjoner av IL-1β i 48 timer og totalt antall levedyktig celletall vurderes ved MTT-assay. Resultatene uttrykt som middelverdier ± standardavvik. * P
< 0,01 vs. kontroll
Effekter av cytokin-inhibering eller reseptorantagonisme på IL-1β-stimulering av proliferasjon
Forbehandling av cellene med interleukin-1-reseptorantagonist avskaffet stimulerende virkninger av IL-1β på [ 3H] tymidin inkorporering (figur 3). Tidligere studier har vist at IL-1β kan aktivere gastrisk epitelceller, inkludert AGS-celler, for å utskille andre cytokiner, spesielt interleukin-8 og granulocytt-makrofag-kolonistimulerende faktor (GM-CSF) [31, 32]. Derfor er videre studier ble foretatt for å vurdere om de stimulerende virkninger av IL-1β ble mediert av en av disse to cytokiner. Nøytraliserende antistoffer mot enten IL-8 eller GM-CSF hadde ingen effekt på ikke-stimulert [ 3H] tymidininkorporering. Nøytralisering av IL-8 hadde ingen effekt på IL-1β-stimuated vekst, men den anti-GM-CSF-antistoff redusert IL-1β-stimulert proliferasjon med 31 ± 4% (P
< 0,01) (figur 3). Figur 3 Effekt av cytokin-hemning på IL-1β-stimuleringen av [3H] tymidin inn i mage-epitelceller AGS-celler ble behandlet med 10 ng /ml IL-1β i 24 timer pluss enten interleukin-1 reseptorantagonist (IL-1RA 500 ng /ml), nøytraliserende anti-IL-8-antistoff (10 ug /ml) eller nøytraliserende anti-GM-CSF-antistoff (5 pg /ml). DNA-syntese ble bestemt ved [3H] tymidininkorporering. Resultatene uttrykt som middelverdier ± standardavvik. * P
< 0,01 vs. IL-1β stimulering i fravær av inhibitor.
Effekter av GM-CSF på proliferasjon
I lys av de resultater som ble oppnådd med anti-GM-SCF-antistoff, de direkte vekst-stimulerende virkninger av GM-CSF ble undersøkt. GM-CSF hadde en kraftig vekst stimulerende virkning på AGS celler: signifikant forbedring av [ 3H] tymidin inkorporering ble observert ved alle konsentrasjoner (0,001-100 ng /ml) av GM-CSF. GM-CSF seg så ut til å være et mer potent enn stimulerende IL-1β; maksimal stimulering på 108 ± 17% over kontrollen ble sett med 100 ng /ml GM-CSF (figur 4). Den inhiberende virkning av anti-GM-CSF-antistoff ble bekreftet ved avskaffelse av vekst stimulerende virkning på 1 ng /ml GM-CSF (data ikke vist). Tidligere studier har vist at IL-1β-stimulerte GM-CSF frigivelse under lignende forhold i AGS-celler til å være omtrent 10-20 pg /brønn /24 timer i [32]. For å bekrefte resultatene oppnådd med anti-IL-8-antistoff, [ 3H] tymidin inkorporering ble målt som respons på IL-8. Ingen forbedring av proliferasjon ble sett ved en hvilken som helst konsentrasjon av IL-8 (0,001-100 ng /ml) (data ikke vist). Under like forhold IL-1β-stimulerte IL-8 frigjøring er ca 3000 pg /brønn /24 timer [31]. Figur 4 Effekt av GM-CSF på proliferasjon av mage-epitelceller. AGS-celler ble behandlet med økende konsentrasjoner av GM-CSF i 24 timer. Celleformering ble bestemt ved [3H] tymidininkorporering. Resultatene uttrykt som middelverdier ± standardavvik. * P
< 0,05, ** P
< 0,01 vs kontroll
Mekanisme for IL-1β-stimulering av celleproliferasjon
spesifikke inhibitorer genistein, som hemmer tyrosin-kinaser og PD 98059, som hemmer MAP-kinase kinase (MEK), og derved hemmer ERK-reaksjonsveien, ble brukes til å vurdere de mulige intracellulære reaksjonsveier som medierer effektene av IL-1β. For å undersøke effekten av IL-1β forskjellige fra de for GM-CSF, ble disse eksperimentene utføres i nærvær av anti-GM-CSF-nøytraliserende antistoff. Som vist i figur 5, hverken genistein eller PD 98059 forandres ikke-stimulert [ 3H] tymidininkorporering. Genistein fullstendig avskaffet IL-1β-stimulering av spredning. Inhibering av MEK med PD 98059 redusert IL-1β-stimulert proliferasjon av 58 ± 5% (P
< 0,01) (figur 5), men ikke helt oppheve vekst stimulerende virkning av IL-1β. Videre øker til supramaksimal konsentrasjon av PD 98050 ikke lenger inhibere IL-1β-stimulert proliferasjon (data ikke vist). Figur 5 Effekt av hemning av tyrosin-kinase og MEK aktivitet på IL-1β-stimulert gastrisk epitelcelleproliferasjon. AGS-celler ble behandlet med 10 ng /ml IL-1β i 24 timer i nærvær av tyrosin kinase inhibitor genistein (100 uM) eller MEK-inhibitor PD 98059 (25 uM). Proliferasjon ble bestemt ved [3H] tymidininkorporering. Studier ble utført i nærvær av anti-GM-CSF-antistoff (5 pg /ml). Resultatene uttrykt som middelverdier ± standardavvik. * P
< 0,01 vs kontroll
Diskusjon
Denne studien viste at IL-1β økt spredning av AGS celler. Denne effekten ble reversert ved den reseptor-antagonist, tyder det ble formidlet via det interleukin-1-reseptor. IL-1β stimulerte både [ 3H] tymidin inkorporering, som et mål for stimulering av DNA-syntetisk hastighet og også totalcelletall målt ved MTT-analyse. Dette illustrerer at stimulering av DNA-syntese av IL-1β er oversatt til en reell økning i celletall., En del av den stimulerende virkning av IL-1β synes å være indirekte. Nøytralisering av GM-CSF i media førte til en betydelig reduksjon av IL-1β-stimulert proliferasjon. AGS-celler er kjent for å utskille GM-CSF i respons til IL-1β [32]. GM-CSF i seg selv var en potent stimulerende av celleproliferasjon. Således er det sannsynlig at en del av vekststimulerende virkninger av IL-1β skyldes en autokrin formidler virkningen av GM-CSF. Det er begrenset med tidligere data som tyder på at GM-CSF stimulerer spredning av ikke-hematopoetiske celler; Dippold et al
viste at eksogen GM-CSF-stimulert vekst av to av to kulturer avledet fra gastriske karsinomer og to av ni pankreas karsinom-cellelinjer [33, 34]. Men i motsetning til dagens forskning, autokrin produksjon av GM-CSF var det ikke noen påvisbare.
Gastriske epitelceller også produsere IL-8 i respons til IL-1β [31]. Men i dette modellsystemet, IL-8 alene hadde ingen pro-proliferativ virkning og nøytralisering av IL-8 påvirket ikke den stimulerende virkning av IL-1β. Derfor er det lite sannsynlig at IL-8 har en autokrin rolle i vekst-stimulerende virkning av IL-1β. Det er mulig at andre cytokiner produsert av epiteliale mage celler i respons til IL-1β, kan H. pylori eller
andre inflammatoriske fornærmelser også spille en rolle som autokrine eller parakrine formidlere av vekst. Det har nylig blitt rapportert at en annen C-X-C kjemokin, GRO /Cinc-1, som også er oppregulert i H. pylori-infeksjon
stimulert proliferasjon i rottemage epitelceller [35]. Rollen til disse andre potensielle autokrine mediatorer fortjener videre studier.
Resultatene av inhibitoren undersøkelser tyder sterkt på at tyrosin-kinase-aktivitet er essensiell for den vekstfremmende virkning av IL-1β i AGS-celler. Tyrosinkinaseinhibitoren genistein opphevet den stimulerende virkning av IL-1β. IL-1β er kjent for å aktivere en mengde av intracellulære signalveier [31, 36-39], men i den aktuelle situasjon synes det å være et absolutt krav for signalisering via en tyrosin-kinase, etterfølgende på reseptoraktivering.
Mitogen -aktivert protein kaskade er et godt karakterisert sti formidling av cellevekst-stimulerende virkninger av flere vekstfaktorer og hormoner. Inhibering av ERK-reaksjonsveien, og MEK-inhibitor PD 98059, noe som forhindrer aktivering av ERK ved fosforylering, hadde en signifikant inhibitorisk virkning mot den stimulerende virkning av IL-1β. Dette tyder på at aktivering av ERK-reaksjonsveien er viktig ved formidling av vekststimulerende virkninger av IL-1β. Aktivering av MAP-kinase-kaskader, inkludert p42 og P44 ERK trasé og p46JNK og p55JNK c-Jun NH 2-terminale kinaser av IL-1β har blitt demonstrert i rotte gastriske epitel-celler [41, 42], men funksjonell viktighet av disse banene ble ikke undersøkt. Aktivering av ERK og JNKs ble inhibert av genistein [41], i samsvar med den slutning av denne studien som MAPK ligge på nedstrømssiden av tyrosin-aktivitet i IL-1β-induserte signalering. Men i denne studien PD 98059 ikke fullstendig oppheve de stimulerende virkning av IL-1β, noe som tyder på at alternative reaksjonsveier, aktivert følgende på tyrosinkinase-aktivitet, også spille en rolle i signalisering av de proliferative responser overfor IL-1β. Videre studier er i gang i dag for å undersøke disse.
Det er motstridende data tilgjengelig om de direkte effektene av IL-1β på mage epitelproliferasjon. Selv om denne studien og studien av Fan et al
hjelp stimulert-leukocytter kondisjonerte medier viste økt spredning av menneske AGS cellelinje [14], andre har vist hemming av serum, TGF-α og EGF-stimulert spredning i RGM1 rotte gastriske epitel-celler med IL-1β [41, 42]. Tominaga et al
viste at forbehandling av RGM1 celler med IL-1β i 6 timer inhibert proliferasjon ved 24 timer, men den hemmende virkning ble tapt ved 48 timer, [41]. Årsakene til disse avvikene er ikke klart. De kan reflektere iboende forskjeller mellom cellelinjer, forskjeller i aktivering og involvering av parakrine vekstfremmende trasé, art variabilitet, en effekt som er spesifikt for visse vekstfaktorer, eller underliggende forskjeller i biologien til cellelinjer avledet fra cancer (AGS) eller normal vev (RGM1). De studier som viser inhibering av proliferasjon av IL-1β ble utført i nærvær av sterke vekstfremmende stimuli (høyt serum eller spesifikke vekstfaktorkonsentrasjoner i dyrkningsmedier), bane fra den nåværende studier ble utført på serumfrie eller 1% serum media . Det er mulig at flere signalveier aktivert av IL-1β har ulik effekt på spredning, den dominerende effekten avhengig av de komplekse relasjonene stimuli og signalveier under forskjellige omstendigheter. Proinflammatoriske cytokiner som IL-1β og TNF-α aktivere forskjellige signalveier med avvikende resultater og ulike tids kurs i mage endokrine og parietalceller [37, 38, 43-46]. Videre studier er i gang undersøke de spesifikke rollene til de ulike signalveier i mage epitelceller under forskjellige forhold.
Det er nå sterke epidemiologiske data som knytter H. pylori
med magekreft. Den kreftfremkallende prosessen synes å innebære en rekke tiltak: H. pylori
indusert betennelser utvikler seg til atrofi, intestinal metaplasi, dysplasi og til slutt kreft [47]. Tilsvar H. pylori
infeksjon i mongolske ørkenrotte induserer lett mage atrofi og kreft [6]. Mens gastrisk karsinogenese er utvilsomt en multifaktoriell prosess, med sykdomsfremkallende bakterier og vertsfaktorer, inkludert HLA status, diett og antioksidant status [47, 48], er det klart at øket gastrisk epitelproliferasjon, spesielt når relativt økt sammenlignet med apoptose, er en viktig del av veien [49, 50]. Økt gastrisk epitelproliferasjon er typisk av H. pylori-infeksjon
; det er påviselig gjennom alle faser av infeksjonen og utrydding av infeksjonen reduserer spredning. Økt spredning er en viktig markør for økt risiko for gastrointestinal adenokarsinom [12]. Mekanismene for den økede spredning er ikke helt forstått. In vitro
studier testing kulturer av H. pylori eller
bestanddeler har gitt motstridende resultater i forskjellige systemer, med ulike celletyper og bakteriestammer. Direkte stimulering av mage epitelproliferasjon av H. pylori
har blitt rapportert av noen forfattere [14, 15], mens enten nøytrale effekter [15] eller økt apoptose og redusert spredning har blitt rapportert av andre [16-18]. Fan et al
rapportert at kondisjonert medium fra enten H. pylori eller
mitogen aktivert lymfocytter direkte stimulert AGS celleproliferasjon [14], noe som tyder på at den inflammatoriske respons kan være delvis ansvarlig for forbedring av epitelproliferasjon. IL-1β produksjon er forbedret i H. pylori-infeksjon og
dette cytokinet er å anse som å være sentral i reguleringen av pro-inflammatorisk respons i H. pylori-infeksjon
.
IL-1β er en dyp hemmer av mavesyresekresjon in vivo product: [51] og i isolerte parietalceller [37, 38]. Genetisk polymorfisme av IL-1β genklusteret forårsaker økt transkripsjonen aktivitet er assosiert med økt risiko for pre-kreft og kreft histologiske forandringer i H. pylori-infeksjon
[21, 22]. Den generelle hypotese som forklarer denne observasjonen har vært at forbedret IL-1β produksjon som følger av H. pylori-infeksjon
er ansvarlig for bedre suppresjon av syresekresjon, som igjen gir større kolonisering av syre-sekresjon legeme mucosa [24]. Dette større kolonisering provoserer ytterligere betennelse, som til slutt fører til tap av spesialiserte syre-sekretorisk epitel (atrofi) og ytterligere forsterker den onde sirkelen av økt betennelse og redusert syresekresjon [52]. Gastric atrofi predisponerer betydelig til kreft [3]. Det antas at atrofi i kombinasjon med mediatorer utgitt inflammasjon slik som frie oksygenradikaler og nitrogenoksyd, kosthold, anti-oxidant tilstand og eventuelt bakteriell overvekst og dannelse av nitrosaminer i achlorhydric magen [53] fremme histologiske endringer, årsaken mutageneisis og kjøre progresjon av kreft.
en alternativ, men ikke gjensidig utelukkende, hypotese er at den forbedrede cytokinrespons forbedrer epitelcelleproliferasjon direkte og selv disponerer for kreft, i tillegg til virkningene på syresekresjon. Den økte cellefornyelsen av dette hyperproliferative svar vil i seg selv gjøre slimhinnene mer sårbare for mutagene effekter av frie radikaler og andre giftige produkter som genereres i achlorhydric betennelse i mage.
Andre steder i mage-tarmkanalen, har IL-1β vist seg å stimulere [ 3H] tymidin inkorporering og øke celle antall dyrkede humane colonic subepiteliale myofibroblasts, som er antatt å ha betydning i ombygging av slimhinnene i betennelse [54]. Den pro-proliferative effekter av IL-1β i mage-tarmkanalen fortjener videre studier, gitt viktigheten av dette cytokin i reguleringen av den mukosale inflammatoriske respons.
Konklusjoner
Resultatene av denne studien viser at IL-1β og GM-CSF kan direkte stimulere mage epitelproliferasjon. Dette kan forklare proliferative responser til klimaanlegg lymfocytter media demonstrert av Fan et al product: [14]. Forbedret epitelproliferasjon grunn av IL-1β kan bidra til økt risiko for magekreft og forstadier til kreft i H. pylori
-infected personer med bestemte IL-1β alleler forbundet med høyere nivåer av produksjonen. IL-1β stimulerer proliferasjon via reseptor-mediert aktivering av en tyrosin-kinase pathway. Nedstrøms signalisering innebærer ERK-avhengige og-Uavhengig trasé.
Videre studier vil være nødvendig å klarlegge mekanismene som er involvert i IL-1β-stimulering av mave epitelproliferasjon, samt data som korrelerer IL-1β genotype, IL-1β proteinproduksjon og epitelproliferasjon in vivo
Disse vil kompliment studien og ytterligere forbedre vår forståelse av H. pylori
indusert magekreft
Liste over forkortelser
EGF:..
epidermal vekstfaktor
ERK:
ekstracellulært signal relatert kinase
GM-CSF:
granulocytt-makrofag kolonistimulerende faktor
IL:
interleukin
JNK:
c-Jun NH 2-terminal kinase
KART:
mitogen aktivert protein
MTT - 3- [4:
5-dimetyltiazol-2-yl] -2,5 difenyl tetrazolim bromide
TCA:
trikloreddiksyre
TGF-α.
transformerende vekstfaktor alfa
Erklæringer
forfatternes opprinnelige innsendte filer for Images Nedenfor er linkene til forfatternes originale innsendte filer for bilder. 12876_2001_21_MOESM1_ESM.pdf Forfatteroriginalfilen for figur 1 12876_2001_21_MOESM2_ESM.pdf Forfatteroriginalfilen for figur 2 12876_2001_21_MOESM3_ESM.pdf Forfatteroriginalfilen for figur 3 12876_2001_21_MOESM4_ESM.pdf Forfatteroriginalfilen for figur 4 12876_2001_21_MOESM5_ESM.pdf Forfatteroriginalfilen for figur 5 konkurrerende interesser
Ingen oppgitt.
 San Francisco Gastroenterology introduserer vår pasientportal
San Francisco Gastroenterology tilbyr nå en pasientportal som vil gi våre pasienter enkel tilgang til vårt kontor og våre tjenester. Etter å ha fylt ut et kort registreringsskjema, vil pasienter kunne
San Francisco Gastroenterology introduserer vår pasientportal
San Francisco Gastroenterology tilbyr nå en pasientportal som vil gi våre pasienter enkel tilgang til vårt kontor og våre tjenester. Etter å ha fylt ut et kort registreringsskjema, vil pasienter kunne
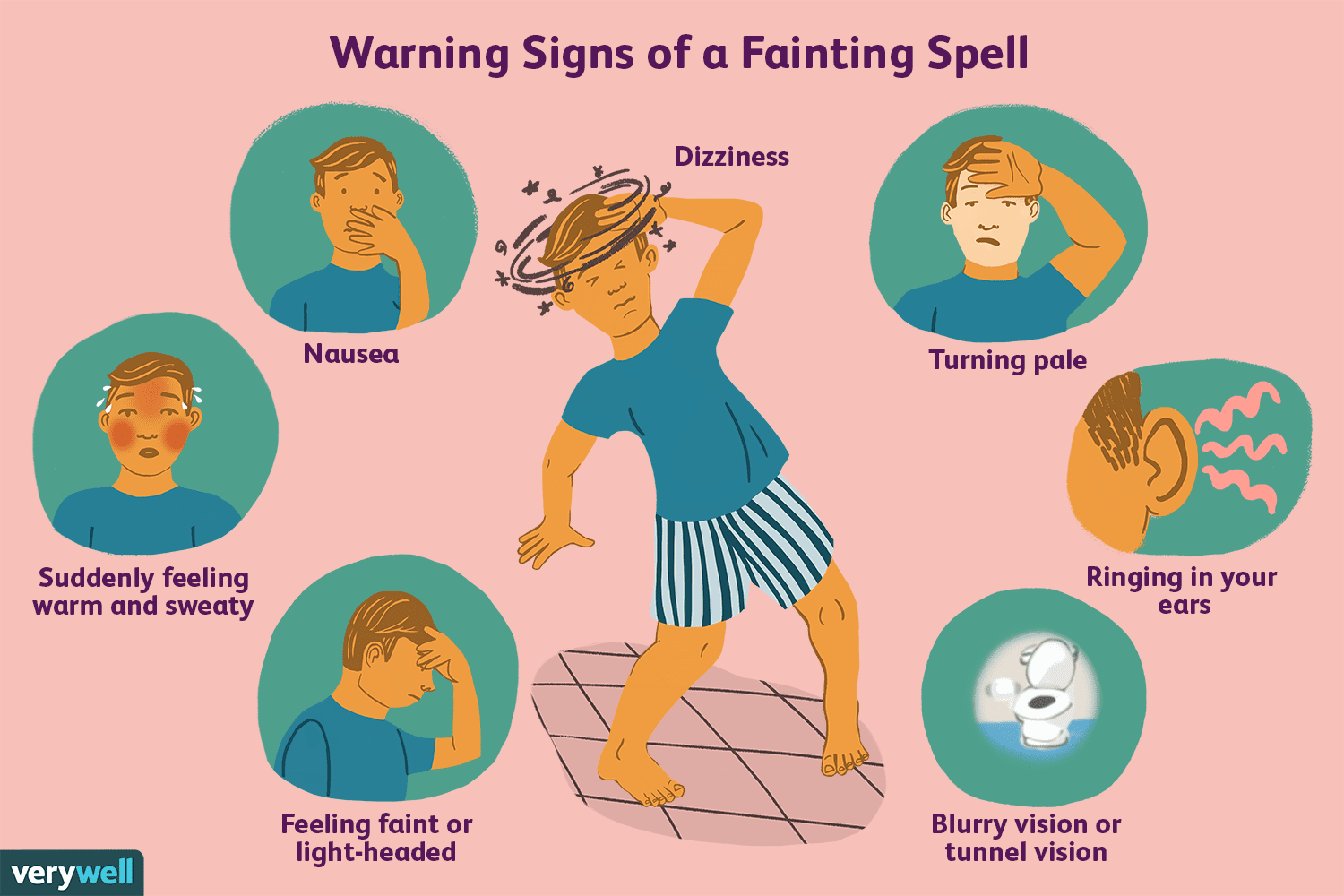 Oversikt over vasovagalrefleksen
Begynner du noen gang å svette og føle at du kommer til å besvime under avføring, eller føler du deg svak ved synet av blod? Det er mulig at vagusnerven din forårsaker denne følelsen og utløser kroppe
Oversikt over vasovagalrefleksen
Begynner du noen gang å svette og føle at du kommer til å besvime under avføring, eller føler du deg svak ved synet av blod? Det er mulig at vagusnerven din forårsaker denne følelsen og utløser kroppe
 Behandling av acid reflux hos babyer og barn
Spedbarn har ofte sure oppstøt, men de fleste trenger ikke behandling som medisiner. Hvis de spytter opp etter mating, men går opp i vekt, sover godt og ikke er masete, er de sannsynligvis fine. Noen
Behandling av acid reflux hos babyer og barn
Spedbarn har ofte sure oppstøt, men de fleste trenger ikke behandling som medisiner. Hvis de spytter opp etter mating, men går opp i vekt, sover godt og ikke er masete, er de sannsynligvis fine. Noen