Абстрактный Введение материалы и методы Субъекты 1. ISC маркеры коррелируют с уровнями CDX2 в слизистой оболочке желудка Для того, чтобы подтвердить положительную связь OLFM4 3. LGR5 4. Маркеры ISC выражены в пищевод Барретта поражений Обсуждение H <бр>. пилори
<р> желудочной кишечной метаплазии (IM) является весьма распространенным предраковый поражения; Однако молекулярные механизмы, регулирующие его развитие остаются неясными. Ранее мы показали, что популяция клеток, экспрессирующих кишечных стволовых клеток (ISC) маркер LGR5
увеличивается заметно в IM. В данном исследовании мы дополнительно исследовали молекулярные характеристики этих LGR5
+ клеток в IM, исследуя профиль экспрессии нескольких маркеров ISC. Следует отметить, что мы обнаружили, что ISC маркеры, включая OLFM4
и EphB2
-Есть положительно связаны с CDX2
выражение в неопухолевых желудка тканей. Этот вывод был подтвержден при поражении желудка или без метаплазии, которые показали, что OLFM4 и экспрессия EphB2 постепенно увеличивается с метапластического прогрессии. Кроме того, РНК-гибридизация показала, что LGR5
+ клетки coexpress несколько маркеров ISC и оставался приурочено к основанию метапластических желез, напоминающие, что нормальных кишечных крипт, в то время как те, в нормальных антральных желез не выразил ни из этих маркеров. Кроме того, большое количество ISC маркеров клеток, экспрессирующих были диффузно распределены в желудочном аденом, предполагая, что эти маркеры могут облегчить желудка онкогенеза. Кроме того, пищевод Барретта (BE) -Какой является гистологически похожа на кишечной метаплазией-проявляли одинаковое распределение маркеров ISC, что указывает на присутствие популяции стволовых клеток с кишечным дифференцировке. В заключение, мы определили, что LGR5
+ клеток в желудочном IM и ВЕ coexpress маркеры ISC и демонстрируют тот же профиль экспрессии, как те, что в нормальных кишечных крипт. Взятые вместе, эти результаты вовлекают кишечную типа популяции стволовых клеток в патогенезе обмена мгновенными сообщениями, а также обеспечивают важную основу для понимания развития и поддержания этого заболевания
<р> Образец цитирования:. Jang Б. Г., Ли Б. Л., Ким WH (2015) Кишечные стволовых клеток Маркеры в кишечном метаплазии желудком и пищеводом Барретта. PLoS ONE 10 (5): e0127300. DOI: 10.1371 /journal.pone.0127300
<р> Академический редактор: Энтони W.I. Ло, Больница королевы Марии, ГОНКОНГ
<р> Поступило: 8 января 2015 года; Принято: 13 апреля 2015; Опубликовано: 21 мая 2015
<р> Copyright: © 2015 Jang и др. Это статья открытого доступа распространяется в соответствии с условиями лицензии Creative Commons Attribution, которая позволяет неограниченное использование, распространение и воспроизведение на любом носителе, при условии, что оригинальный автор и источник кредитуются
<р> Доступность данных: Все соответствующие данные находятся в пределах своих подтверждающей информации, файлов бумаги и
<р> Финансирование: Это исследование было поддержано грантом Кореи медицинских технологий R &Amp; D Project через институт Корея Индустрия здоровья развития (Хиди), финансируемого Министерством. Здоровье &Amp; Благополучие, Республика Корея (номер гранта: HI14C1277). Доноры не играет никакой роли в дизайн исследования, сбора и анализа данных, решение о публикации или подготовки рукописи
<р> Конкурирующие интересы:.. Авторы заявили, что не существует никаких конкурирующих интересов
<р> предопухолевых кишечная метаплазия (IM) связано с повышенным риском развития рака желудка и представляет в примерно одной четверти людей по всему миру. [1] IM часто приводит к хроническим атрофическим гастритом после заражения хеликобактерной
, которые могут затем перейти к желудочной эпителиальной дисплазии или карциномы. [2] разнообразие генетических и эпигенетических изменений были вовлечены в патогенез человеческого IM. [3] Кроме того, длительное И.М. индуцируется экспрессии CDX2 было показано, что приводит к раку желудка у трансгенных мышей, что свидетельствует о том, что само по себе IM играет значительную роль в возникновении рака желудка. [4]
<р> Поскольку IM является важным предшественником в желудочном канцерогенезе, потенциал, чтобы обратить вспять эти поражения представляет большой интерес. [5] Предыдущие исследования сообщили, что ликвидация H
. пилори
достаточно обратного IM, но другие обнаружили, что значительная часть пациентов все еще присутствует с IM, даже после того, как эффективного искоренения. [5] IM, как полагают, является «точкой невозврата» в гистологических каскада от хронического гастрита до аденокарциномы; [6] Таким образом, попытки понять молекулярные механизмы, регулирующие создание и поддержание IM имеют решающее значение для разработки стратегий для прерывания желудочного канцерогенеза. Например, CDX2 ауторегуляция предлагается оказать существенное влияние на стабильность обмена мгновенными сообщениями поражений. [7] В то время как IM крипты в человеческом желудке клоновая и содержат мультипотентных стволовых клеток, [8] остается плохо изученным ли родные желудка стволовые клетки первоначальный источник метаплазии или, если они служат только для поддержания установленных повреждений.
<р> открытие нормальных слизистой оболочки желудка стволовых клеток совпала с идентификацией Wnt гена-мишени LGR5
как маркер стволовых клеток в кишечный эпителий. [9] исследование родословная трассировки позже выяснилось, что LGR5
+ клетки мультипотентных стволовые клетки, ответственные за обновление желудочного эпителия у мышей. [10] Наша группа ранее показали, что небольшое число LGR5
+ клетки также находиться в нижней части антральных желез человека и резко увеличивают в IM поражениях. [11] Эти данные привели нас к мысли, что LGR5
может быть маркером для кишечных стволовых клеток (ISCS), участвующих в поддержании обмена мгновенными сообщениями.
<р> пищевод Барретта (BE) является метапластический преобразование кишечного эпителия и столбчатый связано с повышенным риском развития аденокарциномы, подобно тому, что наблюдалось с желудочным обмена мгновенными сообщениями. [12] Следует отметить, что человека, с поражениями проявляют повышающую регуляцию LGR5
выражение, когда по сравнению с нормальным эпителием, и наводит на мысль о присутствии LGR5
+ стволовые клетки в ВЕ. [13]
<р> Несколько молекулярных маркеров ISC были идентифицированы в дополнение к LGR5
, включая PROM1
[14], Bmi1 <бр> [15], LRIG1
[16], и ASCL2
, который был идентифицирован как фактор транскрипции для контроля кишечника судьбу стволовых клеток. [17] Кроме того, OLFM4
[17] и EphB2
[18] также высоко выражены в ISCS. В данном исследовании мы стремились обнаружить дополнительные маркеры ISC, участвующих в генезисе и поддержание желудочного обмена мгновенными сообщениями и BE, а также изучить их колокализацию с LGR5
+ клеток РНК гибридизация для дальнейшего выявления молекулярной характеристики LGR5
+ клеток в IM в отношении кишечника типа стволовых клеток фенотипа.
<р> Формалин -fixed и парафин (FFPE) желудочные образцы с добавлением или без кишечной метаплазии (IM) были собраны из пяти пациентов, перенесших эндоскопическую подслизистую рассечение в Сеульского национального университета (больницы SNUH) с 2008 по 2010 IM поражениями были разделены на желудочно-и -intestinal смешанный (GI), и исключительно кишечный (I) подтипы (также известный как неполных и полных типов, соответственно) [19]. Образцы пищевода Барретта были выделены из двух пациентов с аденокарциномой гастроэзофагеального перехода, и нормальный тонкой кишки образец полученные от пациента с раком толстой кишки. Свежезамороженной неопухолевой ткани желудка были получены из 28 больных раком желудка, перенесших хирургическую гастрэктомию с 2001 по 2005 г. в SNUH.
Этические утверждение
<р> Все человеческие образцы были получены с помощью лечебной хирургической резекции , Это ретроспективное исследование проводилось с использованием сохраненных образцов после патологического диагноза. Образцы были анонимными до исследования, таким образом, письменное согласие не требовалось. Дизайн исследования был одобрен Институциональным наблюдательным советом в Сеульском национальном университетском госпитале при условии ссылки (анонимизации: H-1209-037-424).
РНК гибридизация
в <р> На месте гибридизация для LGR5
, ASCL2
, OLFM4
и EphB2
осуществлялось с помощью набора для анализа RNAscope FFPE (Advanced Cell Diagnostics, Inc. , Hayward, CA, США), как описано выше. [11] Положительный пятно определяли как наличие коричневых точечными точек в ядре и /или цитоплазме. Убиквитин C и бактериальный DapB
гены служили в качестве положительного и отрицательного контроля, соответственно.
Выделение РНК и количественный ПЦР в реальном времени
<р> Суммарную РНК экстрагировали из парафин Срезы ткани с помощью комплекта RNeasy FFPE (Qiagen, Valencia, CA, США), как описано ранее [20]. обратной транскрипции кДНК получали из 1-2μg тотальной РНК со случайными гексамере праймеров и GoScript системы обратного транскрипции (Promega, Madison , WI, USA). Количественные ПЦР в реальном времени (QRT-PCR) реакции были проведены с использованием премикса Ex Taq (Takara Bio, Сига, Япония) в соответствии с рекомендациями завода-изготовителя, а также проанализированы данные с использованием программного обеспечения последовательности системы обнаружения (версия 1.4, Applied Biosystems). Были использованы следующие экспрессии генов TaqMan анализы: Hs00173664_m1 ( LGR5
), Hs00362096_m1 ( EphB2
), Hs00270888_s1 ( ASCL2
), Hs00197437_m1 ( OLFM4 <бр>), Hs01009250_m1 ( PROM1
), Hs00394267_m1 ( LRIG1
), Hs00995536_m1 ( Bmi1
), Hs00178027_m1 ( DCLK1
), Hs010780810_m1 ( CDX2
), Hs00212584_m1 ( CLDN18
) и Hs0275899_g1 ( GAPDH
). GAPDH
служил в качестве эндогенного контроля.
Трансфекция CDX2
<р> CDX2 кДНК (pCMV6-CDX2) был приобретен у OriGene (Роквилл, штат Мэриленд, США). Клетки рака желудка были высеяны в количестве 1 × 10 6 клеток /лунку в 6-луночного планшета и трансфицировали 2,5 мкг кДНК или пустым вектором управления с использованием реагента для трансфекции Липофектамин 2000 (Invitrogen, Carlsbad, CA, USA) в соответствии с заводом-изготовителем инструкции. Клетки подвергали анализу QRT-PCR приблизительно через 24 ч после трансфекции.
Статистический анализ
<р> Статистический анализ проводили в Призма 5 (GraphPad Software, Inc., Сан-Диего, Калифорния, США). Корреляция между выражениями маркеров кишечных стволовых клеток и CDX2
оценивали с помощью линейного регрессионного анализа. Средние различия между группами FFPE желудка образцов оценивали с помощью одностороннего ANOVA. Различия между группами сравнения после трансфекции CDX2
в желудочном линиях раковых клеток были выполнены с использованием Student т
-тестов. Результаты считались значимыми при р
&л; 0.05.
Результаты
<р> Ранее мы сообщали об относительном увеличении LGR5
+ клеток в IM поражений желудка человека. [11] Это побудило нас предположить, что они LGR5
+ клетки могут выступать в качестве самообновляющихся стволовых клеток для оказания помощи в поддержании и распространении метапластического эпителия в слизистой оболочке желудка. Таким образом, мы стремились определить дополнительные маркеры ISC, которые коррелировали с CDX2
выражение в IM. Для этого, мы измерили уровни экспрессии CDX2
и восемь ISC markers- LGR5
, ASCL2
, OLFM4
,
, DCLK1
, LRIG1
и Bmi1
-в нормальной ткани желудка. Исследуемые ткани показали широкий спектр CDX2
уровней, представляющих различные степени обмена мгновенными сообщениями, так как CDX2
выражение положительно коррелирует с IM прогрессии (рис 1А). Были обнаружены три маркера ISC коррелируют с CDX2
выражение: OLFM4
, EphB2
, и Bmi1
. В частности, OLFM4
( р
&л; 0,0001, г 2 = 0,56) (рис 1B) и EphB2
( р
&л; 0,0001, г 2 = 0,52) (рис 1C) продемонстрировали сильную положительную корреляцию с CDX2
, в то время как Bmi1
обратно коррелирует ( р
= 0,0002, г 2 = 0,42) (рис 1D). Нет значимая связь с CDX2
выражение было определено с остальными пятью ISC маркеров (S1) Рис.
2. Выражение маркера ISC коррелирует с IM прогрессии
и EphB2 с услугой обмена мгновенными сообщениями, мы выбрали четыре Гистологически-различных типов тканей желудка; нормальный антральная слизистую оболочку без обмена мгновенными сообщениями (п = 4), хронический активный гастрит без IM (N = 3), желудка и кишечника смешанного типа (типа GI) IM (п = 6), а исключительно кишечного типа (I типа) IM (п = 5) (фиг.2А). Claudin-18 является самым высоким уровнем экспрессии белка плотный узел в желудке. Как и следовало ожидать, наш анализ показал, что клаудин-18 выражение уменьшается с увеличением степени обмена мгновенными сообщениями ( р
&л; 0,0001) (рис 2В), в то время как CDX2
выражение увеличивается ( р
&л; 0,0001) (рис 2С). Мы также обнаружили, что OLFM4
и уровни EphB2
последовательно увеличивается с каждым последующим поражением, подтверждая, что эти маркеры тесно связаны с IM прогрессии ( р
= 0,008 и 0,001, соответственно, на фиг 2D и 2E). В отличие от этого, Bmi1
и LRIG1
выражение показал тенденцию к снижению с IM прогрессии. ( р
= 0,002 и 0,0006 соответственно; рис 2F и 2G) <бр>
+ клетки в кишечной метаплазии локализуются с другими маркерами ISC
<р> Для того, чтобы определить, есть ли прямая связь существует между LGR5
и ISC маркеров в IM, мы исследовали, могут ли их совместная экспрессия РНК гибридизация. Выражение LGR5
, ASCL2
, EphB2
и OLFM4
впервые были рассмотрены в нормальной человеческой секции тонкой кишки, чтобы проверить эту технику, и было обнаружено, локализовать конкретно к клеткам внутри ниши стволовых клеток кишечных крипт, как и ожидалось (S2 рис). Так как LGR5
+ клеток в нормальных кишечных крипт также выражают маркеры ISC, мы предположили, что LGR5
+ клетки в IM также могут проявлять подобный паттерн экспрессии. Таким образом, мы повторили процедуру на последовательных участках эндоскопических образцов подслизистой диссекции (N = 5), каждая из которых содержала множественные очаги gi- или I-типа IM среди неопухолевой ткани. Небольшое количество LGR5
+ клеток у основания нормальных антральных желез были лишены экспрессии маркеров ISC (рис 3А), тогда как в I-типа IM показал выражены все три маркера (рис 3B) , Кроме того, GI-типа IM поражения отображается один и тот же профиль экспрессии в целом для этого выражения ISC маркер был расположен выше остальных желудочных желез, а не ограничивается базальных областей (S3), за исключением рис. Эта картина экспрессии последовательно наблюдалась во всех образцах. Эти результаты показывают, что LGR5
+ клетки в IM отличаются от нормальных антрума в выражении ISC маркеров, которые, как правило, ограничена клетками в криптах кишечника. Интересно отметить, что IM получены из фундального желез, где LGR5
+ клетки, как правило, нет, получают те же результаты (S4 рис). Таким образом, представляется вероятным, что население LGR5
+ клеток в IM не является результатом распространения существовавшие ранее LGR5
+ клетки, но это скорее появление LGR5
+ клетки с приобретенным дифференцировке, предполагая, что кишечная, как популяция стволовых клеток устанавливается в IM. Кроме того, желудка аденомы (п = 5), также экспрессируют высокие уровни маркеров ISC на протяжении очагов поражения, а не ограничивается железистых крипт (рис 3в). Как показано на фиг.3, это накопление ISC маркеров клеток, экспрессирующих по метаплазии к последовательности дисплазия импликативн участия кишечного типа стволовых клеток в желудочном онкогенеза и дополнительных исследований, чтобы исследовать связь между кишечными маркеров стволовых клеток и развития опухолей желудка являются безусловно, оправдано.
<р> Далее мы попытались определить, является ли также были выражены маркеры ISC в пищевод Барретта (ВЕ). Для этого были оценены два образца аденокарциномы, возникающих на фоне ВЕ для выражения CDX2
, OLFM4
, EphB2
, и PROM1 <бр> с помощью анализа QRT-PCR (рис 4A). Важно отметить, что оба и аденокарциномы выражены более высокие уровни всех четырех маркеров ISC, когда по сравнению с нормальным эпителием (рис 4В, 4С, 4D и 4E). В то время как LGR5
и ASCL2
не показали каких-либо существенных изменений по сравнению с анализом RT-PCR, вероятно, из-за низкого числа копий транскриптов РНК гибридизация показала четкую популяцию клеток с
и OLFM4
выражение на стыке желудка и метапластических желез, напоминающие GI-типа IM (рис 4F, 4G, 4H, 4I и 4J).
<р> область перешеек /шейку желудочного блока ранее считалось, чтобы охватить нишу стволовых клеток, в которых происходит IM, и было высказано предположение, что metaplasic переход от одного желудка клонального блока происходит через клональной экспансии и крипт деления. [8], потому что LGR5
+ клетки идентифицированы как мультипотентными кишечника, как стволовые клетки у мышей [10] и существуют в человеческом желудке антральном [11], то правдоподобным думать, что IM может развиться из этой популяции клеток. Тем не менее, сохраняется возможность того, что другая популяция стволовых клеток может лежать в основе этого процесса. Например, SOX2
+ клетки также были идентифицированы в качестве отдельных желудочных стволовых клеток, а также популяции клеток этикетки исключительно для тех, кто LGR5
выражения. [21] трансдифференцировку может также привести к возникновению для метапластических клеток. Spasmolyitc полипептид, экспрессирующих метаплазия в котором пилорические железы типа появляются в oxyntic слизистой оболочке возникают из-зрелых главных клеток, [22], а не LGR5
-expressing клетки. [23] Действительно, трансгенная Cdx1 <бр> или CDX2
результаты экспрессии в развитии IM париетальных клеток, полученных у трансгенных мышей. [24] Таким образом, остается неуловимым IM является ли это следствием кишечной стволовых клеток перепрограммирования или трансдифференцировка клеток с ISC приобретенного типа свойства. [12, 25]
<р> Различные усилия пытались классифицировать IM типов поражений желудка. Matuskura и др. предложил систему классификации, основанную на наличии тонкого кишечника пищеварительные ферменты; определяется как полный и неполный тип обмена мгновенными сообщениями, [26], тогда как Джесс и Филипе представила три сорта IM на основе морфологии и гистохимических муцина окрашивания. [27] В последнее время, новая классификация была предложена Tatematu и др., В которых И.М. можно разделить на желудочном-и-кишечном смешанный (GI) и исключительно кишечными типа (I). [19] В GI-типа IM , желудка и кишечника фенотипические маркеры появляются как на железистых и клеточном уровне, таким образом, было высказано предположение, что ИМ может быть вызвано постепенным intestinalization стволовых клеток из gi- до I-типа. [28] Здесь мы наблюдали постепенное увеличение маркеров ISC OLFM4
и EphB2
с последующим intestinalization слизистой оболочки желудка. Наряду с увеличением уровни CDX2
, которые вызывают кишечную дифференцировку и фенотип, эти паттерны экспрессии предполагают преобразование общей популяции стволовых клеток к более кишечно-подобный фенотип стволовых клеток. Кроме того, неожиданная обратная корреляция Bmi1
и LRIG1 с услугой обмена мгновенными сообщениями требует дальнейших исследований, чтобы подтвердить этот результат и уточнить его клиническое значение.
Искоренение имеет потенциал, чтобы предотвратить рак желудка, [29] и, возможно, ослаблена прогрессирование предраковых желудка поражений, таких как IM. [30, 31] Однако, как установлено, оказывается, что H
. пилори
ликвидация не может полностью предотвратить рак желудка. [6] На самом деле, около 80% пациентов с ИМ не показали никаких изменений или прогрессирование IM после лечения антибиотиками. [31] Кроме того, мета-анализа был сделан вывод что H
. пилори
ликвидация не оказывает никакого влияния на желудочную IM. [32] Эта необратимость IM может быть частично объяснено содержание CDX2
выражение через петлю ауторегуляции, которая не зависит от начального триггера, поддержание кишечный фенотип. [33] Кроме того, мы показали, что LGR5
+ клеток у основания метапластических желез последовательно выражают другие маркеры ISC, указывающие на фенотип стволовых клеток кишечного типа. Мы считаем, что это стабильная популяция стволовых клеток может дать дополнительное объяснение долговечными природы обмена мгновенными сообщениями. Кроме того, терапевтические стратегии достаточно, чтобы конкретно нацелены на LGR5
+ популяции клеток в сочетании с H
. пилори
ликвидация потенциально может подорвать стабильность обмена мгновенными сообщениями, таким образом, ускорить восстановление нормальной слизистой оболочки желудка.
<Р> пищевод Барретта (BE) является предраковым поражение, которое разделяет несколько морфологической и молекулярные характеристики с желудочный И.М., главным образом, так как это является метапластический преобразование кишечного цилиндрического эпителия в результате хронического воспаления. Мы считаем, что данное исследование характеризует еще одно сходство между этими двумя поражениями в присутствии LGR5
+ клеток с экспрессии маркеров ISC. Этот вывод согласуется с предыдущим отчетом, показывающим, что LGR5
выражение было значительно повышен в ВЕ, и что население является вероятным источником клеток из-за этого метаплазии. [13] Совсем недавно, LGR5
+ клетки были идентифицированы в середине желез Барретта по гибридизация и предложены действовать как стволовые клетки, так как они проявляют как желудка и кишечника дифференциации. [34] Мы также обнаружили, LGR5
+ клеток в районах, расположенных между желудочных и метапластических желез в ВЕ, которые соответствуют середине желез Барретта. Кроме того, наличие маркеров ISC в LGR5
+ популяция клеток еще больше усиливает их потенциал для дифференциации кишечника. Таким образом, на основе этих результатов, представляется разумным предположить, что LGR5
+ клеток в BE вероятно, функционируют как стволовые клетки, которые поддерживают кишечную фенотип ВЕ, подобно тому, что видел в IM.
<р> CDX2 является фактором транскрипции мастер для экспрессии кишечных маркеров дифференцировки, и, как полагают, лежат в основе развития ВЕ. В то время как нормальная слизистая оболочка желудка не выражает CDX2
, сильное выражение обнаруживается в IM. [35, 36] Кроме того, у трансгенных мышей показали, что CDX2
выражение само по себе достаточно, чтобы вызвать IM [37 , 38], предполагая, что CDX2
может также способствовать развитию популяции стволовых клеток с кишечным фенотипа. Таким образом, мы рассмотрели, если CDX2
непосредственно участвует в экспрессии маркеров ИУС: LGR5
, ASCL2
, OLFM4
, и EphB2
(S5 рис). Однако трансфекция эксперименты показали, что только EphB2
был незначительно влияет CDX2
выражения. Конечно, эти данные следует интерпретировать с осторожностью, так как были получены в клеточных линиях GC с различными биологическими свойствами от доказательства неопухолевых эпителия желудка или кишечника стволовых клеток. Тем не менее, представляется вероятным, что дополнительные сигнальные факторы наряду с CDX2
необходимы для индукции экспрессии маркера ISC.
<Р> Таким образом, мы определили, что LGR5
+ клеток в желудочном IM и BE coexpress маркеры ISC, что свидетельствует о кишечном типа популяции стволовых клеток, который заменяет существовавшие ранее желудочные стволовые клетки. Эта находка, кажется, дают важный ключ для понимания механизма, лежащего в основе живучесть IM после H
. пилори
искоренение. Кроме того, наши данные свидетельствуют о LGR5
+ клетки являются перспективным объектом для обратного IM, и, возможно, предотвратить их прогрессирование рака желудка в.
Поддержка Информация
S1 Рис. Корреляция кишечного стволовых клеток (ISC) маркеров с уровни CDX2
в неопухолевых желудочных тканях. Не
никакой корреляции находится между CDX2
выражения и некоторые ISC маркеры, такие как LGR5
(г 2 = 0,01, р
= 0,59), ASCL2
(г 2 = 0,01, р
= 0,59) , PROM1
(г 2 = 0,11, р
= 0,08), LRIG1
(г 2 = 0,06, <ем> р <бр> = 0,21) и DCLK1
(г 2 = 0,09, р
= 0,11)
DOI:. 10,1371 /journal.pone.0127300.s001
( PPTX)
S2 рис. Визуализация кишечных маркеров стволовых клеток с помощью РНК гибридизация (МОГ) в.
РНК ISH проводили на фиксированных формалином и залитых парафином образца тонкой кишки. (A, B) группа LGR5
+ стволовые клетки идентифицируют в нижней части всех крипт, приобщенных с клетками Paneth. Другие маркеры стволовых клеток кишечника, такие как ASCL2
(C, D), EphB2
(E, F), и OLFM4
(G, H) также установлено ограничивается склепе основаниями. Увеличение: А, С, Е, G × 100; B, D, F, H × 400
DOI:. 10,1371 /journal.pone.0127300.s002
(PPTX)
S3 Рис. Выражения маркеров стволовых клеток кишечника в GI типа IM.
Остающиеся желудочных желез часто обнаруживаются в базальных областях типа GI IM (А и В). РНК ISH показывает, что LGR5
(C) и EphB2
(D) выражения локализуются над желудочных желез. Интересно, что OLFM4
(Е) выражение наблюдается в желудочных желез, а также, хотя его интенсивность значительно слабее, чем в метапластических желез. Когда эти желудочных желез исчезают по мере развития IM (A и F), распределение всех LGR5
(G), EphB2
(H) и OLFM4
(I) строго ограничивается базальных областях. Стрелки указывают оставшиеся желудочных желез. Увеличение: A × 40; B, C, D, E, F, G, H, I × 200
DOI:. 10,1371 /journal.pone.0127300.s003
(PPTX)
S4 Рис. Кишечные маркеры стволовых клеток в кишечной метаплазии (IM) из тела желудка.
(А и В) Небольшой фокус IM в середине фундального желез, обозначенных стрелками, показывает те же паттерны экспрессии
(D), и OLFM4
(E) в качестве IM из антрума. Увеличения: A × 100; B, C, D, E × 200
DOI:. 10,1371 /journal.pone.0127300.s004
(PPTX)
S5 Рис. Эффект CDX2
на экспрессию стволовых клеток кишечника (ISC) маркеров в рак желудка (GC) клеточных линий.
Трансфекция CDX2
на четыре линии GC клеток, MKN74 (A ), MKN28 (B), SNU484 (с) и SNU668 (D) значительно увеличивает количество мРНК CDX2
(**, р
&л; 0,01; ***, р
&л; 0,005). EphB2
выражение лишь незначительно повышается за счет экспрессии CDX2
в трех из четырех клеточных линий GC (***, р
&л; 0,005). Никаких различий не обнаружено в уровнях LGR5
, ASCL2
и OLFM4
на CDX2
сверхэкспрессии (нс, не имеет существенного значения).
DOI: 10.1371 /journal.pone.0127300.s005
(PPTX)
 Охриплость
Факты о охриплости Охриплость или хриплый голос — это симптом, который возникает по разным причинам. Охриплость — это ненормальное изменение голоса. Наиболее распространенной причиной охриплости голо
Охриплость
Факты о охриплости Охриплость или хриплый голос — это симптом, который возникает по разным причинам. Охриплость — это ненормальное изменение голоса. Наиболее распространенной причиной охриплости голо
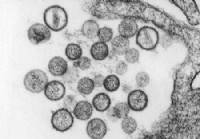 Ранние признаки и симптомы хантавирусного легочного синдрома (HPS)
Факты о хантавирусе и хантавирусном легочном синдроме (HPS) Рисунок 1:Изображение частиц хантавируса Sin Nombre; ИСТОЧНИК:CDC/D. Лорен Кетай, доктор медицины Хантавирусы — это РНК-содержащие вирусы,
Ранние признаки и симптомы хантавирусного легочного синдрома (HPS)
Факты о хантавирусе и хантавирусном легочном синдроме (HPS) Рисунок 1:Изображение частиц хантавируса Sin Nombre; ИСТОЧНИК:CDC/D. Лорен Кетай, доктор медицины Хантавирусы — это РНК-содержащие вирусы,
 Ленивое обжаривание говядины
Быстрый семейный ужин может быть вкуснее ресторанного, если вы уделите несколько минут маринованию мяса перед его приготовлением. Попробуйте этот рецепт жареной говядины, и вы получите взрыв вкуса! Я
Ленивое обжаривание говядины
Быстрый семейный ужин может быть вкуснее ресторанного, если вы уделите несколько минут маринованию мяса перед его приготовлением. Попробуйте этот рецепт жареной говядины, и вы получите взрыв вкуса! Я