Títo rýchlo sa množiaci zahraniční útočníci predstavujú, zdaleka, najväčšia hrozba pre novorodenecký imunitný systém, ktorý musí tieto organizmy rozpoznať a klasifikovať ako neškodné, komenzálne alebo patogénne.
Výskum ukazuje, že účinný „presluch“ alebo komunikácia medzi ranými mikróbmi a mukóznymi imunitnými bunkami je zásadný pre tvorbu zdravých mikrobiálnych spoločenstiev a podporu dobre fungujúceho imunitného systému.
Bunky imunitného systému, ktoré sa podieľajú na slizničnej imunite, sa vyvíjajú v orgáne nazývanom týmus umiestnený pod hrudnou kosťou nad srdcom. Do teraz, nebolo jasné, či črevné mikróby ovplyvňujú vývoj týchto buniek v týmuse v ranom veku.
Vedci z Centra pre výskum slizničnej a imunologickej biológie (MIBRC) v Massachusetts General Hospital teraz uvádzajú, že črevné mikróby regulujú vývoj špecializovaných imunitných buniek v týmuse, ktoré zohrávajú rozhodujúcu úlohu v tolerancii sliznice.
Zistenia ich rozsiahleho výskumu boli publikované v Zborník Národnej akadémie Scienca e, USA tento týždeň. Nitya Jain, PhD., a kolegovia zamerali svoje štúdie na podskupinu imunitných buniek, ktoré exprimujú transkripčný faktor PLZF.
Tieto bunky, súhrnne sa nazývajú vrodené a vrodené lymfocyty, typicky fungujú na rozhraní črevnej slizničnej bariéry a poskytujú imunitnú ochranu na mukóznych miestach.
Študovať vývoj týchto imunitných buniek v kontexte črevných mikróbov, vedci monocolonizovali myši bez klíčkov s modelovým ľudským komenzálom, Bacteroides fragilis, a demonštrovali, že tento jeden druh baktérií môže obnoviť vývoj vrodených a vrodených lymfocytov PLZF+ v týmuse malých myší.
V ďalších štúdiách dôkazov o koncepcii ukázali, že mutant B. fragilis bez expresie polysacharidu A (PSA) nie je schopný urobiť to isté, čo naznačuje, že špecifické mikrobiálne antigény by mohli regulovať tento vývojový proces v ranom veku.
Podobný deficit v týchto bunkách bol pozorovaný u mutantných myší, ktorým chýbala expresia Toll -like receptora 2, receptor, ktorý rozpoznáva baktérie a bakteriálne zložky, vrátane B. fragilis PSA, na spustenie ochranných imunitných reakcií hostiteľa.
Aby sme pochopili, ako bola táto mikrobiálna správa doručená vývoju buniek týmusu, Jainova skupina použila nový myšací model na sledovanie migrácie buniek z hrubého čreva do týmusu.
Stratégia konverzie fotografií, vyvinuté za pomoci skupiny Guillerma „Garyho“ Tearneyho z MGH vo Wellmanovom centre pre fotomedicínu, bolo zdôraznené v časopise Journal of Visualized Experiments v roku 2018.
Vedci ukázali, že trieda buniek prezentujúcich antigén, nazývaná plazmacytoidné dendritické bunky (pDC), je potlačená črevnými mikróbmi a v ranom veku migruje z čreva do týmusu, aby regulovala vývoj tymických lymfocytov.
Prvýkrát, Jainova skupina odhalila „novú komunikáciu medzi črevnými mikróbmi a vyvíjajúcimi sa bunkami v týmuse, "hovorí Jain." Formuje imunitný "repertoár" v ranom živote a ovplyvňuje to, ako hostiteľ bude reagovať na choroby počas celého života. "
Predpokladá sa, že nevyvážený vývoj črevného mikrobiómu dieťaťa hrá úlohu vo vývoji chorôb neskôr v živote. Narušenie mikrobioty v detstve antibiotikami alebo diétou, napríklad, súvisí so zvýšeným rizikom alergií, astma a autoimunitné poruchy vrátane celiakie a zápalového ochorenia čriev (IBD).
Jainova skupina demonštruje jeden mechanistický základ tohto pozorovania. Ukazujú, že týmusové bunky PLZF+ sa v ranom živote nevyvíjali efektívne u myší liečených širokospektrálnymi antibiotikami, ale myši ošetrené v neskoršom veku boli ušetrené.
Jain hovorí, že „sa zdá, že existuje časové obdobie raného života, keď vývoj imunitných buniek v týmuse bol obzvlášť citlivý na mikrobiálne vplyvy“.
Navyše, štúdia ukazuje, že mikrobmi indukovaný zmenený vývoj vrodených a vrodených buniek týmusu v ranom veku pretrváva až do dospelosti a vedie k zvýšenej náchylnosti na experimentálnu kolitídu.
Dôležité je, Závažnosť ochorenia môže byť zmiernená prenosom buniek PLZF+ z myší, ktoré sa v ranom živote vyvinuli s normálnou mikrobiotikou, hovorí Jain.
Dodáva, "To má významné dôsledky pre návrh stratégií na liečbu autoimunitných porúch, ako je IBD. Naše štúdie poukazujú na predtým nepreskúmanú cestu, ktorá môže byť vyvinutá ako adoptívna bunková terapia pre pacientov."
Riaditeľ MIBRC Alessio Fasano, MD poznamenáva, že rastúce dôkazy ukazujú, že včasný vývoj zdravého imunitného stavu vyžaduje ideálny symbiotický vzťah medzi vyvíjajúcimi sa deťmi a ich komunitou mikroorganizmov.
Stále je veľkým otáznikom to, ako si „vyberieme“ svoj ideálny mikrobióm, ktorý by náš imunitný systém naučil brániť nás, a nie nám škodiť. Nitya a jej skupina-prvýkrát-objasnili veľmi rané mechanizmy, ktoré sú zodpovedné za vytvorenie zdravého vzťahu medzi ľudským hostiteľom a mikrobiómom. "
Alessio Fasano, MD, Riaditeľ, MIBRC
 Antiemetiká na nevoľnosť a vracanie
Čo môže spôsobiť nevoľnosť a zvracanie? Lieky používané na liečbu nevoľnosti a zvracania sa nazývajú antiemetiká. Mnoho typov antiemetík môže znížiť závažnosť nevoľnosti. Nevoľnosť a vracanie sa
Antiemetiká na nevoľnosť a vracanie
Čo môže spôsobiť nevoľnosť a zvracanie? Lieky používané na liečbu nevoľnosti a zvracania sa nazývajú antiemetiká. Mnoho typov antiemetík môže znížiť závažnosť nevoľnosti. Nevoľnosť a vracanie sa
 Psychoterapia pre syndróm dráždivého čreva (IBS)
Bolo vám niekedy povedané, že symptómy IBS sú vo vašej hlave? Máte pocit, že nemáte kontrolu nad príznakmi? Sú vaše príznaky znepokojujúce a nepredvídateľné? Príznaky IBS môžu byť výzvou. Myšlienky a
Psychoterapia pre syndróm dráždivého čreva (IBS)
Bolo vám niekedy povedané, že symptómy IBS sú vo vašej hlave? Máte pocit, že nemáte kontrolu nad príznakmi? Sú vaše príznaky znepokojujúce a nepredvídateľné? Príznaky IBS môžu byť výzvou. Myšlienky a
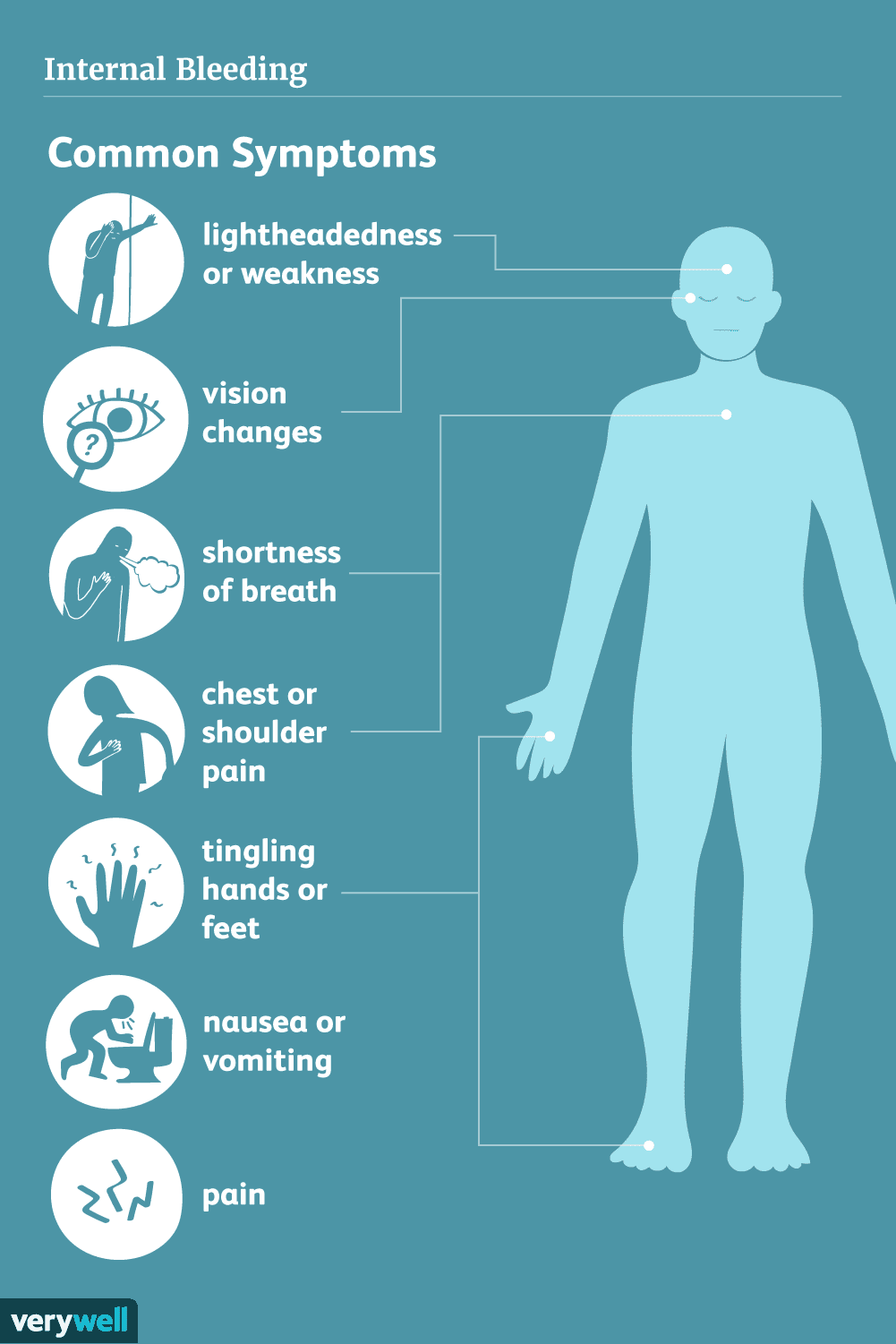 Príznaky vnútorného krvácania
Príznaky vnútorného krvácania sa môžu líšiť od jedného prípadu k druhému. Môže to byť náhle a rýchle s extrémnou bolesťou, šokom a mdlobou. Alebo to môže byť pomalé a „tiché“ s niekoľkými príznakmi, k
Príznaky vnútorného krvácania
Príznaky vnútorného krvácania sa môžu líšiť od jedného prípadu k druhému. Môže to byť náhle a rýchle s extrémnou bolesťou, šokom a mdlobou. Alebo to môže byť pomalé a „tiché“ s niekoľkými príznakmi, k