Povzetek
Mangiferin (MF), ki je xanthonoid od Mangifera indica , se je izkazalo, da imajo antisekretornimi in antioksidativno gastroprotektivnih učinke proti različnim želodca modelov razjede; Vendar pa njegov molekularni mehanizem še ni bila pojasnjen. Zato je bil cilj te študije preizkusiti svoje modulatorni učinek na več signalnih poti z modelom ishemija /reperfuzijske prvič. Živali smo obdelali z MF, omeprazolom (OMP) in vozila. V Mehanistične študije so pokazale, da je MF posreduje svoje gastroprotektivnih učinek delno preko inducira izražanje Nrf2, HO-1 in PPAR-y skupaj z downregulating da od NF-κB. Presenetljivo je, da je učinek MF, še posebej visoka doza presegla ki jih OMP posredovano razen Nrf2. Molekulske Rezultati se je odrazilo na biomarkerjev izmerjenih, kjer je antioksidant učinek MF, ki se kaže s povečanjem skupno antioksidativno kapaciteto in glutation, poleg normalizira raven malondialdehida. Poleg tega MF zmanjšala /višino I-R povzročene dušikovega oksida, učinek, ki je boljši kot OMP. V serumu, MF, v odvisnosti od odmerka, izboljšano endotelijske sintaze dušikovega oksida, medtem ko se je zmanjšala inducibilne izooblike. V zvezi s protivnetnim učinkom MF je znižalo raven v serumu, IL-1β in SE-selektina, učinkov, ki so se zrcali na ravni tkiva mieloperoksidaze, v nevtrofilcev infiltracijo marker. Poleg tega MF imela tudi antiapoptotic znak dokazuje dvignili raven Bcl-2 in zmanjševanje da kaspaze-3, da je povezano odmerka. Kot zaključek so posredovane v intimated gastroprotektivna mehanizmi MF, delno z modulacijo oksidativnega stresa, vnetje in apoptozo morda prek Nrf2 /HO-1, PPAR-γ /NF-κB signalne poti.
Citation : Mahmoud-Awny M, Attia AS, Abd-Ellah MF, El-Abhar HS (2015) Mangiferin blaži želodčne razjede v ishemiji /reperfuziji podgane: Vključevanje PPAR-y, NF-κB in Nrf2 /HO-1 signalnih poti. PLoS ONE 10 (7): e0132497. doi: 10,1371 /journal.pone.0132497
Urednik: Ashraf B. Abdel-Naim, Fakulteta za farmacijo, Ain Shams University, EGIPT
Prejeto: 18. marec 2015; Sprejeto: 15. junij, 2015; Objavljeno: 21. julij 2015
Copyright: © 2015 Mahmoud-Awny et al. To je prost dostop članek razširja pod pogoji Creative Commons Attribution License, ki omogoča neomejeno uporabo, distribucijo in razmnoževanje v katerem koli mediju, pod pogojem, da prvotni avtor in vir knjižijo
Razpoložljivost podatkov: Vsi pomembni podatki so v prispevku
financiranje:.. avtorji nimajo podpore ali sredstva za sporočanje
nasprotujočimi si interesi. avtorji so izjavili, da ne obstajajo konkurenčni interesi
Uvod
v želodcu malady blaginjo upshots congregated za stiske ravnovesje med destruktivno in zaščitne dogodkov. Oksidativni stres je ključni dejavnik, ki povzroča razjede želodca in povzroča prekomerno prostih radikalov (FR-) [1]. Želodca ishemija /reperfuzijske (I /D) arhetip posnema stresom povzročene želodcu, v tem primeru povišane MRS, dušikov oksid (NO), levkocitov adhezijske molekule "E-selektina" [2], nevtrofilno infiltracijo [3] in redoks neravnovesje [4] igrajo pomembno vlogo v svoji patogenezo. Prav tako ima ključno vlogo pri škodi na I /R jedrski faktor kappa B (NF-κB), redoks občutljiv transkripcijski faktor, [5]. Uravnava izražanje številnih genov, povezanih z vnetjem in celične poškodbe, kot je interlevkin (IL) -1β, -6, celičnih adhezijskih molekul in inducibilnim sintaze dušikovega oksida (iNOS). Po drugi strani pa več dejavnikov posredujejo svoje prebavila pred oksidativnim poškodbe ga lajšanje vnetni odziv, to vključuje peroksisom-proliferator aktiviran receptor (PPAR) -y [6, 7] in heamoxygenase-1 (HO-1) [8]. Slednji je inducibilni izoforma HO, ki se odziva na napetosti, kot oksidativnim stresom in ostane splošno velja kot zaščitni mehanizem pred poškodbami oksidativni tkiva [9].
Ena od transkripcijskih regulatorjev HO-1, jedrska povezanih faktor-E2 faktor-2 (Nrf2) [9], ki je lokalizirano v citoplazmi pod normalnimi pogoji in komunicira z Keap1 (molekulska senzor cistein bogati protein Kelch podobno ECH povezujejo protein 1), ki se hitro razgradi ki ga ubikvitin-proteazomske poti [10, 11]. Contrariwise, pod oksidativnimi pogoji stres, Keap1 oksidira in Nrf2 ubikvitinacije se spusti [11], pri čemer se sprošča, zato Nrf2 od Keap1. Nrf2 se nato prenesen v jedru na povodec z antioksidantno odzivni element za ciljne promotor gena v [12, 13], ki povzroča takojšnje transaktivacije od kodiranja genov. Ti geni vključujejo številne encimsko antioksidant in razstrupljanja gene, kot je glutation (GSH) peroksidaze /reduktaze, HO-1, in GSH S-transferaze [14].
Mangiferin (MF), naravno glucosylxanthone, ima gastrozaščitnega učinek preko Na molekularnem nivoju, je ta cilj za oceno možno sodelovanje Nrf2 /HO-1, PPARy, in NS -κB signalnih poti v gastroprotektivni učinka MF, poleg drugih biomarkerjev k določitvi morebitnih gastroprotektivnih mehanizme, s pomočjo hipoksije /model dotoka kisika. materiali in način Živali Moški Wistar podgane, ki tehtajo 180-220 g (Zavod za oftalmologijo, Giza, Egipt), ki je obdržal čez 12h svetloba /tema ciklov, stalnih okoljskih pogojev in so bile ohranjene na pravilno prehrano večerjo in vodo ad libitum Mangiferin [MF] je bila kupljena od Sigma-Aldrich Chemical Company (St Louis, MO, ZDA) in omeprazol [OMP] iz Chemo SA (Lugano, Švica). Vse druge kemikalije in reagenti so bili analitsko čisti. MF in OMP smo raztopili v fiziološki raztopini, ki se vbrizga intraperitonealno. model I /R je bila izvedena po metodi prej opisal Kotani et al. [17], z nekaterimi spremembami. Na kratko, pod tiopentalom anestezijo (50 mg /kg, i.p.), je podgana celiakijo arterijo okludiramo 30 minut., Nakar reperfuzijske dovoljena 72 ur z declamping arterijo. Podgane so bili dodeljeni v 5 skupine (n = 7-9); Živali v prvi skupini prejeli fiziološko raztopino in celiakalne arterijo je ravna brez vpenjanje bo služila kot kontrolni skupini, navidezni pogon. Podgane iz naslednjih skupin so bili podvrženi I /R; neobdelani (druga) skupina, prejeli fiziološko raztopino in je bila označena kot pozitivno kontrolo (I /R), medtem ko so ostale 3 skupinami obdelamo z MF (10 mg /kg; MF 10; tretja skupina), MF ( 20 mg /kg; MF 20; četrta skupina), in OMP (20 mg /kg; OMP 20; peta skupina). Vse obdelave naredimo 30 min. Pred operacijo in za 3 dni po reperfuzije. histopatološke preiskave želodec, od treh reprezentativnih živali v vsaki skupini, je bil takoj potopijo v 10% formalinom-fiziološko raztopino, vgrajeni v parafin in 5 pm so bili pripravljeni, obarvali s hematoksilinom in eozinom (H &E), in mikroskopsko pregledati biokemične analize na koncu časa reperfuzijskih in pod globoko eter anesteziji, v krvi je bilo odvzeto. vratne vene pripraviti serumi, nato pa smo živali usmrtimo ter želodec smo izrezali, odprli vzdolž večjega ukrivljenosti in splaknemo z ledeno mrzlo fiziološko raztopino kuhinjske soli. Obseg bruto poškodbe sluznice (razjede Index) je bila ocenjena in izražena kot vsota ulkusa dolžin na želodcu v mm [18]. Na kratko, je osvetljena lupa (3x), uporabljene za merjenje dolžine dolge lezij (mm) v žleznega dela želodca, medtem ko so petechea lezije prešteti in vsakih pet lezije so bili predstavljeni kot 1 mm razjede. O 50 mg želodčne sluznice je bila potopljena preko noči pri RNA kasnejši raztopini, shranjena pri -80 ° C pa do kvantitativne PCR v realnem času (QRT-PCR) kvantifikacijo. Preostali sluznica je bila razrezana off in homogenizirali v ledeno mrzlo fiziološko raztopino (MPW-120, Poljska) z največjo hitrost za 1 min. Homogenat smo centrifugirali pri 5000 rpm 5 minut pri 4 ° C in dobljene supernatante shranjeni v aliquotes in shranimo pri -80 ° C do določitve želodčnih parametrov. Homogeno /serumske vrednosti naslednjih parametrov smo ovrednotili z uporabo ustreznih ELISA, kot je prikazano v oklepajih.. IL-1β, sE-selektina (Abcam Inc., Cambridge, Velika Britanija, Cat št ab100768 in ab171334, v tem zaporedju), iNOS, eNOS (EIAab, Wuhan, Kitajska, Cat št E0837r in E0868r, v tem zaporedju), celična levkemija B /limfom-2 (Bcl-2;. USCN Life Science Inc, Wuhan, Kitajska, Cat Ne. E90778Bo) in kaspaze-3 (Cusabio Biotech Co., Wuhan, Kitajska, Kat. št CSB-E08857r). Vsak biomarkerjev je bil obdelan v skladu s postopki proizvajalcev predvidenih. Serum skupna kapaciteta antioksidant (TAC) smo merili z metodo Benzie in Starin [19]. Na kratko smo železov tripyridyltriazine (Fe 3 + -TPTZ) kompleks zmanjša železa obliki, ki jo antioksidantov prisotne v vzorcu, pri kislem pH, da dobimo intenzivno modro barvo, ki jo je mogoče nadzorovati z merjenjem spremembe absorbance pri 593 nm. Sprememba je neposredno povezana s kombiniranim ali popolni zmanjševanje moči elektrondonorsko brez encimske antioksidante, prisotne v reakcijski zmesi. Stopnja TAC je izražen kot iM /L. dejavnost MPO (U /gm), marker tkiv nevtrofilcev infitration, je bila ocenjena v skladu s Bradley et al. [20]. Metoda temelji na merjenju vodikovega peroksida odvisni oksidacije o-dianisidine, ki jih MPO katalizirano, ki ima za posledico nastanek spojine kaže povečano absorpcijo pri 460 nm. Kot indeks peroksidacijo lipidov thiobarbituric kislin reaktivnih snovi (TBARS), ki ga MDA predstavljal, je bila uporabljena za določitev škode oksidativno po metodi Mihara in Uchiyama [21]. MDA-TBA adukt razvija roza barve, ki je bil izločen s n-butanol in izmerjena na dveh valovnih dolžin, viz želodca sluznični NO proizvodnja je bila ocenjena posredno nitrita /koncentracije nitratov po metodi Miranda et al. [23], pri čemer smo uporabili vanadija triklorid zmanjšanje nitrata v nitrit. Roza azo-dye proizveden z reakcijo nitrita z sulfanilne kisline, čemur sledi naknadno sklopitev s N- (1-naftil) etilendiamin smo izmerili kolorimetrično pri 540 nm in NOx je bila izražena kot uM /gm. Total RNA je bila vzeta iz želodčne sluznice s pomočjo preprosto P Total RNA ekstrakcijo komplet (BioFlux, Hangzhou, Kitajska). Čistost pridobljene RNA smo preverili spectrophoto-metrično pri 260/280 nm. Enake količine RNA (0,368 ug) smo retrotranscribed v prvi sklopa komplementarne DNA (cDNA), pri 37 ° C za 50 minut. uporabi 200 U /ul M-MuLV reverzne transkriptaze (SibEnzyme, Novosibirsk, Rusija), 1 ul naključno heksamerni (Qiagen, LRS Laboratories, Inc. Koreja) in 0,1 M DTT v reakcijski zmesi 50! Li. Za oceno izražanje antioksidantov in povezanih z vnetjem ciljnih genov, je RT-PCR izvaja z uporabo SYBR zelena PCR Master Mix (Qiagen), kot jih je določil proizvajalec opisal. Na kratko, v 25 ul reakcijske obsega 5 xl cDNA dodamo 12,5 ul z 2x SYBR zelenega centralnega mešanice in 2,5 ul (2,5 um) vsake primer. Sekvence oligonukleotidnih bili: PPAR-γ oligonukleotidni 5'-GCGGAGATCTCCAGTGATATC-3 '; Protismiselni oligonukleotid 5'-TCA GCGACTGGGACTTTTCT-3 '; NF-κB p65 oligonukleotidni 5'-TGCAGAAAGAAGACATTGAGGTG-3 '; protismerni oligonukleotidni 5'AGGCTAGGGTCAGCGTATGG-3 '; Nrf2 oligonukleotidni 5'-ATGGCC ACACTTTTCTGGAC-3 '; Protismiselni oligonukleotid 5'-AGATGTCAAGCGGGTCACTT-3 '; HO-1 oligonukleotidni 5'CGTGCAGAGAATTCTGAGTTC-3 '; antisense primer 5'- AGACG CTTTACGTAGTGCTG-3 '; in gliceraldehid-3 fosfat dehidrogenaze (GAPDH) oligonukleotidni 5'-GGGCAGCCCAGAACATCA-3 '; antisense primer 5'-TGACCTTG CCCACAGCCT-3 ". PCR reakcije vključenih 15 min pri 95 ° C za aktivacijo HotStarTaq DNA polimerazo, čemur sledi 45 ciklov pri 94 ° C 15 sekund (denaturacijski), 55 ° C za 30 sekund (žarjenje) in 72 ° C za 30 sekund (podaljšek ). Relativni izraz je bila izračunana od 2 -ΔΔCT formulo [24]. Podatki so izražene kot povprečne ± S.E.M od 7-9 živali. Statistične primerjave med sredstvi so bile izvedene s pomočjo enosmerne analize variance (ANOVA), ki ji sledi preizkus Student-Newman-Keuls. Statistična pomembnost razlik je zdelo na P Vpliv MF in OMP na I /index razjeda-R povzroča MF, v odvisnosti od odmerka, prepovedano I /-R povzroča želodčne poškodbe, kot z vrednostmi indeksa razjede (tabela 1) in učinek MF 20 je bil primerljiv s tistim, ki ga OMP ponudil predstavila 20. Vpliv MF in OMP na mRNA izražanje antioksidativnih genov Kot je prikazano na sliki 1A in 1B, je razvidno prilagodljivi odgovor pred poškodbami z I /R v uravnavanjem Nrf2 in HO-1 mRNA, kar pojasnjuje razlog za povišane ravni GSH v nezdravljeni skupini I /R. Te mRNA upregulations so še žive v tretiranih skupinah, kar kaže, s tem, da je antioksidativno kapaciteto MF. Kot je prikazano v tabelah 2 in 3 I /R žalitev povzročila neravnovesje v oksidativnega /nitrosative statusa. Porast v ravni MDA (182%) in proizvodnja NOx (187,6%), vzporedno z 5,1 gub povečanje iNOS, je bila v I /R nezdravljeni skupini. Nasprotno, I /R Poškodba razpolovi dejanskega eNOS in zmanjšali TAC (69,7%), v primerjavi s placebo skupino. Vse te spremembe so bile vrnjene s OMP, kot tudi MF, na način, odvisen od doze. V skoraj vseh parametrov MF 20 je imela pomembno učinek. Glede GSH, model I /R, nepričakovano, je povišana za 32%, učinek, ki se je še okrepljeno različni režimi drog. Kot je prikazano na sliki 1C, živali z I /R škode pokazala znatno zmanjšanje želodca izražanje protivnetno PPAR-y (25% ravni navideznega), z izrazito povečanje s tem, da v vnetnih faktorja NF-κB (11,9-krat) (Slika 1D). Zanimivo je, da MF obdelan so skupine, ki lahko nevtralizirajo I /učinkov, povezanih z R glede na velikost odmerka preskuša. OMP, na drugi strani, je pokazala manjši učinek kot MF storila NF-κB, vendar ni spremenila zmanjšala PPAR-y. Tabela 4 prikazuje I /-R posredovane želodčne zlo, ki se je še poslabšalo vnetne biomarkerjev. Je povečala koncentracijo serumu IL-1β, SE-selektina in želodca MPO aktivnost za 5,2, 5,6 in 2,2 gub, oziroma, saj v primerjavi z lažno operirane kontrolno skupino. Vse te spremembe so znatno ustavila z obdelavo z MF v odvisnosti od odmerka. Kljub temu, MF 20 učinki nadomeščene da posreduje referenčno standardno OMP. Te ugotovitve kažejo, da lahko MF modulirajo vnetnih citokinov in nevtrofilci zaposlovanje za ublažitev I /-R povzročene škode. Kot je razvidno iz tabele 4, je I /R žalitev sproži apoptozo želodčne sluznice, kot je razvidno iz 6.85 v koraku zvišanja stopnje kaspaze-3. V istem smislu, I /R zmanjšal nivo anti-apoptotske markerja Bcl-2 (59%). Vendar pa uporaba MF, v odvisnosti od odmerka, je precej ustavila te spremembe, učinke, ki so presegli tiste, ki jo posreduje OMP. izboljšanjem učinki različnih režimov drog na testiranih biomarkerjev so potrdile tudi histološke ugotovitev, predstavljenih na sliki 2. slika prikazuje mikro fotografske posnetke iz želodčne sluznice, ki kažejo, [A] normalno želodca sluznice (mu), Submukozno (sm) in muscularis ( ml) arhitektura v oddelku rat na-navidezni pogon. [B] I /R sekcije odkrili sloughed sluznico (m), juxtraposed z osnovnim krvavitev (črna puščica), [C] huda žilna zastoji (V), osrednja vnetne celice infiltracijo (m), kar je predvsem nevtrofilcev, in edem (O) v submucosa. [D] MF 10 oddelek razkril le zastoje v Submukozno krvnih žilah (V) z blagim infiltracije vnetnih celic (rumena puščica) in /ali edem. Po drugi strani pa [e] MF 20 prerez, podoben Sham-Krmilni kaže normalno nedotaknjen histološko strukture, razen zelo blago žilne zastoji (v) v submucosa; MF 20 učinek nadomeščene da od OMP [F], kjer so preobremenjene krvne žile (V) in edem v Submukozno plasti še vedno odkrita v oddelkih OMP. Pogovor Čeprav prejšnje študije so dokazale antioksidant [15] in protivnetne [25] zmogljivosti MF, vendar nobeden ni pojasnil morebitne molekularne poti, ki sodelujejo pri popravljanje motene redoks /vnetnih sistemov. Tako so v tem delu smo preverili želodčne sluznice izražanje Nrf2 /HO-1 razumeti, če je to signalizacijo pot vpleten v mehanizem MF antioksidanta. Poleg tega je raziskava usmerjena izražanje NF-κB in PPAR-y raziskati tudi nekaj možnih MF protivnetnim molekularne strojev. Naše raziskave transdukcije signala je pokazala, da I /R je bistveno molekul mRNA za Nrf2 in HO-1, ki kaže na morebitno prilagodljivo učinek telesa proti I /R poškoduje žalitev; te ugotovitve posnema Pan in sodelavci [26] v I /model mrežnice R. Okrepljeno HO-1 protein izraz, ki ga Nrf2 [27] urejena, se lahko pojavijo kot odziv na oksidativni stres [28] in vnetnih bolezni, ki je splošno sprejeto kot zaščitni mehanizem pred poškodbami oksidativni tkiva [9], dejstva, ki podpirajo naše ugotovitve. MF, na drugi strani pa je potrdil svojo antioksidant učinek, ki ga nadalje dvižne izražanje Nrf2 in HO-1, rezultati, ki so bili že prej posnetih v hepatotoksične modela [29]. Kolikor nam je znano, je ta ugotovitev v prvi neposreden dokaz za gastroprotektivni vloga MF skozi Nrf2 /HO-1 antioksidant poti v I /modelu razjed-R povzroča. antioksidant značaj MF se je še pokazalo tukaj z njegovo sposobnost za boj proti I /višino-R psihomotorične lipidnih peroksidov [30] in zmanjšanje celotnega dovoljenega ulova [31]. Vendar pa je učinek I /R in MF o GSH pokazala enak vzorec prišlo v Nrf2 in HO-1 izraz, kjer je I /R povzročila subtilen, še znatno povišanje GSH, učinek, ki je še povečal s MF [32] . Ta ukrep, kaže na morebitno kompenzacijsko odziv proti I /R poškodbe in povezuje GSH z signalne poti Nrf2 /HO-1, ki podpira dosedanja Das et al. [29]. Korelacija med GSH in Nrf2 se lahko nanaša na molekularni navzkrižno pogovor med molekul Nrf2 in γ-glutamylcysteine ligaze v [10, 33], encima, ki katalizira omejitvijo tečaja korak v GSH sintezi [34]. Poleg tega, HO-1 antioksidant vloga izhaja iz njene sposobnosti, da pospeševala razdelitev pro-oksidanta hem v železo, biliverdin in ogljikovega monoksida [35]; biliverdin se nato pretvori v bilirubina, ki deluje kot antioksidant proti peroksidacijo lipidov [36]. Poleg popravljanje status zaskrbljen redoks, MF razširil svoj vpliv, da bi lahko povzročili nitrosative stresa, kot dobro. MF nasprotju I /R vpliva na ravni Enos /iNOS, kjer je obnovljena aktivnost konstitutivni encim eNOS [37] in zmanjšala v zdravju škodljivega inducibilne izoformo [38]. Zato se pričakuje, da je povišana raven iNOS v nezdravljeni skupini, odgovorni za raven presežka NOx, ki ogroža celovitost želodčne sluznice preko škodljivi dogodki, ki sledijo, I /R žalitev za vključujejo povečano sproščanje vnetnih mediatorjev in rekrutiranje levkocitov, poleg motili oksidacijske /nitrosative stroje [42]. V sedanji študiji MF potrjene njeno protivnetno /imuno modulatorni učinek, ki je bil predhodno dokumentirano [25, 43], z zaviranjem IL-1β [43], E-selektina [25] in nevtrofilcev infiltracijo [44] v drugih različni modeli. Ti učinki se lahko delno povezano s MF-modulacijskih sprememb na molekularnem nivoju. MF inducirano gensko ekspresijo PPAR-y, skupaj z downregulation matičnega vnetne transkripcijskega faktorja /mediatorja NF-κB, ovirajo tem, učinek I /R. Prejšnje študije so poročali, da je I /R škodljivi učinek posredovana delno preko Pred Wu et al. [53] je poročal, da PPAR-γ prekomerno ščiti tudi membranski potencial mitohondrijske in preprečuje apoptozo s navzgornje regulacije izražanja anti-apoptotskih Bcl-2 družine proteinov. Podobno, ogljikov monoksid, stranski produkt HO-1 aktivnost, daje anti-apoptotske aktivnosti s strani up-regulacije anti-apoptotske molekule Bcl-2, in navzdol-ureditev pro-apoptotično signala Bax [54]. Podatki trenutne študije so pokazale, da I /-R povzročena škoda želodca je povezano tudi z apoptozo, kar dokazuje znatno zmanjšanje Bcl-2 [55] in na nadmorski višini kaspaze-3 [56], medtem ko je MF vrnila I /R inducirano apoptozo s vzdrževanega nadmorske višine odmerka ravni Bcl-2, in zmanjšanje ravni kaspaze-3. MF anti-apoptotični učinek sovpada z rezultati Ghosh et al. [38] in se lahko pripiše MF posredovano uravnavanjem PPAR-y in /ali ravni HO-1 mRNA Vse te ugotovitve so še dodatno kaže na histoloških sprememb.; I /R žalitev povzročila ukinitev epitelijske zaščitnim slojem, kar je povzročilo v katerem temelji krvavitev z izrazito zastoji krvnih žil, skupaj z vnetne celice infiltracijo v lamine proprie, učinek, ki označuje prenehanje pretoka krvi, ki je bila priložena edema. Zastojev krvnih žil lahko posledica nadmorski višini vazokonstriktor endotelina-1 v želodcu tkiva [57], večjo infiltracijo levkocitov [58], in /ali zmanjšano delovanje eNOS kakor izhaja iz trenutne študije. V skladu s tem, I /R ni bila priložena le tvorbo prostih radikalov, ampak tudi z jasnim zmanjšanjem ravni endogenih antioksidantov in večjo infiltracijo vnetnih celic, spremembe, ki so bile ovirajo MF, zlasti na ravni visokih odmerkih, kjer normalno histološko opazili strukturo. Glede na referenčno OMP drog, ki izvaja svojo gastroprotektivnih učinek s svojo antioksidant, antiapoptotic [59], in protivnetno [60] ukrepi, ki presegajo zaviranju kisline [61], smo razmejene tukaj, molekularne dogodke, ki prispevajo k teh učinkov. V tej raziskavi smo dokumentirano, da OMP antioksidant učinki, ki so evidentirani z zaviranjem peroksidacijo lipidov in povečanje obrambnih biomarkerjev, nam posreduje preko Čeprav je učinek OMP na Nrf2 izražanja presegla 20, vendar je nasprotno bilo očitno na HO-1 in GSH, neskladja, ki lahko MF povezano z njihovimi učinki na NF-κB. Slednje je bilo dokazano, da deluje kot negativni regulator Nrf2 poti tekmuje z njo za vezavo na transkripcijski koaktivator CREB vezavo proteina (CBP) in tako spodbujajo vezavo co represorskim histon deacetilaze 3 (HDAC3) da antioksidant odzivni element (SE) [62]; ti učinki lahko retard Nrf2 povzročenega prepisa njenih nadaljnjim ciljev. Poleg tega antiapoptotic last OMP sklicuje ne le na njegovo sposobnost, da poveča raven antiapoptotic beljakovin, Bcl-2 ali zmanjševanje stopnje apoptoze marker, kaspaze-3, kot je zaznati v tej študiji, ampak tudi o zmanjšanju oksidativne poškodbe DNK [59]. Končno, lahko sklepamo, da je gastroprotektivnih učinek MF, še posebej v odmerku 20 mg /kg, je mogoče pripisati aktivacijo Nrf2 /HO-1 antioksidantno poti, PPAR-γ protivnetno pot preko
svojih antisekretornimi in antioksidativnih aktivnosti, kar je bilo potrjeno v različnih živalskih modelih razjede želodca [15], vendar ne I /model R, ki je cilj trenutnega dela. MF so poročali, da posredujejo svoje antioksidativno delovanje na različnih ravneh oksidativnega zaporedju. Generira MF fenoksi radikale in se veže na kovinskih ionov (Fe 2 + /3 +) v obliki stabilne MF-železovega kompleksa, ki ne dopušča nastajanje hidroksila (OH) ostanki in /ali okso-ferryl skupine in scavenges lipidov peroksi /alkoksi radikale, s tem, ohranjanje celične oksidacije-antioksidant ravnotežja [16]. Kljub podrobnih celične reakcije, opisane pa so poti molekularne signalne ni reševati prej.
. Pred eksperimentiranje (24 ur) vse živali, ki so bile nastanjene individualno, v širokih očesa od spodaj kletke in se postili. Živali so se ravna v skladu s smernicami, ki jih odbor za živali oskrbe in uporabe Fakulteta za farmacijo, Cairo University, Kairo, Egipt odobrenih (številka dovoljenja: PT 575). Vsi kirurški postopki so bili izvedeni v skladu s tiopentalom anesteziji, in si je prizadevala za zmanjšanje trpljenja.
Droge
Indukcija želodčne sluznice ishemije /reperfuzije (I /D), in zdravljenje
oddelkov
Ocenjevanje homogenata /parametrov v serumu s pomočjo ELISA tehnika
Ocena želodca dejavnosti /vsebine mieloperoksidaze (MPO), malondialdehida (MDA), zmanjšana glutation (GSH) in skupno dušikovega oksida (NOx).
., 520 in 535nm. Metoda, ki jo Ahmed et al. [22] je bila sprejeta oceniti nebeljakovinskih sulfhidrilne skupine (predvsem GSH) z reakcijo z reagentom Ellmana je po obarjanje beljakovin SH-skupine. Reakcijo z reagentom Ellmana se tvori stabilen rumeno barvo 5 merkapto-2-nitrobenzojsko kislino, ki je bilo merjeno s kolorimetrično pri 412 nm (mg /gm).
kvantitativna v realnem času (RT) -PCR
Statistična analiza
< 0.05.
Rezultati
Vpliv MF in OMP parametrov redoks
Vpliv MF in OMP na mRNA izražanja PPAR-y in NS -κB geni
Vpliv MF in OMP na želodca vnetnih citokinov in nevtrofilcev infiltracijo
Vpliv MF in OMP na apoptoze biomarkerjev
Vpliv MF in OMP na želodca histopatoloških sprememb
njegovo interakcijo z superoksid anion in oblikovanje peroksinitrit [39]. Slednji je močan prostih radikalov, ki perturbs celične makromolekule s peroksidacijo lipidov, neposredne mitohondrijske oslabitve, ki zavirajo membrane Na + /K + - ATPaze dejavnost, in oksidativni beljakovin spremembo [40]. Contrariwise, lahko MF-posredovano proizvodnja NOx se vozi iz obnovljenih eNOS in ne iNOS, ki podpirajo, tako, antioksidanti /prosti radikali hlapov lastnosti MF [16]. Zaščitni NO poteši proste radikale, s posledično ohranitev GSH v želodčne sluznice; GSH deluje kot nukleofilne lovilec superoxides in kot kofaktor v GSH-peroksidaze posredovana zmanjšanje vodikovi peroksidi [41].
zatiranja PPAR-y mRNA [7, 45], ki je transkripcijski faktor, ki deluje kot vpliven pleiotropski regulator anti-vnetja, antioksidant, in cleanup procesov fagocitni posredovano. Poleg njegovega neposrednega genomske učinka, je PPARy ugotovljeno, da negativno vpliva na delovanje drugih transkripcijskih faktorjev kot NF-κB, ki je podlaga za številne vidike protivnetnim /imunomodulatorno učinek PPARy [25, 46], dejstva, da tone z našimi ugotovitvami. Poleg tega so poročali okrepljeno izraz PPARy, da zavira nastajanje NOx /iNOS [47], tako da s tem, razlaga za MF-zavrtje v iNOS. PPARy ovira tudi-makrofagov usmerjenih citokine in levkocitov adhezijske molekule, kot je videti tukaj, delno preko
zatiranja gensko izražanje NF-κB [25, 48]. Poleg tega so poročali MF zmanjša adhezijo PMN na endotelij in varovano proti njihovemu infiltracijo v želodcu tkivo [49], poleg modulacijo PPAR-y in NF-κB izražanja. Te ugotovitve potrjujejo naša na E-selektin, iNOS in MPO, kot smo že omenili. Poleg tega lahko MF-inducirane HO-1 Povecanje racionalizirati protivnetno značaj MF, preko
svoji stranski produkt ogljikov monoksid, ki daje protivnetno lastnine [50]. V ta namen so eksperimentalni rezultati naše raziskave ugotoviti še gastroprotektivnih mehanizme na obeh molekularnih in celičnih ravni, s katerim MF zavarovanih želodčne sluznice pred I /-R povzročene škode. Ti rezultati potrjujejo z ugotovitvami prejšnjih raziskav v poskusni kolitis modela [51, 52], in natančno določiti, da protivnetno delovanje MF.
signalne poti Nrf2 /HO-1. OMP zaviral tudi vnetnih citokinov IL-1β, kot tudi nevtrofilcev oprijem in infiltracijo z zmanjšanjem nivoja sE-selektina in MPO aktivnost, v tem zaporedju zastopana. Čeprav OMP navzdol reguliranih ekspresijo NF-κB, še ni mogla boj I /R učinek na PPAR-y, kar kaže, da je protivnetno /imunsko modulatory učinek OMP izhaja iz zatiranja NF-κB izražanje genov, in po možnosti drugi mehanizmi, ne pa da za PPAR-y.
downregulating NF-κB, ter k povečanju antiapoptotic protein Bcl- 2 in zmanjšuje kaspaza-3. Vsi ti mehanizmi končno vzdrževati normalno celovitost želodčne sluznice pregrade.
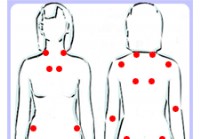 Fibromialgija
Dejstva, ki bi jih morali vedeti o fibromialgiji Ilustracija bolečih točk fibromialgije Fibromialgija je sindrom bolečine, za katerega so značilna kronična bolečina, utrujenost in občutljivost na dot
Fibromialgija
Dejstva, ki bi jih morali vedeti o fibromialgiji Ilustracija bolečih točk fibromialgije Fibromialgija je sindrom bolečine, za katerega so značilna kronična bolečina, utrujenost in občutljivost na dot
 V središču pozornosti:Erin iz NoMoreCrohns
Prednostna naloga je izpostavljanje osebnosti SCD z vsega interneta. Radi poslušamo zgodbe o uspehu in želimo širiti znanje tistih, ki so dovolj pogumni, da delijo svoje posebne zgodbe o prehrani z og
V središču pozornosti:Erin iz NoMoreCrohns
Prednostna naloga je izpostavljanje osebnosti SCD z vsega interneta. Radi poslušamo zgodbe o uspehu in želimo širiti znanje tistih, ki so dovolj pogumni, da delijo svoje posebne zgodbe o prehrani z og
 Poškodbe trebuha pri otrocih morda ne upravičujejo CT skeniranja
Zadnje novice o zdravih otrocih Dojenčkove težave pri hranjenju, povezane z razvojnimi zamudami Njena roka se je ujela v družinski tekalni stezi Ste zaskrbljeni zaradi uporabe družbenih medijev vašeg
Poškodbe trebuha pri otrocih morda ne upravičujejo CT skeniranja
Zadnje novice o zdravih otrocih Dojenčkove težave pri hranjenju, povezane z razvojnimi zamudami Njena roka se je ujela v družinski tekalni stezi Ste zaskrbljeni zaradi uporabe družbenih medijev vašeg