Iskanje novih peptidnih biomarkerjev za raka na želodcu v človeški serumi, ki se lahko izvajajo v klinično izvedljivo metodo predvidevanja za spremljanje raka na želodcu. Raziskovali smo v serumu peptidome iz dveh različnih biorepositories. Prvi smo uporabili fazno tekočinsko kromatografijo pristop C8-reverse za čiščenje vzorcev, ki ji sledi analiza masne spektrometrije. Ti so bili uporabljeni na vzorcih seruma iz nadzora rakavih brez in bolnikov z rakom želodca v različnih kliničnih fazah. Nato smo ustvarili cevovoda za analizo bioinformatika in označene peptid podpis diskriminacijo bolnikov želodec adenokarcinom iz nadzora rakavih bolezni. Matrix Assisted Laser Desorpcijske /ionizacija-Čas letenja (MALDI-TOF) Rezultati 103 vzorcev je pokazala, 9 podpis peptide; z natančnostjo napoved za 89% v nizu usposabljanje in 88% v nizu potrjevanja. Trije diskriminirajo peptidov odkrili so fragmenti apolipoproteinov C-I in C-III (Apoc-I in C-III); Nadalje smo količinsko njihove ravni v serumu, kot tudi CA19-9 in CRP, ki uporablja kvantitativne komercialne kliničnih testov na 142 vzorcih. Apoc-I in Apoc-III kvantitativni rezultati povezana z rezultati MS. Nato smo zaposleni apoB-100-normalizirani Apoc-I in Apoc-III, CA19-9 in ravni CRP za ustvarjanje pravil, določenih za napovedovanje raka želodca. Za usposabljanje, smo uporabili serume iz enega odlagališča, in za potrditev, smo uporabili serume iz drugega skladišča. Napoved natančnosti 88,4% in 74,4%, so bili pridobljeni v nizih usposabljanja in potrjevanja oz. Koncentracije Apoc-I in Apoc-III v kombinaciji z drugimi kliničnimi parametri lahko služijo kot podlaga za oblikovanje diagnostičnega rezultata za bolnike z rakom želodca
Navedba. Cohen M, Yossef R, Erez T, Kugel A Welt M Karpasas MM, et al. (2011) Serum apolipoproteinov C-I in C-III zmanjšajo v rak želodca bolnike: Rezultati MALDI-Based Peptidome in imunsko osnovi kliničnih preskusih. PLoS ONE 6 (1): e14540. doi: 10,1371 /journal.pone.0014540
Urednik: Hana Algül, Technische Universität München, Nemčija
Prejeto: 1. julij 2010; Sprejeto: 22. november 2010; Objavljeno: 18. januar 2011
Copyright: © 2011 Cohen et al. To je odprtega dostopa članek razširja pod pogoji Creative Commons Attribution License, ki omogoča neomejeno uporabo, distribucijo in razmnoževanje v katerem koli mediju, pod pogojem, da prvotni avtor in vir knjižijo
Financiranje:. Bil Financiranje če s strani Evropske skupnosti (FP6 GLYFDIS 037.661). RNTech SAS Francija je navedeno kot zdravstveno blagajno, zaradi dejstva, da so /so bili zaposleni v tem podjetju JT in HB; prispevki JT in HB so opredeljeni kot da Končna odobritev različici objavljena, in niso bili vključeni v prispevku k zasnovi in oblikovanju, ali pridobivanje podatkov, ali analiza in interpretacija podatkov ali pripravi rokopisa. Med financerji imel nobene vloge pri oblikovanju študije, zbiranje in analizo podatkov, sklep, da se objavi, ali pripravi rokopisa
nasprotujočimi si interesi. Dejstvo, da sta dve nekdanji ali sedanji zaposleni RNTech SAS Francija avtorji tega članka ne vpliva na upoštevanje vseh PLoS ONE politike o izmenjavi podatkov in materialov, kot je opisano v spletni vodnik za avtorje.
Uvod
stopnje umrljivosti mnogih raka niso bistveno spremenila v zadnjih 20 let [1]. Zgodnje odkrivanje je bilo dokazano, da močno izboljša učinkovitost zdravljenja raka, vendar odkrivanja je pogosto mogoče šele po pojavu prvih kliničnih simptomov, ki so v nekaterih rakov pride prepozno za uspešno intervencijo. To je v veliki meri posledica pomanjkanja specifičnih in občutljivih testov, ki omogočajo zgodnje pregled in nadzor rakavih držav. Zato je odkritje novih tumorskih biomarkerjev bolj odločilnega pomena za izboljšanje zdravljenja raka. V zadnjem desetletju so številne študije osredotočila na odkrivanje biomarkerjev. Ena izmed najbolj obetavnih virov za odkrivanje biomarkerjev je človeško kri, zlasti seruma in plazme, ki lahko odražajo številne dogodke v telesu, v realnem času. Kljub ogromno naporov, le zelo majhno število beljakovine v plazmi je bilo dokazano, da imajo diagnostično vrednost [2] - [5]. Pogosto so ti biomarkerjev ne stati pri miru in jih spremljajo tudi druge teste za spremljanje in diagnostiko. Večina od njih niso specifični in dovolj občutljiva za široko diagnozo zaslon [6], [7].
Eden od možnih vir novih rakavih biomarkerjev je peptidome. Razlog za osredotočanje na serumskih peptidov temelji na dokazih, da je nastanek in razvoj raka vključuje spremembe v presnovi beljakovin "in peptidi", in na povečano dostopnost metodologije za pregledovanje celotnega peptidome. V zvezi z razvojem raka, lahko pride do sprememb v paleto znotraj in zunaj celičnih peptidov, ki so zastopane v peptidome krvi, ki so lahko značilni za rakasto fazi, in tako diagnostične možnosti [2], [4], [ ,,,0],5]. V zvezi s tehnologijo zaznavanja, nedavni napredek v MS tehnologije omogočajo odkrivanje sto peptidov od nekaj ul seruma [8], [9]. Dejansko prejšnje študije krvi peptidome poročali vrsto podpisa peptidov v serumu, ki so izkazali zdravi pri bolnikih z rakom (pregledati [5]). To se je pokazalo za prostate, mehurja, dojk in raka ščitnice, ki ga Villanueva et al V tem delu smo se osredotočili odkrivanju niz podpisa peptidov, ki bi lahko diagnostično vrednost za raka na želodcu. Da bi to dosegli, smo uporabili tri različne vire serumu vključujejo bolnikov z rakom želodca v različnih fazah. Nanesemo strog protokol za zbiranje in obdelavo serumu [18], z uporabo povezano postopek pridobivanja peptidov in MALDI-TOF branja, s spremenjeno cevovoda analize. Skupaj izboljšano plinovod dovoljeno za identifikacijo peptida vzorec, ki diskriminira med rakom in kontrolnih vzorcev. Ti rezultati so bili podprti na izvornega in novega serumov za tri navedene značilnosti iz vzorca, Apoc-I (dve značilnosti) in Apoc-III, s pomočjo testov, ki temeljijo na imunsko. Nato smo zaposleni serumu od Apoc-I in Apoc-III v kombinaciji s CRP in CA19-9 označevalcev k diskriminaciji bolnikov želodec adenokarcinom iz nadzora rakavih bolezni. Materiali in metode Serum za žetev in ravnanje Sera so bili pridobljeni iz dveh komercialnih virov. 79 sera vzorci pred delovanjem bolnikov z rakom želodca in 33 sera vzorcev iz rakavih brez izravnanih nadzora (vključno z 10 bolnikov gastritis) so bili zbrani s RNTech (Pariz, Francija) v Romuniji. so bili Sera oblika raka in bolniki z rakom ki niso po noči posta na naslednji način: 5 ml krvi je bila pripravljena v vacuette serumu cevi (CatLj005, Greiner Bio One, Kremsmuenster, Avstrija) in levo strjevanju približno 30 minut, nakar cev centrifugirali pri 3.000 obratih na Hettich EBA 20S centrifugo (Hettich Ag, Tuttlingen, Nemčija) za 5 minut pri sobni temperaturi. Ločen seruma smo alikvote v 1 ml alikvote v sterilne kriogeno cevi (Nalgene, Rochester, NY, ZDA) in takoj zamrznili pri (-70) ° C. 22 pred operacijo raka na želodcu sera in 21 kontrol so bili zbrani s Asterand v ZDA (Detroit, MI, ZDA) na naslednji način: 10 ml krvi je bil pripravljen v BD vacutainer SST plus plastično cevko (cat #BEC 367985, BD San Jose, CA, ZDA). Cev smo zmešali s to obračanjem 5-krat in levo strjevanju približno 30 minut v navpičnem položaju. Ta korak je sledilo centrifugiranje 1,100-1,300 g 10 minut pri sobni temperaturi. Ločeni serum je alikvote v 1 ml alikvoti v sterilni kriogene cevi (Nalgene) cevi in takoj zamrznili pri (-70) ° C. Za vir Asterand, na tešče podatki niso bili zbrani na kateremkoli kri črpa v njihovi banki. Sera vzorcev iz obeh družb prenesti na suhem ledu in skladišči (-70) ° C tik ob ob prihodu. Sera vzorce smo odtajali na ledu približno eno uro in pol, 50 ul je alikvote v lo-povezovalne cevi (Eppendorf, Hamburg, Nemčija) in takoj ponovno zamrznjeno na (-70) ° C. Vse vzorčne alikvote shranili pri (-70) ° C do predelave. Tretji vir serumov je bilo pridobljeno v našem laboratoriju od 12 rakavih brez izraelskim nadzorom. Kri je bila pripravljena z blagovno znamko cevi s RNTech (CatLj005, Greiner Bio One) in ravnanje v serumu, ki se uporablja sledil postopek RNTech. Sera dobimo v našem laboratoriju so bili odvzeti iz ne na tešče posameznikov. Oba RNTech in Asterand podjetja so vzpostavili in izvajajo svoje dejavnosti po regulativnih in etičnih standardov, izvajanje na lokalni, nacionalni, evropski, ameriški in mednarodne predpise in priporočila (UN), še posebej, kadar se uporabljajo za biološko zbiranju materiala in obdelave in izkoriščanje raziskav rezultatov. To vključuje tako pisno soglasje vsakega izmed sodelujočih bolnikov z biološko in banke podatkov, in pisnega pooblastila študija iz etiko vsakega kliničnega inštituta prispevajo vzorce za banke družb. Vsak vzorec seruma je bila predelana v dveh do treh ponovitev (iz enakih alikvotov in na ločenih naključnih datumov). Peptide bili pridobljeni na kroglice prevlečenih s C8, sprani, eluiramo, pomešano s CHCA matrico, in nanesejo na MALDI ciljno ploščo. Sera so bili obdelani v ponovitvah in nanesemo MALDI ploščo dvojnikov. Za podrobnejši opis si oglejte S1 datotek. Obdelava podatkov je bila izvedena v dveh korakih. V prvem koraku je bila matrika intenzivnost opravlja iz surovih ASCII datotek MALDI-TOF odčitki iz vseh virov sera vzorčnih pomočjo ponovnega vzorčenja, poravnavanje, in odkrivanje m /z vrhovi, kot je opisano v Villanueva et al (1) so bili dodani metodi seštevanja in filtriranje koraki funkcijo razmisliti nič vrednosti kot posebnih primerih. Naše Prvotni matrica vsebuje precejšnjo količino ničelne vrednosti za različne funkcije v različnih vzorcih. Zaradi splošne omejitve MALDI tehnologije, lahko precejšen del teh vrednosti nič predstavlja manjkajočih vrednosti, namesto prave nič intenzivnosti. Za delno odpravo te omejitve beremo vsak vzorec v ponovitev, in izračunali povprečno intenzivnost, ignoriranje nič branja intenzivnosti. Po tem replikacijskega seštevku je posledica matrika še vedno vsebuje veliko količino vrednosti nič. modeli na SVM mogoče razvrstiti po vrednosti nič predstavlja manjkajočih vrednosti, in ni res nič intenzivnosti. Zato smo filtrirali od funkcije, ki še vedno imeli nič vrednosti v vsaj enem od vzorcev. Nobena od teh odstranjenih funkcij imel jasno prednost v vrednosti nič na poseben klinični nalogo skupine. Nastalo sub-matrika je bila uporabljena v strojnega učenja uvrstitev. (2) je bil razvit nov pristop, s funkcijo za izbiro nastavitev parametrov. Definicije za analizo temelji SVM so bili sprva kot sledi: RNTech želodec v primerjavi z nadzorom RNTech, Asterand želodcu in kontrolno Asterand. Mann-Whitney p-vrednost je bila izračunana za vsakega vrha, v skladu s kliničnimi skupin, definiranih za analizo. Nato smo uporabili Mann-Whitney p-vrednosti in najvišje intenzivnosti kot cutoffs izberite podskupino funkcij (vrhov) za uporabo v strojnega učenja poskusih. Intenzivnost Kritična ni filtriranje vzorcev, v katerih so imeli vsaj eno povprečno branje intenzivnost nad cutoff za vrh testiran. Filter vrednosti bila optimizirana za najboljše rezultate v razvrščevalce osnovi SVM (ki ga proizvaja LIBSVM, linearno jedro) po desetkratno navzkrižno validacijo dveh korakih protokola. Prvi korak je opredeljeno iskanja obsege in intervale, tako za filtre in ponavljanjem čez vse kombinacije. Potem, drugi korak izbrano kombinacijo vrednosti, ki so določene najboljše rezultate in najmanjše število funkcij. (3) korak normalizacija je bil dodan nadzor za navzkrižno vzorec in cross-preizkusnih pristranskosti. Za primerjavo in izbiro funkcij, ki kažejo podobne trende v obeh virov Sera virov pa je cross-source normalizacija intenzivnosti izvaja z uporabo funkcije R "kvantil" opredeliti 9 pragovi X 1 Dodatne metode bioinformatika so na voljo v S1 datotek. , ki temelji na imunske trgovina in klinične teste za različnih apolipoproteinov Apoc-III in apoB 100-vrednosti so bile izmerjene z Immunoturbidometry na Olympus 400 avtoanalizerju, z uporabo K testom komplete (cat # KAI-006 in 6142, Kamiya biomedicinskih, Seattle, WA, ZDA) z kot je opisano predhodno [22]. V hiši je ELISA za Apoc-III je opisano v S1 datotek. Ravni Apoc-I smo testirali z uporabo AssayMax Human Apolipoprotein C-I ELISA kit (Assaypro, St Charles, MO, ZDA) v skladu z navodili proizvajalca. Očiščene človekovih standardi Apoc-I so bile vključene v kompletu. Uporaba metode, ki temelji-MS se opredelijo v serumu peptidov podpis za raka na želodcu Prejšnje študije so pokazale, da dobro -designed in skrbno nadzorovanih sera peptidomics mogoče ločiti posebne bolnike z rakom, ki nosijo in kontrole nerakave temelji na značilnih vzorcih podpisa peptidov v serumu [10], [11]. Ugotavljali smo, ali se ti rezultati lahko reproducirajo za raka na želodcu in ali je taka ločitev zadostuje za analizo serumov iz različnih virov. Prvi smo analizirali profile serum Peptid 62 bolnikov z rakom na želodcu na različnih stopnjah, kot tudi 41 kontrolnega serumov zdravih prostovoljcih. Navedeni serumi so bili pridobljeni iz dveh virov: (i) RNTech, podjetje, ki zbrane serumov v Bukarešti v Romuniji; in (ii) Asterand, podjetje, ki se zbirajo serume v ZDA. Za vsak vir, sta bila sera zbrani z uporabo enotnega standarda klinični protokol. Protokoli so bile primerljive npr vrsto cevi, čas strjevanja in začetno zamrznitev serumov (glej metode), vendar cevi umika krvi so bili različni. Starostna porazdelitev, spol in klinične značilnosti 103 posameznikov, vključenih v tej študiji, so navedene v tabeli 1 in podrobneje S1 datotek v. Povzetek kliničnih fazah želodca, raka izhaja serumov za oba vira je podan v tabeli 1. ravnanje Vzorec je bil po začetni zbiranje enotna, vključuje 2 zamrznjeni odjuge ciklov doseči začetno shranjevanje in poznejše alikvotiranje za ekstrakcijo peptidov in analizo MS. Vse 103 vzorcev seruma smo obdelali ročno, vendar enako zaposlujejo enostopenjsko ekstrakcijo reverzno fazo. Sera vzorce in vzorčne ponovitve so bili obdelani in naključno brati na različne datume za preprečevanje pripravljalno datum povezan pristranskosti. Vse priprave serumi in nanašanje je potekala po istem posamezniku. Podobno so bili vsi MALDI odčitke izvede isti tehnik. Občutljivost MALDI-TOF tehtnice je spremljal redno in stalno umerjen v vseh obravnavah. Analiza temelji MS sera peptidome pokazala 9-peptida podpis, ki razlikuje bolnikov želodec adenokarcinom z rakom prostih nadzora Skupaj 637 množičnih vrhov (funkcij), so bile ugotovljene v 103 preučevanih vzorcih. Rezultati MALDI smo pretvorili v matrico, ki vsebuje intenzivnosti signalov iz 637 masnih vrhov (oprema) za vsako od proučevanih vzorcev seruma s ponovitvami za vsak vzorec (glej metode, bioinformatiko). Medtem ko je nenadzorovana hierarhično grozdenje uporabo vseh funkcij ni ločiti raka in nerakave vzorcev, PCA analizo vseh funkcij za vsak vir sera diferenciranega med rakom in vzorcev nerakave (Številke S1-S3). Ta je predlagal, da je funkcija za filtriranje in izbor bistveno pred zaposlitvijo strojno učenje razvrstitev. Zato smo (i) uporabila funkcijo filtracijo in selekcijsko stopnjo in (ii) zaposleni Mann-Whitney p-vrednosti in najvišje intenzivnosti kot Cutoffs izberite podskupino funkcij (vrhov) za uporabo v strojnega učenja poskusih. (Glej metode, bioinformatika). Nato smo analizirali v okviru posameznega vira (RNTech in Asterand), ali bi se lahko serumi bolnikov in kontrol segregirane. Prejeli smo dobre rezultate za vsako od enega samega vira razvrščevalce sredstev; razvrščevalniki osnovi SVM za RNTech in Asterand imelo 90,0% in 93,0% predvidene natančnosti, oziroma, v skladu z desetkratno navzkrižnega preverjanja niza usposabljanja (tabela 2A). Naključni prelaganje članov skupine za posledico veliko višje p-vrednosti (npr 0,8) in nizko napovedano natančnosti pri usposobljenih modelov na vsak vir sera. To je pokazalo pomen kliničnih pogojih za razvrstitev v dve klinično opredeljenih skupin znotraj vsakega vira sera. Vendar pa single-source razvrščevalniki ni dobro opraviti na vzorcih po izvoru iz drugih je, napovedujejo pravilno klinično stanje le pri 35/60 vzorcev (Asterand na RNTech) in 25/43 (RNTech na Asterand) (tabela 2A). Zato, vir pristranskost peptidome ima pomemben vpliv na točnost napovedi. Nezmožnost modelov usposobljenih od enega vira, da se ustrezno napovedati klinične pogoje iz odčitkov iz drugega vira (tabela 2A) je bolje predstavljena pri preverjanju ki se po razvrščevalce vira specifične (tabela 3) izbrane funkcije. Nekatere lastnosti, ki so dobro delali na en vir je pokazala nasprotno gibanje na drugega vira. Drugi so bili pomembni za razvrstitev v enega vira, vendar je bilo malo ali nič učinka na drugi strani. Te ugotovitve nas je pripeljala do primerjalne analize podatkov iz obeh virov. Izdelali smo box parcel za vse največje intenzivnosti, v skladu s kliničnimi skupinami. Te parcele so pokazali, da pri primerjavi intenzivnosti nadzora in raka za vsako funkcijo v viru, lahko trend opaziti razlikujejo med dvema virov (npr m /z 1520, slika 1A). Tudi ko je bil trend obstojne v obeh virov, bi lahko vrednosti intenzitete drugačna (npr m /z 6431; RNTech višja od Asterand, slika 1B). Da bi ustvarili model predvidevanja, smo morali (i) zavržkov vir specifične pojavov, in (ii) doda še normalizacije korak, ki bi zmanjšali vpliv različnih stopenj intenzivnosti, kjer se je ohranila trend. uporabo mešanega CCD z Mann-Whitney p-mejna vrednost za izbiro funkcij lahko zavržemo pojavov vir specifične. Vrhovi, ki kažejo različne trende v različnih virov, ne bi bilo pomembno, v mešani sklop za ločevanje klinični določeni skupini; Funkcija 1520 manifestirajo nasproten trend med viri, je bil izbran glede na vsako posamezno vira razvrščanje (Slika 1A, tabela 3). Zato je prispevalo k pomanjkanju uspešno izvajanje vsakega posameznega vira razvrščanje na drugega vira (tabela 2A). Kot je bilo pričakovati, ta funkcija ni bil izbran noben model, ki temelji na mešanem nizu. Ustvarili smo mešani podatkovnega niza ter hkrati naključno odstranili 21 vzorcev raka želodca iz mešanega nabora usposabljanja in uporabljati teh 21 vzete vzorce za potrjevanje. Poleg tega smo uporabili 12 rakavih brez kontrolnih vzorcev, zbranih v našem laboratoriju kot samostojni sklop nadzor potrjevanja. Model je bil izbran v skladu z največ predvidoma natančnost v skladu z desetkratno potrditvi križni, kot prej. Najboljši sedaj model za mešani sklop je s pomočjo 9 funkcij (Mann-Whitney p-vrednost filtra 0,044) in je predvideno natančnost 84,1% glede na desetkratno navzkrižnega preverjanja niza usposabljanja. Pomembno je, da natančno napovedati 10/12 izraelske kontrole. Vendar pa ta klasifikator napovedal neustrezno (13 od 21) 21 odstranjenih mešani želodčne vzorci raka, ki se uporabljajo za potrjevanje. Zato, da se zmanjša učinek razlik, povezanih z izvornimi v meje intenzivnosti, je bila uspešnost filtra pri izbiri funkcij okrepljena z uvedbo kvantil korak normalizacije. To normalizacija bila izvedena v skladu s kontrolo vsakega seruma vira, neodvisno od drugih virov (glej metode, bioinformatiko). Za funkcije, kot je m /z 6431 z vztrajno trend v obeh virov, ta korak popravljena intenzivnosti pristranskosti (slika 1D). Dejansko, 6431 funkcija ni bila izbrana za nepremoženjsko normalizirane, ki temelji na mix klasifikatorja. Vendar pa je bila izbrana za normirane temelji na kombinacije razvrščanje (tabela 3). Vendar, za funkcije, kot m /z 1520 z nasprotnimi trendi v obeh virov, ta korak ni mogel spremeniti trend, kot je bilo pričakovano (slika 1C). smo testirali učinek na kvantil normalizacije je z njegovo uporabo pred povprečjem in izbira funkcijo. Za boljšo oceno natančnosti predvidevanja smo uporabili ukrep Matthews koeficient korelacije (MCC). MCC se uporablja v strojnega učenja kot merilo kakovosti binarnih (dva razreda) razvrstitev in vrne vrednost med -1 in +1. Koeficient +1 predstavlja odlično napoved, 0 povprečno naključno predvidevanja in -1 obratno napoved. MCC na splošno velja kot uravnotežen ukrep, ki se lahko uporablja tudi, če so razredi različnih velikosti. Tako smo izračunali MCC za različne poskuse razvrščanja, da se pokaže učinek, ki ga je imela normalizacija o razvrščanju. Rezultati so prikazani v tabeli 2. Upoštevajte, da je brez normalizacije MCC relativno visoka niza usposabljanje ni pokazala povprečen uspešnost v nizu potrjevanja (tabela 2). Korak normalizacija dala podobne visoke vrednosti MCC za usposabljanje in sklopov za potrjevanje (tabela 2). Korak normalizacija za nadzor navzkrižne vir pristranskosti ni razveljavilo potrebo strojno učenje klasifikatorja se opredeli diskriminacijskih vzorec; PCA iz dveh virov mešanih normiranih naborov podatkov ponovno povzročilo slabo ločevanje med rakom želodca in kontrolnih vzorcev (Slika S4). klasifikator izhaja iz mešanega nabora podatkov, po kvantil korak normalizacije, zaposlen 9 funkcij (tabela 2). Tri od 9 funkcij, vključenih apolipoproteinov: Apoc-III (funkcija 9443) in Apoc-I (funkcije 6431 in 6629, tabela 3). Da bi še dodatno preverijo rezultate, ki temeljijo na MALDI, smo najprej razvili test ELISA za kvalitativno odkrivanje Apoc-III v serumu (glej metode) in testirali vse vzorce sera iz Asterand in RNTech. Rezultati ELISA sledila trendu MALDI rezultatov (slika 2A, B); Intenzivnost Apoc-III je bila bistveno višja v kontrolni skupini v primerjavi z rakom skupin v obeh virov sera. Nadaljevali smo testirali korelacijo med Apoc-III ELISA in 9443 MALDI rezultatov na vsakem vzorcu; ELISA in MALDI Rezultati so pokazali pomembno povezanost (p < 0,0001, Kendall je tekel korelacija tau). Nato smo poslali sera alikvotov iz skoraj vseh vzorcih (enako zamrznitev državnih) na zunanji kliničnem laboratoriju, ki temelji na immunoturbidity kvantitativnega testa za Apoc-III [22]. Rezultati so bili pridobljeni v mg /dl (slika 2C), kot je navedeno zgoraj, je bila količina Apoc-III bistveno višja v kontrolni skupini obeh virov sera. Da bi preverili rezultate Apoc-I MALDI, smo uporabili komercialno kvantitativni test ELISA kit, ki vključuje standarde Apoc-I in prepozna oba 6431 in 6629 variant Apoc-I. Rezultati so bili pridobljeni v g /ml (slika 3B) in sledi vzorcu, povzete po MALDI rezultatov (sliki 1D in 3a); Intenzivnost Apoc-I je bila bistveno višja v kontrolni skupini v primerjavi z rakom skupin v obeh virov sera. Za oceno specifičnost Apoc-I in zmanjšanje Apoc-III v serumih bolnikov rak nosijo želodcu, smo testirali apoB-100 ravni. Vzorce testiramo za Apoc-III v zunanjem kliničnem laboratoriju smo testirali vzporedno apoB-100 uporabo stopenj, ki temeljijo na immunoturbidity kvantitativni test. Rezultati so bili pridobljeni v mg /dl (slika 3C) in ni pokazala pomembnega trend med kontrolnimi in želodca skupin raka nosijo. Zato bi lahko izkoristijo ApoB-100 rezultatov kot normalizacijo dejavnik za analizo bioinformatika količinskih Apoc-I in Apoc-III rezultatov (sliki 3C, 3B, 2C, v tem zaporedju). smo analizirali klinično Apoc-I, Apoc-III in apoB-100 za dodatnih vzorcev bolnikov z rakom želodca in kontrole rakom brez (RNTech vir, isti zamrzovanjem stanju, vključno z 10 gastritis bolnikov kontrol rakom brez opomba Tabela 1 za skupno vzorcev številke). Analizirali smo tudi klinično raven CA19-9 in CRP za vse vzorce (enako freeze-state). Nato smo zaposleni Clementine 10.0 programske opreme na vzorcih RNTech za oceno, ali je treba pravila, določena na podlagi apoB-100-normalizirani CI in C-III, CA19-9 in CRP v serumu lahko uporabljajo za razvrstitev med serumov nadzora in raka želodca skupin RNTech vir kot vir za usposabljanje. Kombinacija vseh 4 parametrov dobimo večjo natančnost predvidevanja v primerjavi s kombinacijo manj kot 4 parametrov (slika 4 in podatki niso prikazani). Napoved natančnost seriji za učenje je bilo 88,4%. Uporabili smo RNTech-dobljenih pravil, določenih za vir in napovedovanje natančnost Asterand je bila 74,4% (slika 4). Za tako usposabljanje in potrjevanje je občutljivost odlično (87/90 kombinirana), vendar je specifičnost je manj natančna (37/52 kombinirani). V zadnjih letih je kar nekaj poročil, ki opisujejo MS-identificirane seruma biomarkerjev /podpisi pri rakavih držav so bile ovržene [5], [18]. Različni viri pristranskosti so bili opisani tudi izbor vzorca, ravnanje, obdelava, branje in analizo [18], [20], [21]. Po odstranitvi-pristranskosti prispevajo dejavniki, se je izkazalo, da SELDI-TOF MS cel serum proteomskimi profiliranje z IMAC površino ni zanesljivo odkrivanje raka na prostati [23]. Zato so avtorji ugotovili, da je malo verjetno, da bi pristop masne spektrometrije uporabo nepredelane serum razlikovanje med moškimi in brez raka prostate [24]. Po drugi strani pa druge nedavne študije, ki temeljijo na MALDI-TOF da izogniti, pristranskosti dejavniki, ki prispevajo in zaposleni v enem koraku postopka obdelave sera ugotovljeno diskriminacijo biomarkerjev podpise za različne vrste raka, vključno z rakom na prostati [11]. V tem študija smo sprejeli pristop obdelave sera en korak za identifikacijo podpis, ki temelji na peptidome razlikovati serume, pridobljene od bolnikov želodec adenokarcinom. Naredili smo razumno, da bi se izognili prej poročali o pristranskosti prispevajo dejavniki [18]. Analizirali smo serume iz dveh biorepositories. Opazili smo, da tudi če se ravnanje sera, obdelava, MALDI branje in analiza enako, je analiza peptidome izkrivljeni zaradi biorepository. Poleg družbeno-geografske razlike (Romunija in ZDA kot vir za vzorce v RNTech in Asterand oz), lahko pristranskost v zvezi z izvorno biti zaradi znamko odstopnega krvi cevi, ki se uporabljajo v različnih biorepositories. smo nato uporabili mešan nabor vzorcev iz dveh sera virov za izbiro funkcij in dodal navzkrižno vir normalizacije korak za nadomestitev vir pristranskosti. Ugotovili smo, da (i) z uporabo mešanega CCD z Mann-Whitney p-mejna vrednost za izbiro funkcij lahko zavržete funkcije vir specifične, in (ii) kvantil normalizacija korak pomaga izbrati (za strojno učenje), delno skladnih lastnosti , v katerem so trendi, ki je usklajen med viri, ampak nivoji jakosti se razlikujejo med viri. Potreba po normalizaciji, ko se ukvarjajo z vzorci iz različnih virov, se je že pokazala za temelji na mikromrež visoko pretočne tehnologije [25]. Znano je, da spremembe v eksperimentalnih postopkov in nekontroliranih pogojih (na primer socialno-geografski izvor vzorcev), lahko pripelje do sistemskih meritev odstopanj. Po spremembah, smo vzpostavili navzkrižno vir serum peptida podpis za razlikovanje želodec bolnikov z rakom iz nadzora nerakave. Tri od peptidov sovpadala Apoc-I in Apoc-III. potrjen sva temelji na MALDI rezultatov z neodvisnimi analiznih metod, ki temeljijo na imunski [26]. Podpis peptid vključena Apoc-III in Apoc-I-pridobljene funkcije. Rezultati neodvisne kvantifikacijo njihovih serumskih koncentracij sledila trendu identificiran s pristopom MS. Naša študija je prvi poročal, da so vrednosti v serumu Apoc-I in Apoc-III se lahko uporablja kot potencialnih biomarkerjev za želodec rak. Res je, da so nedavna poročila je navedeno, da bi bila raven apolipoproteinov "v krvi potencialnih biomarkerjev za različne vrste raka. Apoc-I je bila identificirana kot potencialno serumu biomarker za kolorektalnim rakom, hormonsko neodzivnih raka prostate in fibrozo jeter [27] - [29]. Druga poročila je navedeno, da bi bilo Apoc-III tudi potencial biomarkerjev pri raku trebušne slinavke in raka dojke [30], [31]. Vendar pa vse od teh poročil zaposlenih pregled temelji MALDI in pa njihove rezultate ni preverjanja, ki temelji na imunsko ali drugih testih. Niti niso študij serume iz drugega vira kot skupina validacije. Naše ugotovitve bi bilo treba dodatno porabila in potrjene, kot je opisano v [32], [33]. Vendar pa je klinična validacija Apoc-I in Apoc-III rezultate od nas zahtevate, da dodatno preuči diagnostični test, ki temelji na serumskih biomarkerjev, ki se lahko preizkusimo v kliniki, brez potrebe po MS tehnologije. Pravila, določena z uporabo apoB-100-normalizirano C-I in C-III, CA19-9 in CRP kvantitativne ravni v serumu, ustvarjeni za vir RNTech in potrjene na neodvisen vir Asterand imel natančnost predvidevanja za 88,4% in 74,4%, oz. Zato je uporaba teh 4 kliničnih znakov delno premaga vir pristranskosti.
[10], [11]. So poročali o 61 podpisov peptide, ki bi lahko razlikujejo zdravih posameznikov iz 3 različnih vrst rakavih bolnikov. Pri čemer so vsi ti peptidov in /ali njihovih fragmentov običajno najdemo v serumu so opazili razlike v količini med zdravih in prizadetih posameznikov. Čeprav ti rezultati kažejo na potencial, ki ga imajo peptidome profili za diagnozo raka, je še vedno, da se prikaže, da se ta pristop lahko podaljša za odkrivanje biomarkerjev primerne za zgodnje diagnosticiranje in dosledno spremljanje. Najprej je sposobnost teh sera peptidnih biomarkerjev za razlikovanje bolnikov iz nadzora predvsem dokazali pri bolnikih z zelo napredovali ali metastatski tumorji. Poleg tega je bila izpodbijana trdnost teh biomarkerjev; nekontrolirane spremenljivke, predvsem pripisati razlike v ravnanju z vzorcem, obdelavo protokolov in analizo podatkov, se je izkazalo, da bistveno spremeni rezultate teh testov [11] - [19]. Z dajanje velik poudarek na pridobivanju vzorcev, ravnanje, predelava, MS obdelava signalov in statistično analizo je mogoče doseči bolj zanesljive in ponovljive rezultate [18] [20] [21].
Serum za obdelavo vzorcev in priprava za MS- MALDI branje
Analiza podatkov o MALDI Rezultati
[21]. V drugem koraku, je strojno učenje uporabili za opredelitev diskriminacijskih vzorec, ki ga je mogoče uporabiti za razvrstitev bolnikov. Za ta namen, po postopku opisanem v Villanueva sod
[21] je bil spremenjen, kot je opisano spodaj. Spremenjeni cevovod v celoti odvisen odprtokodne programske opreme in dodatne podrobnosti so opisane v poglavju bioinformatika v S1 datotek.
. 9
da razdeliti pomanjšana vrednosti v kontrolnem razredu v 10 kvantilov.
Rezultati
potrjevanja, ki temelji na imunski za funkcije, ki predstavljajo Apoc-I in Apoc-III
Pogovor
 Danka
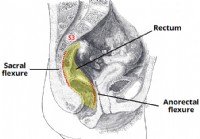
1 Anatomska struktura 2 Anatomska razmerja 2.1 Sprednji del 2.2 Zadaj 3 Nevrovaskularna oskrba 4 Limfna drenaža 5 Klinični pomen – Digitalni rektalni pregled Danka je najbolj distalni segment debe
Danka
1 Anatomska struktura 2 Anatomska razmerja 2.1 Sprednji del 2.2 Zadaj 3 Nevrovaskularna oskrba 4 Limfna drenaža 5 Klinični pomen – Digitalni rektalni pregled Danka je najbolj distalni segment debe
 Ektopična nosečnost (tubalna nosečnost)
Izvenmaternična nosečnost je znana tudi kot jajcevodna nosečnost, saj se pogosto pojavlja v jajcevodih. Kaj moram vedeti o zunajmaternični nosečnosti? Kaj je zunajmaternična nosečnost? Izvenmaterničn
Ektopična nosečnost (tubalna nosečnost)
Izvenmaternična nosečnost je znana tudi kot jajcevodna nosečnost, saj se pogosto pojavlja v jajcevodih. Kaj moram vedeti o zunajmaternični nosečnosti? Kaj je zunajmaternična nosečnost? Izvenmaterničn
 Kaj povzroči, da ima oseba vrečko za kolostomo?
Kaj je kolostomija? Kolostomija je operacija, pri kateri se naredi odprtina iz debelega črevesa navzven skozi trebuh, ki omogoča prehod blata skozi trebuh, namesto da bi prešel skozi črevesje in da
Kaj povzroči, da ima oseba vrečko za kolostomo?
Kaj je kolostomija? Kolostomija je operacija, pri kateri se naredi odprtina iz debelega črevesa navzven skozi trebuh, ki omogoča prehod blata skozi trebuh, namesto da bi prešel skozi črevesje in da