Kræft er en sygdom, der skyldes mutationer i generne i organismen, der påvirkes af det. Disse mutationer resulterer i dysregulering af de involverede celler, slukke programmer, der modulerer cellevækst og spredning, eller som danner tumorer.
Imidlertid, alle menneskelige kræftformer skyldes ikke mutationer i det menneskelige genom alene. For eksempel, kræft i bugspytkirtlen er oftest vært for mikrober, der nedbryder de mest almindeligt anvendte kemoterapilægemidler hos disse patienter, som det fremgår af en undersøgelse fra 2017 i tidsskriftet Science. Dette fik forskeren Gregory Poore til at forfølge mikrobernes rolle i forskellige kræftformer.
Samarbejde med eksperter på tværs af forskellige discipliner, forskerne udforskede de flerlagsinteraktioner, der opstår mellem tumorer og den mængde mikrober, der lever på og i menneskekroppen. Seniorforsker Rob Knight sagde, "Næsten alle tidligere kræftforskningsindsatser har antaget, at tumorer er sterile miljøer og ignorerede det komplekse samspil, humane kræftceller kan have med bakterierne, vira og andre mikrober, der lever i og på vores kroppe. Antallet af mikrobielle gener i vores kroppe er langt større end antallet af menneskelige gener, så det burde ikke være overraskende, at de giver os vigtige spor til vores helbred. "
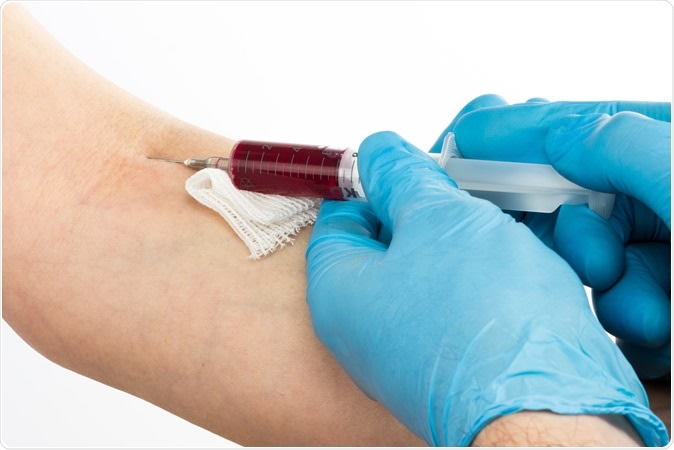 At opdage kræft på de tidligste stadier ud fra en simpel blodudtagning er målet for flere virksomheder, der i øjeblikket udvikler 'flydende biopsier' til at opdage cirkulerende humant tumor -DNA. Nu har UC San Diego -forskere demonstreret, at de kan afgøre, hvem der har kræft, og hvilken type, baseret på en aflæsning af mikrobielt DNA fundet i deres blod. Billedkredit:Szabolcs Borbely / Shutterstock
At opdage kræft på de tidligste stadier ud fra en simpel blodudtagning er målet for flere virksomheder, der i øjeblikket udvikler 'flydende biopsier' til at opdage cirkulerende humant tumor -DNA. Nu har UC San Diego -forskere demonstreret, at de kan afgøre, hvem der har kræft, og hvilken type, baseret på en aflæsning af mikrobielt DNA fundet i deres blod. Billedkredit:Szabolcs Borbely / Shutterstock Det første trin var at undersøge dataene om mikrobielle gener, der er gemt i The Cancer Genome Atlas, som er en massiv database med tumorassocierede genomiske data indsamlet fra tusinder af tumorer og vedligeholdt af National Cancer Institute. Forskerne siger, at deres er første gang, forskere har forsøgt at identificere mikrobielt DNA fra humane genomiske data i en så imponerende skala.
De undersøgte over 18, 000 prøver af humane tumorer taget fra næsten 10, 500 patienter med 33 forskellige typer tumorer. De forsøgte at finde karakteristiske mønstre af mikrobielle gener forbundet med specifikke tumorer. Nogle kendes allerede, såsom koblingen mellem HPV (humant papillomavirus) og kræft i livmoderhalsen, hoved, og hals, eller den af Fusobacterium arter med kræft i tarmen.
Forskerne fandt også mange nye mikrobielle mønstre, som var i stand til at skelne en kræftform fra en anden. Et eksempel er det af Faecalibacterium , en art, der kan udvælge tyktarmskræft fra andre tumortyper.
Forskerne nåede således til en forståelse af, hvordan mikrobiomet for tusindvis af kræftprøver ser ud. Det næste trin var at bruge kraften i maskinlæring til at se, om nogle af disse mikrobielle mønstre var specifikke for kræft af visse typer. De uddannede deres maskinlæringsprogrammer til at samle sådanne specifikke associationer og bruge dem til at diagnosticere kræftformen. De testede derefter deres hundredvis af modeller og fandt, til deres tilfredshed, at de udelukkende kunne identificere den type kræft, der er baseret på det mikrobielle DNA i blodet.
Det næste trin, for forskerne, skulle fjerne avancerede kræftformer fra datasættet. Programmet var stadig i stand til at skelne mellem mange former for kræft i trin I og II kun baseret på mikrobielle data. Forskerne udførte derefter strenge procedurer til dekontaminering af bioinformatikdata, hvilket betyder, at over 90% af mikrobielle data blev fjernet. Ikke desto mindre, maskinen identificerede korrekt mange tidlige kræftformer efter type.
I et pilotstudie, forskerteamet tog blodprøver fra omkring 100 patienter med tre typer kræft, herunder cirka 60, 25, og 15 patienter, hver med prostata, lunge, og melanomkræft. De brugte deres specialfremstillede værktøjer til at sikre, at dataene var så pålidelige som muligt ved at fjerne kontaminerende aflæsninger. De tog derefter aflæsninger af den mikrobielle profil for hver af blodprøverne.
Sammenligning af disse profiler med hinanden og med plasmaprøver taget fra omkring 70 sygdomsfrie frivillige, teamet fandt ud af, at deres machine learning -modeller kunne differentiere mennesker med kræft fra dem uden det, i de fleste tilfælde. Det er, de kunne opfange 86% af mennesker med lungekræft, mens de udelukkede lungesygdomme korrekt hos alle individer, der var negative for denne tilstand. De kunne også skelne mellem hver af de kræftformer. For eksempel, de kunne med rette i 81% af tilfældene fortælle, om patienten havde lungekræft eller prostatakræft.
Medforfatter Sandip Pravin Patel siger, "Evnen, i et enkelt blodrør, at have en omfattende profil af tumorens DNA (natur) samt DNA'et i patientens mikrobiota (pleje), så at sige, er et vigtigt skridt fremad i en bedre forståelse af vært-miljø-interaktioner i kræft. "Han forklarer, at det er muligt at bruge denne tilgang til at holde styr på, hvordan tumoren og mikrobiota ændrer sig med tiden, dermed bruges det som ikke bare et diagnostisk, men et overvågningsværktøj til langsigtet opfølgning af behandlingens effektivitet.
Han fortsætter, "Dette kan have store konsekvenser for plejen af kræftpatienter, og i den tidlige opdagelse af kræft, hvis disse resultater fortsat holder i yderligere test. "
Patel forklarer, at de fleste kræftformer i dag kun kan diagnosticeres ved kirurgisk biopsi, som indebærer at fjerne et stykke af den formodede tumor og få det undersøgt af eksperter. Diagnosen er baseret på de molekylære markører, der er specifikke for hver type kræft. Problemet med denne tilgang er, at den er invasiv, tager tid, og er dyrt.
For nylig, flydende biopsier er blevet udviklet til mange af disse kræftformer. Her bruges en blodprøve til at detektere specifikke mutationer i humant DNA fundet i omløb til diagnosticering af specifikke tumorer. Mens blodmarkører (for det meste molekyler fundet på overfladen af tumorceller) allerede bruges til at diagnosticere og overvåge forløbet af nogle tumorer, genetiske markører er relativt nye. De bruges i nogle tumorer til at spore sygdomsforløbet, men deres anvendelse til tumordiagnose er ikke godkendt af Food and Drug Administration (FDA).
Årsagen er den dårlige nøjagtighed af disse test med hensyn til at skelne mellem normale variationer i menneskelige gener og den sande tilstedeværelse af mutationer i tidlig kræft. Ikke kun det, siger Patel, "de kan ikke opfange kræftformer, hvor menneskelige genomiske ændringer ikke kendes eller ikke kan påvises."
Det betyder, at flydende biopsier sandsynligvis vil have en høj grad af falske negativer, især for sjældne tumorer. Hvis mutationshastigheden er lav, og antallet af skurceller er også lavt, chancerne for at opfange mutationen er faktisk få. Dermed, patienten kan godt blive fortalt, at der ikke er tegn på kræft på trods af tilstedeværelsen af en tumor.
Den aktuelle test, der er baseret på påvisning af mikrobielt DNA frem for tumor -DNA, er, at det afspejler mere mærkbare ændringer, fordi, i modsætning til ensartethed af menneskeligt DNA på tværs af alle væv i menneskekroppen, mikrobielle DNA -profiler varierer enormt fra væv til væv. Dermed, snarere end at håbe på at opfange en af de relativt sjældne ændringer i menneskeligt DNA for at diagnosticere en tumor, det er lettere at opfange ændringer i det mikrobielle DNA, der nøjagtigt kan afspejle tilstedeværelsen af kræft og deres type, tidligere i processen med tumordannelse, sammenlignet med flydende biopsier, i hvert fald på deres nuværende stadium. Dette gælder også om kræft, der ikke har genetiske mutationer, der i øjeblikket kan påvises ved hjælp af flydende biopsier.
Den nuværende platform returnerer muligvis stadig falske negativer, siger forskerne, men de forfiner deres tilgang med flere data for at øge forudsigelsens nøjagtighed. En anden fare ved denne tilgang er overdiagnosticering af tumorer eller en høj falsk-positiv rate.
Og for det tredje, mange mutationer er ikke kræftfremkaldende, men er relateret til alder eller er af den type, der løser sig spontant. Faktisk, uden den mikrobielle DNA -test, den enkelte ville slet ikke vide om dem. Selv nogle tidlige kræftformer er ikke virkelig fortjent til behandling. Som resultat, det er vigtigt at huske, at screening og diagnosticering af kræft tidligt ikke altid er påkrævet. Behovet for sådanne procedurer bør afgøres af en kliniker.
Positive mikrobielle aflæsninger bør heller ikke betragtes som kræft, medmindre der foretages yderligere tests for at bekræfte, at en tumor er til stede, bestemme dens type og placering.
Teamet ser frem til at udvikle en FDA-godkendt test til diagnosticering af kræft.
For at opnå dette, de skal profilere de 'normale' mikrobielle mønstre blandt raske mennesker i mange forskellige befolkningsgrupper. For det andet, de skal afgøre, om de mikrobielle signaturer, der findes i dødt blod, afspejler tilstedeværelsen af døde, Direkte, eller åbne mikrober. Dette er vigtigt for at udvikle en mere præcis tilgang.
De foreløbige fund skal valideres i en større population med en langt større variation af patienter, hvilket indebærer en forhåndsomkostning med høje omkostninger. For at hjælpe med at nå deres mål, teamet har indgivet patentansøgninger og startet et firma ved navn Micronoma.
Forskerne påpeger, at selvom mikrobiologer normalt bruger dekontamineringsprotokoller i deres arbejde, det er ikke en hyppig praksis i kræftstudier. De håber, at denne undersøgelse vil ændre vægten inden for kræftbiologi, ved at gøre kræftforskere mere bevidste om mikroberne i menneskekroppen.
For det andet, det kan hjælpe med at skubbe det nye felt af kræftassocierede blodmikrobiomer frem til terapeutiske midler, hjælper med at forstå, hvad mikroberne gør ved kræft, og om de kan bruges til at behandle disse tilstande. Og hvis ja, det næste spørgsmål er, om de kan leveres eller efterlignes for at behandle kræft mere vellykket.
 COVID-19:Ser stadig patienter, men begrænser kapaciteten
COVID-19:Ser stadig patienter, men begrænser kapaciteten
 Hvad er den forventede levetid for en person med colitis ulcerosa?
Hvad er den forventede levetid for en person med colitis ulcerosa?
 Vegetariske proteinkilder på lavFODMAP-diæten
Vegetariske proteinkilder på lavFODMAP-diæten
 Skal din hund også tage probiotika?
Skal din hund også tage probiotika?
 Dækket perforering af et perforeret ulcus - Diagnose af akut abdomen
Dækket perforering af et perforeret ulcus - Diagnose af akut abdomen
 Fire ting, der forårsager mavesmerter | Arshad Malik, MD
Fire ting, der forårsager mavesmerter | Arshad Malik, MD
 SIBO fra et mandligt perspektiv
Vi har alle meget forskellige SIBO-historier, og at dele dem kan hjælpe med at styrke os på vores rejse. I denne uge får vi selskab af gæsteblogger Josh Sabourin fra SIBO Survivor. Josh slutter sig ti
SIBO fra et mandligt perspektiv
Vi har alle meget forskellige SIBO-historier, og at dele dem kan hjælpe med at styrke os på vores rejse. I denne uge får vi selskab af gæsteblogger Josh Sabourin fra SIBO Survivor. Josh slutter sig ti
 Ciguateraforgiftning
Ciguatera-forgiftningscenter Tag Pancreatitis-quizzen Forøg fordøjelsessundheden Diashow med fordøjelsesbesvær:Problemfødevarer, der skal undgås Patientkommentarer:Ciguatera-forgiftning - oplevelse Pa
Ciguateraforgiftning
Ciguatera-forgiftningscenter Tag Pancreatitis-quizzen Forøg fordøjelsessundheden Diashow med fordøjelsesbesvær:Problemfødevarer, der skal undgås Patientkommentarer:Ciguatera-forgiftning - oplevelse Pa
 Sådan sætter du vellykkede SIBO-nytårsforsætter
I starten af hvert nyt år sætter folk over hele verden beslutninger for det kommende år. Alligevel har mange mennesker givet op i den tredje uge af januar. Ved udgangen af februar er de fleste men
Sådan sætter du vellykkede SIBO-nytårsforsætter
I starten af hvert nyt år sætter folk over hele verden beslutninger for det kommende år. Alligevel har mange mennesker givet op i den tredje uge af januar. Ved udgangen af februar er de fleste men