Langsigtet opfølgning og retrospektiv undersøgelse af 533 gastriske kræfttilfælde
Abstract
Baggrund
mavekræft (GC) er den tredje hyppigste årsag til kræft dødsfald i Kina og resultaterne af GC patienter er dårlig. Formålet med forskningen er at undersøge de prognostiske faktorer af mavekræft patienter, som havde helbredende hensigt eller palliativ resektion, afsluttet klinisk database og opfølgning.
Metoder
Denne retrospektiv undersøgelse analyseret 533 GC patienter fra tre videregående henvisning undervisning hospitaler fra januar 2004 og december 2010, som havde helbredende hensigt eller palliativ resektion, komplet klinisk database og opfølgning oplysninger. GC-specifikke samlet overlevelse (OS) status blev bestemt af Kaplan-Meier-metoden, og blev gennemført univariat analyse for at identificere mulige faktorer for overlevelse. Multivariat analyse ved hjælp af Cox proportional hazard model og en fremadrettet regression procedure blev udført for at definere uafhængige prognostiske faktorer.
Resultater
Ved sidste opfølgning, median follow-up tid på 533 GC patienter var 38,6 mo (interval 6,9 til 100,9 mo), og medianen GC-specifikke OS var 25,3 mo (95% CI: 23,1-27,4 mo). De skønnede 1-, 2-, 3- og 5-årige GC-specifikke OS satser var 78,4%, 61,4%, 53,3% og 48,4%, hhv. Univariate analyse identificeret følgende prognostiske faktorer: hospital, alder, køn, kræft websted, kirurgi typen, resektion typen, andet organ resektion, HIPEC, LN status, tumor invasion, fjernmetastaser, TNM stadie, postoperativ SAE, systemisk kemoterapi og IP kemoterapi. I multivariat analyse blev syv faktorer identificeret som uafhængige prognostiske faktorer for overlevelse på lang sigt, herunder resektion type, HIPEC, LN status, tumor invasion, fjernmetastaser, postoperativ SAE og systemisk kemoterapi.
Konklusioner
Resektion type, HIPEC, postoperativ SAE og systemisk kemoterapi er fire uafhængige prognostiske faktorer, som kunne interveneret for GC patienter til forbedring af overlevelse.
Nøgleord
mavekræft GC-specifikke samlede overlevelse Prognose Multivariat analyse Klinisk patologiske faktorer Baggrund
Gastric kræft (GC) fortsat den næststørste årsag til kræft død på verdensplan [1], der tegner sig for 8% af de samlede sager og 10% af de samlede dødsfald i 2008 [2]. I Kina GC er den tredje hyppigste årsag til kræft dødsfald [3] og resultaterne af GC patienter er dårlig, især for patienter i fremskredent stadium, og 5-års overlevelse er mindre end 20% -25% [4].
tidlig diagnose og tidlig behandling forbliver den bedste strategi for GC. I Kina, men et flertal af GC patienter er ikke tidligt kræft ved det tidspunkt, hvor de søger lægehjælp [5, 6]. Derfor er kirurgi-baserede tværfaglig behandling tilgang berettiget med henblik på at forbedre både samlet overlevelse (OS) og livskvalitet.
Trods denne fornuftige viden, er der ingen almindeligt accepteret tværfaglig behandlingsstrategi i Kina, primært som følge af manglen på store database information afspejler den kliniske virkelighed af den nuværende behandling situation.
i vores tidligere undersøgelser på GC patienter, evaluerede vi de fælles tumormarkører til diagnosticering af mavekræft. I disse relativt store kohortestudier, stadium III og videre patienter tegner sig for over 65% af den samlede patientpopulation [6, 7], et resultat ligner andre rapporter fra Kina [5, 8]. For disse patienter GC er ikke længere en lokal sygdom, men mindst en regional eller en systemisk sygdom.
Øjeblikket kirurgi er stadig den mest effektive behandling for GC, tilbyder en fremragende chance (90%) af en kur for tidlig GC patienter [9]. Kirurgiske procedurer har en stor indflydelse på OS og tilbagefald [10]. R0 resektion med D2 lymphadenectomy betragtes som standard kirurgiske teknik [11, 12], som D2 lymphadenectomy havde lavere tilbagefald og GC-relaterede dødelighed [13]. Men for fase III og videre patienterne, den aktuelt vedtaget kirurgiske procedure fjerner kun lokal tumor masse, men ofte forsømmer mikro-metastaser. Derfor er yderligere adjuverende behandlinger der kræves for at sikre en bedre behandling effektivitet.
I de seneste år har vores database vokset sig større og mere detaljerede oplysninger om de store klinisk-patologiske karakteristika er blevet akkumuleret. Derfor gennemførte vi denne omfattende analyse af de indsamlede fra tre store universitetshospitaler i det centrale Kina data, så som at vinde dybere indsigt i de vigtigste funktioner i GC i det centrale Kina og identificere uafhængige faktorer for prognose, der kunne interveneret.
Metoder
Etik erklæring
Alle patienter forudsat skriftligt informeret samtykke for deres oplysninger, der skal lagres på hospitalet databasen; og vi opnåede separat samtykke til forskning. Undersøgelse godkendelse blev opnået fra uafhængige etiske udvalg fra Zhongnan Hospital i Wuhan University. Undersøgelsen blev gennemført i overensstemmelse med de etiske standarder af World Medical Association Helsinki Deklarationen.
Patienter
Denne undersøgelse omfattede i alt 533 GC patienter fra tre tertiære hospitaler, fra januar 2004 til december 2010. Disse patienter undergik resektion med helbredende hensigt (D2 lymphadenectomy) eller palliativ resektion. Alle de detaljerede klinik-patologiske oplysninger var til rådighed, herunder demografiske variabler, underliggende co-morbiditet, kirurgisk modalitet, lab og image studieinformation, patologiske rapporter, præ- og postoperative behandlingsformer og opfølgende oplysninger. Patologisk oplysninger blev hovedsagelig fokuseret på tumortype, patologiske sortering, TNM etaper, blodkar eller neurale invasioner. Den patologiske mellemstation var baseret på den 7. udgave af AJCC mellemstationer kriterier [14]. Postoperative behandlinger blev fokuseret på kemoterapi og cykler, og strålebehandling hvis relevant. GC patienter med T2 eller højere, skal eventuelle N tumorer modtager systemisk kemoterapi undtagen patienter, der afslog tilbuddet [15]. Hypertermisk intraperitoneal kemoterapi (HIPEC) og intraperitoneal kemoterapi (IP kemoterapi) var adjuverende kemoterapi, og kun dem, der havde peritoneal carcinomatose (PC) bør modtage [16]. I vores undersøgelse, den systemisk kemoterapi administreres var hovedsageligt FOLFOX4 og FOLFOX6 blev HIPEC primært bruger lobaplatin og paclitaxel, og IP kemoterapi var docetaxel og carboplatin.
Disse patienter blev fulgt op hver 3. måned i de første 2 år efter operation, hver 6. måned på tredje postoperative år og hvert år derefter. Al den opfølgende oplysninger blev indarbejdet i en standardiseret database.
Database konstruktion
Ovennævnte oplysninger blev indarbejdet i en central database, der er oprettet ved Zhongnan Hospital i Wuhan University, som undergår regelmæssig ajourføring hver 3. måned .
statistisk analyse
Alle sager støtteberettigelse fra den centrale database blev analyseret af SPSS 17,0 statistisk pakke software (SPSS Inc., Chicago, IL, USA). De variable var hospital (Zhongnan Hospital, Heji Sygehus eller Hubei Tumor Hospital), køn (mand eller kvinde), alder (≤65 år eller > 65 år), kræft hjemmeside (øverste tredjedel [ekskl pladecellekræft på gastroøsofageal krydset], midterste tredjedel, nederste tredjedel eller hele maven), patologisk type (godt eller intermediært differentieret adenocarcinom, dårligt differentieret eller udifferentieret karcinom, signetring celle karcinom eller mucious adenocarcinom eller andre), kirurgi type (proksimal gastrektomi, distal gastrektomi eller total gastrektomi), resektion type (for maven selv) (palliativ resektion eller helbredende resektion), andet organ resektion (hovedsagelig omfattede lever, milt, tarme, ovarie-, ovarie- kanaler) (0, 1, 2 eller ≥ 3), HIPEC (ja eller nej), lymfe node status (LN status) (n0, N1, N2 eller N3), tumor invasion (T1, T2, T3, T4A eller T4B), fjernmetastaser (M0 eller M1), patologisk stadium (I, II, III A, III B, IIIC eller IV) [14], postoperativ alvorlig uønsket hændelse (postoperativ SAE) (defineret som livstruende begivenheder efter drift, herunder gastrointestinal obstruktion, anastomotiske lækage, og blødning fører til grad 3 og derover anæmi, abdominal absces) (ja eller nej), systemisk kemoterapi (0, 1 til 6 cykler eller > 6 cyklusser), IP-kemoterapi (ja eller nej), GC-specifik samlet overlevelse (GC-specifikke OS, defineret som tidsperioden fra første behandling til GC-specifik død, med den sidste opfølgende tid den 31. maj, 2012) .
numeriske data blev analyseret direkte. Kategorien data blev konverteret efter behov. Kaplan-Meier overlevelse kurve blev anvendt til at undersøge overlevelsen status, ved anvendelse log rank test for at dechifrere den statistiske signifikans, der blev bedømt som P
< 0.05 i hele denne undersøgelse.
At arbejde uafhængige faktorer for overlevelse, blev en Cox proportional hazard model, der anvendes til først opnå de mulige faktorer og derefter bruges regression procedure frem til endelig at identificere de uafhængige faktorer.
Resultater
Kendetegn af patienterne
alt 533 patienter med GC blev rekrutteret fra 3 tertiære henvisning universitetshospitaler, herunder 194 patienter fra Zhongnan Hospital i Wuhan University, 182 patienter fra Heji Hospital og 157 patienter fra Hubei Tumor Hospital. På tidspunktet for sidste opfølgning, 278 dødsfald (52,2%) forekom, herunder 126 dødsfald (64,9%) ud af 194 tilmeldte patienter fra Zhongnan Hospital i Wuhan University, 84 dødsfald (46,2%) ud af 182 tilmeldte patienter fra Heji Hospital , og 68 dødsfald (43,3%) ud af 157 tilmeldte patienter fra Hubei Tumor Hospital. Den mediane alder af sager var 58 år (spændvidde 20-85 år), og han-til-kvinde-forholdet var 2,7 til 1. Nærmere oplysninger om større demografisk og klinisk-patologiske egenskaber blev opført i tabel 1.Table 1 Karakteristik af 533 GC patienter indskrevet i denne undersøgelse
Variabler
Total n (%)
Events n (%)
Median GC-specifikke OS (95% CI) (mo )
P-værdi
Alder (år)
≤ 65
380 (71,3)
178 (46,8)
51,7 (39,7-63,7)
< 0.001
> 65
153 (28,7)
100 (65,4)
28,0 (21,6-34,4)
Køn
Mand
389 (73,0)
192 (49,4)
39,7 (29,9-49,5)
0,019
Female
144 (27,0)
86 (59,7)
28,0 (17,9-38,1)
Kræft websted
Øvre tredje
156 (29,3)
80 (51,3)
32,6 (25,9-39,3)
0,004
Mellemøsten tredje
119 (22,3)
61 (51,3)
38,9 (9,4-68,4 )
Lavere tredje
222 (41,7)
112 (50,5)
42,1 (34,2-49,9)
Hele mave
36 (6,8)
25 (69,4)
13,2 (10,1-16,3)
Patologisk typen
Adeno WD /ID
131 (24,6)
59 (45,0)
42,1 (29,9-54,2)
0,212
Adeno PD /FN
299 (56,1)
160 (53,5)
34,9 (27,5-42,4)
Signet ring /mucious Ca
85 (15,9)
49 (57,6)
28,0 (10,9-45,1)
Andre
18 (3.4)
10 (55,6)
33,7 (20,0-47,5)
Kirurgi typen
proksimal gastrektomi
169 (31,7 )
82 (48,5)
35,9 (20,5-51,3)
< 0.001
Distal gastrektomi
268 (50,3)
128 (47,8)
46,6 (38,1-55,1)
Total gastrektomi
96 (18,0)
68 (70,8)
17,4 (11,3-23,4)
resektion typen
Palliativ resektion
11 (2.1)
11 (100,0)
9,8 (8,0-11,6)
< 0.001
Helbredende resektion
522 (97,9)
267 (51,1)
38,9 (31,8-46,0)
Andre orgel resektion (n)
0
507 (95,1)
256 (50,5)
39,3 (32,5-46,0)
< 0,001
1
14 (2.6)
11 (78,6)
24,1 (9,6-38,7)
2
8 (1.5)
7 (87,5)
12.4 (2,7-22,2)
≥ 3 fotos 4 (0.8)
4 (100,0)
13,6 (2,7-24,4)
HIPEC
Ingen
505 (94,7)
251 (49,7)
39,7 (32,4-47,0)
< 0.001
Ja
28 (5.3)
27 (96,4)
13,4 (9,6-17,2)
LN status
n0
172 (32,3)
51 (29,7 )
67,3 (59,8-74,8)
< 0.001
N1
112 (21,0)
57 (50,9)
35,9 (26,8-45,0)
N2
143 (26,8)
86 (60,1)
27,0 (19,9-34,1)
N3
106 (20,0)
84 (30,5)
14,4 (12,0-16,8)
Tumor invasion
T1
25 (4,7)
3 (12,0)
75,4 (66,4-84,4)
< 0.001
T2
85 (15,9)
19 (22,4)
72,7 (62,2-83,2)
T3
2 (0,4)
1 (50,0)
29,1 (10,7-47,4)
T4A
332 (62,3)
187 (56,3)
33,0 (26,6-39,4)
T4B
89 (16,7)
68 (76,4)
14.8 (10,8-18,9)
Fjernmetastaser
Ingen
478 (89,7)
224 (46,9)
42,5 (34,6-50,4)
< 0.001
Ja
55 (10,3)
54 (98,2)
10,6 (9,0-12,1)
TNM mellemstationer
trin I
79 (14,8)
8 ( 10.1)
85,2 (76,1-94,3)
< 0.001
Trin II
100 (18,8)
35 (35,0)
53,9 (46,6-61,3)
Stage IIIA
80 (15,0)
38 (47,5)
40,0 (21,7-58,3)
trin IIIB
116 (21,8)
67 (57,8)
28,0 (14,9-41,1)
Stage IIIC
117 (22,0)
90 (76,9)
14,8 (10,6-19,1)
Stage IV
41 (7,7)
40 (97,6)
11,1 (9,7-12,4)
Postoperativ SAE
Nej
458 (85,9)
205 (44,8)
49,8 (32,5-67,0)
< 0.001
Ja
75 (14,1)
73 (97,3)
14,8 (10,0-19,6)
Systemisk kemoterapi (cykler)
0
217 (40,7)
128 (59,0)
26,3 (19,2-33,4)
0,001
1 til 6
302 (56,7)
142 (47,0)
51,7 (36,6-66,9)
> 6
14 (2.6)
8 (57,1)
37,8 (16,9-58,7)
IP kemoterapi
Ingen
521 (97,7)
267 (51,2)
37,0 (29,8-44,2)
0,003
Ja
12 (2.3)
11 (91,7)
11,1 (7,0-15,1)
GC: mavekræft; GC-specifikke OS: mavekræft-specifik samlet overlevelse; Adeno WD /ID: godt differentieret eller mellemliggende differentieret adenocarcinom; Adeno PD /FN: dårligt differentieret eller udifferentieret carinoma; Signet ring /mucious Ca: Signet ring celle karcinom eller mucious adenocarcinom; HIPEC: hypertermisk intraperitoneal kemoterapi; LN status: lymfeknude-status; SAE: alvorlig uønsket hændelse; IP kemoterapi:. Intraperitoneal kemoterapi
GC-specifikke OS
På tidspunktet for sidste opfølgning, median follow-up tid var 38,6 mo (interval 6,9 til 100,9 mo), og 278 patienter døde ud af hele 533 vurderbare patienter (52,2%). Den mediane GC-specifikke OS var 25,3 mo (95% CI: 23,1-27,4 mo). overlevelse kurve etapevis Den blev vist i figur 1. De anslåede 1-, 2-, 3- og 5-årige GC-specifikke OS satser var 78,4%, 61,4%, 53,3% og 48,4%, hhv. Den mediane overlevelse fra trin I, II, III A, III B, IIIC og IV var 85,2 mo (95% CI: 76,1-94,3 mo), 53,9 mo (95% CI: 46,6-61,3 mo), 40,0 mo (95% CI: 21,7-58,3 mo), 28,0 mo (95% CI: 14,9-41,1 mo), 14,8 mo (95% CI: 10,6-19,1 mo) og 11,1 mo (95% CI: 9,7-12,4 mo), hhv. Som vist i figur 1, blev fundet signifikante forskelle i GC-specifikke OS blandt forskellige kliniske stadier. Patienter med klinisk fase III B og videre havde meget dårligere GC-særstatus OS end andre patienter. Figur 1 Kaplan-Meier overlevelse kurven for de 533 GC patienter i denne undersøgelse.
Dødelighed analyse
På tidspunktet for sidste opfølgning, 278 patienter (52,2%) døde blandt hele 533 vurderbare patienter. Med hensyn til absolutte antal patientens død på årsbasis, var der 114 (41,0%), 92 (33,1%), 43 (15,5%), 18 (6,5%), 8 (2,9%) dødsfald, henholdsvis i 1., 2ed, 3., 4., og 5. postoperative år. Kun 3 (1,1%) dødsfald efter 5 år. Oplysninger om GC-specifikke død i forhold til de kliniske faser blev afbildet i figur 2. Sætte sammen, var der 249 (89,6%) dødsfald inden tre år efter operation. Figur 2 Oplysninger om GC-specifikke dødsfald i forhold til de kliniske faser.
univariate overlevelsesanalyse
I denne undersøgelse blev alle variabler analyseret ved Kaplan-Meier-kurve og log-rank test. Blandt disse variabler, patologisk form havde ingen statistisk signifikant effekt på GC-specifikke OS (P
= 0,212), men statistisk signifikante faktorer var hospital (P
= 0,008), alder (P
< 0,001) , køn (P
= 0,019), kræft stedet (P
= 0,004), kirurgi type (P
< 0,001), resektion type (P
< 0,001), andet organ resektion ( P
< 0,001), HIPEC (P
< 0,001), LN status (P
< 0,001), tumor invasion (P
< 0,001), fjernmetastaser (P
< 0,001), TNM stadie (P
< 0,001), postoperativ SAE (P
< 0,001), systemisk kemoterapi (P
= 0,001), og IP-kemoterapi (P
= 0,003) (tabel 1).
multivariate overlevelsesanalyse
Efter univariat overlevelse analyse, de ovennævnte signifikante faktorer blev yderligere underkastet multivariat analyse ved anvendelse af Cox proportional hazard model og regression procedure fremad. Følgende variabler blev identificeret som uafhængige faktorer for prognose: tumor invasion (P
< 0,001), LN status (P
< 0,001), fjernmetastaser (P
< 0,001), resektion type ( P
= 0,015), HIPEC (P
= 0,049), postoperativ SAE (P
< 0,001) og systemisk kemoterapi (P
< 0,001) (tabel 2) .table 2 Uafhængig prognostisk faktorer af 533 GC patienter identificeret ved multivariat analyse
kovariat
χ2
P
HR
95% CI
Lavere
Upper
Tumor invasion
13,008
< 0.001
1,022
1.010
1,034
LN status
36,845
< 0.001
1,462
1,293
1.653
Fjernmetastaser
29,004
< 0.001
2,832
1,939
4,137
Resektion type
5.900
0.015
0.430
0.218
0.850
HIPEC
3.863
0.049
1.707
1.001
2.910
Postoperative SAE
27,752
< 0.001
2,507
1,781
3,528
Systemisk kemoterapi
24,064
< 0.001
0,521
0,402
0,676
GC: mavekræft; HR: hazard ratio; CI: konfidensinterval; LN status: lymfeknude-status; HIPEC: hypertermisk intraperitoneal kemoterapi; SAE:. Alvorlig hændelse
Diskussion
flere vigtige punkter betragtes fra dette studie. Først et flertal af GC patienter er på avanceret klinisk stadie. I vores serie af 533 patienter, 354 tilfælde (66,4%) var klinisk fase III og videre. For disse patienter GC er ikke længere en lokal sygdom, men mindst en regional eller en systemisk sygdom. Selvom kirurgi kunne fjerne store tumorer masse selv, kan det efterlade nogle usete kræftceller i operationsområdet. Derfor bør mere intensiv adjuverende kemoterapi følges for at udrydde disse venstre-over kræftceller. To omfattende randomiserede kliniske forsøg har allerede vist overlegenheden af denne tilgang i forhold til konventionel kirurgi alene [17, 18]. En anden rimelig fremgangsmåde er at starte perioperative kemoterapi, til ned-trins tumoren, efterfulgt af helbredende resektion. Det er blevet bevist, at sådan behandler modalitet faktisk kunne forbedre de kliniske resultater af GC patienter [19].
Andet vores analyse viste, at over 40% af GC dødsfaldet i det første år efter operationen, og yderligere 30% plus GC dødsfaldet i det andet år efter operation [20-22]. Derfor er det klinisk vigtigt at designe rationelle strategier for at løse disse problemer. En vigtig overvejelse er, at høje risikofaktorer bør undersøges og identificeres, således at reducere dem og mindske risikoen død. En anden strategi er at designe en tæt opfølgning plan og nøje at gennemføre det, for at identificere de patienter med tidlige tegn på tilbagefald og anvende passende behandlinger. Blandt de for tiden anvendte metoder, serum tumormarkører undersøgelse og medicinsk billedbehandling undersøgelser er mest udbredte metoder. Regelmæssige overvågning blod tumormarkører carcinoembryonisk antigen (CEA) og carboxyl antigen 19-9 (CA19-9) kunne bidrage til at give advarsel oplysninger om kræft tilbagefald [23].
Forskellige klinisk-patologiske faktorer er blevet rapporteret at påvirke GC-specifikke OS, såsom alder, køn, cancer site, kirurgi type, resektion typen, andet organ resektion, HIPEC, LN status, tumorinvasion, fjerne metastaser, TNM stadie, postoperativ SAE, systemisk kemoterapi og IP kemoterapi [5, 7, 8, 20, 24-28]. Disse resultater er i overensstemmelse med vores undersøgelse. I vores undersøgelse, patologisk form ikke havde nogen indvirkning på GC-specifikke OS, hvilket ikke er i overensstemmelse med adskillige tidligere undersøgelser, der konkluderede, at patologiske type var en vigtig faktor for prognose og overlevelse af GC [5, 24], men er i overensstemmelse med nogle andre undersøgelser, der rapporterede, at patologisk form ikke havde nogen indflydelse på GC-specifikke OS [7, 27]. Dette kan skyldes den forskellige typningsmetode anvendes. Det er blevet dokumenteret, at Lauren histologisk klassifikation er en enkel og praktisk typningsmetode at have signifikant korrelation med overlevelse GC. Clinicalpathological informationer om denne undersøgelse blev opnået fra hospitalsafdeling for patologi, og de ikke vedtage Lauren klassificering. I fremtidige studier bør vi vedtage denne klassifikation.
For kræftpatienter, de kliniske resultater afhænger af flere vigtige faktorer, som kan opdeles i dem, der ikke kan grebet såsom TNM stadie, og dem kan grebet såsom behandling modeller . Efter Cox proportional hazard model analyse, vi arbejdede ud syv uafhængige faktorer, der havde stor betydning for overlevelse, seks af disse syv faktorer er allerede blevet godt anerkendt som de vigtigste determinanter for patienternes overlevelse [5, 7, 8, 29]. Hvad fortjener særlig opmærksomhed, er konstateringen af, at HIPEC er også en selvstændig faktor for forbedret overlevelse. Flere faser I-III undersøgelser har allerede vist behandlingen fordel af HIPEC. Glehen et al. fortløbende behandlet 49 avancerede GC patienter med HIPEC, hvilket resulterede i 10,3 måneder af GC-specifikke OS, mod 6,1 måneder af GC-specifikke OS behandlet med kun standard helbredende resektion [30]. I en anden undersøgelse af Yonemura et al., 107 GC patienter også behandlet med HIPEC, og GC-specifikke OS var 11,5 måneder [31]. Endnu vigtigere, en nylig fase III-prospektivt, randomiseret klinisk forsøg bekræftede også overlevelse fordel af 11,0 måneder i HIPEC gruppen mod 6,5 måneder i CRS-gruppen [32]. Desuden randomiseret en systematisk gennemgang og meta-analyse af 13 acceptable kvaliteter kontrollerede forsøg har også fastslået, at HIPEC har betydelig overlevelse fordel over den aktuelt standard behandling for fremskreden GC [33]. Tilsammen alle disse kendsgerninger bekræfter værdien af HIPEC til behandling af stadium III og videre GC patienter. I denne undersøgelse var den mediane overlevelse af patienter med HIPEC var 13,4 mo (95% CI: 9,6-17,2), som var kortere end andre uden HIPEC (39,7 mo [95% CI: 32,4-47,0]). Det var på grund af patienter med HIPEC var mavekræft med metastaser og prognose ikke var optimistisk. Men den mediane overlevelse af patienter med HIPEC var længere end patienter med metastaser (13,4 mo vs
10,6 mo, P
< 0,05). Det understøtter HIPEC har signifikant overlevelsesfordel selvom der kunne være udvælgelsesskævhed i denne henseende på grund af det begrænsede antal patienter, der behandles ved HIPEC.
Postoperativ SAE inkluderet gastrointestinal obstruktion, anastomotiske lækage, og blødning fører til grad 3 og derover anæmi , abdominal absces. Alle disse er blevet bekræftet at have en væsentlig negativ indvirkning på GC-specifikke OS. . I undersøgelsen af Sierzega et al [34], median OS af patienter med anastomotiske lækage var signifikant lavere end patienter med ikke-anastomotiske lækage (4,1 mo vs. 23 mo, P
< 0,001), og progression -fri overlevelse af patienter med anastomotiske lækage var også signifikant kortere end patienter med ikke-anastomotiske lækage (11 mo vs. 19 mo, P
= 0,021). . I en anden undersøgelse af Yoo et al [35], den gennemsnitlige OS for patienter med anastomotiske lækage var signifikant lavere end patienter med ikke-anastomotiske lækage (30,5 mo vs. 96,2 mo, P
< 0,001). Anastomotiske lækage kunne fremme gastrisk cancer progression ved at forlænge inflammation [34-36]. Ifølge Tokunaga et al. [37], GC patienter med intraabdominal infektion havde en dårligere 5-års OS sats og 5-tilbagefald overlevelse end patienter uden intraabdominale infectins (66,4% vs. 86,8%, P
< 0,001 og 64,9% vs. 84,5%, P
< 0,001). I en anden undersøgelse af Li et al. [38], postoperative komplikationer, herunder gastrointestinal obstruktion, anastomotiske lækage, og blødning førende og abdominal absces alle var uafhængige og negative prognostiske faktorer for GC. Derfor bør der gøres alt for at reducere risikoen for postoperativ SAE, herunder omhyggelig patient udvælgelse til operation og optimeret perioperativ patientpleje.
Konklusion
Sammenfattende denne undersøgelse identificeret fire uafhængige prognostiske faktorer, som kunne interveneret til GC patienter, herunder helbredende resektion, HIPEC, postoperativ SAE og systemisk kemoterapi, og tre uafhængige prognostiske faktorer, der ikke kan interveneret: tumorinvasion, LN status og fjern metastase. Derfor bør øge opmærksomheden blive rettet mod bedre forståelse tumor biologi involveret i kræft invasion og metastase, og raffinering tværfaglig strategier omfattende behandling at øge effektiviteten og reducere SAE.
Erklæringer
Tak
Dette arbejde understøttes af Award for fremragende ph.d.. Kandidater Finansieret af Undervisningsministeriet i Kina (nr 5052011303014), Science Fund af National Natural Science Foundation of China (nr 81.171.396), Science Fund for Creative Research Grupper af National Natural Science Foundation of China (nr 20.621.502, 20.921.062 ), og de grundforskning Midler til de centrale universiteterne i Undervisningsministeriet i Kina (nr 4.103.005).
Authors 'oprindelige indsendt filer til Images of Nedenfor er links til forfatternes oprindelige indsendte filer til billeder. 12893_2012_471_MOESM1_ESM.tiff Forfatternes oprindelige fil til figur 1 12893_2012_471_MOESM2_ESM.tiff Forfatternes oprindelige fil til figur 2 konkurrerende interesser
Forfatterne erklærer, at de ikke har nogen konkurrerende interesser.
Forfattere bidrag
YL, GFY og JDL undfanget af undersøgelsen, og deltog i sit design og koordinering. WQH, LWW, SGY, HLZ, CWP og WJZ deltog i databasen indsamling og opfølgning. WJZ udført de statistiske analyser og udarbejdet manuskriptet. Alle forfattere læst og godkendt den endelige manuskript.
 Specifik kulhydratdiæt Ceviche-opskrift
Jeg har bemærket, at siden jeg startede med den specifikke kulhydratdiæt, vil jeg nogle gange falde ind i rutiner med at spise de samme par måltider igen og igen, fordi jeg ved, at det får mig til at
Specifik kulhydratdiæt Ceviche-opskrift
Jeg har bemærket, at siden jeg startede med den specifikke kulhydratdiæt, vil jeg nogle gange falde ind i rutiner med at spise de samme par måltider igen og igen, fordi jeg ved, at det får mig til at
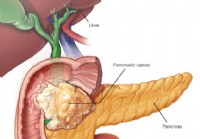 Bugspytkirtelkræft (adenokarcinom)
Bugspytkirteltumorer kan klassificeres i fire kategorier:Vi vil fokusere på adenocarcinom her, da det er den type kræft, der findes i 95 % af diagnosticeret bugspytkirtelkræft. Epitel:Duktalt epitel
Bugspytkirtelkræft (adenokarcinom)
Bugspytkirteltumorer kan klassificeres i fire kategorier:Vi vil fokusere på adenocarcinom her, da det er den type kræft, der findes i 95 % af diagnosticeret bugspytkirtelkræft. Epitel:Duktalt epitel
 Sjov med fiber:Madmidler mod forstoppelse
Du betragter måske ikke fiber som sjovt, men dit fordøjelsessystem gør! Hele fødevarer får den til at brumme og køre jævnt. Her er grunden til, at din krop har brug for kostfibre plus velsmagende mad,
Sjov med fiber:Madmidler mod forstoppelse
Du betragter måske ikke fiber som sjovt, men dit fordøjelsessystem gør! Hele fødevarer får den til at brumme og køre jævnt. Her er grunden til, at din krop har brug for kostfibre plus velsmagende mad,