Samtidig overekspression af serum p53 mutation relateret til Helicobacter pylori
infektion
Abstract
Baggrund & Mål
I provinsen Cádiz (Spanien), den justerede dødeligheden for mavekræft i kystbyen Barbate er 10 /100.000 indbyggere, mens der i den indre by Ubrique, satsen er dobbelt så høj. Satsen for Helicobacter pylori Hotel (H. pylori
) infektion (H. pylori
antistoffer) i den normale befolkning var 54% i Ubrique, men kun 32% i Barbate. I de to årtier siden dens oprindelige opdagelse, har p53 fundet et ualmindeligt fremtrædende plads i vores forståelse af menneskets mavekræft og H. pylori
årsag ophobning af reaktive ilt arter i slimhinden rummet. Denne undersøgelse blev designet til at sammenligne serumniveauer af p53 i en population karakteriseret ved høj dødelighed på grund af mavekræft og en høj forekomst af H. pylori
infektion og en anden population, hvor dødeligheden af denne årsag og forekomsten af H. pylori
infektion er lave.
Materialer og metoder
319 emner fra lav dødelighed befolkning og 308 fra den høje dødelighed befolkning blev undersøgt, som var 71 patienter med mavekræft. Vi målte serum immunoglobulin G antistof til H. pylori
og serum mutant p53 protein og ceruloplasmin.
Resultater
Forskellen mellem de to populationer i forekomsten af H. pylori
infektion var signifikant (p <0,001). Af seropositive, havde 81% forhøjet værdier af mutant p53, sammenlignet med 11% af seronegative (p < 0,0001). Serumkoncentration af ceruloplasmin var signifikant højere i seropositive med forhøjet mutant p53-protein end i seronegative med normale niveauer af p53 (p < 0,05).
Konklusioner
Der er en signifikant sammenhæng mellem infektion med H. pylori
, forhøjede titre af H. pylori
antistoffer og positivitet for serum mutant p53-protein. Sådanne oplysninger kan øge vores grundlæggende viden i molekylær patologi mavekræft og beskyttelse mod H. pylori
infektion.
Introduktion
Dødelighed på grund af mavekræft i Spanien er faldet markant siden perioden 1960-1965, men er stadig høj i nogle bjerg steder [1]. I den sydlige atlantiske provins Cadiz, kystnære byer som Barbate har en justeret dødelighed på 10 /100.000 indbyggere, mens byer som Ubrique, beliggende i den bjergrige region 30 kilometer inde i landet, har en justeret dødelighed på 20 /100.000 [2 ]. En tidligere undersøgelse viste, at antallet af Helicobacter pylori infektion (bestemt ved at måle serum H. pylori
IgG antistoffer) i den normale befolkning var 54% i Ubrique, men kun 32% i Barbate, hvor dødeligheden for mavekræft er sænke. Mean antistoftitere er også højere i området med den højere dødelighed [2].
H. pylori
, oprindeligt under slægten Campylobacter [3], er et allestedsnærværende bakterielt patogen der inficerer mere end 50% af verdens befolkning. H. pylori
var først dyrket in vitro, og vist at være associeret med gastritis og mavesår, af Marshall og Warren [4]. H. pylori
infektion hos ubehandlede patienter er sædvanligvis livslang, og den igangværende kronisk infektion kan være en ætiologisk agens for kronisk gastritis, mavesår sygdom og carcinom [5]. Kronisk infektion med H. pylori
påvirker cirka halvdelen af verden og resulterer i malignitet i en lille delmængde af denne population. Selvom hyppigheden af infektion i de udviklede nationer falder med en deraf følgende fald i H. pylori
associeret mavesår sygdom, gastrisk kræft fortsat den anden væsentlig årsag til kræft død på verdensplan, med H. pylori
infektion er en vigtig henføres faktor i udviklingen af gastrisk cancer [6]. Forskning i forholdet mellem de to er i gang, men foreslog, at mellem 35 og 55% af alle gastrisk kræft kan være relateret til H. pylori
infektion [7].
Siden 1994 Internationalt agentur for forskning i kræft (IARC) betegnet H. pylori
som en klasse i kræftfremkaldende for mennesker, det nu godt accepteret, at gastrisk infektion med H. pylori
er en risikofaktor for udvikling af mavekræft [8]. Selvom den præcise patogenetiske rolle af H. pylori
i gastrisk carcinogenese er fortsat uklart, er det blevet præciseret, at denne organisme bidrager til ændringer i epitelcelleproliferation, som kan være den initierende begivenhed i en kaskade kulminerede i udviklingen af mavekræft [ ,,,0],9], men det vides ikke, om den øgede risiko er på grund af tilstedeværelsen af mutant p53 genereret af kronisk gastritis eller en direkte virkning af bakterierne på p53 onkogen [10, 11].
p53 genmutation er forbundet med omkring 70% af tumorer af forskellige orignis [12, 13]. p53-genet fungerer som en "gatekeeper af cellen", for sin rolle i forebyggelse af ophobning af genetiske ændringer gennem regulering af kritiske kontrolpunkter mellem slutningen af G1 og begyndelsen af S at omdirigere celler med en mutation i genomet mod apoptose eller programmeret celledød. Denne nøgle onkogen forhindrer således fastholdelsen af et defekt genom og udvikling af en cancer [14].
Adskillige nyere undersøgelser er blevet offentliggjort på tilstedeværelsen af p53 i patienter med H. pylori
infektion, mavekræft, eller begge. Men konklusionerne er selvmodsigende, og det har været vanskeligt at udvikle en enkelt sammenhængende hypotese, der kan redegøre for alle resultater, der meddeles dato [15]. Palli et al [16] fandt p53 mutanter i 33 ud af 105 tilfælde af mavekræft og Domek et al [17] arbejdet med den hypotese, at tumorigenese indebærer deregulering af celledeling og apoptose. Disse forskere undersøgte celleproliferation og apoptose i det gastriske epitel af børn inficeret med H. pylori
, og fandt, at den apoptotiske indeks var signifikant højere hos patienter med H. pylori
gastritis end hos patienter med sekundær gastritis eller sund kontrol emner. De rapporterede også, at apoptose nedsat, når den bakterielle infektion blev udryddet. Wu et al, rapporterede, at der findes forskellige veje for gastrisk carcinogenese i forskellige histologiske undertyper af mavekræft og dens progression, hvor H. pylori
infektion kan spille en vigtig rolle [18]. Hibi et al konkluderede, at vedvarende H. pylori
infektion forårsaget gastritis, med degeneration og regeneration af epitelet at øget celleproliferation og akkumulering af p53 [19]. Dette vil til gengæld øget ustabilitet af genet, som afspejlet i udviklingen af karcinom, ved hjælp af immunhistokemiske metoder til at undersøge p53 udtryk, og konkluderede, at udtrykket er forbundet med histopatologiske fænotyper, og at genetiske ændringer kan ikke blive påvirket af H. pylori
infektion [20]. Chang et al, noterede sig, at H. pylori
infektion og mutation af tumorsuppressorgen p53 kan være signifikant relateret med processen med gastrisk carcinogenese i godt differentierede og moderat differentierede carcinomer [21]. Men Hongyo et al, hævdede, at H. pylori
infektion var mere almindelig hos patienter uden nogen mutation i p53 [22].
Udviklingen af en enzym-bundet antistof (ELISA) for mutant p53 protein gør det muligt at bestemme mest mutant p53 proteiner i mennesker og andre pattedyr [23]. Denne test er blevet anvendt til at bestemme mutant p53-protein i serum fra tilsyneladende raske personer med H. pylori
infektion, detekteret som tilstedeværelse af antistoffer mod specifikke IgG [24], beacuse fleste patienter inficeret med H. pylori
producere en let identificeret systemiske humorale immunforsvar responde, bestående primært af IgG. Cirkulerende H. pylori
antistoffer vedvarer paa konstante niveauer i årevis under infektion. Salg mutant p53 proteiner har en halveringstid på omkring 24 timer, mens normale proteiner har en halveringstid på omkring 20 min. Det er denne forlænget halveringstid, som fører til ophobning af påviselige mængder af p53-protein [25].
Reaktive oxygenarter (ROS) er en gruppe af meget reaktive oxidative molekyler impliceret i ældningsprocessen, i flere kroniske inflammatoriske lidelser , og i kræftfremkaldende veje i forskellige epiteliale distrikter [26]. En stigning i celle ROS, det være sig på grund af overproduktion og /eller latrintømning manglende evne, kan resultere i alvorlige skader på forskellige celle komponenter, herunder membraner, mitokondrier og nukleare samt mitokondrie-DNA [27].
Ceruloplasmin (CP) er en 132 kd cuproprotein som sammen med transferrin, tilvejebringer størstedelen af antioxidant kapacitet i serum. Cp er et serum ferroxidase der indeholder mere end 95% af kobberet i plasma. Dette protein er et medlem af multicopper oxidase familien, en evolutionært bevaret gruppe af proteiner, der udnytter kobber til par substratoxidering med fire-elektron reduktion af oxygen til vand. Trods behovet for kobber i ceruloplasmin funktion, dette protein ikke spiller nogen væsentlig rolle ved transport eller metabolisme af dette metal [28, 29].
I denne undersøgelse har vi forsøgt at sammenligne forholdet mellem serumniveauer af mutant p53-protein og H. pylori
infektion i to populationer af lignende socioøkonomisk status, men med meget forskellige dødelighed for mavekræft. Et andet formål var at undersøge indirekte ved at måle serumkoncentrationen af antioxidanten ceruloplasmin hos patienter med tegn på H. pylori
infektion. Serum niveauer af ceruloplasmin normalt varierer omvendt med serum nitrit niveauer [30-32].
Materialer og metoder
Studietype
Det var en komparativ, tværsnit, case-kontrol undersøgelse af to populationer med forskellig dødelighed fra mavekræft. Denne undersøgelse har været i gang siden marts 2002 til oktober 2005. Der Serum ceruloplasmin niveauer blev også sammenlignet hos patienter med og uden H. pylori
infektion, og hos patienter med og uden mutante former af p53. Efterforskerne vidste ikke, om emnet var positiv eller negativ for H. pylori
antistoffer, når de testede p53 status. Med henblik på sammenligning blev der serumniveauer af H. pylori
antistoffer og p53 status også bestemt i 71 patienter med gastrisk cancer.
Hvis H. pylori
infektion er relateret til cancer, nulhypotesen var, at enhver variation eller forskel i seropositivitet for bakterien mellem befolkningerne med høje og lave dødelighed på grund af mavekræft skyldes tilfældigheder. Den alternative hypotese var, at variationer eller forskelle i seropositivitet mellem de to populationer tyder på, at seropositivitet for H. pylori
infektion er relateret til dødelighed fra mavekræft.
Ceruloplasmin, en organisk antioxidant, er en markør for tilstedeværelsen af frie radikaler. Vi målte serumkoncentrationer af ceruloplasmin og kiggede for korrelationer af disse værdier med serum H. pylori
antistoftitre og p53 niveauer.
Formålet med denne undersøgelse var at sammenligne serum p53 værdier i en population er kendetegnet ved en høj grad af dødelighed som følge af mavekræft og en høj forekomst af H. pylori
infektion og en befolkning med en lav dødelighed fra denne årsag og en lav forekomst af H. pylori
seropositivitet.
Undersøgelse befolkninger
befolkningen bestod indbyggere i to byer ligger 30 kilometer fra hinanden i provinsen Cadiz (det sydlige Spanien), uden forudgående behandling af H. pylori
eller som havde nylig udryddelse af H. pylori
mindst 8 uger før blev rekrutteret . Selvom den samfundsøkonomiske niveau af de to byer er ens, er Barbate ligger på Atlanterhavskysten, mens Ubrique ligger i et bjergrigt indre område. Vi gennemførte en ernæringsmæssig analyse og spørgeskemaundersøgelse for socioøkonomisk status for at sammenligne andre risikofaktorer, som kan påvirke H. pylori
infektion mellem grupperne. Ingen signifikante forskelle i de ernæringsmæssige faktorer eller socioøkonomisk status, såsom Hollingshead indeks, hustype, antal søskende, og fortrængning indeks, blev fundet mellem grupperne. Deltagerne var fast bosiddende i disse byer, der var sund og asymptomatisk på tidspunktet for undersøgelsen. Mænd og kvinder i alderen 18 år og derover var inkluderet.
Kontrolgruppen bestod i patienter diagnosticeret med histologisk bekræftet mavekræft, på afdelinger for Intern Medicin, Medicinsk Onkologi og Kirurgi, fra University Hospital Puerto Real fra Cadiz. Den mediane alder af patienterne var 59 år (spændvidde: 33-85 år) og 57,5% af patienterne i serien var mænd. Kirurgiske eksemplarer af 71 formalin fast paraffin indlejret mavekræft med tilstødende ikke-involveret normale maveslimhinden blev opnået fra Patologisk Institut fra vores Hospital. Tilstedeværelse af tumor i sektionerne blev bekræftet ved hematoxylin og eosin-farvning, og histologisk typebestemmelse af tumorerne blev udført ifølge både Lauren klassificering og WHO-retningslinjerne [33]. Prøver blev undersøgt af to independet erfarne patologer, der også evalueret hæmatoxylin-eosin (H &E). Og Giemsa farvede slides for tilstedeværelsen af H. pylori
gastriske kræftformer blev klassificeret ifølge WHO klassifikationen samt differentiaded ( n = 21), moderat differentieret (n = 25), dårligt differentierede (n = 13), og signetring cellecarcinomer (n = 12). Evaluering af tumor etape blev udført i henhold til kriterierne i Den Internationale Union Against Cancer (UICC) [34].
Emner med en historie af gastrisk kirurgi, dyspepsi, sår på tolvfingertarmen, mavesår, malignitet, positiv status for human immundefekt virus og /eller hepatitis B, aktiv gastrointestinal blødning, eller brug af steroider eller immunosuppressive lægemidler, H2-receptor-blokkere, antibiotika, bismuthforbindelser eller protonpumpehæmmere eller tage stoffer interfererer med frie radikaler produktion (herunder vitaminer C, A og E, selen og zink) eller lignende nonprescription, blev udelukket. Der blev også udelukket, hvis de havde haft nogen sygdom, for hvilken pålidelige kliniske oplysninger ikke var tilgængelige, eller hvis der ikke kunne opnås blodprøver. Ikke mere end to medlemmer af samme familie blev inkluderet
Sampling procedure
Vi studerede i alt 627 emner:. 308 fra Barbate og 319 fra Ubrique. Deres aldre lå fra 18 til 85 (median 55) år. Til statistisk analyse blev inddelt i 3 aldersgrupper; yngre gruppe (18-40 år n = 101, median alder = 29), midaldrende gruppe (41-60 år, n = 197, gennemsnitsalder = 53) og ældre gruppe (≥ 61 år, n = 119, median alder = 76). Sampling var tilfældig, og blev stratificeret for disse tre aldersgrupper undergrupper. Deltagerne i denne befolkningsundersøgelse blev besøgt i deres hjem. Alle kvalificerede emner gav deres informerede samtykke til deltagelse i denne undersøgelse og udføres i henhold til de god klinisk praksis retningslinjer og Helsingfors-erklæringen.
Variabler
Som kvantitative variabler vi indspillede serum niveau af H. pylori
IgG-specifikke antistof, udtrykt som IU /L [2, 35], serumniveau af p53, udtrykt som ng /ml, og serumkoncentrationen af ceruloplasmin, udtrykt som mg /L [36]. Som en nominel variabel indspillede vi om emnet var hjemmehørende i Barbate eller Ubrique. Som dichotomous variabel vi bruges seropositivitet /seronegativ reaktion for H. pylori
, med en cut-off værdi på 51 IU /L.
En blodprøve på 10 ml blev opnået ved venepunktur, og serummet blev separeret og opbevaret ved -80 ° C indtil analyse. Serumkoncentration af H. pylori Salg IgG-antistoffer blev målt med Biolab Malakit (Wavre, Belgien) ved anvendelse af et enzymbundet immunosorbentassay (ELISA). Ved at bruge dette system, blev producentens anvisninger følges. H. pylori
infektion blev defineret som et positivt ELISA resultat. ELISA til serum p53 var fra Oncogene Research (Calbiochem, Cambridge, MA, USA), der udelukkende påvises mutant p53-protein, for at eliminere muligheden for krydsreaktion med andre proteiner, især forskellige inflammationsrelaterede produkter. Dette assay anvender et monoklonalt muse-antistof og et kanin-polyklonalt antistof; de tidligere reagerer med en epitop lokaliseret mellem aminosyrerne 155 og 214 i p53-proteinet, og binder udelukkende til epitopen eksponeret på mutantprotein, men ikke på den vildtypeproteinet. Derfor assayet er meget selektiv. Alle prøver og standarder blev analyseret in duplo. H. pylori
IgG og mutant p53 blev kvantificeret ved at ekstrapolere den gennemsnitlige optiske tæthed for hvert sæt af dubletter på en standardkurve opnået med kendte koncentrationer af oprensede H. pylori Salg antistoffer og mutant p53 hhv. For alle analyser vi brugte en Labinstruments SLT-400 ELISA spektrofotometer (Salzburg, Østrig) med en 405 nm filter til H. pylori
et 450 nm filter til p53 [24]. Serum ceruloplasmin blev målt ved nephelometri med en Behring nefelometer 100 analysator (Behringwerke AG, Marburg, Tyskland).
Statistisk analyse
Alle statistiske beregninger blev udført under anvendelse af SPSS software pakken (SPSS version 10.0 for Windows, Inc, Chicago, IL ) [37]. Beskrivende statistik blev beregnet for hver variabel (midler og konfidensintervaller). Den statistiske signifikans af forskellene mellem grupper blev analyseret ved t-test eller Mann-Whitney U-test. Signifikans af forskellen mellem de seropositive og seronegative populationer i byer med høj og lav dødelighed på grund af mavekræft blev fundet for serumkoncentration af p53-protein. De mulige sammenhænge mellem serum ceruloplasmin koncentration, H. pylori
IgG-antistof-niveau og p53-niveau. Alle tests af signifikans blev 2-tailed, og en p-værdi på 0,05 eller mindre blev betragtet statistisk signifikant.
Resultater
Helicobacter H. pylori
IgG-antistof (tabel 1) Salg In kystbyen Barbate, 92 af de 308 forsøgspersoner (29,87%) var positive for H. pylori
IgG-antistof, med en middelværdi på 242,5 IU /L (95% CI 232-386). Middelværdi i negative forsøgspersoner (n = 216) var 19,4 IU /L (CI 16-24). I de indre by Ubrique, 257 af de 319 forsøgspersoner var positive (80,56%), med en middelværdi på 397,3 IU /L (95% CI 345-405 IU /L). Gennemsnittet i negative forsøgspersoner (n = 62) var 16,6 IU /L (CI 12-22). Forskellen i antallet af seropositive i de to populationer var signifikant ved p < 0.001.Table 1 Serum koncentration af anti-H. pylori
IgG-antistoffer.
Befolkning
N
Mean (IU /L)
CI
95%
p-værdi
Barbate
308
-------
H. pylori
(+)
92
242,5
232-386
< 0,001
H. pylori
(-)
216
19,4
16-24
Ubrique
319
-------
H. pylori
(+ )
257
397,3
345-405
< 0,001
H. pylori
(-)
62
16,6
12-22
mavekræft
71
-------
H. pylori
( +)
68
400
305-495
< 0,001
H. pylori
(-)
3
17,4
15-19
CI, konfidensinterval
Mutant p53 genotype (tabel 2)
Af de 349 forsøgspersoner, som var seropositive for H . pylori
IgG-antistof, 286 (81,94%) havde mutant p53, med en middelværdi på 0,973 ng /ml (95% CI 0,847-1,098). Af de 278 seronegative personer, blev mutant p53 protein påvist i kun 27 (9,71%), med en middelværdi på 0,239 ng /ml (95% CI 0,131-0,346). Hyppigheden af kvantificerbare mutationer var således signifikant højere hos personer, som var seropositive for H. pylori
IgG-antistof end i seronegative personer (p < 0,001). Middelværdien serum værdien var signifikant højere hos patienter med gastrisk cancer (1,973 ng /ml, 95%, CI 0,895-2,103) end i seropositive individer (0,973 ng /ml) eller seronegative personer (0,239 ng /ml) (begge p < 0,001) .table 2 Serum koncentrationen af mutant p53 protein og ceruloplasmin
Befolkning
N
mutant. p53 protein
Mean
(ng /ml)
CI 95%
Ceruloplasmin
Mean
(mg /L)
CI 95 %
Samlet H. pylori
positiv
349
-----
-----
477
435-519
HP ( +) og p53 positive
286
0,973
0,847-1,098
486
439-532
Samlet H. pylori
negativ
278
--- -
-----
414
366-461
HP (-) og p53 positive
27
0,239
0,131-,346
420
414-433
mavekræft
71
1,973
0,895-2,103
763
703-823
HP, Helicobacter pylori
Serum ceruloplasmin (tabel 2)
af de 349 forsøgspersoner, som var seropositive for H. pylori
IgG-antistof, betyde serumkoncentration af ceruloplasmin var 477 mg /l (95% CI 435-519). Af de 278 seronegative personer, middelkoncentration var 414 mg /l (95% CI 366-461). Af de 286 patienter, der var seropositive for H. pylori
IgG-antistof og som også havde mutant p53, betyder ceruloplasmin koncentration var 486 mg /l (95% CI 439-532). Dette var betydeligt højere end i de 27 forsøgspersoner, som var seronegative for bakterieinfektion (420 mg /l, CI 414-433), med t = 2,23 (p < 0,05).
Korrelationer mellem variabler
Vi fandt ingen signifikante korrelationer mellem p53 og H. pylori
antistofniveauer (R = 0,038) eller mellem p53 og ceruloplasmin fusion (R = 0,139) i patienter, som havde anti-H. pylori
antistoffer.
Patienter med mavekræft
seropositive for H. pylori
blev påvist i 68 af 71 patienter (Tabel 1). Mean serumniveauer af mutant p53 i de 71 patienter med mavekræft var 1,973 ng /L (95%, 0,895 til 2,103). Mean serumkoncentration af ceruloplasmin i denne gruppe var 763 mg /L (95% CI 703-823). Gennemsnitshøjden af mutant p53-protein hos cancerpatienter var signifikant højere end hos raske personer, som var seropositive for H. pylori
infektion (p < 0,001), men højere end i seronegative personer (p < 0,01). (Tabel 2).
Diskussion
Det er nu accepteret, at H. pylori
infektion er en risikofaktor for mavekræft. Imidlertid forbliver mekanismen for carcinogenese er forbundet med denne bakterieinfektion i maven, ikke belyst. De direkte virkninger af H. pylori
er bestemt relevante for induktionen af atrofisk gastritis og cancer, og en række virulensfaktorer af H. pylori
kan have en rolle at regulere epitel- celle responser forbundet med inflammation [38, 39].
Vores resultater viser, at blandt personer med H. pylori
infektion, en højere end normal nummeret også har forhøjede p53-protein. Der synes at være en klar sammenhæng mellem tilstedeværelsen af mutant p53 og seropositivitet for H. pylori
; dog vil der være behov prospektive studier at demonstrere en årsagssammenhæng mellem de to fænomener. Det gennemsnitlige serum niveau af mutant p53 protein, vi fandt hos personer med H. pylori
infektion var højere end middelværdien hos personer uden infektion, og var således høj nok til potentielt lette udviklingen af kræft. I de sjældne tilfælde, hvor mutant p53 protein blev fundet i seronegative individer, middelværdien var lavere end hos patienter med mavekræft.
Det er en pålidelig laboratorium procedure, eftersom Shim et al, med samme laboratorium procedure af mutant serum p53 måling har fået sammenlignelige men højere resultater i serum af tilfælde med colorectal carcinom [40]. Serumniveauerne af mutant p53 er markører for tissular hyperekspression af dette gen, som er blevet demostrated Suwa et al, hos patienter med pancreatisk carcinom [41]. På den anden side, Mukarami et al, vist forholdet mellem H. pylori
infektion og en direkte sekvensanalyse af p53-gen mutation i en biopsiprøve af human gastrisk mucosa, synes dette resultat at være involveret i reaktionsvejen, der fører til dysplasi eller karcinom [42].
H. pylori
overlever i værten forårsager kronisk inflammation ved at ændre signalveje, nedregulere inflammation og dysregulating vært immunrespons. Carcinogenese i maven er en flertrinsproces; selvom p53 mutation er et vigtigt led i kæden, måske er det en forfremmelse faktor og der er behov andre lokale initierende faktorer for kræft at udvikle [15]. Vores resultater understreger vigtigheden af disse yderligere kræftfremkaldende faktorer, som ikke er direkte relateret til p53 og blev ikke undersøgt her. Selvom p53 mutation er en nødvendig faktor, er det ikke i sig selv tilstrækkeligt til at udløse mavekræft.
Hvis en patient findes at være H. pylori
positivt, er det vigtigt, at infektionen er udryddet på grund af risikoen for disse pepti mavesår og gastriske cancere. Prospektive undersøgelser vil udlevere skæbnen for de personer, som er seropositive for H. pylori
som også udvikler betydelige niveauer af mutant p53. Resultaterne af sådanne undersøgelser vil gøre det lettere at afgøre, om det er umagen værd at behandle H. pylori
infektion i seropositive men asymptomatiske personer; for nu, synes det risikabelt at erklære, som gør Konturek et al, [43], at profylaktisk behandling ikke er indiceret.
Tilstedeværelsen af serum mutant p53 i sig selv giver ingen oplysninger om, hvorvidt mutationen var et resultat af en genotoksisk virkning af selv eller af en posttranskriptionel ændring i p53 forårsaget af bakterielle toksiner bakterie. Selv om data fra denne undersøgelse ikke kaste lys over dette spørgsmål, konsekvenserne for p53-molekylet er de samme uanset den involverede mekanisme.
Shiao et al, er blevet postuleret, at kronisk atrofisk gastritis, intestinal metaplasi og dysplasi er præcancerøse stadier af mave tumorigenese og at mutation af p53-genet er en tidlig begivenhed i maven tumorigenese [44]. Denaturering af det normale protein på grund af lagring kan udelukkes som årsag til tilstedeværelsen af mutant p53 i vores fag:. Alle blodprøver blev behandlet på samme måde, uanset H. pylori
status
H. pylori
kan udøve en mutagen effekt på p53 gennem produktion af frie radikaler i cellen. Denne hypotese understøttes af koncentrationerne af serum ceruloplasmin, et vigtigt organisk antioxidant: middelkoncentration var højere hos forsøgspersoner, som var seropositive for H. pylori
og som også havde mutant p53, end hos patienter, der var negative for begge. Andre undersøgelser har dokumenteret tilstedeværelsen af frie radikaler i maveslimhinden af personer med H. pylori
infektion [45-47].
Bidrag p53 til den efterfølgende forekomst af mavecancer blev signifikant i H. pylori
-seropositve fag og ikke i H. pylori
-seronegative emner.
Oxidative skader er veldokumenteret i kroniske gastrisk inflammatoriske sygdomme [48, 49]. Nylige offentliggjorte resultater viste, at mucosal oxidativ skade i H. pylori-infektion er forbundet med forøget inflammatorisk celleinfiltration, øget apoptose og celleproliferation, hvorimod det er blevet postuleret, at den gradvise ophobning af oxidativ DNA-beskadigelse i visse gener, såsom p53, kan bidrage til gastrisk carcinogenese [26].
Sådanne data antyder, at apoptose kan induceres af både transkriptionel aktivering af en række af målgener og også ved en række andre begivenheder, der kan formentlig omfatte signaltransduktion [50].
sammenfattende vores resultater tyder på, at H. pylori
infektion bidrager til udviklingen af gastrisk cancer ved at hæve niveauerne af mutant p53. Selv om dette kan være et nødvendigt promotor i udseendet af cancer, er det ikke i sig selv en risikofaktor i fravær af en tidligere udløsning eller initiering eller mutagene eller flere faktorer, og den anden side tilstedeværelsen af anti-H. pylori
antistoffer i humane sera er fortsat en af de enkleste metoder til påvisning af H. pylori
bakterier, og serologiske metoder spiller således en vigtig rolle i den kliniske praksis.
Forfattere 'Oplysning af potentielle interessekonflikter
forfatterne erklærer, at de ikke har nogen konkurrerende interesser
Forkortelser
ELISA:..
(enzymbundet immunosorbentassay)
erklæringer
Tak
forfatterne takker Karen Shashok for at oversætte den originale manuskript til engelsk. Denne undersøgelse blev delvist understøttet et tilskud til videnskabelig forskning fra Clinica Jerez (ASISA). Vi vil gerne takke sygeplejerske specialist Francisca Cabo for deres sygepleje bistand og yde omsorg til patienterne.
Forfattere 'originale indsendte filer til Images of Nedenfor er links til forfatternes oprindelige indsendte filer til billeder. 13046_2009_312_MOESM1_ESM.pdf Forfatternes oprindelige fil til figur 1
 Sådan passer du på din fordøjelsessundhed:regelmæssigt indtag af fermenteret mælk kan forbedre milde fordøjelsessymptomer
Sådan passer du på din fordøjelsessundhed:regelmæssigt indtag af fermenteret mælk kan forbedre milde fordøjelsessymptomer
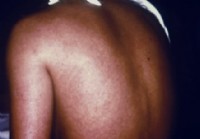 Marburg Virus Disease
Marburg Virus Disease
 Stills sygdom (systemisk debut juvenil idiopatisk arthritis)
Stills sygdom (systemisk debut juvenil idiopatisk arthritis)
 Orgasm:The Original Anti-Inflammatory
Orgasm:The Original Anti-Inflammatory
 Opbevaring af dit SIBO butiksskab – del 1
Opbevaring af dit SIBO butiksskab – del 1
 Årstiderne skifter:Sådan kan du støtte immunsundhed
Årstiderne skifter:Sådan kan du støtte immunsundhed
 Hvordan massescreeningsindsats har hjulpet med at identificere flere tilfælde af cøliaki hos børn
Et nyt massescreeningsprogram for børn i skolealderen i Italien fandt ud af, at den samlede forekomst af cøliaki næsten er fordoblet i de sidste 25 år. Cøliaki Infographic. Billedkredit:E
Hvordan massescreeningsindsats har hjulpet med at identificere flere tilfælde af cøliaki hos børn
Et nyt massescreeningsprogram for børn i skolealderen i Italien fandt ud af, at den samlede forekomst af cøliaki næsten er fordoblet i de sidste 25 år. Cøliaki Infographic. Billedkredit:E
 Hvad er der med soja på lavFODMAP-diæten?
Når det kommer til eliminationsfasen af low FODMAP diæten, er soja opført på mange undgå lister. Men er soja altid en no-go for dem, der eliminerer FODMAPs for deres IBS? Det korte svar:det kommer a
Hvad er der med soja på lavFODMAP-diæten?
Når det kommer til eliminationsfasen af low FODMAP diæten, er soja opført på mange undgå lister. Men er soja altid en no-go for dem, der eliminerer FODMAPs for deres IBS? Det korte svar:det kommer a
 9 måder at gøre det nemmere at leve med sur reflukssygdom
Selvom du måske er blevet diagnosticeret med gastroøsofageal reflukssygdom (GERD), betyder det ikke, at du ikke kan nyde dit liv fuldt ud. Der er måder at kontrollere GERD på, som ikke nødvendigvis få
9 måder at gøre det nemmere at leve med sur reflukssygdom
Selvom du måske er blevet diagnosticeret med gastroøsofageal reflukssygdom (GERD), betyder det ikke, at du ikke kan nyde dit liv fuldt ud. Der er måder at kontrollere GERD på, som ikke nødvendigvis få