Seit 22 Jahren, Kibow ® hat sich auf die Erforschung und Entwicklung von Nahrungsergänzungsmitteln für die Nierengesundheit konzentriert, die auf dem Konzept basieren, eine fehlgeschlagene Nierenfunktion auszugleichen, indem das Mikrobiom des BOWels (daher der Name KIBOW) zur Entfernung von Giftstoffen genutzt wird. Dies basiert auf den Eigenschaften hochstammspezifischer und selektiver Probiotika und Präbiotika für verschiedene Anwendungen zur Darmmodulation. Kibow ® ist bekannt für sein Flaggschiffprodukt Renadyl™ (ein Prä-/Probiotikum für die Nierengesundheit), Kibow Fortis ® (eine Multifaser für Wellness), Kibow Flora™ (ein Probiotikum für die Gesundheit des Immunsystems) für den Menschen, und Azodyl™, ein Tierarzneimittel für Nierenversagen, das speziell für Katzen und Hunde entwickelt wurde (seit Juli 2006 exklusiv an Vetoquinol USA lizenziert). Das Unternehmen prüft auch die Entwicklung neuer auf die Organfunktion ausgerichteter Nahrungsergänzungsmittel und erweitert damit sein Produktportfolio im kommenden Jahr.
Der aktuell vermarktete Kibow ® Nahrungsergänzungsmittel für Menschen und Haustiere werden von der US-amerikanischen FDA als Nahrungsergänzungsmittel eingestuft. Obwohl die Produkte über zwei Jahrzehnte mit Pharma-ähnlicher Validierung (https://kibowbiotech.com/rd/) (https://kibowbiotech.com/journal-publications/) entwickelt wurden, die potenzielle Verwendung dieser Produkte ist durch die US-amerikanischen FDA/FTC-Vorschriften eingeschränkt, da keine Ansprüche auf Gesundheits- oder Krankheitsbehandlung geltend gemacht werden können. Ebenfalls, diese Produkte, als Nahrungsergänzungsmittel, nicht berechtigt sind, eine medizinische Kostenerstattung zu erhalten. Angesichts dieser Einschränkungen und des Wunsches, mehr chronische Nierenpatienten zu erreichen und ihnen zu helfen, Kibow ® hat eine neuere und fortschrittlichere Live Biotherapeutic (LBP)-Formulierung entwickelt, die als von der US FDA zugelassenes und klinisch validiertes pharmazeutisches Produkt wissenschaftlich weiterentwickelt werden soll.
Da Probiotika lebende Mikroben sind, Dieses neue Produkt fällt unter die Live Biotherapeutic Product (LBP)-Medikamente gemäß dem Center for Biological Evaluation Research (CBER) und den US-amerikanischen FDA-Vorschriften. Dies wird das erste LBP-Medikament für CKD-Patienten in den Vereinigten Staaten sein und würde für eine medizinische Kostenerstattung in Frage kommen. Das Unternehmen initiiert den IND-Prozess und plant die erforderlichen klinischen Studien. Nach erfolgreichem Abschluss der vorgeschlagenen randomisierten, kontrollierte klinische Studien bei CKD III/IV-Patienten und Übermittlung der Daten an die FDA zur Überprüfung und Zulassung, Kibow ® wird sich darauf vorbereiten, sein LBP-Medikamentenprodukt im Jahr 2023 in den USA und anderen Ländern auf den Markt zu bringen. Dies wird dazu beitragen, dass viel mehr Patienten Zugang zu dieser neuartigen Behandlungsoption haben und sich diese leisten können.
Kibow ® plant außerdem zusätzliche klinische Studien mit Patienten, die sich einer Dialyse unterziehen, um verbesserte Ergebnisse und das Potenzial zur Verringerung der Dauer und/oder Häufigkeit der Dialyse zu untersuchen. Auch diese klinische Studie soll vor 2023 abgeschlossen sein. Kibow ® freut sich auf diesen nächsten Meilenstein, der Dialysepatienten immens zugute kommen und die Medicare-Ausgaben für das US-Gesundheitssystem um mehrere Milliarden Dollar erheblich reduzieren könnte. Kibow ® Der Start seiner hundertprozentigen Pharmasparte von Biotech und seine Maßnahmen zur Erlangung des LBP-Medikamentenstatus stehen im Einklang mit der Mission des kürzlich ins Leben gerufenen HHS/ASN KidneyX-Programms (https://www.kidneyx.org/) sowie der vom Präsidenten unterzeichnete Durchführungsverordnung zur Förderung der Nierengesundheit (https://www.whitehouse.gov/presidential-actions/executive-order-advancing-american-kidney-health/).
 Colitis ulcerosa:Symptome, Ernährung, Behandlung, Ursachen
Colitis ulcerosa:Symptome, Ernährung, Behandlung, Ursachen
 Symptome und Ursachen des zyklischen Erbrechens (CVS)
Symptome und Ursachen des zyklischen Erbrechens (CVS)
 Salbei:Gemeiner Salbei, Garten- und Schwarzer Salbei
Salbei:Gemeiner Salbei, Garten- und Schwarzer Salbei
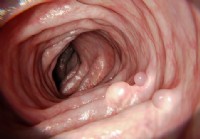 Darmpolypen:Symptome, Ursachen, Krebsrisiko, Behandlung und Vorbeugung
Darmpolypen:Symptome, Ursachen, Krebsrisiko, Behandlung und Vorbeugung
 Dünndarmblutung
Dünndarmblutung
 7 Schlüssel für schnellen und ganzheitlichen Fettabbau!
7 Schlüssel für schnellen und ganzheitlichen Fettabbau!
 Rotavirus-Infektion
Fakten zur Rotavirus-Infektion Zu den Symptomen des Rotavirus gehören Fieber, Erbrechen und wässriger Durchfall. Rotavirus ist die häufigste Ursache für Magen- und Darmentzündungen (Gastroenteri
Rotavirus-Infektion
Fakten zur Rotavirus-Infektion Zu den Symptomen des Rotavirus gehören Fieber, Erbrechen und wässriger Durchfall. Rotavirus ist die häufigste Ursache für Magen- und Darmentzündungen (Gastroenteri
 Cystinurie – Nierensteine
Die Steine, verglichen mit der Größe eines Viertels (einer 0,25-US-Dollar-Münze), stammten aus der Niere einer jungen Frau mit Cystinurie, dem häufigsten Defekt, der beim Transport einer Aminosäure (e
Cystinurie – Nierensteine
Die Steine, verglichen mit der Größe eines Viertels (einer 0,25-US-Dollar-Münze), stammten aus der Niere einer jungen Frau mit Cystinurie, dem häufigsten Defekt, der beim Transport einer Aminosäure (e
 Was ist eine Ampullektomie?
Was ist eine Ampullektomie? Ampullektomie kann als offene Operation und laparoskopische Operation durchgeführt werden. Eine Ampullektomie ist die chirurgische Entfernung der gesamten Vaterampull
Was ist eine Ampullektomie?
Was ist eine Ampullektomie? Ampullektomie kann als offene Operation und laparoskopische Operation durchgeführt werden. Eine Ampullektomie ist die chirurgische Entfernung der gesamten Vaterampull