tiivistelmä
Caveolin-1 (Cav1) on telineen proteiini ja taudinaiheuttajan reseptorin limakalvon ruoansulatuskanavassa. Krooninen infektio Mahalaukun epiteelisoluihin Helicobacter pylori Author Yhteenveto Infektio -bakteerin Helicobacter pylori Citation: Hitkova I, Yuan G, Anderl F, Gerhard M, Kirchner T, Reu S, et ai. (2013) Caveolin-1 Suojaa B6129 hiiret vastaan Helicobacter pylori Toimittaja: Steven R. Blanke, University of Illinois, Yhdysvallat vastaanotettu: toukokuu 23, 2012; Hyväksytty 4 helmikuuta 2013 Julkaistu: 11 huhtikuu 2013 Copyright: © 2013 Hitkova et al. Tämä on avoin pääsy artikkeli jaettu ehdoilla Creative Commons Nimeä lisenssi, joka sallii rajoittamattoman käytön, jakelun ja lisääntymiselle millä tahansa välineellä edellyttäen, että alkuperäinen kirjoittaja ja lähde hyvitetään. Rahoitus: Tämä tutkimus tukivat apurahoja EB ja MPAE Deutsche Krebshilfe (108287) ja DFG (BU-2285). MPAE tukee myös avustusta Deutsche Krebshilfe (107885), DFG (SFB 824, TP B1), Else Kröner Stiftung (nro P14 /07 //A104 /06) ja BMBF (Mobimed 01EZ0802; KMU-innovativ nro 0315116B. rahoittajat ollut mitään roolia tutkimuksen suunnittelu, tiedonkeruu ja analyysi, päätös julkaista tai valmistamista käsikirjoituksen. kilpailevat edut: kirjoittajat ovat ilmoittaneet, etteivät ole kilpailevia intressejä ole. Johdanto Helicobacter pylori kaksi suurta H. pylori Caveolin-1 (Cav1) on 21-24 kDa ja keskeinen rakenteellinen proteiinin kaveoleja, erikoistunut muoto lipidilautan mikrodomaineja. Kaveoleja ovat 50-100 nm pulloon /putkimainen kohtiin, solukalvon runsaasti makrofageissa, endoteelin ja sileän lihaksen soluissa, tyypin I penumosyy- ja rasvasolut, missä ne osallistuvat solujen kuljetusprosesseihinsa myös endosytoosin, kolesterolin ulosvirtauksen ja kalvoliikenteessä [15] , [16]. Tässä yhteydessä Cav1 voi toimia myös estäjä clathrin riippumaton endosytoosin ja estää patogeenien /toksiini ottoa [17], [18]. Sitoutumalla sen rakennustelineet domain, Cav1 suoraan estää lukuisia reseptorit ja entsyymit mukaan lukien tyrosiinikinaaseiksi Src ja Ras perhe, G-proteiinien ja Typpioksidisyntaasit [15]. Sen lisäksi rooli kalvoliikenteessä, Cav1 on siten verkonohjausohjelmisto säätelyyn solujen lisääntymisen ja eloonjäämisen [19]. Cav1 myös kykenee tärkeä tehtävä solun liikkuvuus ja muuttoliike sekä sisällä epiteelin, strooman ja endoteelin kudosten valvomalla solu-solu kontakteja, soluväliaineen tarttuvuus ja immuunivastetta [20], [21], [22], [23] . Cav1 suoraan sitoutuu kolesterolia, ja transkriptio Cav1 säätelee negatiivisesti transkriptiotekijä steroli-reagoivan elementin sitova proteiini-1 (SREBP1) [24]. SREBP1 on sidottu endoplasmakalvostoon (ER) inaktiivisena 125 kDa: n esiasteen ja aktivoituu olosuhteissa kolesterolin puutos proteolyyttisellä katkaisulla Golgin laitteessa. Tämä lohkaisu seuraa translokaatio aktiivisen 68 kDa SREBP1 tumaan, jossa se sitoutuu sterolin reagoiva elementit (SRE) kohdegeenien, kuten Cav1, mukana kolesterolin synteesiä ja rasvahappojen [25]. H. pylori Siksi arveltu, että kolesterolia sitovia proteiineja SREBP1 ja Cav1 ovat tavoitteita H. pylori Ethics lausuma Eläinkokeiden tehtiin yhteisymmärryksessä eettisten ohjeiden on Technische Universität München (Saksan Animal Welfare Act, Deutsches Tierschutzgesetz) ja oli hyväksytty (7.2-1-54-2531-74-08) by hallituksen Baijerin (Regierung von Obb., Munich, Saksa). Eläimet Homotsygoottinen Cav1 knockout (Cav1-KO) (kanta Cav1tm1Mls /J; stock numero 004585) ja sovitetun kontrolli villi tyyppinen (WT) (kanta B6129SF2 /J; stock numero 101045) hiiriä (8 viikkoa) saatiin Jackson Laboratory (Bar Harbor, Maine) ja ylläpidettiin sekoitettu taustaa patogeenittomassa hiiri laitos [28], [ ,,,0],29]. Kokeellinen mahahaava suoritettiin indometasiinin julkaisemassa ennen [30]. Infektio hiirten hiirellä sopeutettuja CagA /VacA-toimitus puutteellinen H. pylori Kemikaalit olivat Merckiltä (Darmstadt, Saksa) tai Sigma (Taufkirchen, Saksa). Polyklonaaliset antiseerumit olivat SREBP1 (# PA1-46142, ThermoFisher Scientific, Waltham, MA), Cav1 (N-20, sc-894), SREBP1 (C-20, sc-366), CagA (b-300, SC-25766) FAK (A-17, sc-557), fosfori-FAK (Tyr-397, sc-11765), Hsp90 alpha /beta (H-114, sc-7947), Lamin A /C (H-110, SC- 20681, kaikki Santa Cruz Biotech., CA), yleinen ja fosfori ERK1 /2 (p44 /p42), p38, JNK (kaikki Cell Signaling, Danvers, MA) ja Ki-67 (SP6, DCS GmbH, Hampuri, Saksa ). Hiiren monoklonaaliset vasta-aineet olivat Cav1 (ɢ406) ja fosfo-Cav1 (pY14,ɣ338) (molemmat BD /Transduction Lab., San Jose, CA), DLC-1 (C-12, sc-271915) ja beeta-Actin (AC-15, sc-69879) (molemmat Santa Cruz Biotech.). Makrofagi-spesifinen rotan anti-hiiren F4 /80-vasta-ainetta (# MF48000) saatiin Invitrogen (Life Technologies, Darmstadt, Saksa). Chicken anti- H. pylori Ihmisen alkion munuaisen (HEK293), Madin-Darby koiran munuainen ( MDCK), vanhempien ihmisten GC solulinjoissa (AGS, MKN45, N87) (kaikki American Type Culture Collection, Rockville, MD), ja stabiilisti transfektoidut kloonit syntyy sen ylläpidettiin kuten aiemmin on kuvattu [37]. Infektio solujen solun mukautettu CagA-toimitus taitavia H. pylori DNA-konstruktit ekspressioplasmidin pEGFP-CagA mainittiin muualla [38]. ~800 Emäsparin fragmentti proksimaalisen ihmisen Cav1 promoottori (AF019742, asema 69-859) [24] monistettiin PCR: llä genomisesta DNA: ihmisen normaalia maksan ja kloonattiin KpnI /Hindlll pGL3-luc lusiferaasireportteriplasmidi ( Promega GmbH, Mannheim, Saksa). Isoformi 4: ihmisen DLC1 mRNA [39] (DLC1v4, NM_001164271.1) monistettiin ihmisen hepatooma HepG2-soluissa ja lisätään BamHI /Notl-ekspressiovektorin Ptarget (pT, Promega GmbH). Ohimenevä transfektio ja lusiferaasin määritykset suoritettiin kuten aiemmin [37]. H. pylori Ex vivo Koko mahat leikattiin hiirillä, ja pesäkkeiden muodostuminen määritettiin oleellisesti, kuten on kuvattu [31] . Antral liuska mahan punnittiin, sijoitettiin 5 ml: aan Brucella liemi, ja seosta vorteksoitiin 10 minuutin ajan. Laimennokset 1:10, 1:100 ja 1:1000 valmistettiin, ja 100 ui kutakin laimennosta maljattiin H. pylori Jäljellä oleva mahan pestiin steriilillä vedellä. Antral nauhat leikattiin, jäädytettiin nestemäisessä typessä ja säilytettiin -80 ° C: ssa, kunnes RNA. Loput mahan pantiin 3 ml: aan 4% (w /v) paraformaldehydillä (PFA) fosfaattipuskuroidussa suolaliuoksessa (PBS) ja niitä inkuboitiin 24 tunnin ajan 4 ° C: ssa. Sitten vatsa leikattiin pitkin suurempaa ja pieni kaarevuus kahtia, jonka jälkeen nestehukka ja upotettavaksi parafiiniin histologista analyysiä. Solut infektoitiin H. pylori havaitseminen immunologisesti proteiinien SDS-PAGE: lla ja WB suoritettiin kuten aiemmin [41]. Matrix laserdesorptiomassaspektriä /ionisaatio (MALDI-MS) on kuvattu yksityiskohtaisesti [29]. värjäys suoritettiin triple-väritilassa visualisointiin 4,6- diamino-2-fenyyli (DAPI), Alexa-488 ja -594 digitaalikameralla-kytketty (Axiovision, vapauta 4.4) fluoresenssi mikroskooppi (Axiovert 200M, Carl Zeiss MicroImaging GmbH, Hallbergmoos, Saksa). Konfokaalimikroskopia (Axiovert 40, Zeiss) ja 3D-jälleenrakentamiseen H. pylori histopatologisissa ja immunohistokemia (IHC) B Krooninen aktiivinen gastriitti määriteltiin samanaikainen läsnäolo sekä neutrofiilisten liuskatumaisten (PMN) ja mononukleaaristen solujen (lymfosyytit ja plasman soluja) sisällä mahalaukun limakalvon. Aktiivinen (PMN) ja krooninen (mononukleaariset) tunkeutuminen sisään arvioitiin seuraavasti: parafinoidut mahalaukun kudoksesta leikattiin 3 um: n leikkeiksi käyttäen puoliautomaattinen mikrotomi (Leica Microsystems GmbH, Wetzlar, Saksa). Sitten leikkeitä värjättiin käyttäen hematoksyliinillä & Eosiini (H &E) ratkaisuja. Histopatologisen analyysi toteutettiin kolme patologit (CR, SR, TK) sokaissut tutkimuksen setup. Morfologiset muutokset mahalaukun limakalvon luokiteltiin päivitetty Sydney järjestelmä [32], [42]. Arvosana gastriitti pisteytettiin perustuu tiheys intramucosal tulehduksellisten infiltraattien mononukleaaristen ja PMN solujen julkaistu ennen [43]: none (0), lievä (1+), kohtalainen (2 +) ja vaikea (3+). Lisäksi hyperplastisessa tai regeneratiivinen epiteelin muutoksia, menetys parietaalisoluihin ja taajuus imukeräsissä tai lymfaattisen aggregaattien havaittu. Intensiteetti H. pylori ChIP (Kit Upstate, Millipore GmbH, Schwalbach, Saksa) ja kaikki muut menetelmät suoritettiin, kuten aiemmin on kuvattu [45]. Oligonukleotidit on lueteltu taulukossa S1. elinkelpoisuus kiinnittyneet solut mitattiin 1- (4,5-dimetyylitiatsol-2-yyli) 3,5-difenyyli-formatsaaniksi (MTT ) määritys (Roche Diagnostics GmbH, Mannheim, Saksa) valmistajan suosittelemia. Määrittämään solun tarttumisen, 1 x 10 4 solut ympättiin 6 cm soluviljelymaljoille varten 1-6 tuntia, minkä jälkeen toistuva pesu PBS: llä. Jäljellä olevat tarttuneet solut kiinnitettiin 4% (w /v) PFA PBS: ssä, värjättiin kristallivioletilla ja sen jälkeen laskettiin käyttäen ImageJ (NIH, Bethesda, MD). Haavojen parantumisen kokeet suoritettiin oleellisesti, kuten on kuvattu [46]. Lyhyesti, soluja kasvatettiin konfluenssiin 6 cm: n maljoille, ja 5 mm: n alusta otettiin yksikerroksista käyttämällä käännettyä sininen kärki seuraa inkubointi soluviljelmälevyihin vielä 24, 48 ja 72 tuntia. Haavan seurattiin päälle kiinnitystä ja solujen värjäys kristalliviolettiliuokseen kirkkailla kentän mikroskopia (Axiovert 200M, Carl Zeiss MicroImaging GmbH). Tulokset ovat keskiarvoja ± keskivirhe vähintään 5 eläintä per genotyyppi tai 3 itsenäistä koetta eri solujakojen. Ohjelmisto GraphPad Prism (versio 4.0, La Jolla, CA) käytettiin analysointiin. P-arvot (* p < 0,05) laskettiin käyttäen Studentin t ja Fisherin tarkka testejä. Human: Cav1: NM_001753.4, Q03135; B2M: NM_004048.2, P61769; IL8: NM_000584.3, P10145; DLC1 v1: NM_182643.2, Q96QB1; DLC1 v4: NM_001164271.1, Q96QB1; ACS: NM_018677.3, Q9NR19; HMGCoAS: NM_001098272.2, Q01581; HMGCoAR: NM_000859.2, P04035; LDLR: NM_000527.4, P01130; beeta-aktiini: P60709; Lamin V: P02545; Lamin C: P02545; Hsp90 alpha: P07900; Hsp90 beta: P08238; ERK1 (P44): P27361; ERK2 (P42): P28482; FAK: Q05397; JNK1: P45983; JNK2: P45984; p38: Q16539; Src: P12931; SREBP1: P36956; Ki-67: P46013; Hiiri: Cav1: NM_007616.4, P49817; B2M: NM_009735.3, Q91XJ8; TNFalpha: NM_013693.2, P06804; IFN-gamma: NM_008337.3, P01580; IL1beta: NM_008361.3, P10749; IL6: NM_031168.1, P08505; CD4: NM_013488.2, P06332; CD19: NM_009844.2, P25918; CD25: NM_000417.2, P01589; CD86: NM_019388.3, P42082; CCL5-: NM_013653.3, P30882; CXCL1: NM_008176.3, P12850; PPARg2: NM_015869.4, P37231; TFF2: NM_009363.3, Q9QX97; Koira: B2M: NC_006612, XP_850148; H. pylori Cav1-hiirillä näyttää parannettu gastriitti kun infektio CagA-toimitus epäpätevä H. pylori arvioimiseksi histologisia muutoksia aiheutettiin mahan kudokseen H. pylori Cav1-puutos edistää rekrytointi makrofagien osaksi tartunnan mahalaukun limakalvon arvioimiseksi identiteetti immuunisolujen, jotka edistävät H. pylori Samanlaisia tuloksia saatiin kokeista, käyttöön nopean mahalaukun vahinkoa hiirissä injektoimalla indometasiinia [30] (Fig.S1). Yhdenmukainen parannetun kudosvauriota Cav1-KO vatsat (* p = 0,0161, WT versus arvioimiseksi toimintaa Cav1 aikana H. pylori Cav1 suojelee ihmisten GC soluja vastaan CagA aiheuttamaa uudelleenjärjestelyn solun tukirangan muodostuminen neulamaisia ulkonemia ( "kolibri") on tyypillinen morfologiset fenotyyppiä AGS solujen vastauksena infektio CagA-toimitus taitavia H. pylori tueksi Näiden havaintojen soluadheesiota ja haavan hinnat olivat voimakkaampia AGS /Cav1 verrattuna AGS /EV-solut (Fig.S2). Yhdenmukaisia sen toiminta tavoitteeksi proteiinin CagA ja osa paikallisia tarttumista [48], WB analyysit (Fig. 4D) myös havaittiin korkeampi (0,4 ± 0,1 AGS /EV versus CagA-toimitus toimivaltaisten H. pylori Cav1 on osoitettu fosforyloituvan sytosolientsyymien tyrosiinikinaaseja (Src, Abl) on tyrosiini 14 [49], ja fosforyloitu Cav1 ja src molemmat aktivoivat pieni GTPaaseja Rho /Rac /Cdc42 jotka säätelevät solun tukirangan toimintojen [13], [50]. Tunnistaa taustalla molekyylimekanismin miten Cav1 suojaa CagA liittyvän solun stressistä, arvioimme signalointireittejä aloittaman CagA-toimitus taitavia H. pylori Emme voineet havaita suora vuorovaikutus tai kvantitatiivinen rinnakkaispaikantumisen of CagA proteiini tai H. pylori tunnistamiseksi ehdokkaaksi proteiinia, joka antaa suojan CagA on Cav1 riippuva tavalla, proteiini vuorovaikutus näytön perustuu MALDI-MS suoritettiin (Fig. 7A). AGS /Cav1 soluja infektoitiin 16 h H. pylori Tämä tulos sai meidät täydentää cDNA variantti 4 ihmisen DLC1 [39] ihmisen hepatooma HepG2-soluissa (kuvio . 7C). CDNA insertoitiin ekspressiovektoriin Ptarget (pT-DLC1v4) ja sen jälkeen hetkellisellä trans- vanhempien AGS tai HEK293-soluissa 24 tuntia. WB-analyysit havaittu ilmentymistä ~110 kDa: n proteiinin, yhdenmukainen ennustetun koon DLC1v4 [39]. Transfektoitiin lyhytaikaisesti AGS-solut infektoitiin sitten H. pylori
( H. Pylori
) on merkittävä riskitekijä ihmisen mahasyövän (GC), jossa Cav1 on usein alassäädetty. Kuitenkin toiminta Cav1 on H. pylori
infektio ja patogeneesi GC jäi tuntemattomaksi. Osoitamme tässä, että Cav1-hiirillä, tartunnan 11 kuukaudeksi kanssa CagA-toimitus puutosta H. pylori
kanta SS1, kehittyi vakava gastriitti ja kudosvaurioita, mukaan lukien menetys parietaalisoluihin ja foveolar liikakasvu ja näytetään alempi kolonisaatiota mahalaukun limakalvon kuin villityypin B6129 samasta poikueesta. Cav1-null hiiret osoittivat suurempaa tunkeutumista makrofagien ja B-solujen ja eritystä kemokiinien (RANTES), mutta oli kevyemmästä CD25 + säätelijä-T-solujen. Cav1 puutteesta ihmisen GC soluja (AGS), infektoitu CagA-toimitus taitavia H. pylori
kanta G27, olivat herkempiä CagA liittyvää cytoskeletal stressin morfologit ( "kolibri") verrattuna AGS pysyvästi transfektoitujen solujen Cav1 (AGS /Cav1). Infektio AGS /Cav1 solujen laukaisi rekrytointi p120 RhoGTPase-aktivoivan proteiinin /poistetaan maksasyövän-1 (p120RhoGAP /DLC1) ja Cav1 ja torjua CagA aiheuttama tukirangan uudelleenjärjestelyjä. Ihmisen GC solulinjoissa (MKN45, N87) ja hiiren vatsan kudosta, H. pylori
alassäädetty endogeeninen ilmentyminen Cav1 riippumatta CagA. Mekanistisesti H. pylori
aktivoitu steroli-reagoiva elementti sitova proteiini-1 (SREBP1) tukahduttaa transkriptio ihmisen Cav1 geeni steroli reagoiva elementit (SRE) proksimaalisen Cav1 promoottori. Nämä tiedot ehdotti suojaava rooli Cav1 vastaan H. pylori
indusoimaan tulehdus ja kudosvaurio. Ehdotamme, että H. pylori
hyödyntää alas-säätely Cav1 horjuttaa isännän immuunivastetta ja edistää signalointi sen virulenssitekijöiden isäntäsoluissa.
( H. pylori
) vaikuttaa pääasiassa lapsia kehitysmaissa, joilla on riski edetä syöpään (GC) kuin aikuisilla monien vuosien jatkuva infektio, erityisesti kantoja, jotka ovat positiivisia onkogeenisel- virulenssitekijäksi CagA. Hävittämiseksi H. pylori
antibiooteilla on hoito valinta, mutta voi myös muuttaa alttius allergiat ja muissa elimissä. Siten uusien diagnostisten tai ennustetekijöitä markkereita tarvitaan joka tunnistaa varhain molekyylitason muutoksia mahalaukun limakalvon siirtymävaiheessa kroonisen tulehduksen syöpään. Tutkimuksessamme havaitsimme, että tuumorisuppressorigeenin caveolin-1 (Cav1) pelkistetään, kun infektio H. pylori
, ja CagA riitti, mutta ei välttämätöntä, että tämä alassäätöä. Menetys Cav1 johtui H. pylori
: sta riippuvaisen aktivaation steroli-reagoivan elementin sitova proteiini-1 (SREBP1), ja tämä tapahtuma poistetaan vuorovaikutusta Cav1 kanssa p120 RhoGTPase-aktivoivan proteiinin /poistetaan, maksasyövän-1 (p120RhoGAP /DLC1), toinen bona fide
tuumorisuppressoriproteiinia mahalaukun kudosta. Lopullisesti, Cav1 ja DLC1 voivat muodostaa uusia molekyylimarkkereiden H. pylori
infektoiduista mahalaukun limakalvon ennen neoplastisen transformaation epiteelin.
gastriitti. PLoS Pathog 9 (4): e1003251. doi: 10,1371 /journal.ppat.1003251
( H. pylori
) on gram-negatiivinen bakteeri, joka colonizes vatsat n. 50% maailman väestöstä ja lisää riskiä kroonisten gastriitti, mahahaava tauti, mahalaukun limakalvo liittyvä imukudos (MALT) lymfooma, limakalvon surkastumista ja mahasyövän (GC) [1], [2]. tämän perusteella etiologiasta, H. pylori
on luokiteltu luokkana karsinogeeniksi Maailman terveysjärjestön (WHO) vuonna 1994 [3].
toksiinien [4], CagA ja VacA, sisäistetään osaksi mahan epiteelisolujen injektio kautta bakteerien tyypin IV eritystä järjestelmä (CagA) [5], tai suoralla insertoimalla lipidilauttojen (VacA) [6], [7]. Lipidilauttoja ovat kolesteroli ja sfingolipidikeramidi-rikas mikrodomaineja solukalvon [8], [9], jotka hyödyntävät monet taudinaiheuttajia, kuten virukset, loiset ja bakteerit, helpottaa omaksumista koko organismeja ja /tai sisäistämistä myrkkyjä isäntäsoluihin [ ,,,0],10], [11], [12]. Esimerkiksi Neisseria spec
. käyttää lipidilauttoja ja Rho-välitteistä signalointia aktiinisytoskeletonin päästä sytosoliin [13]. Pseudomonas aeruginosa
hyödyntää lipidilautan liittyvä toll-like reseptori 2 infektion keuhkojen epiteelisolujen [14].
on osoitettu aineenvaihdunta kolesterolin isäntäsolun kalvoon, ja isäntä kolesterolin muuttaa onkogeenisiä ominaisuuksia CagA [26], [27].
infektion ja /tai efektoritoimintoja. Tarkemmin, kysyimme, onko (i) H. pylori
hyödyntää Cav1 helpottamaan injektiota ja alavirtaan signalointi CagA mahalaukun epiteelisolujen tai (ii) Cav1 toimii suojaavana "este-valvoa" proteiini, joka estää taudin herättämän H. pylori
. Tämän testaamiseksi fenotyyppien jotka johtuvat H. pylori
infektio tutkittiin Cav1-hiirillä ja ihmisillä GC solulinjoissa. Tuloksemme osoittivat, että Cav1 suojattu B6129 hiiriä vastaan H. pylori
-aiheiset gastriitti ja kudosvaurioita in vivo
riippumatta CagA. H. pylori
aktivoidaan myös SREBP1 ja alassäädetty ilmentyminen hiiren ja ihmisen Cav1 riippumatta CagA. Lisäksi Cav1 torjua CagA riippuvaisen solun tukirangan uudelleenjärjestelyjä in vitro
rekrytoimalla tuumorisuppressorigeenin poistettu maksasyövän-1 (DLC1).
Materiaalit ja menetelmät
kanta SS1 suoritettiin letkulla suun kautta kuvatulla [31]. Keskimääräinen aika hiiriä eri geneettisissä taustoissa (C57BL /6, B6129, BALB /c) toteutettava edetä krooninen gastriitti ja sen jälkeen (mahalaukun surkastuminen, hyperplasia, dysplasia) [32] vaihtelee välillä 10 ja 15 kuukautta tartuttamisen kanssa vakioviittausta kanta SS1 [28], [33], [34], [35]. Tämän vuoksi päätimme tehdä meidän analyysi tämän ajan kuluessa.
reagenssit
polyklonaalista Ab käytettiin kuvatulla [36]. Seerumin sytokiinien mitattiin ELISA: lla (R &D Systems, Minneapolis, MN) mukaan valmistajan ohjeiden. Pull-down määritykset pieni GTPaaseja Rho /Rac /Cdc42 ostettiin BIOCAT (Heidelberg, Saksa).
Soluviljely
kanta G27 suoritettiin kuten aiemmin [36].
Bakteeri kulttuuri
SS1 ja G27 bakteerit otettiin talteen -80 ° C glyserolikantaliuokset ja kasvatettu Wilkins-Chalgren (WC) veriagarlevyille mikroaerobisissa olosuhteissa (10% CO2, 5% O2, 85% N2, 37 ° C) 2-3 päivää. Hiiren sopeutuneet H. pylori
SS1 kerättiin agarmaljoille varten in vivo
infektioiden kuten aiemmin julkaistuista [31]. SS1 kanta oli PCR-positiivinen Caga
geeni ja mRNA mutta ei pistä toiminnallista CagA proteiini [40] kuten ilmeistä puuttuessa "kolibri" fenotyyppi infektoituneissa AGS soluissa (tuloksia ei ole esitetty) . Solu-mukautettu H. pylori
bakteerit CagA-toimitus taitavia G27 paino
ja CagA-Deleetiomutantin G27 Delta Caga
kerättiin agarmaljoille ja kasvatettiin sen jälkeen jatkuvassa rinnakkaisviljelemällä MDCK-solut, kuten on kuvattu [36].
määrän pesäkkeitä muodostavien yksiköiden (CFU) B
selektiivinen WC veriagarmaljoilla. Bakteeri- pesäkkeet määritettiin sen jälkeen, kun 5 päivää ja normalisoitiin painon vastaavan mahan kappaletta.
käsittely hiiren mahalaukun kudoksen
gentamysiiniä suojan määritys
G27 -kannan 2-24 h infektiokertoimella (MOI) 500:1. Sen jälkeen solut pestiin kolme kertaa PBS: llä jäljelle jääneiden bakteerit ja annettiin lisäksi inkuboitiin 2 tuntia 37 ° C: ssa kostutetussa ilmakehässä, DMEM /F12 (10% FCS, 10% Brucella liemi), johon gentamysiiniä (200 ug /ml ), penisilliiniä /streptomysiiniä (100 ug /ml) ja kloramfenikolia (100 ug /ml). Absence of ekstrasellulaaristen bakteerien vahvistettiin mikroskoopilla, ja seuraavaksi solut hajotettiin havaitsemiseksi solunsisäisten CagA Western blot (WB).
Coimmunoprecipitation (CoIP) ja Western blot (WB) B
Immunofluoresenssikoe
infektoiduista soluista, joissa LSM510 (Zeiss) ja Volocity (Improvision, Tübingen, Saksa) tehtiin kuten aiemmin [37].
kolonisaation mahalaukun limakalvon lieväksi (muutama ja yksi bakteereja satunnainen jakauma), kohtalainen (yhden ja ryhmitelty bakteerien epäjatkuvan jakelu) ja vakavia (tiheä bakteeri klusterit kattavat mahan limakalvon jatkuvaa kerrosta). Useiden kymmenien eri alueiden mahassa määritettiin. Immunohistokemiallinen (IHC) suoritettiin parafiinileikkeillä edellä kuvatulla tavalla [44].
elektroforeettinen liikkuvuus shift (EMSA), kromatiinin immunosaostuksella (chip), käänteistranskriptio-PCR (RT-PCR) ja kvantitatiivinen PCR (qPCR)
Cellular määrityksissä
Tilastot
Liittyminen numerot
: CagA: YP_002266135.1, B5Z6S0; UreB: YP_626814.1, Q1CV82.
Tulokset
SS1
infektio, B6129 WT ja Cav1-KO hiiret infektoitiin hiiren sopeutettuja ja CagA-toimitus puutteellinen H. pylori
kanta SS1. Hiiret lopetettiin 11 kuukautta myöhemmin, ja H. pylori
eristettiin resektoitiin mahan kudoksessa [31]. Cav1-KO hiiret osoittivat vähemmän bakteerien määrää mahalaukun limakalvon kuin WT hiirillä (7,3 ± 2,4 WT versus
1,6 ± 0,5 KO × 10 3 pmy /mg vatsan kudosta; * p = 0,0141; n = 15 per genotyyppi) (Fig. 1A). Histopatologisia analyysi paljasti, että molemmat WT ja Cav1-KO hiirille kehittyi aktiivinen krooninen gastriitti liittyy soluttautuminen mononukleaaristen ja liuskatumaisten (PMN) soluja mahalaukun limakalvon (Fig. 1 B). Sen sijaan, infektoimattomat WT ja Cav1-KO-hiirten ei ollut intramucosal tulehdusta (tuloksia ei ole esitetty). Sen sijaan gastriitti oli merkittävästi parannettu vuonna H. pylori
infektoituihin Cav1-KO hiirillä verrattuna tartunnan WT hiirillä (Kuva. 1 C). In Cav1-KO hiirten keskimääräinen pistemäärä gastriitti (0,7 ± 0,2 WT versus
1,7 ± 0,1 KO; * p = 0,0002, n = 15 per genotyyppi) oli ankarampi (taulukko 1) kuin WT hiirillä ja mahan limakalvon näytteillä intramucosal B-solufollikkelit, foveolar liikakasvu ja menetys parietaalisoluissa. Nämä tiedot osoittavat, että Cav1-vajaukseen liittyy lisääntynyt tulehdusreaktio mahalaukun limakalvon ja tehottomampi kolonisaatiota H. pylori
.
-aiheiset tulehduksen Cav1-KO hiiret, RT-qPCR analyysi valittujen sytokiinien, pinta markkereita ja kemokiinien suoritettiin (Fig. 2A). Yhdenmukainen havaittu tulehdus, H. pylori
SS1 indusoima TNFalpha ja IFN-gamma-mahalaukun limakalvon sekä WT ja KO-hiirissä. Lisäksi totesimme lisääntynyt mRNA ilmentymä CD19 (B-solut) (1,6 ± 0,3 WT versus
3,3 ± 0,9 KO; p = 0,0512, n = 15 per genotyyppi) ja RANTES (CCL5) (1,3 ± 0,2 WT versus
2,1 ± 0,6 KO; p = 0,0449, n = 15 per genotyyppi) mahalaukun kudoksessa H. pylori
infektoituihin Cav1-KO hiirillä verrattuna tartunnan WT hiirillä. Sitä vastoin mRNA-tasot CD4 (auttaja-T-solut), CD25 (T-sääntely-solut) ja CD86 (antigeeniä esittelevät solut) ovat tukahdutti H. pylori
riippumatta Cav1 tilan. Immunohistokemiallinen (IHC) havaittiin merkittävä lisäys intramucosal F4 /80-positiivisia makrofageja mahalaukun kudoksessa tartunnan Cav1-KO hiirillä verrattuna WT littermates (Fig. 2B). CD3-positiivisten lymfosyyttien sijaitsivat eri puolilla ja sisällä intramucosal munarakkuloita (tuloksia ei ole esitetty).
KO, n = 9 per genotyyppi), jolle on ominaista tulehdus, eroosio ja haavaumat, Cav1-hiirillä ilmaisi myös suurempia määriä mRNA: iden, jotka koodaavat haava paranemista proteiinien apilatekijän-2 (TFF2) (0,8 ± 0,3 WT versus
2,3 ± 0,4 KO; * p = 0,0048, n = 9 per genotyyppi) ja peroksisomiproliferaattorin reseptori- gamma (PPARg) (0,6 ± 0,2 WT versus
2,5 ± 0,5 KO; * p = 0,0008, n = 9 per genotyyppi). Yhteenvetona, nämä tulokset osoittivat, että menetys Cav1 parantaa herkkyyttä hiirten mahalaukun tulehdus ja kudosvaurio.
Cav1 kumpikaan sivupersoonat tarttumista H. pylori
kantojen eikä eloonjäämisen ihmisen GC solujen
infektio in vitro
, ihmisen mahalaukun epiteelisolujen linja AGS käytettiin, joka oli stabiilisti transfektoitu Cav1 ekspressioplasmidilla (AGS /Cav1) tai tyhjän vektorin (AGS /EV) [37]. Ensin tutki Cav1 vaikuttaa solujen selviytymistä upon H. pylori
infektio (Fig. 3A). AGS klooneja kanssa ja ilman Cav1 infektoitiin 48 tunnin ajan solun mukautettu CagA-toimitus toimivaltaisten H. pylori
kanta G27 eri infektiomultiplisiteettiarvoilla (MOI) välillä 1:100 ja 1:2000. Kolorimetrinen MTT määritykset paljastivat, että Cav1 ollut vaikutusta yleiseen eloonjäämiseen AGS solujen upon H. pylori
infektio. Samanlaisia tuloksia saatiin CagA-toimitus epäpätevä H. pylori
SS1 ja Western blot (WB) analyysi havaitsemiseksi ja ilmentävät fosforylaatiota eloonjäämisen kinaasien (AKT /PKB, ERK1 /2, p38MAPK) (tuloksia ei ole esitetty). Koska sekä H. pylori
ja Cav1 vuorovaikutuksessa lipidilauttoihin, kysyimme, onko tarttuvuus bakteerien soluihin riippuu läsnäolosta Cav1. AGS /Cav1 ja AGS /EV-solut infektoitiin (MOI = 10), jossa G27 (Fig. 3B, C) tai SS1 (tuloksia ei ole esitetty) bakteereja 30 minuuttia, mitä seuraa pesu ja sen jälkeen inkubointi tuoretta alustaa 2 tuntia. Sen jälkeen solut värjättiin immunofluoresenssimikroskopialla, ja bakteerien lukumäärä, joka tarttuu Cav1 ilmentävien tai tyhjän vektorin transfektoidut solut laskettiin (Fig. 3B, C). Mitään eroja tarttuvuuden havaittiin välillä AGS /Cav1 ja AGS /EV soluja, mikä viittaa siihen, että Cav1 ei vaikuta tarttuvuus H. pylori
bakteerit isäntäsoluille.
kantoja ja translokaation CagA sytosoliin [47]. Jotta voidaan tutkia roolia Cav1 tässä stressin aiheuttama uudelleenjärjestely aktiinisytoskeletonin, AGS /Cav1 ja AGS /EV infektoitiin 16 h H. pylori
G27 wt
tai isogeenisissä mutantti Delta Caga
(MOI = 100). Infektoidut solut värjättiin kuten edellä on kuvattu, ja numerot pitkänomaisen AGS-soluja määritettiin (Fig. 4A, B). Cav1 puutteesta AGS solut osoittivat huomattavasti enemmän pitkänomainen morfologit kuin Cav1 ilmentävien solujen (11 ± 0,8% AGS /EV versus
4 ± 0,8% AGS /Cav1; * p = 1,1 × 10 -8; n = 3 per klooni). Kuten odotettua, ei "kolibri" fenotyyppi saatiin soluissa tartunnan kanssa CagA toimitusta puutteellinen SS1 tai CagA-Deleetiomutantin G27 Delta Caga
kantoja, jotka ovat sekä pysty pistää funktionaalisen CagA proteiinia isäntäsoluihin (tuloksia ei ole esitetty). AGS /EV soluja tuotetaan myös enemmän IL8 mRNA kun H. pylori
G27-infektion kuin AGS /Cav1 soluja (64 ± 19 EV versus
19 ± 6 Cav1; * p = 0,0176, n = 3 per klooni) (Fig. 4C). Nämä tulokset osoittivat, että Cav1 suojaa CagA liittyvän solun stressistä.
1,4 ± 0,1 AGS /Cav1 , * p = 0,0012, n = 3 per klooni) fosforyloidun fokaalisen adheesion kinaasi (FAK) in Cav1 ilmentävien solujen tartunnan H. pylori
G27. Nämä tiedot tukevat että AGS /Cav1 solut infektoitu CagA-toimitus toimivaltaisten H. pylori
säilyttivät levittäytyneet epiteelin kunnossa verrattuna korosti pitkänomainen fenotyyppi Cav1 /EV-soluissa.
G27 laukaisee sitoutumisen p120RhoGAP /DLC1 on Cav1 ihmisen GC-soluissa
G27. Infektio AGS solujen herätti nopean fosforylaation Cav1 in AGS /Cav1 soluja ja Src molemmissa AGS /Cav1 ja AGS /EV-soluissa. Tämä tulos osoitti, että Cav1 toimii alavirtaan CagA riippuvainen Src aktivaation jälkeen, mutta ennen aktivointia pieniä GTPaaseja (Fig. 5A, B). Tätä päätelmää, proteiini tasot fosforyloitua JNK, joka asuu alle Src, olivat korkeampia AGS /EV soluja verrattuna AGS /Cav1 soluja.
G27 bakteerien Cav1 in CoIP tai immunofluoresenssilla (Fig. 6A, B). Gentamysiini suoja määritykset paljastivat, että kokonaismäärä ruiskutetaan solunsisäisen CagA oli myös riippumaton Cav1: n läsnä ollessa (kuvio. 6C). Siten Cav1 eivät estäneet tarttumista H. pylori
bakteerit eikä ruiskuttamalla CagA isäntäsoluun, vaan vähensi alavirran vaikutuksia CagA on solunsisäisen signaloinnin.
G27 (MOI = 100), jota seuraa solujen lyysin huoneenlämpötilassa MES-puskuroidussa 1% (v /v) Triton-X100. Proteiinivyöhykkeet saostetaan Cav1 antiseerumilla visualisoitiin hopeavärjäyksellä, ja peptidit tunnistettiin MALDI-MS julkaistu aiemmin [29]. Proteiini fragmentti ~95 kDa sisältämien vastaavien peptidien variantti 4 p120 Rho GTPaasia aktivoivan proteiinin /poistetaan maksasyövän-1 (p120RhoGAP /DLC1) [51], [52], tuumorisuppressoria liittyy paikallisia tarttumista ja kaveoleja /Rasvalautat [53]. DLC1 variantti 4 (DLC1v4) on ennustettu koko ~110 kDa ja rikastettiin näytteistä soluista, jotka oli infektoitu H. pylori
G27 verrattuna infektoitumattomiin soluihin (taulukko S2). Nämä tulokset vahvistettiin CoIP on Cav1 ja endogeenisen DLC1 proteiinin AGS /Cav1 solut (Fig. 7B), mikä osoittaa, että H. pylori
G27 herätti erityistä rekrytointi DLC1 on Cav1 infektoituneissa ihmisen mahalaukun epiteelisolujen.
G27 (MOI = 100) vielä 16 tuntia. Immunofluoresenssivärjäyksen paljasti, että DLC1 sinänsä
ei estänyt muodostumista CagA aiheuttama "kolibri" fenotyyppi (19 ± 2% AGS /DLC1 versus
19 ± 2% AGS /EV; n = 3 per klooni) verrattuna tyhjällä vektorilla transfektoidut solut (Fig. 8A, B). Sen sijaan, DLC1 edistänyt solunlevitys- (20 ± 3% AGS /DLC1 versus
11 ± 2% AGS /EV; * p = 0,0067, n = 3 per klooni) n rooli säätelyssä paikallisessa tarttumisessa [ ,,,0], H. H. pylori
infektio. pylori
.
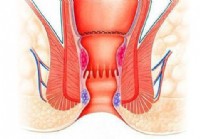 Mitä eroa on nidotulla hemorrhoidopeksialla ja peräpukamanpoistolla?
Mitä peräpukamat ovat? Peräpukamat ovat turvonneet suonet peräsuolen ja peräaukon alimmassa osassa. Niitä kutsutaan myös paaluiksi. Peräpukamia voidaan hoitaa hemorrhoidektomialla tai nidotulla hem
Mitä eroa on nidotulla hemorrhoidopeksialla ja peräpukamanpoistolla?
Mitä peräpukamat ovat? Peräpukamat ovat turvonneet suonet peräsuolen ja peräaukon alimmassa osassa. Niitä kutsutaan myös paaluiksi. Peräpukamia voidaan hoitaa hemorrhoidektomialla tai nidotulla hem
 Mitä ovat 7 kakkatyyppiä? Bristolin jakkarataulukko
Kakka voi vaihdella värin, hajun, määrän ja rakenteen suhteen. Ota selvää, mitkä seitsemästä kakkatyypistä ovat terveitä ja mitkä voivat viitata ongelmaan Kakka voi vaihdella värin, hajun, määrän ja
Mitä ovat 7 kakkatyyppiä? Bristolin jakkarataulukko
Kakka voi vaihdella värin, hajun, määrän ja rakenteen suhteen. Ota selvää, mitkä seitsemästä kakkatyypistä ovat terveitä ja mitkä voivat viitata ongelmaan Kakka voi vaihdella värin, hajun, määrän ja
 7 helposti valmistavaa SIBO-ateriaa, joita voit valmistaa tänä talvena
7 helposti valmistavaa sibo-ateriaa, jotka voit valmistaa tänä talvena Lämpötilan notkahdus kertoo, että on taas täydellinen aika esitellä klassisia talvireseptejä keittiössämme. Todellakin, kun sää
7 helposti valmistavaa SIBO-ateriaa, joita voit valmistaa tänä talvena
7 helposti valmistavaa sibo-ateriaa, jotka voit valmistaa tänä talvena Lämpötilan notkahdus kertoo, että on taas täydellinen aika esitellä klassisia talvireseptejä keittiössämme. Todellakin, kun sää