Le Helicobacter de co-évolué pylori
et le cancer gastrique: trinité de la virulence bactérienne, susceptibilité de l'hôte et le mode de vie
Résumé
Helicobacter pylori
est important agent étiologique non encore prouvées de cancer gastrique. l'infection de H. pylori est plus répandue dans les pays asiatiques en développement, comme l'Inde et il est généralement acquis à un âge précoce. Il a été deux décennies depuis Marshall et Warren (1984) décrit la première bacilles incurvée dans l'estomac de l'ulcère et gastrite patients. Cette découverte leur a valu le prix Nobel récemment, mais le débat de savoir si H. pylori
est un agent pathogène ou d'un organisme commensal est encore chaud. Les associations avec des facteurs spécifiques de la maladie restent des années après les illusoires séquences génomiques ont été mis à la disposition. Cytotoxine antigène associé A (CagA
) et les soi-disant gènes région de plasticité du cluster sont impliqués dans la pathogenèse du carcinome de l'estomac. Un autre facteur de virulence VacA dont le rôle est encore discutable, a récemment été projeté dans la pathologie du cancer gastrique. Les études sur l'évolution à travers la variation génétique dans les populations de H. pylori ont fourni une fenêtre sur l'histoire des migrations des populations humaines et d'une co-évolution possible de ce pathogène avec son hôte humain. relations symbiotiques possibles ont été sérieusement débattues depuis la découverte de ce pathogène. Le débat a été encore intensifié comme certaines études ont proposé l'infection de H. pylori être bénéfique dans certains humains. Dans ce commentaire, nous essayons de discuter brièvement de H. pylori
comme un agent pathogène humain, et quelques-unes des questions importantes liées à sa physiopathologie dans différents hôtes.
'Nous dansons autour dans un anneau et supposons, le secret se trouve au milieu et sait »- Contexte de Robert Frost
Barry J. Marshall et Robin Warren, deux chercheurs australiens qui ont découvert la bactérie Helicobacter pylori
en 1982 ont obtenu le Prix Nobel 2005 de physiologie ou médecine . Ce «vieux travail de détective médical fashioned 'impressionné l'Assemblée Nobel de l'Institut Karolinska, à se déplacer loin de la recherche fondamentale [1, 2] et pour récompenser la recherche qui propose un organisme bactérien controversée beaucoup comme un agent pathogène dangereux. Il était un dogme de longue date dans la science médicale que le stress et le mode de vie facteurs conduisent à la gastrite et l'ulcère gastro-duodénal. Warren et le maréchal réfutées ce dogme et a clairement indiqué que les bacilles courbe appelé Campylobacter pyloridis
(plus tard nommé Helicobacter pylori
) étaient la principale cause de l'ulcération peptique, adénocarcinome gastrique distal, et le lymphome gastrique [3]. Peu après, H. pylori de modèle de colonisation est devenu l'un des exemples les mieux étudiés de l'évolution de l'agent pathogène et son rôle dans la biologie de l'infection. Cela a marqué aussi le début d'un concours sur la durée de H. pylori
avait été colonisant estomac humain, la promotion de l'analogie d'un organisme symbiotique coévolué avec son hôte humain.
H. pylori
comme un marqueur de l'homme peuplant et migration: exemple de co-évolution
H. pylori
est probablement co-évolué avec son hôte et, par conséquent, les origines et l'expansion des multiples populations et sous-populations de H. pylori
miroir anciennes migrations humaines. origines antiques de H. pylori
dans le monde et en Inde ne sont pas claires et discutable. On ne sait pas comment les différentes vagues de migrations humaines dans les différents continents ont contribué à l'évolution de la souche diversité de H. pylori
. Notre groupe a récemment tenté de répondre à ces questions à travers les origines génétiques de cartographie de H. pylori
des Péruviens indigènes (d'ascendance amérindienne) [4] et les Indiens (Devi et al.
, Données non publiées) et leur comparaison génomique avec des centaines d'isolats provenant de différentes régions géographiques. A cet effet, l'identité génétique des souches a été disséquée par fluorescence longueur des fragments amplifiés polymorphisme (FALP) analyse, multilocus sequence typing (MLST) des gènes de ménage et analyse la séquence de B adhésine et
oip les gènes A du bab . Le cag
toute pathogénicité-île (cag
PAI) à partir de ces souches a également été analysée par PCR et séquençage des gènes. Dans le cas des populations de Amérique du Sud H. pylori, il a été observé que, bien que le génotype européen (hp
-Europe) prédominait dans les souches péruviennes indigènes, environ 20% de ces souches représente une sous-population ayant une ascendance amérindienne ( hsp-Amerind
). Cependant, toutes ces souches ont été montrées pour abriter un type cag «occidentale» complète
PAI, indépendamment de leur appartenance ancestrale et les motifs qui l'entourent. Ceci indique une éventuelle acquisition de cag
PAI par les souches de hsp-amérindiennes des souches européennes, au cours des décennies de co-colonisation. Ces observations, par conséquent, ont suggéré la présence de H. pylori ancestrale
(hsp-Amerind
) dans les Amérindiens du Pérou, qui peut-être réussi à survivre et rivaliser avec les souches espagnoles qui sont arrivés dans le Nouveau Monde il y a environ 500 ans. Il a été suggéré que ce qui aurait pu arriver après Peruvian les souches de H. pylori cag natif acquis
séquences PAI, soit par une nouvelle acquisition en cag
souches séronégatifs ou par recombinaison dans cag
souches Amérindiennes positives. En cas de souches indiennes, presque tous les isolats analysés ont révélé une ascendance européenne et appartenaient à MLST génogroupe hp-Europe. Le cag
PAI hébergé par des souches indiennes a également révélé des caractéristiques européennes sur l'analyse basée sur la PCR et le séquençage entier PAI. Ces observations suggèrent que H. pylori
en Inde ont des origines très anciennes en Europe (Devi et al
, données non publiées). Ces résultats devraient renforcer les spéculations liées au remplacement à grande échelle des anciens peuples indigènes de l'Inde par des nomades indo-aryennes, portant premières pratiques et langues néolithiques du Croissant Fertile.
H. pylori
dans les maladies gastriques
H. pylori
provoque une ulcération peptique, adénocarcinome gastrique et le lymphome gastrique. adénocarcinome gastrique est la deuxième cause de décès par cancer dans le monde entier principalement en raison de l'incidence élevée, évolution de la maladie agressive, et le manque d'options de traitement efficaces menant à un nombre de décès d'un million par an dans le monde [3]. H. pylori
est impliqué dans adénocarcinome gastrique distal, qui est plus fréquente que celle proximale. H. pylori
provoque également le tissu cellulaire B associé aux muqueuses lymphoïde (MALT) lymphome de l'estomac [3], mais en même temps associé négativement avec des formes plus sévères de l'oesophagite par reflux et de ses séquelles - Barrett œsophage et adénocarcinome oesophagien [5 , 6]. Cette corrélation négative est la principale raison qui fait H. pylori
un moindre mal. Il y a eu un intérêt récent pour regarder si H. pylori
provoque ou facilite les maladies humaines de l'intestin autres que le tractus gastro-intestinal supérieur ou syndromes comme purpura thrombopénique idiopathique [5, 6], les maladies de la peau, maladies du foie, et cardio-vasculaires et maladie cérébrovasculaire. Mais beaucoup d'entre eux ont été associés le plus souvent avec des Helicobacters autres que H. pylori
[7, 8].
Bactérienne proinflammatoire codé et facteurs cancérigènes
Des études révèlent que le risque de développer un carcinome gastrique était beaucoup plus grande avec l'infection de la bactérie H. pylori [9]. Le cag
Un gène de H. pylori
est le facteur de virulence principale qui mène au développement de l'adénocarcinome gastrique par dérèglement de l'architecture cellulaire et la signalisation. Présence d'une cag fonctionnelle
Un gène détermine le H. pylori
type de souche à être agressif ou légère. Le cag
A-positives souches provoquent une ulcération plus intense de l'estomac ou du duodénum et sont plus dommageables que les cag
les A-négatives [10] conduisant à une gastrite atrophique et cancer gastrique [11, 12]. CagA, le produit de protéine effectrice de
cag A, est la tyrosine phosphorylée par kinases Src après sa sécrétion sur la surface de la muqueuse intestinale [13]. des motifs Epiya dans la séquence de la protéine CagA jouent un rôle critique dans la phosphorylation de la tyrosine, ce qui active à son tour une phosphatase SHP2 d'agir comme un oncoprotéine. SHP2 comme aide à la croissance cellulaire et la motilité, la dérégulation par CagA est un mécanisme important de oncogène codé par H.pylori
. CagA basé sur la variation de séquence au site de liaison de SHP2, est sous-classés en deux principaux types épidémiologiques - CagA Est asiatique (avec une liaison plus forte SHP2 et une plus grande activité biologique) et CagA Western (diminution de liaison SHP2 et plus doux potentiels ulcéreuse). Souches avec de multiples motifs CagA de phosphorylation de tyrosine sont plus fréquemment associés au cancer gastrique que ceux avec moins de motifs de type C [14-16].
Incidence de l'infection par H. pylori
portant CagA biologiquement plus actif pourrait expliquer la fréquence élevée du cancer de l'estomac dans certains pays tels que le Japon et la Corée. Cependant, d'autres populations avec des taux d'infection extrêmement élevés, comme les Indiens ont l'incidence presque négligeable du carcinome gastrique [17]. Les raisons possibles de ces différences étranges de l'issue de la maladie peuvent être expliqués à la lumière des différences de susceptibilité génétique au sein des populations d'accueil, les facteurs environnementaux tels que les habitudes alimentaires, et la souche différences de H. pylori
.
H. pylori
a une seule copie du vac
un gène codant pour la protéine VacA, a sécrété 95 kDa peptide. Le vac
Un gène varie dans la séquence de signal (allèles S1a, S1b, S1C, s2) et /ou sa région médiane (allèles m1, m2) entre les différentes populations
H. pylori. Les différents allotypes de s et m régions déterminent l'étendue de la cytotoxicité de VacA. Souches avec vac
Un génotype s1 /m1 sont plus fréquemment associés au cancer gastrique que les autres types [18]. Entre autres fonctions, VacA a été montré pour induire l'apoptose dans les cellules épithéliales. Récemment, il a été proposé VacA une toxine puissante immunomodulateur, en ciblant le système immunitaire adapté pour supprimer les réponses immunitaires locales pour prolonger l'issue de l'infection et empêcher ainsi la clairance par le système immunitaire de l'hôte [19]. Le VacA a fait l'objet de la biochimie intense mais il manquait des preuves solides qu'il est en effet impliquée dans la pathogenèse. Une étude récente affirme que VacA a un rôle minuscule comme un facteur de virulence lors de l'évasion de la cellule par H. pylori
. Ils ont montré que la vac
Un mutant nul de H. pylori
a pu échapper à des lignées cellulaires spécifiques, comme l'a fait son type sauvage [20]. Par conséquent, la participation VacA fait toujours partie d'un débat sur son être un véritable facteur de virulence et attend une enquête plus approfondie.
Outre la virulence cardinale Facteurs CagA et VacA, plusieurs autres protéines de la cag
PAI, enveloppe de la membrane externe protéines, flagellines, adhésines, neutrophiles protéine d'activation (NAP), porines, LPS, uréase et certains membres de la région que l'on appelle groupe de plasticité peut jouer un rôle important dans les processus inflammatoires
microévolution pendant la colonisation:. peut-il être lié à la virulence optimisation?
On a longtemps supposé que i) les facteurs de virulence de H. pylori sont caractéristiques stables au milieu d'un génome sinon rapide évolution et recombiner et ii) que ces facteurs peuvent être liés à la progression ou le résultat des maladies, à tout temps. Toutefois, les données de plusieurs rapports actuels contre ces hypothèses. Deux sous-clones d'un H. pylori
souche co-colonisé un seul patient avec des variations de vac
Une région mi, ce qui rend l'un des deux sous-clones non toxiques [21]. La raison pour cela était clairement le microévolution via
recombinaison dans l'estomac. Notre groupe a déjà montré une grande délétion dans vac
Un gène se produisant dans l'un des deux isolats d'une souche de progéniteur commun chez un patient français, a obtenu 9 ans d'intervalle [22]. Ce fut très probablement un cas d'adaptation ou d'évolution in vivo
. Duplication ou suppression de la cag
Un gène a été démontré par Aras et al
., [23] dans deux isolats existant à un individu et récupéré 7 ans d'intervalle. Kersulyte et al
, ont montré la suppression complète de cag
PAI par recombinaison [24]. En outre, diverses méthodes de génotypage appliquées à deux ou plus de H. pylori
isolats obtenus à partir du même patient ont révélé des empreintes similaires, avec des différences mineures [25, 26]. Cela peut être possible en raison du fait que deux ou plusieurs isolats récupérés à partir d'un patient peuvent partager une relation ancestrale avec une souche fondatrice, mais ont subi des altérations génomiques indépendants. Ce phénomène a été nommé comme «microévolution» [25, 27]. Toutefois, la preuve de la séquence est nécessaire pour confirmer l'emplacement et l'étendue de la microévolution et la confirmation phénotypique [16] est nécessaire pour déterminer si un tel microévolution conduit à la modification ou l'optimisation de la virulence en réponse au changement dans l'environnement gastrique.
Hôte facteurs génétiques H. pylori
Induced carcinome
facteurs de l'hôte jouent également un rôle important dans la prédisposition à H. pylori
maladies et susceptibilités induites vers les résultats pathologiques graves. Les facteurs de l'hôte pertinents H. pylori maladies induites
comprennent principalement des composants du système de sécrétion gastrique et l'appareil immunitaire. Fait intéressant, la gastrite et l'ulcère de maladies qui résultent d'une infection bactérienne, ont des profils cliniques distincts et sont inversement associés à un degré élevé de sécrétion d'acide, alors que les cancers gastriques sont associés à la sécrétion d'acide faible en raison de la perte de masse des cellules pariétales [28, 29 ]. Dans une étude récente portant sur une population indienne East, les auteurs ont suggéré une association entre les polymorphismes du gène IL1β et médiée risque de l'ulcère duodénal de H. pylori. Ils ont observé davantage les effets des génotypes spécifiques IL1β sur l'expression de l'ARNm IL1β dans la muqueuse gastrique. Leurs vivo
études en ont encore été confirmées, pour la première fois, par vitro
expériences, qui représentent les génotypes de risque homozygotes opposés qui ont été observés chez les patients ulcère duodénal [30]. Donc, ce qui pourrait expliquer le fait que les différences de risque de cancérogenèse chez les personnes de différentes zones géographiques pourraient refléter des différences dans leur constitution génétique
Le Pays énigme en développement:.? Indiens, l'alimentation et la prédisposition au cancer gastrique
Quelle est énigmatique le scénario de cancer gastrique en Inde? La réponse est simple. Ce pays a une forte prévalence des infections de H. pylori et un faible risque de cancer gastrique contrairement à certains des pays développés avec H. pylori
faible taux de colonisation, comme la Chine et le Japon. L'Inde est connue pour une très forte incidence de l'infection à H. pylori
[31, 32]. Biologiquement CagA inactive pourrait être un facteur contributif dans la faible prévalence des ulcères gastriques et le cancer en Inde. Cependant, les études de phénotypage fondées sur l'évaluation in vitro
fonction CagA dans les isolats indiens n'a pas été fait. À notre avis, il sera approprié d'impliquer la fonctionnalité CagA seul. Le spectre et les résultats de la pathologie dans l'infection de H. pylori est étroitement régie par toutes les trois facteurs - la virulence, la génétique de l'hôte et l'environnement. Il semble que l'environnement de l'estomac (acidité, tampon et le contenu de mucus) régi par des facteurs de style de vie (alimentation, les habitudes alimentaires, l'alcoolisme, de l'hygiène bucco-dentaire, l'hygiène de l'eau, l'hygiène personnelle, la proximité avec les communautés et les animaux agricoles) et les déterminants génétiques de la sensibilité sont les conducteurs principaux du résultat pathologique. Bien que les facteurs de la pauvreté associée (surpeuplement, une mauvaise hygiène, le statut socio-économique plus faible, compromis l'hygiène de l'eau, etc.) dans des pays comme l'Inde facilitent la fréquence élevée de H. pylori
colonisation, après l'éradication re-colonisation rapide et l'âge inférieur d'acquisition [33 ]; un fait surprenant est que ces zones sont à risque plus faible de développer un cancer gastrique [34]. Corrélation entre l'infection et le cancer de l'estomac H. pylori a été jusqu'ici sans succès en Inde [35]. Une étude récente de l'Inde portant sur 279 patients atteints de tumeurs gastriques n'a pas montré une prévalence plus élevée de l'infection de H. pylori chez les patients présentant des tumeurs gastriques par rapport aux témoins (101 dyspepsie non ulcéreuse et 355 sujets sains) [36]. Ces observations remettent en question la polyvalence des modèles simplifiés de la cancérogenèse gastrique basé sur l'infection de H. pylori. Nous pensons que dans le contexte indien, le régime alimentaire comme un facteur environnemental majeur régit la dynamique démographique de cancer gastrique principalement en régulant l'intégrité physiologique des niches de la muqueuse gastrique. Et c'est là; les habitudes alimentaires et les facteurs de style de vie deviennent importants dans le contexte de progression de la gastrite à un cancer gastrique. Les régimes alimentaires faibles dans les légumes, les fibres et les fruits et élevés dans les aliments conservés dans le sel ou la viande de sel transformés augmentent le risque de cancer de l'estomac [37].
Par conséquent, dans de telles situations, il semble y avoir une différence dans la fréquence de distribution de l'estomac L'incidence du cancer. Les régions du sud et de l'est de l'Inde ont une fréquence plus élevée de cancer gastrique que le reste du pays [38]. Le riz est l'aliment de base dans le sud, alors que les poissons, la viande, les épices et les sels sont les principaux produits alimentaires en partie orientale [37-39]. Contrastingly, la grande population végétarienne dans le nord de l'Inde est à faible risque de cancer gastrique. Mais les temps changent; flourish rapide de la culture d'entreprise post-mondialisation a fast-foods, des bouteilles d'eau exempte de germes, le lait pasteurisé et les morceaux de viande conservés jusqu'à nos jours de vie dans les grandes villes indiennes. Cependant, il sera trop tôt pour le lier avec l'augmentation du nombre de cancers gastriques dans les villes en Inde [39].
Inversement, faible à l'incidence négligeable du cancer gastrique comme enregistré pour les zones rurales en Inde par le registre national du cancer [39] nous amène à se demander pourquoi les communautés rurales ont des avantages distincts en termes de moins de dommages de l'infection de H. pylori. Il doit être étudié si ces avantages sont dus à leur régime alimentaire à base de produits frais de la ferme et de leur «amitié» avec les soi-disant «vieux amis», le groupe de bactéries qui pourraient être le maintien des niveaux de populations immunitaires réglementaires cellulaires et ont été étroitement associés pendant la majeure partie de l'évolution des mammifères
. Déclarations
Remerciements
Auteurs tient à remercier le professeur Seyed E. Hasnain pour ses conseils et pour les discussions.
YA est récipiendaire de junior Research Fellowship du Conseil de Scientific & Recherche industrielle (CSIR), Gouvernement. de l'Inde. La recherche dans le laboratoire de NA a été soutenu par des subventions du Département de la biotechnologie, Govt. de l'Inde.
Intérêts concurrents
L'auteur (s) déclarent avoir aucun conflit d'intérêts.
 D'autres rappels de bœuf cru en raison de la bactérie Salmonella :USDA
D'autres rappels de bœuf cru en raison de la bactérie Salmonella :USDA
 Le rôle des mastocytes dans notre santé
Le rôle des mastocytes dans notre santé
 Troubles digestifs :ce que signifient votre type et la couleur de caca
Troubles digestifs :ce que signifient votre type et la couleur de caca
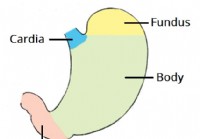 L'estomac
L'estomac
 Types de sondes d'alimentation et leurs utilisations
Types de sondes d'alimentation et leurs utilisations
 Le microbiome du pénis est un réservoir pour les bactéries associées à la vaginose bactérienne
Le microbiome du pénis est un réservoir pour les bactéries associées à la vaginose bactérienne
 Qu'est-ce que cela signifie lorsque vous vomissez de la bile ?
Le fait de vomir de la bile nest pas toujours préoccupant, car il peut résulter daffections moins graves, telles que des vomissements à jeun. La bile est un liquide jaune verdâtre produit par le foie
Qu'est-ce que cela signifie lorsque vous vomissez de la bile ?
Le fait de vomir de la bile nest pas toujours préoccupant, car il peut résulter daffections moins graves, telles que des vomissements à jeun. La bile est un liquide jaune verdâtre produit par le foie
 Probiotiques
Un homme mange du yaourt au petit-déjeuner. Que sont les probiotiques ? Lidée que les bactéries sont bénéfiques peut être difficile à comprendre. Nous prenons des antibiotiques pour tuer les infectio
Probiotiques
Un homme mange du yaourt au petit-déjeuner. Que sont les probiotiques ? Lidée que les bactéries sont bénéfiques peut être difficile à comprendre. Nous prenons des antibiotiques pour tuer les infectio
 Cinq raisons d'investir dans votre santé intestinale dès maintenant
Des milliards de bactéries vivent dans votre intestin. Lorsquils sont équilibrés et heureux, ils protègent votre santé. La seule façon de le savoir est deffectuer un test du microbiome intestinal. Vo
Cinq raisons d'investir dans votre santé intestinale dès maintenant
Des milliards de bactéries vivent dans votre intestin. Lorsquils sont équilibrés et heureux, ils protègent votre santé. La seule façon de le savoir est deffectuer un test du microbiome intestinal. Vo