Estratto
Il tratto gastrointestinale degli animali è stato adattato per la loro fonte primaria di cibo per ottimizzare l'utilizzo delle risorse e l'assunzione di energia. specie di pipistrelli temperate si nutrono soprattutto di artropodi. Questi contengono la chitina carboidrati ricchi di energia, che è digeribile per gli enzimi endogeni di un tipico tratto gastrointestinale dei mammiferi. Tuttavia, il tratto gastrointestinale di specie di pipistrelli deve essere adattato alla loro dieta ed essere in grado di digerire chitina. Abbiamo ipotizzato che (i) le specie di pipistrelli vespertilionid europei hanno il chitinasi enzima digestivo e che (ii) l'attività chitinolytic si trova nell'intestino, come è stato trovato per specie di pipistrelli del Nord America. I tratti gastrointestinali di sette specie di pipistrelli ( Pipistrellus pipistrellus Visto:. Strobel S, Roswag A, Becker NI, Trenczek TE, Encarnação JA (2013) I pipistrelli insettivori Digest chitina nello stomaco Utilizzando acido mammiferi chitinasi. PLoS ONE 8 (9): e72770. doi: 10.1371 /journal.pone.0072770 Editor: François Blachier, Istituto nazionale di ricerca agronomica, Francia | Ricevuto: March 26, 2013; Accettato: 12 Luglio 2013; Pubblicato: 3 Settembre 2013 Copyright: © 2013 Strobel et al. Questo è un articolo ad accesso libero distribuito sotto i termini della Creative Commons Attribution License, che permette l'uso senza restrizioni, la distribuzione e la riproduzione con qualsiasi mezzo, a condizione che l'autore originale e la fonte sono accreditati Finanziamento:. Gli autori non hanno alcun sostegno o finanziamento di riferire Conflitto di interessi:.. Gli autori hanno dichiarato che non esistono interessi in competizione Introduzione Animali avere ingerire e digerire il cibo per garantire la funzionamento continuo del loro metabolismo interno coprendo, per esempio, la loro energia, proteine e vitamine requisiti [1]. Il processo a più stadi della digestione include passaggi enzimatici meccaniche, chimiche e di nutrienti conversione [2]. specie Bat hanno un alto specifica massa domanda di energia a causa della loro piccola dimensione e la capacità di volare attivamente [3], [4]. Negli animali volanti, il cibo deve essere elaborata rapidamente per ridurre la domanda di energia causata da un aumento della massa di volo [2]. specie di pipistrelli europei hanno una dieta composta prevalentemente da artropodi [5]. Hanno tempi di ritenzione brevi [6] ma un'alta efficienza digestivo [7]. Questo suggerisce che il loro tratto gastrointestinale (GI) è altamente adattato alle loro dieta dal momento che digerisce artropodi rapidamente e completamente. Pertanto, si potrebbe sostenere che le specie di pipistrelli europei dipendono enzimi digestivi specifici artropodi. Poiché artropodi consistono di fino a 75% chitina (contenuto energetico 21,2 kJ /g, [8]), è altamente plausibile che le specie di pipistrello sono in grado di digerire materiale chitinoso, come è stato dimostrato in altri vertebrati, come la lucertola verde europea ( Lacerta viridis chitina può essere degradata da chitinasi (CE 3.2.1.14) e alcuni lisozimi (CE 3.2.1.17) [11], [12]. Nei mammiferi, sono stati identificati solo due chitinasi: chitotriosidasi e chitinasi acida mammiferi (AMCase) [13], entrambi i quali sono classificati come endochitinases [14]. Chitotriosidasi è secreto principalmente dai fagociti e agisce contro gli agenti patogeni chitina contenenti [15]. AMCase ha finora solo stato identificato nei topi (Mus musculus), macachi (Macaca fascicularis) e gli esseri umani [16], [17]. Esso è altamente espresso nello stomaco e del polmone, indicando una doppia funzione digestiva e immunologica [16], [17]. attività Chitinolytic può anche provenire da enzimi endogeni, cibo ingerito presenti nel tratto gastrointestinale, o enzimi prodotti dai microrganismi [18], [19]. attività Chitinolytic nel tratto GI è stato trovato in molte specie di pipistrelli insettivori [8], [9]. Tuttavia, non vi è alcuna conoscenza circa corrispondente enzima. Jeuniaux [9] ha verificato l'attività chitinolytic nel tratto gastrointestinale di Rhinolophus ferrumequinum Noi ipotizziamo che (i) specie europee di pipistrelli insettivori della famiglia Vespertilionidae possedere attività chitinolytic nel tratto gastrointestinale, come è stato dimostrato per le specie di pipistrelli insettivori del Nord America [8] e una specie di pipistrelli europei della famiglia Rhinolophidae [9] e (ii) l'attività chitinolytic si trova nell'intestino, come è stato mostrato nella specie nordamericana [8]. In questo studio, abbiamo individuato l'attività chitinolytic e identificato l'enzima corrispondente come AMCase utilizzando un test enzimatico, immunoblotting e immunoistochimica. Etica dichiarazione Tutti gli individui usato in questo studio morto a centri di riabilitazione di volontariato per i pipistrelli. Essi sono stati consegnati da volontari senza alcun tipo di rimborso. Secondo l'Animal Welfare Act tedesco (TschG § 4 (3)) e alla legge federale la protezione della natura (BNatSchG § 45 (4)) senza il permesso è richiesto per lavorare sulle carcasse. Lo stomaco del mouse era un residuo di uno studio da parte dell'Istituto di Anatomia e Biologia Cellulare presso la Justus-Liebig-University of Giessen che è stato approvato dalla Giunta regionale (n V54-19C20 /15C Giessen 20/23 400AZ). Nessun animale è stato ucciso per le finalità di questo studio. carcasse sono state memorizzate subito dopo la morte a -20 ° C. I pipistrelli sono stati consegnati sul ghiaccio cioè congelato per l'Università di Giessen. Le carcasse sono state conservate per un massimo di sei mesi a -80 ° C fino preparazione del tessuto. osservazioni macro e microscopiche verificato l'ottima conservazione degli organi e cellule che ha fatto enzimatiche e istologici esami dei tessuti possibile. preparazione dei tessuti Le carcasse di sette specie di pipistrelli insettivori, senza alcun segno di putrefazione ( Pipistrellus pipistrellus Preparazione di frazioni proteiche solubili segmenti del tratto GI di campioni, non fisso fresche di P. Pipistrellus Determinazione dell'attività chitinolytic Per misurare l'attività chitinolytic, piastre di gel di agarosio sono state preparate come descritto da Zou, Nonogaki &.; Welbaum [24] con alcune modifiche. acido fosforico chitina gonfio è stato preparato miscelando 10 g chitina da gusci di granchio (Roth, Germania) con acido fosforico 100 mL 85% e incubate per 48 ore a 4 ° C. Poi è stato aggiunto 2 L acqua di rubinetto fredda e la torta risultante è stato lavato fino a raggiungere pH 6,5 [25], [26]. Agarosio (1,6%) è stato sciolto in tampone di incubazione (pH 5,0) [24] in un forno a microonde e raffreddato a 50-60 ° C. Successivamente, è stata aggiunta la chitina gonfia acido fosforico (0,5%) e 10 ml di questa sospensione è stato pipettato in 85-mm Petri. Dopo la polimerizzazione, i pozzi da 4 mm di diametro sono stati perforati in pezzi di agarosio e gel sono stati rimossi con una pompa a getto d'acqua Polvere liofilizzata di chitinasi standard dal Serratia marcescens Per analizzare l'attività enzimatica a differenti valori di pH, piastre di gel sono stati preparati come prima, ma con differenti valori di pH (pH 4,0, pH 5,0, pH 6,0, pH 7,0 e pH 8,0). Surnatanti dello stomaco, duodeno, digiuno /ileo, ileo /colon e del colon /retto di un individuo di p. pipistrellus L'espressione della chitinase nel tratto GI analisi Western blot. Western blotting è stato eseguito per identificare e localizzare biochimicamente chitinasi nel tratto gastrointestinale di specie di pipistrelli europei e di escludere l'attività chitinolytic causata da lisozimi. I sopranatanti di campioni di tessuto provenienti da sei specie di pipistrelli (campioni sezione tratto gastrointestinale (stomaco, duodeno, digiuno /ileo, ileo /colon e del colon /retto):. P pipistrellus I supernatanti di ogni tessuto 750 mcg stati mescolati 01:01 in 2 × SDS tampone di gel-loading e riscaldata a 95 ° C per 3 min. Di ciascun campione, 15 ml è stato sottoposto ad una risoluzione di gel di 12% e il gel di impilamento 5%. Elettroforesi è stata eseguita in condizioni riducenti con una tensione di 100 V. Le proteine separate sono stati electroblotted per 1 h ad una corrente costante di 0,8 mA /cm 2 su membrane PVDF. I blot sono state bloccate con 5% non grassa latte in polvere in tris salina tamponata (TBS, pH 7,5) contenente 0,1% di Tween 20 (Roth) per 1 h prima di incubazione con un anticorpo policlonale di coniglio diretto contro l'N-terminale di chitinasi acida ( AVIVA Systems Biology, CA, USA; diluito 1:1000 in TBS contenente BSA 1%) a 4 ° C durante la notte. Dopo lavaggio con TBS contenente 0,05% di Tween 20 e 0,1% BSA, le membrane sono state incubate per 1 h con alcalina anticorpi fosfatasi capra coniugato policlonale di coniglio IgG (H & L) (Roth, Anti Rabbit-AP 4751; diluito 1:7500 in TBS contenente 1% BSA). Le macchie sono state lavate quattro volte e legame degli anticorpi è stato visualizzato mediante incubazione con bromochloroindoyl fosfato (Bethesda Research Laboratories, MD, USA) e del substrato nitroblu tetrazolio (Biotech Trade & Service GmbH, Germania) secondo Harlow e Lane [30] immunoistochimica. Per localizzare AMCase a livello cellulare, analisi immunoistochimica è stata eseguita su segmenti del tratto GI di P. Pipistrellus attività Chitinolytic Siamo stati in grado di rilevare chitinolytic attività nei campioni di stomaco di tutti gli individui (ad esempio Fig. 1) e nel campione colon /retto uno, M. Myotis, M. l'espressione della chitinase nel tratto GI analisi Western blot del M. musculus Abbiamo ipotizzato che le specie europee di pipistrelli insettivori della famiglia Vespertilionidae hanno la chitinasi enzima digestivo. Questa ipotesi è stata confermata dalla presenza di attività chitinolytic nello stomaco di specie studiate. Inoltre, un vero e proprio chitinasi, più in particolare AMCase, potrebbe essere biochimicamente identificata in tutti i campioni di stomaco. chitinasi attivi sono comuni e conservata tra i mammiferi [14]. Tuttavia, la posizione e la funzione del AMCase differiscono tra le specie e non sono completamente risolti [31]. Abbiamo inoltre ipotizzato che l'attività chitinolytic si trova nell'intestino, soprattutto nel piccolo intestino, come è il sito dove il principale digestione enzimatica e l'assorbimento avviene [32]. I nostri risultati non hanno confermato questa ipotesi come l'attività chitinolytic era localizzata principalmente nello stomaco e per tre individui a bassi livelli di attività nel colon /retto. L'elevata variabilità dell'attività chitinolytic negli individui studiati potrebbe essere causato variando attività digestiva degli individui al momento della morte. Questo è supportato da diverse quantità di cibo trovati nel tratto GI. L'attività chitinolytic nei campioni di stomaco, ma non nei campioni di colon /retto potrebbe essere fatta risalire all'attività del AMCase e non ad un lisozima da western-blotting. L'attività di pipistrello AMCase era ottimale tra pH 5,0 e pH 6,0. Questi livelli di pH sono paragonabili con l'ambiente acido nello stomaco di specie di pipistrelli insettivori come misurato nel presente studio e riportato da Naumova e Zharova [33]. Questa è una prima indicazione per la rilevanza biologica di AMCase durante la digestione in questa parte del tratto GI. Tuttavia, ulteriori esperimenti come le prove di efficienza digestivi dovrebbero essere condotti per verificare se l'attività di AMCase pone un significato biologico di digestione chitina. AMCase ha una duplice funzione di immunità e la digestione di organismi chitina contenenti [34], [35]. Per esempio, AMCase umana non è adatta all'ambiente acido dello stomaco, a differenza del AMCase trovato in topi [31]. Lo stomaco AMCase di M. musculus I risultati immunoistochimici di questo studio supportano la localizzazione del AMCase nello stomaco di specie di pipistrelli, in particolare nelle ghiandole gastriche della mucosa . Inoltre, abbiamo scoperto che l'enzima era situato in o intorno sommi cellule situate alla base delle ghiandole gastriche, come precedentemente indicato per lo stomaco AMCase di M. musculus Ringraziamo E. Rio di Pusteria, R. Keil , N. Dittrich e S. Wiegand per i campioni animali e Y. Kühnel, C. von Bredow, A. Diebel e l'ecologia dei mammiferi Gruppo per il loro aiuto.
, Plecotus auritus
, Myotis bechsteinii
, Myotis nattereri
,
e Nyctalus leisleri
) sono stati testati per l'attività chitinolytic mediante test di diffusione. tratto gastrointestinale di p. pipistrellus
, P. auritus
, M.
nattereri, M. Myotis,
e N. leisleri
sono stati esaminati per acida chitinase mammiferi mediante analisi Western Blot. Le sezioni di tessuto del tratto gastrointestinale di p. pipistrellus
sono stati immunoistochimica analizzati per individuare la chitinasi mammiferi acida. attività Chitinolytic è stata rilevata nello stomaco di tutte le specie di pipistrelli. Analisi Western Blot ha confermato la chitinasi mammiferi acida nei campioni di stomaco. Immunoistochimica del P. pipistrellus
tratto gastrointestinale indicato che acida chitinasi mammiferi si trova nelle cellule principali stomaco alla base delle ghiandole gastriche. In conclusione, specie europee di pipistrelli vespertilionid hanno chitinase mammiferi acido che viene prodotto nelle ghiandole gastrici dello stomaco. Pertanto, i tratti gastrointestinali di specie di pipistrelli insettivori evoluti un adattamento enzimatico alla loro dieta
), il merlo comune ( Turdus merula
) e la volpe rossa ( vulpes vulpes
) [9], [10].
, una specie di pipistrelli europei della famiglia Rhinolophidae. Whitaker et al. [8] dimostrato attività chitinolytic nel tratto gastrointestinale del Nord America vespertilionid specie di pipistrelli dei generi Myotis
, Eptesicus
, nycticeius
, Lasiurus
, Pipistrellus
e Lasionycteris
. Hanno isolato ceppi di batteri che producono chitinasi dall'intestino come fonte per l'attività chitinolytic. Al contrario, [9] Jeuniaux trovato prove di attività chitinolytic nella mucosa gastrica dello stomaco di Rhinolophus ferrumequinum
mentre l'intestino mostrato alcuna attività chitinolytic. Tuttavia, Buchholz, Wells & Conaway [20] non ha potuto rilevare qualsiasi chitinase nelle specie di pipistrelli insettivori Pipistrellus subflavus
e Myotis grisescens
. Inoltre chitinasi, alcuni lisozimi sono in grado di sciogliere la chitina [11], [12]. Ad esempio, Phillips, Weiss & Tandler [21] ha rilevato il lisozima in ghiandole salivari di specie di pipistrelli insettivori e ipotizzato che potrebbe agire come un enzima chitinolytic nella saliva. Tuttavia, lisozimi sono principalmente anti-batteriche e sono una parte importante del sistema immunitario [22] o per la digestione dei batteri nei ruminanti [12].
Materiali e Metodi
stoccaggio dei tessuti
( n
= 14), Plecotus auritus
( n
= 3), Myotis bechsteinii
( n
= 1), Myotis nattereri
( n
= 3), Myotis daubentonii
( n
= 2) , Myotis Myotis
( n
= 1) e Nyctalus leisleri
( n
= 1)) sono stati utilizzati in questo studio (Tabella 1) . Dopo l'apertura della parete addominale, il tratto GI è stato rimosso, lavato con NaCl allo 0,9%, ed essiccato su carta da filtro. Il tratto GI è stato diviso in esofago, stomaco, duodeno, digiuno /ileo, ileo /colon e del colon /retto dopo Ishikawa et al. [23] e pesato su una bilancia digitale (EW2200-2NM, la precisione: 0,01 g; Kern & Sohn GmbH, Balingen, Germania). Inoltre, lo stomaco di un Mus musculus
(ceppo C57BL /6, Nero 6; n
= 1). È stato utilizzato come controllo positivo per il rilevamento AMCase mediante western blotting
( n
= 11), P. auritus
( n
= 3), M. bechsteinii
( n
= 1), M. nattereri
( n
= 3), M. daubentonii
( n
= 2), M. Myotis
( n
= 1) e N. leisleri
( n
= 1) e lo stomaco di M. musculus
sono stati macinati singolarmente in un mortaio e pestello con purissimo mare di sabbia (Merck, Germania) e 0,9% di NaCl (importo tessuto standardizzato: 1 ml ogni 100 tessuto mg). Gli omogenati sono state incubate overnight a 4 ° C [10] e poi centrifugato (20 min, 3500 g, 4 ° C). I surnatanti sono stati mantenuti a -20 ° C fino a quando ulteriori analisi
(5 U.; Sigma-Aldrich, Germania) è stato sciolto in 1 ml di tampone di incubazione, come il brodo soluzione standard. Una concentrazione nota di chitinasi standard è stato aggiunto ad ogni piastra come tampone di riferimento e l'incubazione è stato utilizzato come controllo negativo. Innanzitutto, 6 campioni microlitri di ciascuna soluzione sono stati pipettati in ogni pozzetto, dopo di che le piastre sono state incubate per 20 min a temperatura ambiente per consentire campioni diffondono nel agar. Poi un ulteriore campione L è stato aggiunto a ciascun pozzetto e le piastre sono state incubate a temperatura ambiente per 20 minuti seguita da incubazione a 37 ° C per 20 h. piastre di agarosio sono state poi colorate con lo 0,1% calcofluor (calcofluor Illuminante M2R, Sigma, MO, USA) per 10 minuti e si lavano con acqua distillata per 2 ore. zone litiche sono state visualizzate utilizzando transilluminazione UV e poi fotografati. I diametri delle zone litiche sono stati misurati utilizzando GIMP (versione 2.6.11; www.gimp.org). Utilizzando una serie di diluizioni di riferimento della soluzione chitinasi azione con attività enzimatiche tampone di incubazione sono stati calcolati in base al diametro della zona rispetto al logaritmo della concentrazione e variazione tra le piastre sono stati adeguati agli standard chitinasi interni utilizzati su ogni piastra di Petri.
sono stati utilizzati. Le zone litiche sono state visualizzate utilizzando transilluminazione UV e analizzati come prima. Inoltre, i valori di pH delle sezioni del tratto gastrointestinale di cinque individui su P. pipistrellus
sono stati misurati utilizzando carta pH multicolore-coded (pH 0,0-6,0: Acilit, accuratezza 0,5; 6,5-10,0 pH: Indicatore speciale, accuratezza 0,3; Merck).
( n
= 2 ), P. auritus
( n
= 2), M. nattereri
( n
= 1), M. myotis
( n
= 1) e n leisleri
( n
= 1); campioni di stomaco supplementari:.. P pipistrellus
( n
= 9), M. nattereri
( n
= 1), M. daubentonii
( n
= 2)) e lo stomaco di un M. musculus
utilizzato come controllo positivo [27] sono stati sottoposti a elettroforesi sodio dodecil solfato-poliacrilammide (SDS-PAGE) (Laemmli [28] modificato dopo Sambrook, Fritsch & Maniatis [29]).
( n
= 3). Le parti del tratto GI sono stati fissati in paraformaldeide al 4% in tampone fosfato isotonico (pH 7,0) per 24 h prima di essere state lavate 4 × 1 h con TBS. Poi i blocchi di tessuto sono stati disidratati in una serie graduata di etanolo (30%, 50%, 70%, 90%, 100%) ed infine inclusi in paraffina. I blocchi di paraffina sono stati tagliati in sezioni di 4-9 micron di spessore con un microtomo slitta (Leitz, Germania) sono stati essiccati durante la notte. Per ottenere i siti di legame antigene accessibili, sezioni di tessuto sono stati predigeriti con pepsina (Sigma) dopo Goto et al. [27]. Le sezioni sono state lavate con 0,01% Tween 20 in TBS. siti non specifici sono stati bloccati con 5 siero di capra% (Merck) nel 3% di BSA (AppliChem, Germania). Le sezioni sono state esposte all'anticorpo policlonale di coniglio diretto contro l'N-terminale di acido chitinasi (AVIVA Systems Biology; diluito 1:200 in TBS contenente 1% BSA) in una camera umida. Gli anticorpi non legati sono stati rimossi mediante lavaggio con TBS, prima che l'anticorpo secondario (ChromeoTM 546, Abcam, Regno Unito, diluito 1:2500 in 0,5% di BSA in TBS) è stata applicata. Per le sezioni di contrasto nucleari sono state incubate con 0,05% 4 ', 6-diamidino-2-phenylindole (DAPI) (AppliChem). Dopo un risciacquo finale con TBS, le sezioni sono state montate con 1,4-diazabiciclo [2.2.2] ottano soluzione (DABCO) (Sigma). Per il controllo di autofluorescenza e specificità di legame degli anticorpi le sezioni sono state elaborate con isotiocianato di fluoresceina (FITC) marcato anticorpo secondario ma senza anticorpo primario. Le sezioni sono state valutate utilizzando un microscopio a fluorescenza (Olympus BX60 F-3; Olympus Optical Co LTP, Germania).
Risultati
nattereri e N. leisleri
ciascuna (Tabella 2). Nessuna attività chitinolytic poteva essere misurata nel duodeno, digiuno /ileo o campioni di ileo /colon. L'attività chitinolytic nei campioni di stomaco era più alta tra pH 5,0 e pH 6,0 (Fig. 2). Sostenere nostri risultati precedenti, nessuna attività chitinolytic è stata rilevata nelle altre regioni del tratto GI, indipendentemente dal valore del pH. Il valore del pH medio del tratto GI di P. pipistrellus
( n
= 5) è stato 5,6 ± 0,2 nello stomaco, 7,0 ± 0,3 nel duodeno, 7,1 ± 0,2 nel digiuno /ileo, 7,0 ± 0,2 nell'ileo /colon e 7,0 ± 0,5 nel colon /retto.
stomaco mostrava una banda caratteristica ad un peso molecolare relativa di 46 k, indicando la presenza di AMCase. Inoltre, in tutti i campioni di stomaco di P. pipistrellus, P. auritus, M. nattereri
, M. Myotis
, e N. leisleri
una banda proteica chiaro a 46 k è stato identificato (per le immagini rappresentative Western Blot, vedi Fig. 3 per Pipistrellus
e Fig. 4 per Plecotus, Myotis
e Nyctalus
). Questa banda di proteine non è stato rilevato nel esofago, duodeno, digiuno /ileo, ileo /colon o campioni del colon /retto delle specie di pipistrelli (Fig. 3). Tutti i risultati immunoistochimici sono stati controllati per autofluorescenza e non specifico vincolante della secondaria di anticorpi coniugati con accoppiato. sezioni di stomaco sono stati positivi per l'etichettatura degli anticorpi anti-AMCase, mentre nel esofago, duodeno, digiuno /ileo, ileo /colon e del colon /retto sezioni è stata notata alcuna vincolante. Nelle sezioni di stomaco, l'etichettatura anti-AMCase è stato limitato alla parte inferiore delle ghiandole gastriche lungo la mucosa gastrica intorno ai nuclei delle cellule DAPI-macchiato (Fig. 5).
Discussione
contiene aminoacidi sostituzioni che sono necessarie per l'adattamento con l'ambiente acido dello stomaco [31]. Inoltre, Stivale et al. [17] hanno dimostrato che la AMCase mRNA di M. musculus
si trova solo nello stomaco. Se queste sostituzioni di amminoacidi sono presenti nel AMCase di specie di pipistrelli resta da dimostrare.
[27], [31], [34]. cellule principali secernono enzimi digestivi [36] che si trovano nei numerosi granuli citoplasmatici [37]. Un enzima comune prodotto da questo tipo di cellula gastrico è pepsinogeno, precursore della pepsina enzima proteolitico [38]. Goto et al. [27] ha dimostrato che il sito produttivo di stomaco AMCase di M. musculus
è in questi granuli di secrezione. Pertanto, è più probabile che AMCase è anche secreta dalle cellule principali gastriche specie di pipistrelli. Questo è in contrasto con i risultati di Whitaker et al. [8], che ha dichiarato che chitinasi in specie del blocco è prodotta da ceppi di batteri che producono chitinasi (principalmente della famiglia Enterobacteriaceae) nell'intestino. E 'noto che i batteri intestinali producono chitinase per soddisfare le proprie esigenze nutrizionali [39]. Tuttavia, enterobatteri chitinase-produzione si possono trovare anche nei tratti GI di mammiferi che non si nutrono di materiale chitinoso [19]. Ciò suggerisce che non vi è alcuna stretta connessione tra chitina digestione e batteri chitinolytic. In questo studio, bassa attività chitinolytic stata misurata nell'intestino di solo alcuni individui, e nessun AMCase poteva essere rilevato quando separa l'intestino dallo stomaco. Questa attività chitinolytic occasionale può essere spiegata dal trasporto del AMCase prodotto nello stomaco nell'intestino con il cibo, come discusso da Suzuki et al. [34] e di avvio et al. [17]. Inoltre, la bassa attività chitinolytic nell'intestino può essere causato da enterobatteri chitinasi-produzione [8]. Tuttavia, la quantificazione di questi batteri sarebbe necessaria per verificare la partecipazione nella digestione chitina da questi simbionti. Pertanto, è plausibile che la chitina in specie di pipistrelli insettivori è digerito da una combinazione di endogena stomaco AMCase e chitinasi secreti dai batteri intestinali, come è stato suggerito per M. musculus
[17]. Questo studio dimostra chiaramente che i pipistrelli insettivori europei della famiglia Vespertilionidae hanno l'enzima digestivo AMCase. Abbiamo dimostrato che questo enzima è attivo e si trova nello stomaco, in particolare nel o intorno alle principali cellule alla base delle ghiandole gastriche.
Riconoscimenti
 Passaggio a una dieta a base vegetale:consigli e suggerimenti
Passaggio a una dieta a base vegetale:consigli e suggerimenti
 Cosa c'è da sapere sulla sindrome dell'intestino irritabile (IBS)
Cosa c'è da sapere sulla sindrome dell'intestino irritabile (IBS)
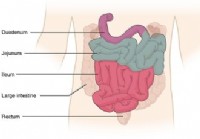 I 15 principali segnali di pericolo di cui hai bisogno per consultare un gastroenterologo
I 15 principali segnali di pericolo di cui hai bisogno per consultare un gastroenterologo
 È possibile ottenere una cura all'80% per colite ulcerosa, morbo di Crohn, celiachia o IBS?
È possibile ottenere una cura all'80% per colite ulcerosa, morbo di Crohn, celiachia o IBS?
 Il microbioma polmonare prevede la gravità della malattia da COVID-19
Il microbioma polmonare prevede la gravità della malattia da COVID-19
 Test comuni utilizzati per diagnosticare il dolore addominale
Test comuni utilizzati per diagnosticare il dolore addominale
 Come fermare naturalmente la diarrea in 30 giorni usando la dieta SCD
Ero a un punto di rottura nella mia vita ed ero disposto a fare qualsiasi cosa per migliorare. Quando il mio medico mi ha detto che questo era linizio di un lungo viaggio e mi ha cacciato dal suo stud
Come fermare naturalmente la diarrea in 30 giorni usando la dieta SCD
Ero a un punto di rottura nella mia vita ed ero disposto a fare qualsiasi cosa per migliorare. Quando il mio medico mi ha detto che questo era linizio di un lungo viaggio e mi ha cacciato dal suo stud
 Disturbi da eliminazione nei bambini
Fatti che dovresti sapere sui disturbi delleliminazione nei bambini La maggior parte dei bambini con encopresi soffre anche di stitichezza. La stitichezza è definita come un gruppo di disturbi assoc
Disturbi da eliminazione nei bambini
Fatti che dovresti sapere sui disturbi delleliminazione nei bambini La maggior parte dei bambini con encopresi soffre anche di stitichezza. La stitichezza è definita come un gruppo di disturbi assoc
 Quanto tempo ci vuole per riprendersi da una procedura di gastrodigiunostomia?
Come viene eseguita una gastrodigiunostomia? Il recupero da una procedura di gastrodigiunostomia richiede circa sei settimane. Una gastrodigiunostomia è una procedura chirurgica eseguita in anestesi
Quanto tempo ci vuole per riprendersi da una procedura di gastrodigiunostomia?
Come viene eseguita una gastrodigiunostomia? Il recupero da una procedura di gastrodigiunostomia richiede circa sei settimane. Una gastrodigiunostomia è una procedura chirurgica eseguita in anestesi