Regolamento della miosina catena leggera fosfatasi (MLCP) via proteina chinasi C (PKC) e l'inibitore 17 kDa PKC-potenziata di miosina fosfatasi catena leggera (CPI-17) è stato segnalato come Ca 2 + percorso di sensibilizzazione di segnalazione nel muscolo liscio (SM), e, quindi, possono essere coinvolti in tonico contro contrazioni fasiche. Questo studio ha esaminato l'espressione della proteina e la distribuzione spazio-temporale dei PKCα e CPI-17 nei tessuti intatti SM. KCl o carbachol (CCh) stimolazione del tonico SM stomaco fondo genera una contrazione sostenuta, mentre l'antro dello stomaco fasica genera una contrazione transitoria. Inoltre, il fondo tonica genera una maggiore forza relativa rispetto antro fasica con 1 pM forbolo 12, stimolazione 13-dibutyrate (PDBu) che è segnalato per attivare la PKCα - CPI-17 pathway. Western blot analisi ha dimostrato che questa differenza contrattile non è stato causato da una differenza nell'espressione della proteina di PKCα o CPI-17 tra questi due tessuti. risultati immunoistochimici mostrano che la distribuzione dei PKCα negli strati longitudinali e circolari del fondo e antro non differiscono, essendo prevalentemente localizzati in prossimità della membrana plasmatica delle cellule SM. La stimolazione di entrambi i tessuti con 1 mM PDBu o 1 micron CCh non altera questa distribuzione PKCα periferica. Non ci sono differenze tra i due tessuti per la distribuzione CPI-17, ma a differenza della distribuzione PKCα, CPI-17 sembra essere distribuiti diffusamente nel citoplasma in condizioni tessuto rilassato ma sposta ad una distribuzione essenzialmente periferica a livello della membrana plasmatica con stimolazione i tessuti con 1 mM PDBu o 1 micron CCh. I risultati di doppia marcatura dimostrano che né PKCα né CPI-17 co-localizzano al adherens giunzione (vinculin /talin) sulla membrana ma essi co-localizzano tra loro e con caveoli (caveolina) a membrana. Questa mancanza di differenza suggerisce che il PKCα - percorso CPI-17 non è responsabile per il tonico contro contrazioni fasiche osservati in fondo allo stomaco e antro Visto: Zhang Y, Hermanson ME, Eddinger TJ (2013) Tonic. e Phasic Smooth contrazione muscolare non viene regolata dalla PKCα - CPI-17 Pathway in suina stomaco Antrum e Fundus. PLoS ONE 8 (9): e74608. doi: 10.1371 /journal.pone.0074608 Editor: Wenhui Hu, Temple University School of Medicine, Stati Uniti d'America Ricevuto: 13 Marzo 2013; Accettato: 4 agosto 2013; Pubblicato: 18 Settembre 2013 Copyright: © 2013 Zhang et al. Questo è un articolo ad accesso libero distribuito sotto i termini della Creative Commons Attribution License, che permette l'uso senza restrizioni, la distribuzione e la riproduzione con qualsiasi mezzo, a condizione che l'autore originale e la fonte sono accreditati Finanziamento:. Questo lavoro è stato sostenuto dalla National Science Foundation (NSF), Dipartimento di Scienze biologiche ed Graduate School, Marquette University. I finanziatori avevano alcun ruolo nel disegno dello studio, la raccolta e l'analisi dei dati, la decisione di pubblicare, o preparazione del manoscritto Competere interessi:.. Gli autori hanno dichiarato che non esistono interessi in competizione Introduzione Il meccanismo (s) determinare tonico (sostenuta) vs. fasica contrazioni (transitoria) muscolatura liscia (SM) rimane irrisolto. innervazione Diverse e molecole di segnalazione che circola in aggiunta al recettore unico e proteine espressione (isoforma) e vie di segnalazione intracellulare complicare la questione. Non inaspettatamente, ci sono più ipotesi proposte per spiegare tonico manutenzione vigore nel SM tra cui: miosina del muscolo liscio cross-ponti slowly- o non andare in bicicletta chiamati ponti fermo [1], [2], [3], [4]; reclutamento di miosina non muscolare II [5], [6], [7]; formazione di caldesmon o calponin dipendenti actina-to-miosina cross-link [8], [9]; formazione di strutture di forza-cuscinetto del citoscheletro [10], [11], [12]; e regolazione della miosina LC 20 fosforilazione attraverso percorsi secondo messaggero che interessano miosina catena leggera chinasi (MLCK) e miosina fosfatasi catena leggera (MLCP) l'attività [13], [14], [15], [16], [17] , [18]. Quest'ultima categoria è di interesse a causa della riportato espressione differenziale, la localizzazione e la regolamentazione di queste seconde proteine messaggero in vari tessuti SM. regolazione variabile di attività MLCK e MLCP potrebbe fornire non solo un mezzo per Ca 2 + sensibilizzazione, ma anche un possibile meccanismo per tonico contro fasica contrazione. L'inattivazione del MLCP tramite il PKCα -CPI-17 percorso permetterebbe di catena mantenuto alta miosina luce (MLC 20) fosforilazione e quindi una forza contrattile sostenuta. Un fallimento per inattivare MLCP ridurrebbe MLC 20 fosforilazione e la forza, con una conseguente contrazione transitoria. Stomach fundus SM genera un tonico (sostenuta) contrazione mentre stomaco antro SM genera un fasica contrazione (transitorio) in risposta ad una varietà di stimoli. Ca 2+ sensibilizzazione, che coinvolge l'attivazione di G- secondo percorsi messaggero accoppiati a proteine che sensibilizzano le proteine contrattili di [Ca 2 + i] inibendo MLCP, possono verificarsi da una delle numerose vie. Uno dei percorsi riportati per l'inibizione dell'attività MLCP include la proteina chinasi C /C-chinasi attivata PP1 inibitore della proteina di 17 kDa (PKC /CPI-17) pathway [19], [20]. proteina recettore G-coupled (GCPR) attivazione con conseguente attivazione della fosfolipasi C (PLC), idrolizza fosfatidilinositolo 4,5-bisfosfato (PIP 2) per la produzione di inositolo 1,4,5-trifosfato (IP 3) e diacilglicerolo (DAG). DAG è noto per attivare PKC che può causare la fosforilazione di CPI-17 di inibire selettivamente MLCP (recensione per viscerale SM in [17]). PKC è creduto per essere regolata da sua attivazione e distribuzione spaziale all'interno della cellula, quest'ultimo essendo controllato da ancoraggio proteine che legano e limitano la posizione di PKC a regioni specifiche della cellula [21], [22]. Ad esempio, i rapporti di costitutivamente attivo L-tipo Ca 2 + canali e la loro regolamentazione da PKC [23], [24] suggerisce che PKC è localizzata nei pressi della membrana delle cellule muscolari lisce. La funzione cellulare di CPI-17 nella cellula potrebbe variare a seconda del suo livello di espressione della proteina e se si trova vicino alla membrana plasmatica in cui si trova PKCα /attivato, o associata con i filamenti spessi contrattile miosina dove sarebbe situato MLCP a de -phosphorylate catena leggera della miosina 20 (MLC 20). L'espressione di PKCα e CPI-17 e il loro spazio-temporale ri-distribuzione al momento dell'attivazione del tessuto sono stati proposti a Ca 2 + sensibilizzazione dei tessuti muscolari lisce (per la revisione [14], [15], [16], [17]). Così è possibile che le differenze nella loro espressione e cellulare localizzazione /traslocazione potrebbero essere coinvolti nella determinazione tonico vs. risposte contrattili fasica. Per queste due proteine di essere parte di un percorso coinvolti in attività di inibizione MLCP durante l'attivazione dei tessuti, e, quindi, causando un tonico o una risposta fasica, hanno bisogno di essere espresse a livelli adeguati e posizionato nella posizione corretta nella cella al momento giusto. Poiché PKC viene attivato da DAG (una membrana fosfolipidica vincolato), deve anche essere a membrana almeno temporalmente per questo accada. E se CPI-17 sta per inibire la MLCP da defosforilando MLC 20 sui filamenti spessi, CPI-17 a un certo punto deve essere nel citosol associata ai filamenti spessi presenti. Con questi due passaggi che si verificano in due regioni spazialmente distinte della cella, una o entrambe queste proteine deve traslocare all'altra area per loro di interagire e completare il percorso. Lo scopo di questo studio era di testare l'ipotesi che il PKCα - CPI-17 Ca 2+ pathway sensibilizzazione è coinvolta nel determinare tonica (sostenuta) e fasiche (transitorio) risposte contrattili in muscoli lisci. Per fare questo abbiamo determinato l'espressione della proteina e la distribuzione spazio-temporale dei PKCα e CPI-17 nel dell'antro dello stomaco fasica e tonica fondo dello stomaco in condizioni rilassate e attivati. I risultati mostrano alcuna differenza significativa nella espressione di una di queste due proteine, né nella loro distribuzione periferica tra questi due tessuti non sono coerenti con l'ipotesi che la PKCα- CPI-17 Ca 2 + percorso di sensibilizzazione è il fattore determinante per la tonico contro fasica risposte contrattili osservate in questi tessuti. Metodi organi e tessuti Handling tessuti suina (stomaco) sono stati ottenuti da Hansen Carne servizi (Franksville, WI) e messo in soluzione fredda salina fisiologica (PSS, (in mm): 140.1 NaCl, 4.7 KCl, 1.2 Na 2HPO 4, 2.0 MOPS (pH 7,4), 0,02 Na 2EDTA, 1.2 MgSO 4, 1.6 CaCl 2, e 5,6 glucosio). Stomaci venivano pulite di sangue, tessuto connettivo lasso, e in alcuni casi, la mucosa e congelati immediatamente o conservato in PSS in frigorifero per 0-2 giorni. Alcuni organi erano congelato appena possibile dopo post-mortem (60-90 minuti). Alcuni organi sono stati incubati in PSS e /o stimolate con 1,0 mM CCh o PDBu (Sigma) a 37 ° C per vari tempi prima del congelamento. tempi di incubazione variabile e le concentrazioni di agonisti sono stati testati anche. Per l'immunoistochimica tutto il tessuto è stato memorizzato congelato fino sezionato e immunoreacted. Congelamento in tutti i casi ha coinvolto ponendo pezzi di tessuti o strisce di tessuto in isopentano raffreddato in azoto liquido seguita da conservazione a -80 ° C. Cinque o sei sezioni micron dei tessuti congelati sono stati tagliati su un criostato Leica CM1900, raccolto su vetrini e conservati congelati (0-1 giorni) fino immunoreacted. Il anticorpi utilizzati sono stati ottenuti dalle seguenti fonti: PKCα (H-7 e C-20) e (H-60) 17-CPI da Santa Cruz Biotech, Santa Cruz CA; Vinculin e Talin da Sigma, Saint Louis, Missouri; Caveolina 1 da BD Biosciences, San Jose, CA; Cy2 e Cy3 Donkey Topo anti o coniglio di secondaria da Jackson ImmunoResearch, West Grove, PA; Alexa Fluor 594-falloidina e DAPI da Molecular Probes, Eugene, OR. Tutti questi anticorpi sono stati utilizzati precedentemente nel nostro laboratorio per immunoistochimica e western blotting dove essi mostrano specificità per una banda di peso molecolare corretto per la rispettiva proteina indicato [25], [26], [27]. I controlli negativi dove l'anticorpo primario non è incluso mostrano alcuna reattività per queste bande e non immunofluorescenza su sezioni di tessuto. sezioni di tessuto congelato raccolto su vetrini sono stati scongelati a temperatura ambiente e quindi fissate con paraformaldeide al 2% per 10 minuti, permeabilizzate in 0,5% Triton X-100 per 10 minuti e bloccate con 5 mg /ml di BSA per 1 ora prima di reagire con l'anticorpo primario overnight (4 ° C) e quindi l'anticorpo secondario appropriato per un'ora a temperatura ambiente. Dopo l'anticorpo secondario, i tessuti sono stati incubati con DAPI (0,5 micron), falloidina (10-50 nM) o DAPI /falloidina come appropriato per nuclei colorazione e /o actina filamentosa. lavaggi multipli sono stati utilizzati seguendo le incubazioni primarie e secondarie, e il di contrasto. vetrini sono stati montati utilizzando tamponata 75% glicerolo con lo 0,2% di n-propile gallato per ridurre al minimo fading. Tutte le soluzioni immunoreacting sono state fatte in PBS-Tween [(in g /litro: NaCl 8.0, KH 2PO 4 0.2, Na 2HPO 4 1,15, KCl 0,2,), 1% tween- 20, pH 7,4] con 0,1% BSA. I controlli negativi inclusi 0,1% di BSA, senza l'anticorpo primario, e non ha mostrato alcuna reazione immunologica. Microscopia Le sezioni sono state osservate utilizzando un microscopio Olympus IX70 con illuminazione epifluorescenza. Le immagini digitali sono state scattate con una fotocamera CCD a 16 bit Princeton Instruments (Princeton, NJ), controllati attraverso una scheda PCI tramite IPLab per Windows su un PC (Ver 3.6, Scanalytics,. Fairfax, VA). Le immagini sono state scattate utilizzando un × (1,25 NA) lente olio 100 × (1.3 NA) o 60 o un (NA 0,9) Lente d'aria 40 × e memorizzati sul PC. filtri di emissione utilizzati sono stati 405, 490 e 570 nm. Le sezioni sono state viste anche utilizzando un microscopio confocale Nikon (Nikon A1 confocale Eclipse Ti). Gli obiettivi utilizzati sono stati 100 × (1,4 NA) lente olio a 425, 488 e 561 nm. Risultati simili sono stati osservati in distribuzioni di immunofluorescenza utilizzando questi due sistemi diversi. Immagine analisi della distribuzione della PKC /CPI-17 di celle individuali nei tessuti Profili di intensità di fluorescenza sono stati presi per le singole celle in sezioni di tessuto trasversali. Le sezioni sono state osservate a basso ingrandimento (10-20x) per evitare le zone di manufatti apparente (pieghevole dei tessuti, congelare danni, ecc). In una zona di libero artefatto l'ingrandimento è stato aumentato a 40-100x, e le immagini sono state scattate in questi ingrandimenti elevati. Tre diverse aree all'interno di una sezione di tessuto sono stati scelti per scattare foto. Serie Z-stack sono stati presi singolarmente per ciascuno dei tre canali di colore utilizzati. sono stati presi 1 sezioni micron di spessore Z, e 15-25 sezioni Z sono stati presi per ogni sezione di tessuto (figure S1 & esempi S2 spettacolo Z-stack di CPI-17 immunoreattività in antro con e senza attivazione del tessuto). Ogni serie Z stack è stato esaminato per ogni sezione per identificare l'immagine centrale z, e questa immagine è stata convertita in a.bmp di file, che è stato importato a NIS-Elements AR 3.0 (Nikon) su un PC per analizzare i dati. Profili di PKCα e falloidina intensità di fluorescenza sono stati ottenuti per le singole celle in sezioni di tessuto trasversali. Una linea è stata tracciata attraverso il centro del campo dell'immagine. Dieci cellule attraversati dalla linea sono stati selezionati per misure. Sulla base delle nostre precedenti protocolli [25], i primi cinque pixel (~0.7 micron) su entrambi i lati della cella in cui l'intensità phalloidin fortemente aumentato dal basale sono stati definiti come la periferia della cellula. Per misurazioni citosolici, una linea è stata collocata ad almeno 2 micron dalla periferia cellulare. misure di intensità sono state effettuate utilizzando una regione di interesse (ROI) all'incirca al centro della cella (per misure citosolici), o lungo la membrana cellulare (per misure periferici). Per coerenza, la dimensione della ROI viene mantenuta costante per le misurazioni periferiche e citosoliche. Le cellule in sezione con diametri molto piccoli (non in grado di misurare il ROI citosolico almeno 2 micron dalla periferia) o con nuclei presente (colorazione visibile DAPI in cui le limitazioni spaziali e organelli perinucleari potrebbe confondere la distribuzione) sono stati esclusi dall'analisi. Per PKCα, è stato utilizzato il rapporto tra l'intensità media del PKCα alla periferia sull'intensità totale PKCα (somma di intensità PKCα dalla ROI alla periferia e ROI nel citosol). Dieci cellule per campo e tre diversi campi sono stati sottoposti alla misurazione per l'analisi dei dati per ciascuna regione del tessuto, cioè trenta cellule sono state contate e mediati per ciascun campione (n = 1). La dimensione finale campione è stato n = fosse applicato 5. Le stesse procedure per misurare l'intensità di CPI-17, tranne che un solo campo di 10 cellule sono stati usati per ciascun campione (n = 1), con una dimensione di campione finale di n = 3. Misure meccaniche Immediatamente prima dell'uso, le strisce di tessuto sono stati tagliati e fissati su ciascuna estremità, con i morsetti fissati tra i ganci su una barra metallica fissa e un trasduttore di forza isometrica (Harvard Apparatus, Holliston, MA), in PSS bollito con il 95% O 2/5% di CO 2 in camere muscolari camicia d'acqua (Radnoti Tecnologia di vetro, Monrovia, CA) a 37 ° C. La lunghezza di ciascuna striscia è stata variata riposizionando l'asta metallica stazionaria. muscolo liscio strisce di tessuto (antro stomaco e fundus) sono stati equilibrati per 1 he steso ad una tensione passiva approssima Lo utilizzando una curva lunghezza-tensione abbreviato . Per contrarre i tessuti, PSS è stato sostituito con K + - PSS (109 mm KCl viene sostituito iso-osmoticamente per NaCl) [28]. Le strisce muscolari sono stati attivati ripetutamente con stiramento del tessuto tra ogni attivazione, fino picco di forza mostrato più un notevole aumento rispetto alla contrazione precedente. Chambers arrossate tre volte con PSS dopo ogni attivazione del tessuto. Almeno due ripetibili successivi K + - PSS contrazioni sono stati usati per ottenere una traccia forza di serie con 10 minuti di riposo tra ogni contrazione prima di iniziare l'esperimento. I tessuti sono stati poi attivati con 1 micron carbachol e rilassato di nuovo, come è stato eseguito durante K + - contrazioni PSS. contrazioni successivi inclusi tutti 1 micron fentolamina e propranololo per bloccare α- e β - adrenergici, rispettivamente. Dopo la finale di 1 micron CCh contrazione e lavare, i tessuti sono stati attivati con 1 mM PDBu per registrare il loro risposta meccanica. Segnali di tensione da trasduttori di forza sono stati digitalizzati da PowerLab 400 o 4 SP hardware (ADInstruments, Castle Hill, Australia) visualizzato sullo schermo del computer (v3.6 Grafico o 4.0, ADInstruments) come forza (g) a 10 Hz e conservato dal comando software su un disco rigido per le analisi successive. I dati sono stati realizzati con il programma di foglio di calcolo di Excel 2000 (Microsoft, Redmond, WA). L'espressione proteica è stato analizzato come descritto in precedenza [29]. I tessuti sono stati omogeneizzati in 50 mg /ml in 0,125 M Tris, 2% di sodio dodecilsolfato (peso /volume), 20% glicerolo, 0,1% blu di bromofenolo (peso /volume) e 20 mM di ditiotreitolo. Le proteine sono state risolte a basso gel sodio dodecilsolfato di reticolazione [30] e immunoblotting è stata eseguita come precedentemente descritto [31]. L'anticorpo PKCα riconosciuto sia una singola banda o più frequentemente di un doppietto a ~76 kD, mentre l'anticorpo CPI-17 riconosce una singola banda a ~17 kD. Queste dimensioni sono coerenti con la dimensione prevista per queste proteine basati sulla mobilità gel. Per garantire la precisione delle macchine occidentali, le curve di carico sono state fatte per entrambi i campioni del fondo oculare e antro dello stomaco in un intervallo di 5 volte di carichi (4-20 microlitri) per actina (Coomassie colorazione blu) e PKCα e CPI-17 (Western blotting) . I risultati hanno mostrato una relazione lineare in questo intervallo per tutte e tre le proteine da entrambi i tessuti (R 2 > 0,98 per tutti i risultati, n = 3). La quantificazione di PKCα e di espressione della proteina CPI-17 è stato fatto su macchine occidentali utilizzando 5-10 carichi microlitri che era all'interno di questa gamma lineare (n = 6). comparazioni statistiche sono state effettuate utilizzando MINITAB (Minitab Inc. State college, PA). A un campione t-test è stato utilizzato per testare la distribuzione di PKCα /CPI-17 (una periferica al contenuto totale ROI di 0,5 indica una distribuzione "uniforme" in cellule muscolari lisce (SMC)) in dell'antro e fondo in condizioni di riposo. Un modo ANOVA è stata effettuata per verificare PKC /CPI-17 differenze di distribuzione per i due tessuti con diversi parametri di stimolazione. Due esempi di t-test sono stati utilizzati per testare il significato della differenza di livello di espressione di PKCα o CPI-17 in antro e fondo. A due code F-test per l'uguaglianza di due deviazioni standard (SDS) ha determinato una SD significativamente più basso nel rapporto di caveolina per PKCα rispetto alla SD del rapporto di vinculin a PKCα. Un valore di P < 0,05 è stato considerato significativo per tutti i test statistici. Nessun test statistici sono stati fatti sui dati relativi alla forza e la figura 1 è rappresentativo di dati simili provenienti da 6 diversi animali. dati Western Blot è da sei animali. PKCα dati di distribuzione è una media di trenta cellule misurati ad animale e cinque animali sono stati testati. CPI-17 dei dati di distribuzione è una media di 10 cellule misurati ad animale e tre animali sono stati testati. dati proteina co-localizzazione si basa su un 'n' di almeno 20 cellule provenienti da almeno 3 animali. Risultati suina fondo stomaco è un tonico in primo luogo il tessuto muscolare liscio che risponde alla stimolazione con una contrazione sostenuta mentre l'antro è principalmente fasica liscia tessuto muscolare che risponde alla stimolazione con una contrazione transitoria (Fig. 1). Nei tessuti queste risposte sono probabilmente il risultato di stimolazione diretta del muscolo liscio come l'aggiunta di 1 mM propranololo (β agonisti bloccanti) e fentolamina (α agonisti bloccante) è stato utilizzato per impedire l'attivazione dei recettori adrenergici a causa di potenziale rilascio di neurotrasmettitori simpatici. La stimolazione della muscolatura liscia con PDBu viene utilizzato di routine per causare la contrazione della muscolatura liscia via PKC attivazione [32], [33], [34]. Un micron PDBU provoca una piccola contrazione lenta in strisce fundus stomaco (~ 40% di K + risposta stimolazione) mentre l'antro mostra essenzialmente alcuna risposta (< 5% K + stimolazione) (Fig. 1). La differenza tra le risposte sostenuta e transitori di questi due tessuti a KPSS e CCh, e la presenza o assenza di una risposta contrattile alla stimolazione PDBu potrebbe essere dovuto alla espressione e /o la distribuzione spazio-temporale dei secondi messaggeri a valle (PKCα e CPI-17) che sono preteso di essere responsabile per l'inibizione MLCP con la stimolazione PDBu. Per esaminare questo abbiamo misurato i livelli di espressione e determinato la distribuzione spazio-temporale dei PKCα e CPI-17 in questi tessuti. La figura 2 mostra i risultati Western Blot per l'espressione di CPI-17 e PKCα nel antro stomaco e fondo. I tessuti sono stati trattati per controllare la concentrazione di proteine, ed i risultati sono stati calcolati in base all'intensità del rispettivo segnale di proteine, e normalizzati per l'espressione della proteina actina (Fig. 2). Entrambi i metodi (solo dati normalizzati mostrati) hanno indicato che né l'espressione di CPI-17 proteina né quella di proteine PKCα è significativamente diverso (p > 0,23 & p > 0,28, rispettivamente, n = 6) quando si confrontano questi due tessuti SM. I controlli sono stati eseguiti utilizzando una serie di carichi per confermare l'intervallo di linearità del carico, e che i campioni utilizzati per la quantificazione erano all'interno di questo intervallo (dati non mostrati, vedere metodi). Perché non ci sono differenze di espressione per queste due proteine tra questi due tessuti, abbiamo accanto proceduto a determinare se le differenze nella loro distribuzione spaziale-temporale potrebbe spiegare la differenza nelle loro risposte alla stimolazione PDBu. La figura 3 mostra risultati immuohistochemical per la distribuzione di PKCα negli strati longitudinali e circolari del fondo e antro. In condizioni di riposo in soluzione rilassante in assenza di generazione di forza dal tessuto, la PKCα sembra essere distribuito in modo univoco preferenzialmente in prossimità della periferia del (colore verde Fig. 3-, PSS) SMC. Stimolazione dei tessuti con 1 mM CCh (3 ') o 1 mM PDBu (10 e 30') non altera la distribuzione periferica di PKCα. Il rapporto della distribuzione del PKCα prossimità della membrana plasmatica rispetto al PKCα cellulare totale è stato usato per quantificare i possibili cambiamenti nella distribuzione di questa proteina in queste diverse condizioni. La Figura 4 mostra i risultati come il rapporto tra la PKCα alla periferia cella relativa ai PKCα totali presenti nella cella (periferiche /(periferico + citosol), vedere metodi). Un rapporto di 0,5 indicherebbe una distribuzione "divisa" della proteina tutta la cellula. Il rapporto PKCα (periferico /totale) variava 0,64-0,68 in tutte le condizioni esaminate. Questi valori sono significativamente superiore a 0,5 (p < 0,05), indicando che PKCα si trova in primo luogo alla periferia delle cellule (che non è "uniformemente" distribuito nella cellula) e che questa distribuzione non cambia tra le condizioni rilassate o stimolati <. br> a causa PKCα si propone di attivare la CPI-17, si è proceduto a determinare la distribuzione spazio-temporale dei CPI-17 in questi tessuti in condizioni simili. Figura 5 mostra i risultati immuohistochemical per la distribuzione di CPI-17 negli strati longitudinali e circolari del fondo e antro. In condizioni di riposo in soluzione rilassante quando non c'è generazione di forza dal tessuto, il CPI-17 appare essere distribuiti diffusamente la SMC (Fig. 5- PSS, fig. S1). Stimolazione dei tessuti con 1 pM CCh (30 ') (ma non 1 pM CCh per 3', dati non mostrati) o 1 mM PDBu (30 ') determina un cambiamento significativo in questa distribuzione tale che la CPI-17 appare ora essere principalmente alla periferia della cella in una distribuzione simile a quello osservato per PKCα (Fig. 5, fig. S2). Il rapporto della distribuzione del CPI-17 in prossimità della membrana plasmatica rispetto al totale CPI-17 (periferico + citosolico) è stato utilizzato per quantificare eventuali cambiamenti nella distribuzione di questa proteina in queste diverse condizioni. La Figura 4 mostra i risultati come il rapporto tra periferiche a totale CPI-17. Il rapporto CPI-17 (periferica /totale) variava 0,49-0,67 in tutti i tessuti e le condizioni esaminate. Il rapporto tra CPI-17 periferico /totale in condizioni rilassato non è significativamente diverso da 0,5 (significa 0,49-0,5; p > 0,19) ad indicare che il CPI-17 è distribuito capillarmente in tutte le cellule muscolari lisce in questa condizione. Questo non cambia dopo 3 'di 1 micron stimolazione CCh quanto non vi è ancora alcuna differenza significativa dalle condizioni rilassate (significa = 0,53-0,55; p > 0,05), ad eccezione dei tessuti del fundus in cui la periferica rapporto CPI-17 /totale è significativamente maggiore (p < 0,05) a 3 '(Fig. 4). Con 30 'di entrambi 1 mM CCh o 1 stimolazione micron PDBu, la distribuzione CPI-17 diventa significativamente maggiore di 0.5 per tutti i tessuti e gli strati (mezzi = 0.62-0.67, P < 0,01), indicando che l'IPC-17 si trova ora in primo luogo alla periferia cellule (non è più "uniformemente" distribuito in tutta la cella), simile alla distribuzione di PKCα (Fig. 4). la distribuzione prevalentemente periferica del PKCα (sia in condizioni rilassate e stimolate) e CPI-17 (dopo 30 'stimolazione con CCh o PDBu) non è uniforme alla periferia delle cellule, ma puntata nella distribuzione (Fig. 6). C'è anche una distribuzione puntiforme dei anatomicamente e funzionalmente distinte giunzioni aderenti e caveoli livello della membrana plasmatica SMC [26]. Al fine di determinare se la distribuzione del PKCα e CPI-17 alla membrana corrisponde con il modello puntata di giunzioni aderenti, abbiamo fatto doppia marcatura con due adherens giunzione proteine associate, vinculin e talin. Il modello alternativo di distribuzione dei fluorofori rosso e verde, le membrane mostrano che la PKCα e CPI-17 non co-localizzare sia con vinculin o Talin (Fig. 6), suggerendo che il PKCα e CPI-17 non si associano il complesso adherens giunzione nelle condizioni che abbiamo esaminato. Perché si alternano caveoli con le giunzioni adherens a livello della membrana periferico [26], PKCα e CPI-17 può co-localizzare con la caveoli. Per determinare se la distribuzione puntiforme del PKCα e CPI-17 a livello della membrana corrisponde con il modello puntata delle caveoli, abbiamo anche fatto doppia marcatura di PKCα con caveolina. La distribuzione di PKCα e caveolin co-localizza nella membrana in condizioni sia rilassato e attivati come può stato osservato dalla comparsa della fluorescenza giallo /arancio anziché distinta fluorescenza rossa e verde (Fig. 6). A due code F-test per l'uguaglianza di due deviazioni standard (SDS) ha determinato una SD significativamente più basso nel rapporto di caveolina per PKCα rispetto alla SD del rapporto di vinculin a PKCα (n = 20 celle; p < 0,05) . Inoltre, doppia marcatura di PKCα con CPI-17 dopo l'attivazione del tessuto mostra anche significativa co-localizzazione (n = 20 cellule; p < 0,05) di queste due proteine vicino membrana plasmatica (fig. 7). Questi dati mostrano che PKCα è localizzata principalmente vicino al caveloi alla membrana plasmatica SMC in ogni momento, e che, dopo l'attivazione del tessuto, una porzione significativa della citosolico CPI-17 trasloca nel caveoli al plasma dove co-localizzato con PKCα. Discussione tessuti muscolari lisce sono normalmente caratterizzati come sia "tonico" (che genera una lenta contrazione isometrica mantenuto) o "fasica" (generando una veloce contrazione isometrica transitoria). costituzione della forza e /o accorciamento dei tessuti in SM si ritiene che richiedono elevata miosina fosforilazione catena leggera, consumo di ATP e croce ponte in bicicletta. Un possibile meccanismo responsabile di questi due tipi di contrazioni è differenziale Ca 2+ sensibilizzazione. Ca 2 + sensibilizzazione in muscolatura liscia si ritiene in gran parte essere dovuta all'inibizione della MLCP concomitanza con o successivamente alla attivazione di MLCK durante l'attivazione del tessuto [15], [35]. Uno dei principali percorsi proposti di essere coinvolti in Ca 2 + sensibilizzazione è attraverso i recettori accoppiati a proteine G (GPCR) /fosfolipasi C (PLC) /diacilglicerolo (DAG) /PKC /CPI-17 per inibire MLCP. GPCR di, PLC, e DAG sono tutti situati in /nella membrana plasmatica. La posizione del MLCP è meno certo, ma a un certo punto nel tempo dopo l'attivazione del tessuto MLCP deve essere associato con MLC 20 sulla molecola miosina dei filamenti spessi per defosforilare questa proteina. Perché filamenti spessi sono stati segnalati per essere distribuito in tutto il citoplasma SMC [36], [37], [38], [39], il MLCP dovrà anche essere distribuiti in tutto il citoplasma ad un certo punto durante il rilassamento [40]. Se MLCP si trova all'interno del citoplasma e vicino MLC 20 durante la contrazione, e PKCα e CPI-17 svolgere un ruolo nell'inibire MLCP durante la contrazione, allora almeno CPI-17 ci si aspetterebbe di essere situato all'interno del citoplasma a un certo momento durante la contrazione. I risultati di questo studio mostrano che PKCα è preferenzialmente localizzato nei pressi della membrana plasmatica in condizioni rilassate e attivati e che CPI-17 è anche preferenzialmente localizzato nei pressi della membrana plasmatica in condizioni attivati. Così, questi dati suggeriscono che le differenze nella PKCα- CPI-17 Ca 2 + percorso di sensibilizzazione non può spiegare tonica e fasica contrazioni SM in fondo allo stomaco e antro e ulteriore lavoro è necessario per determinare come la distribuzione spazio-temporale dei CPI- 17 con l'attivazione del tessuto può regolare MLCP a causare Ca 2 + sensibilizzazione della SM contrazione nei tessuti intatti SM. Mentre PDBu provoca una contrazione lenta nel fondo, che è ~ 40% del KPSS indotta picco di forza , piccola contrazione è generata nel antro con la stimolazione PDBu. Dal fondo e antro rappresentano due tipi fondamentali di muscolatura liscia, tonica e fasica, rispettivamente, sembra logico attribuire la differenza di generazione delle forze di proprietà distinte di fasica e tonica muscolare. Woodsome et al [41] hanno riportato che il livello di espressione di CPI-17 in tonica SM vascolare è superiore a quello in fasica SM vascolare. Questo potrebbe spiegare la diversa capacità dei muscoli tonici per mantenere la forza (ad alta concentrazione di CPI-17 inibisce MLCP permettendo MLC 20 fosforilazione di rimanere alto e la forza di essere mantenuta in tonico SM). Questo studio ha esaminato l'espressione della proteina PKCα e CPI-17 e la distribuzione nello stomaco suina viscerale. Con nostra sorpresa, è stata rilevata alcuna differenza significativa nel livello di espressione della proteina PKCα o CPI-17 tra il fondo e antro (Fig. 2).
immunoreazioni e reagenti
Analisi di Forza dati
gel elettroforesi e Western Blotting
Statistica
 Quattro cose che causano mal di stomaco | Arshad Malik, MD
Quattro cose che causano mal di stomaco | Arshad Malik, MD
 Quanto tempo puoi vivere con una malattia renale allo stadio 5?
Quanto tempo puoi vivere con una malattia renale allo stadio 5?
 Che cos'è un'epaticodigiunostomia?
Che cos'è un'epaticodigiunostomia?
 Che cos'è una pancreaticodigiunostomia longitudinale?
Che cos'è una pancreaticodigiunostomia longitudinale?
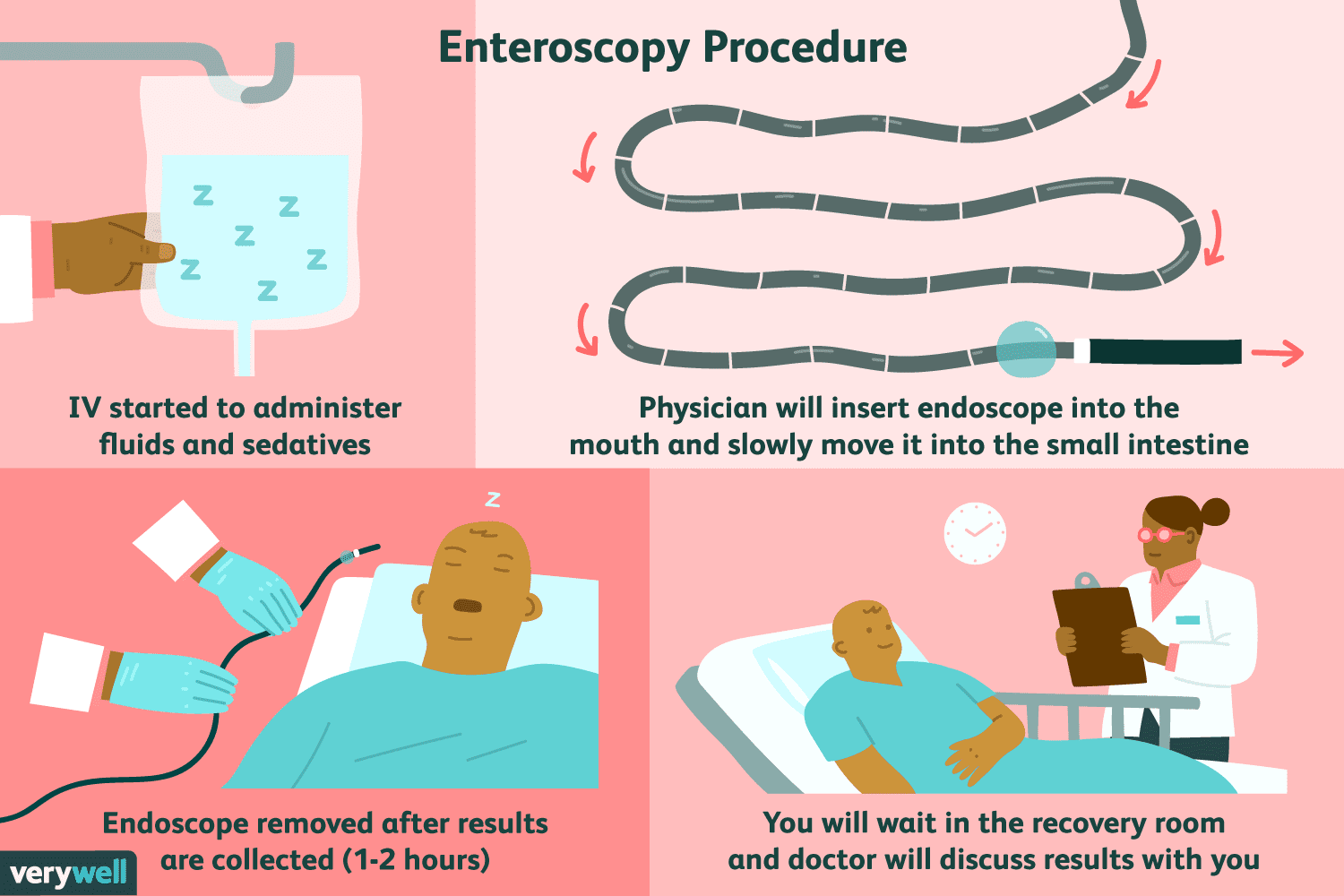 Che cos'è l'enteroscopia dell'intestino tenue?
Che cos'è l'enteroscopia dell'intestino tenue?
 Andare al pronto soccorso per la classe IBS
Andare al pronto soccorso per la classe IBS
 Problemi digestivi comuni negli uomini
Mentre uomini e donne sono entrambi suscettibili ai disturbi gastrointestinali, ci sono alcune condizioni di salute che sono più prevalenti negli uomini. Con gli uomini che in genere visitano i loro m
Problemi digestivi comuni negli uomini
Mentre uomini e donne sono entrambi suscettibili ai disturbi gastrointestinali, ci sono alcune condizioni di salute che sono più prevalenti negli uomini. Con gli uomini che in genere visitano i loro m
 Gastroenterologo a Fort Pierce, Florida
Quando si tratta della tua salute, è importante scegliere un medico che abbia non solo unistruzione qualificata, ma anche lesperienza e la comprovata esperienza nel trattare con successo i pazienti. I
Gastroenterologo a Fort Pierce, Florida
Quando si tratta della tua salute, è importante scegliere un medico che abbia non solo unistruzione qualificata, ma anche lesperienza e la comprovata esperienza nel trattare con successo i pazienti. I
 Quanto velocemente progredisce la nefropatia da IgA?
La nefropatia da immunoglobuline A (IgA) richiede generalmente molto tempo per svilupparsi, progredisce in 10-20 anni e porta a insufficienza renale allo stadio terminale. La nefropatia da immunogl
Quanto velocemente progredisce la nefropatia da IgA?
La nefropatia da immunoglobuline A (IgA) richiede generalmente molto tempo per svilupparsi, progredisce in 10-20 anni e porta a insufficienza renale allo stadio terminale. La nefropatia da immunogl