Dit apparaat biedt een veilige optie voor de behandeling van adolescenten die pijn ervaren door IBS door middel van milde zenuwstimulatie. De actie van vandaag weerspiegelt onze voortdurende inzet om de ontwikkeling van medische hulpmiddelen voor kinderen te bevorderen, zodat kinderen en adolescenten toegang hebben tot veilige en effectieve medische hulpmiddelen die aan hun behoeften voldoen."
Carlos Pena, doctoraat, directeur van het Office of Neurological and Physical Medicine Devices in het Center for Devices and Radiological Health van de FDA
De IB-Stim is een apparaat dat uitsluitend op recept verkrijgbaar is en bestaat uit een kleine elektrische zenuwstimulator voor eenmalig gebruik die achter het oor van de patiënt wordt geplaatst. Het bevat een batterij-aangedreven chip die laagfrequente elektrische pulsen uitzendt om takken van bepaalde hersenzenuwen continu te stimuleren gedurende vijf dagen, op welk moment het wordt vervangen. Het stimuleren van zenuwbanen in en rond het oor zou pijnverlichting geven. Patiënten kunnen het apparaat maximaal drie opeenvolgende weken gebruiken om functionele buikpijn geassocieerd met IBS te verminderen.
IBS is een groep symptomen die samen voorkomen, waaronder herhaalde pijn in de buik en veranderingen in stoelgang, wat diarree kan zijn, constipatie of beide. Met IBS, de symptomen kunnen aanwezig zijn zonder zichtbare tekenen van schade of ziekte in het spijsverteringskanaal.
De FDA beoordeelde gegevens van een gepubliceerde klinische studie met 50 patiënten van 11-18 jaar met IBS - 27 patiënten werden behandeld met het apparaat en 23 patiënten kregen een placebo-apparaat. De studie mat de verandering van baseline tot het einde van de derde week in de ergste buikpijn, gebruikelijke pijn en pijnfrequentie-ernstduur (PFSD)-scores, die meerdere aspecten van pijnervaring omvatten. Veranderingen in stoelgang werden niet geëvalueerd.
Tijdens de studie, patiënten mochten doorgaan met stabiele doses medicatie om chronische buikpijn te behandelen. De ergste pijn bij aanvang was vergelijkbaar tussen de behandelings- en placebogroepen. Een analyse van herhaalde metingen toonde een grotere verandering (verbetering) van de ergste pijn vanaf baseline tot week drie in de behandelingsgroep. Dit effect werd ook gezien in week één en twee. Er werd ook een grotere verandering aangetoond in samengestelde PFSD-scores van baseline tot week drie in de IB-Stim-groep vergeleken met de placebogroep. Behandeling met IB-Stim resulteerde in een afname van ten minste 30% van de gebruikelijke pijn aan het einde van drie weken bij 52% van de behandelde patiënten vergeleken met 30% van de patiënten die de placebo kregen, en een afname van ten minste 30% van de ergste pijn bij 59% van de behandelde patiënten vergeleken met 26% van de patiënten die de placebo kregen. Tijdens de studie, zes patiënten rapporteerden een licht oorongemak en drie patiënten rapporteerden een adhesieve allergie op de plaats van toediening.
Het apparaat is gecontra-indiceerd voor patiënten met hemofilie, patiënten met een pacemaker of patiënten met de diagnose psoriasis vulgaris (een aandoening waarbij huidcellen zich ophopen en schilfers vormen en jeukende, droge plekken).
De FDA heeft de IB-Stim beoordeeld via het de novo premarket-beoordelingstraject, een regelgevend traject voor hulpmiddelen met een laag tot matig risico van een nieuw type. Deze actie creëert een nieuwe regelgevende classificatie, wat betekent dat volgende apparaten van hetzelfde type met hetzelfde beoogde gebruik het 510(k) premarket-proces van de FDA kunnen doorlopen, waarbij hulpmiddelen een vergunning voor het in de handel brengen kunnen verkrijgen door substantiële gelijkwaardigheid aan te tonen met een predicaat hulpmiddel.
Vergelijkbare versies van dit apparaat voor ander gebruik zijn eerder door de FDA goedgekeurd voor het in de handel brengen. De NSS-2 BRIDGE mocht in 2017 op de markt worden gebracht als hulpmiddel om de symptomen van opioïdontwenning te verminderen. De FDA heeft eerst een versie van het apparaat goedgekeurd, bekend als het Electro Auricular Device, in 2014 voor gebruik in acupunctuur.
De FDA verleende een vergunning voor het in de handel brengen van de IB-Stim aan Innovative Health Solutions.
 VS Preventative Task Force adviseert colonkankerscreening op 45-jarige leeftijd
Volwassen vrouw In overleg met vrouwelijke arts zittend op onderzoeksbank in kantoor Sinds 2018 dringt de American Cancer Society er bij de bevolking op aan om op 45-jarige leeftijd gescreend te worde
VS Preventative Task Force adviseert colonkankerscreening op 45-jarige leeftijd
Volwassen vrouw In overleg met vrouwelijke arts zittend op onderzoeksbank in kantoor Sinds 2018 dringt de American Cancer Society er bij de bevolking op aan om op 45-jarige leeftijd gescreend te worde
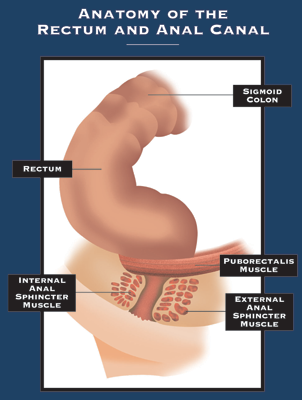 Anale fistels
Wat is een anale fistel? Een fistel is een abnormale verbinding tussen twee organen of twee weefseloppervlakken. Een anale fistel (fistel-in-ano) is een verbinding tussen het anale kanaal en de huid.
Anale fistels
Wat is een anale fistel? Een fistel is een abnormale verbinding tussen twee organen of twee weefseloppervlakken. Een anale fistel (fistel-in-ano) is een verbinding tussen het anale kanaal en de huid.
 Yoga voor een betere spijsvertering
Spijsverteringsproblemen komen steeds vaker voor in de Verenigde Staten. Volgens de National Institutes of Health lijden ongeveer 60 tot 70 miljoen Amerikanen aan een spijsverteringsziekte, om nog maa
Yoga voor een betere spijsvertering
Spijsverteringsproblemen komen steeds vaker voor in de Verenigde Staten. Volgens de National Institutes of Health lijden ongeveer 60 tot 70 miljoen Amerikanen aan een spijsverteringsziekte, om nog maa