Dieses Gerät bietet eine sichere Option für die Behandlung von Jugendlichen, die durch IBS Schmerzen haben, durch die Verwendung einer milden Nervenstimulation. Die heutige Aktion spiegelt unser kontinuierliches Engagement wider, die Entwicklung von pädiatrischen Medizinprodukten voranzutreiben, damit Kinder und Jugendliche Zugang zu sicheren und wirksamen Medizinprodukten haben, die ihren Bedürfnissen entsprechen."
Carlos Peña, Ph.D., Direktor des Office of Neurological and Physical Medicine Devices im Center for Devices and Radiological Health der FDA
Der IB-Stim ist ein verschreibungspflichtiges Gerät, das aus einem kleinen elektrischen Nervenstimulator für den Einmalgebrauch besteht, der hinter dem Ohr des Patienten platziert wird. Es enthält einen batteriebetriebenen Chip, der niederfrequente elektrische Impulse aussendet, um die Äste bestimmter Hirnnerven fünf Tage lang kontinuierlich zu stimulieren. zu welcher Zeit wird es ersetzt. Es wird angenommen, dass die Stimulation von Nervenbündeln im und um das Ohr Schmerzlinderung bietet. Patienten können das Gerät bis zu drei aufeinanderfolgende Wochen lang verwenden, um funktionelle Bauchschmerzen im Zusammenhang mit RDS zu reduzieren.
IBS ist eine Gruppe von Symptomen, die zusammen auftreten, einschließlich wiederholter Schmerzen im Unterleib und Veränderungen des Stuhlgangs, das kann Durchfall sein, Verstopfung oder beides. Mit IBS, die Symptome können ohne sichtbare Anzeichen von Schäden oder Erkrankungen im Verdauungstrakt auftreten.
Die FDA überprüfte Daten aus einer veröffentlichten klinischen Studie, an der 50 Patienten im Alter von 11 bis 18 Jahren mit RDS teilnahmen – 27 Patienten wurden mit dem Gerät behandelt und 23 Patienten erhielten ein Placebo. In der Studie wurde die Veränderung der schlimmsten Bauchschmerzen vom Ausgangswert bis zum Ende der dritten Woche gemessen. übliche Schmerz- und Pain Frequency Severity Duration (PFSD)-Scores, die mehrere Aspekte des Schmerzempfindens beinhalten. Veränderungen des Stuhlgangs wurden nicht ausgewertet.
Während des Studiums, Patienten durften weiterhin stabile Dosen von Medikamenten zur Behandlung chronischer Bauchschmerzen einnehmen. Die schlimmsten Schmerzen zu Studienbeginn waren in der Behandlungs- und der Placebogruppe ähnlich. Eine Analyse mit wiederholten Messungen zeigte in der Behandlungsgruppe eine größere Veränderung (Verbesserung) der schlimmsten Schmerzen vom Ausgangswert bis zur dritten Woche. Dieser Effekt wurde auch in den Wochen eins und zwei beobachtet. In der IB-Stim-Gruppe wurde im Vergleich zur Placebo-Gruppe auch eine größere Veränderung in den zusammengesetzten PFSD-Scores vom Ausgangswert bis zur dritten Woche nachgewiesen. Die Behandlung mit IB-Stim führte bei 52 % der behandelten Patienten zu einer Verringerung der üblichen Schmerzen um mindestens 30 % am Ende von drei Wochen im Vergleich zu 30 % der Patienten, die das Placebo erhielten. und eine Verringerung der schlimmsten Schmerzen um mindestens 30 % bei 59 % der behandelten Patienten im Vergleich zu 26 % der Patienten, die das Placebo erhielten. Während des Studiums, sechs Patienten berichteten von leichten Ohrenbeschwerden und drei Patienten berichteten von einer Klebstoffallergie an der Applikationsstelle.
Das Gerät ist kontraindiziert für Patienten mit Hämophilie, Patienten mit Herzschrittmachern oder Patienten mit diagnostizierter Psoriasis vulgaris (eine Erkrankung, bei der sich Hautzellen ansammeln und Schuppen und juckende, trockene Stellen).
Die FDA hat den IB-Stim im Rahmen des de novo Premarket-Review-Pfads überprüft, ein Regulierungspfad für Produkte mit geringem bis mittlerem Risiko eines neuen Typs. Diese Aktion erstellt eine neue regulatorische Klassifizierung, was bedeutet, dass nachfolgende Produkte desselben Typs mit demselben Verwendungszweck den 510(k)-Vormarktprozess der FDA durchlaufen können, wodurch Produkte eine Zulassung für das Inverkehrbringen erhalten können, indem sie eine wesentliche Gleichwertigkeit mit einem Prädikatsprodukt nachweisen.
Ähnliche Versionen dieses Geräts für andere Anwendungen wurden zuvor von der FDA für das Inverkehrbringen genehmigt. Die NSS-2 BRIDGE wurde 2017 als Hilfsmittel zur Linderung der Symptome eines Opioid-Entzugs zur Vermarktung zugelassen. Die FDA hat zuerst eine Version des Geräts freigegeben, bekannt als das Elektro-Ohrhörer-Gerät, 2014 zur Anwendung in der Akupunktur.
Die FDA erteilte Innovative Health Solutions die Marktzulassung des IB-Stim.
 Beteiligen Sie sich an The Healthy Gut
Hände hoch, wer möchte eine unterstützende, pflegende und inspirierende Gemeinschaft mitgestalten, um Menschen auf ihrer SIBO-Reise zu unterstützen? Sie machen? Nun, das könnte die perfekte Gelegenhei
Beteiligen Sie sich an The Healthy Gut
Hände hoch, wer möchte eine unterstützende, pflegende und inspirierende Gemeinschaft mitgestalten, um Menschen auf ihrer SIBO-Reise zu unterstützen? Sie machen? Nun, das könnte die perfekte Gelegenhei
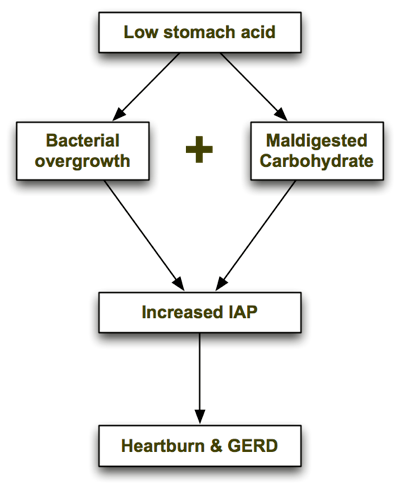 Die spezifische Kohlenhydratdiät heilt GERD?
Konventionelle Weisheit sagt uns viele Dinge, die sich als falsch herausstellen; wir sind der lebende Beweis dafür in der SCD-Community. Warum denken Sie, dass so viele unserer Familienmitglieder, Fre
Die spezifische Kohlenhydratdiät heilt GERD?
Konventionelle Weisheit sagt uns viele Dinge, die sich als falsch herausstellen; wir sind der lebende Beweis dafür in der SCD-Community. Warum denken Sie, dass so viele unserer Familienmitglieder, Fre
 Anämie und ihre Beziehung zu IBD
Anämie ist ein Begriff, der verwendet wird, um eine niedrige Anzahl roter Blutkörperchen zu beschreiben. Es gibt drei verschiedene allgemeine Arten von Blutkörperchen – rote Blutkörperchen, weiße Blut
Anämie und ihre Beziehung zu IBD
Anämie ist ein Begriff, der verwendet wird, um eine niedrige Anzahl roter Blutkörperchen zu beschreiben. Es gibt drei verschiedene allgemeine Arten von Blutkörperchen – rote Blutkörperchen, weiße Blut