Ez az eszköz biztonságos megoldást kínál IBS -ből származó fájdalmat tapasztaló serdülők kezelésére enyhe idegstimuláció alkalmazásával. A mai fellépés tükrözi folyamatos elkötelezettségünket a gyermekgyógyászati eszközök fejlesztésének előmozdítása iránt, hogy a gyermekek és serdülők hozzáférjenek az igényeiknek megfelelő biztonságos és hatékony orvostechnikai eszközökhöz. "
Carlos Peña, Ph.D., az FDA Neurológiai és Fizikai Gyógyászati Eszközök Hivatalának igazgatója az FDA Eszközök és Radiológiai Egészségügyi Központjában
Az IB-Stim egy vényköteles eszköz, amely egy kis egyszer használatos elektromos idegstimulátort tartalmaz, amelyet a beteg füle mögött helyeznek el. Elemmel működő chipet tartalmaz, amely kisfrekvenciás elektromos impulzusokat bocsát ki, hogy öt napig folyamatosan stimulálja bizonyos koponyaidegek ágait, ekkor kicserélik. Úgy gondolják, hogy a fülben és körülötte lévő idegkötegek stimulálása fájdalomcsillapító. A betegek legfeljebb három egymást követő héten keresztül használhatják a készüléket az IBS -hez kapcsolódó funkcionális hasi fájdalom csökkentésére.
Az IBS a tünetek együttes csoportja, beleértve az ismétlődő hasi fájdalmat és a bélmozgások megváltozását, ami lehet hasmenés, székrekedés vagy mindkettő. IBS esetén, a tünetek az emésztőrendszer károsodásának vagy betegségének látható jelei nélkül is jelen lehetnek.
Az FDA áttekintette egy közzétett klinikai vizsgálat adatait, amelyek 50 IBS -ben szenvedő, 11-18 éves korú beteget tartalmaztak - 27 beteget kezeltek az eszközzel, és 23 beteget kaptak placebo -eszközt. A vizsgálat a legrosszabb hasi fájdalomban mért változást mérte az alapvonaltól a harmadik hét végéig, a szokásos fájdalom- és fájdalomfrekvencia -súlyossági időtartam (PFSD) pontszámok, amelyek magukban foglalják a fájdalomélmény több aspektusát. A bélmozgások változásait nem értékelték.
A tanulmány során a betegek megengedték, hogy továbbra is stabil dózisú gyógyszereket alkalmazzanak a krónikus hasi fájdalom kezelésére. A kiindulási időszak legrosszabb fájdalma hasonló volt a kezelés és a placebo csoportok között. Egy ismételt mérési elemzés azt mutatta, hogy a kezelési csoport nagyobb változást (javulást) mutatott a legrosszabb fájdalomban a kiindulási értékről a harmadik hétre. Ez a hatás az első és a második héten is megfigyelhető volt. Nagyobb változást mutattak az összetett PFSD pontszámok is a kiindulási és a harmadik hét között az IB-Stim csoportban a placebo csoporthoz képest. Az IB-Stim kezelés legalább 30% -kal csökkentette a szokásos fájdalmat a három hét végén a kezelt betegek 52% -ánál, szemben a placebót kapó betegek 30% -ával, és legalább 30% -kal csökkent a legrosszabb fájdalom a kezelt betegek 59% -ában, szemben a placebót kapó betegek 26% -ával. A tanulmány során hat beteg enyhe füldiszkomfortról és három beteg ragasztóallergiáról számolt be az alkalmazás helyén.
A készülék ellenjavallt hemofíliás betegeknél, szívritmus -szabályozóval vagy psoriasis vulgaris -szal diagnosztizált betegek (olyan állapot, amelyben a bőrsejtek felhalmozódnak, pikkelyeket képeznek és viszketnek, száraz foltok).
Az FDA a de novo premarket felülvizsgálati útvonalon áttekintette az IB-Stim-et, az új típusú kis és közepes kockázatú eszközök szabályozási útvonala. Ez a művelet új szabályozási besorolást hoz létre, ami azt jelenti, hogy a későbbi, azonos típusú, azonos rendeltetésű eszközök az FDA 510 (k) premarket folyamatán eshetnek át, amely szerint az eszközök forgalmazási engedélyt szerezhetnek a predikátumkészülékkel való lényeges egyenértékűség igazolásával.
Ennek az eszköznek a más célokra készült hasonló verziói korábban forgalomba hozatali engedélyt kaptak az FDA -tól. Az NSS-2 BRIDGE forgalomba hozatalát 2017-ben engedélyezték az opioid-elvonás tüneteinek csökkentésére. Az FDA először törölte a készülék egy verzióját, Electro Auricular Device néven ismert, 2014 -ben az akupunktúrában való használatra.
Az FDA kiadta az IB-Stim forgalomba hozatali engedélyét az Innovative Health Solutions számára.
 Butirát élelmiszerek:a butirát előnyei és milyen élelmiszerek tartalmaznak butirátot
Íme a butirát alacsony szintje, miért van szüksége rá, valamint egy butirátos élelmiszerek listája az emésztési és általános egészségi állapot támogatására. A butirát a latin butyrumból származik ,
Butirát élelmiszerek:a butirát előnyei és milyen élelmiszerek tartalmaznak butirátot
Íme a butirát alacsony szintje, miért van szüksége rá, valamint egy butirátos élelmiszerek listája az emésztési és általános egészségi állapot támogatására. A butirát a latin butyrumból származik ,
 Ehet-e tojást, ha hasmenése van?
Bizonyos ételek súlyosbíthatják a hasmenést. Ezek az élelmiszerek közé tartoznak a tejtermékek, például a tej, a sajt és a fagylalt. Igen, a legtöbb hasmenéses egyénnél a tojás lelassítja a széklet
Ehet-e tojást, ha hasmenése van?
Bizonyos ételek súlyosbíthatják a hasmenést. Ezek az élelmiszerek közé tartoznak a tejtermékek, például a tej, a sajt és a fagylalt. Igen, a legtöbb hasmenéses egyénnél a tojás lelassítja a széklet
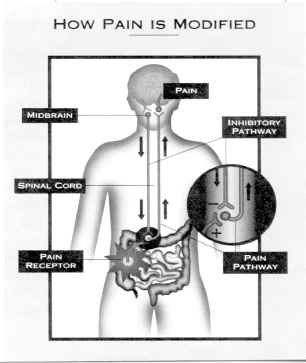 Centrálisan közvetített hasi fájdalom szindróma
A funkcionális gasztrointesztinális (GI) rendellenességekben szenvedőknek számos tünete lehet, amelyek a fájdalommentes hasmenéstől vagy székrekedéstől a hasmenéssel és/vagy székrekedéssel járó fájdal
Centrálisan közvetített hasi fájdalom szindróma
A funkcionális gasztrointesztinális (GI) rendellenességekben szenvedőknek számos tünete lehet, amelyek a fájdalommentes hasmenéstől vagy székrekedéstől a hasmenéssel és/vagy székrekedéssel járó fájdal