EBNA1 bindend en epigenetische regulatie van gastrokine tumor suppressor genen in maagcarcinoom cellen
Abstracte achtergrond
Epstein-Barr-virus (EBV) latent infecteert ~ 10 % van gastrische carcinomen (GC). Epstein-Barr nucleair antigeen 1 (EBNA1) wordt uitgedrukt in met EBV geassocieerde GC en kan gastheer-DNA, waar het cellulaire genregulatie invloed kan binden. Hier laten we zien dat EBNA1 direct bindt aan DNA stroomopwaarts van het divergent getranscribeerde GC-specifieke tumorsuppressorgenen gastrokine 1 (GKN1) en gastrokine 2 (GKN2).
Methods
Wij gebruiken ChIP-Seq, ChIP-qPCR, en EMSA aan te tonen dat EBNA1 bindt rechtstreeks aan de GKN1 en GKN2 promotor locus. We genereren AGS-EBV en AGS-EBNA1 cellijnen om de effecten van EBNA1 op GKN1 en GKN2 mRNA expressie met of zonder 5 'azacytidine onderzoeksbehandeling.
Resultaten
we zien dat gastrokine genen transcriptioneel worden uitgezet door DNA methylering . We tonen ook dat latente EBV infectie verder vermindert GKN1 en GKN2 expressie in AGS gastrische carcinoomcellen, en dat siRNA uitputting van EBNA1 deze repressie gedeeltelijk verlicht. Echter, ectopische expressie van EBNA1 licht gestegen GKN1 en GKN2 basale mRNA-niveaus, maar verminderden hun gevoeligheid voor demethyleringsmiddel.
Conclusies
Deze bevindingen tonen aan dat EBNA1 bindt aan de uiteenlopende promotor van de GKN1 en GKN2 genen in GC cellen, en suggereren dat EBNA1 bijdraagt aan het complex transcriptionele en epigenetische deregulering van de GKN1 en GKN2 tumorsuppressorgenen in EBV positieve GC.
Sleutelwoorden
EBV EBNA1 Maagcarcinoom Gastrokine ChIP-Seq epigenetische Inleiding
Epstein-Barr virus ( EBV) is een menselijke gammaherpesvirus in een groot aantal lymfoïde en epitheliale tumoren, waaronder Burkitt's lymfoom, ziekte van Hodgkin, nasofaryngeaal carcinoom (NPC), en post-transplantatie lymfoproliferatieve ziekte (besproken in [1, 2]). Meer recent is EBV gevonden in ~ 10% van maagcarcinoom (GC) gevallen wereldwijd [3, 4]. EBV geassocieerde GC werd aangetoond dat een monoklonaal uitgroei van EBV geïnfecteerde maagepitheelcellen en wordt beschouwd als een aparte groep van GC zijn [5, 6]. Omdat de incidentie van GC ligt vlakbij 900.000 mensen per jaar [7], kan EBV geassocieerde GC een van de meest voorkomende EBV-geassocieerde kankers.
In EBV positieve gastrische carcinoomcellen, EBV stelt een variant type I latency, waarbij EBV transcriptie is beperkt tot de canonische type I genen EBNA1, Ebers, BART familie niet-coderende RNA en miRNAs, maar met een aantal extra expressie van LMP2A [6, 8-11]. Onder deze latentie genen, EBNA1 de enige viraal nucleair eiwit dat wordt aangetroffen in EBV geassocieerde GC. EBNA1 is vereist voor de oprichting van de latente episomale infectie en voor de lange termijn overleving van latent geïnfecteerde cellen [12-15]. EBNA1 is een DNA-bindend eiwit dat bindt aan zowel virale als gastheer chromosomale locaties. De bindingsplaatsen in het virale genoom zijn gekarakteriseerd voor essentiële functies replicatie en transcriptionele controle van virale genexpressie. Echter, de functie van EBNA1 sequentiespecifieke binding aan het gastheerchromosoom minder goed begrepen. Terwijl EBNA1 kan binden aan de promoter gebieden van verschillende gastheer genen, blijft het onduidelijk of deze genen onder EBNA1 regulering [12, 16, 17]. Overexpressie van de EBNA1 DNA-bindingsdomein, dat functioneert als een dominant negatief in EBV geïnfecteerde cellen, kan cellevensvatbaarheid remmen in geïnfecteerde cellen, wat suggereert dat EBNA1 bindt aan en reguleert cellulaire genen betrokken celoverleving [18]. Ectopische expressie van EBNA1 is aangetoond gastheercel mRNA [19] voeren, maar het is niet duidelijk of deze effecten direct of indirect met specifieke EBNA1 bindingsplaatsen in het cellulaire genoom.
In eerder onderzoek gebruikten we ChIP-seq methoden om het genoom-brede verrijking plaatsen van EBNA1 in latent geïnfecteerde Raji Burkitt's lymfoomcellen analyseren en identificeerde talrijke cellulaire locaties bindend EBNA1 [17]. Onder de EBNA1 cellulaire verrijking plaatsen identificeerden we een significante EBNA1 bindende piek bij het gastrokine 1 (GKN1) en gastrokine 2 (GKN2, ook bekend als trefoil factor interagerende proteïne (TFIZ1)) gencluster. GKN1 en GKN2 werden geïdentificeerd op basis van hun frequent verlies van expressie in neoplastische maagcarcinoom epitheelcellen, vergeleken met normaal maagweefsel [20-22] (beschreven door [23]). Enkele recente studies beschreven antiproliferatieve en anti-invasieve activiteit GKN1 in maagepitheelcellen, die samen met het frequente expressie verlies bij kanker suggereert functioneert het als tumorsuppressor specifieke gastrische epitheel [21, 24-28]. GKN1 kunnen celmigratie en invasie remmen bij wondgenezing, transwell en Matrigel assay alsook alter celmarkers geassocieerd met de epitheliale-mesenchymale overgang [26]. GKN1 en GKN2 genen zijn gelegen in de nabijheid en getranscribeerd in tegengestelde richting, wat suggereert dat ze waarschijnlijk delen een bidirectionele promotor, en zijn onderhevig aan regulering door gedeelde transcriptie regulerende factoren (beoordeeld in [23]).
In deze coördineren studie hebben we aangetoond dat de directe binding tussen EBNA1 en GKN1-GKN2 loci en onderzocht GKN1 en GKN2 genexpressie modulatie door EBV-infectie en EBNA1 eiwit. Onze bevindingen suggereren dat EBV-infectie verder GKN1 en GKN2 expressie kan remmen, en dat het verlies van EBNA1 kunnen epigenetische de-onderdrukking van GKN2 transcriptie te vergemakkelijken. We zagen ook verhoogde DNA-methylatie niveaus GKN1 en GKN2 promotor regio's, en een mogelijke rol voor EBNA1 in de deregulering en epigenetische onderdrukking van deze tumor suppressor locus.
Resultaten
Identificatie van een hoge bezettingsgraad EBNA1 bindingsplaats op GKN1 -GKN2 locus door ChIP-Seq
Eerder verschenen ChIP-Seq gegevens van Raji BL cellen onthulde een beperkt aantal hoogverrijkt EBNA1 bindende sites op basis van de piek scores en lees de cijfers [17]. Nadere inspectie bleek een sterke EBNA1 bindingsplaats stroomopwaarts van de start locaties voor de divergent getranscribeerd GKN1 en GKN2 genen (Figuur 1A, bovenste spoor). Eenzelfde EBNA1 bindende piek werd waargenomen in een afzonderlijke ChIP-Seq experiment uitgevoerd EBV positieve nasofaryngeale carcinoomcellijn C666-1 (full ChIP-seq data elders gepubliceerd), wat aangeeft dat deze binding voorkomt in zowel epitheel alsook lymfoïde celtypes (figuur 1A, lagere spoor). Het centrum van de piek werd op ~ 5 kb van GKN2 en ~ 15 kb van de GKN1 transcriptiestartplaatsen. ChIP-qPCR gebruikt om de EBNA1 binding bij de GKN1-GKN2 promotorgebied zowel Raji en C666-1 cellen (Figuur 1B en C) valideren. qPCR aangegeven EBNA1 gebonden aan de GKN1-2 plaats met gelijke efficiëntie een eerder gevalideerd EBNA1-bindingsplaats op PITPNB promoter. qPCR ook aangegeven dat EBNA1 binding aan GKN1-GKN2 was specifiek omdat er geen detecteerbare binding aan elk EBNA1 cellulair GAPDH locus of EBV OriLyt controlegebieden, zoals verwacht (Figuur 1B en C). De vermeende EBNA1 bindingsplaats GKN1 GKN2-locus werd geïdentificeerd door aanpassing aan een consensus bindingsplaats in het EBV familie herhalingen (FR) gebied, en deze sequentie werd vervolgens getest op binding aan directe EBNA1 door EMSA (figuur 1D). Gezuiverd recombinant EBNA1 DBD eiwit werd getest op binding aan probes bevattende het GKN1-GKN2 ter (GKN1 /2), FR, of een negatieve controle sequentie ontbreekt een consensus EBNA1 bindingsplaats. We vonden dat EBNA1 DBD efficiënt gebonden aan de GKN1-GKN2 site, evenals de consensus FR, maar niet binden aan de controlesequentie. Deze bevindingen suggereren dat EBNA1 interageert met GKN1-GKN2 promoter regio door directe DNA-binding met de EBNA1 DBD. Figuur 1 EBNA1 bindt aan de GKN1 en GKN2 promoter locus. (A) De UCSC genoom browser gebruikt om EBNA1 bindende piek gegenereerd Raji en C666-1 ChIP-seq op GKN1 en GKN2 genloci kaart. RefSeq geannoteerde transcripties worden hieronder de chip-Seq piek aangeduid. (BC) Realtime-PCR validatie van ChIP-seq data voor EBNA1 bindingsplaats op het GKN1 /2 gedeelde promoter regio: EBNA1 (rode balken) of controle IgG (blauwe balken) werden getest door ChIP in Raji (B) of C666-1 cellen (C) voor DNA-binding aan de GKN1 /2 site, PITPNB promotor, GAPDH of EBV Ori-Lyt. (D) EMSA analyse 32P gemerkte probes bevattende Control GKN1 /2 site of EBV FR. Wisselende hoeveelheid EBNA1 DBD eiwit werd gebruikt in de binding reactie (0, 100, 300, 900 ng). Pijlpunten vertegenwoordigen EBNA1 specifiek gebonden complexen of gratis sonde zoals aangegeven. De sonde sequentie van GKN1 /2 site en FR wordt aangeduid met sequentie homoloog (rode letters) tussen GKN1 /2 en FR. De sequentie negatieve controle (Ctrl) wordt ook aangegeven. Error bars geven de standaarddeviatie van het gemiddelde (SDM) voor n = 3.
GKN1 en GKN2 mRNA sterk tot expressie worden gebracht in primaire maagweefsel
wij volgende gemeten GKN1 of GKN2 mRNA niveaus in verschillende maagcarcinoom cellijnen en primaire normaal maagweefsel door qRT-PCR (figuur 2). We vonden dat GKN1 en GKN2 uitgedrukt op veel hogere niveaus (~ 3 x 10
4 maal) in primaire maagweefsel dan in elk van de geteste (Figuur 2A) cellijnen. Hoewel op veel lagere niveaus dan de primaire maag weefsel, GKN1 en GKN2 werden beide uitgedrukt in meetbare niveaus in AGS maagkanker cellijnen, met GKN2 op hogere niveaus uitgedrukt dan alle andere GC cellijnen, of EBV positieve B-cel of NPC cellijnen ( figuur 2B). Zeer lage GKN1 of GKN2 kon worden gedetecteerd in primaire oraal epitheelweefsel verder aangeeft dat deze genen specifiek voor primaire maag-weefsel. Figuur 2 GKN1 en GKN2 mRNA zijn sterk uitgedrukt in primaire maag weefsel. RT-PCR werd uitgevoerd op mRNA niveau van GKN1 (blauwe staven) of GKN2 (rode balken) in verschillende cellijnen waaronder GC afgeleide GTL, MKN28, MKN74, SNU638, AGS analyseren BL-afgeleide Raji, EBV geïmmortaliseerde LCL, EBV positieve NPC lijn C666-1, of primaire mond epitheelcellen te vergelijken met (A) of zonder (B) primaire maag weefsel. Error bars geven de standaarddeviatie van het gemiddelde (SDM) voor n = 3
EBV latency vermindert GKN1 en GKN2 mRNA expressie in GC cellijnen Belgique Om het effect van EBV latente infecties aan GKN1 en GKN2 expressie getest genereerden we een AGS cellijn die EBV B95.8 bacmide. De AGS cellijn werd geselecteerd voor hygromycine resistentie en GFP positiviteit zodat bevatte bacmide componenten. Om de AGS-EBV cellijn karakteriseren, moeten we eerst een analyse van de EBV genexpressie patroon (figuur 3). We vonden dat AGS-EBV cellen bracht detecteerbare niveaus van mRNA EBNA1, BARF0 en LMP2A, maar niet LMP1, EBNA2 of EBNA3C (figuur 3). Hoewel EBV B95.8 bacmide ontbreekt de BART miRNAs, deze bevindingen komen overeen met AGS-EBV cellen tot vaststelling van een variant van type I latentie genexpressie programma met enkele uiting van LMP2A, vergelijkbaar met die in EBV positieve maagcarcinoom tumorweefsel [8, 10 ]. Om verder te karakteriseren AGS-EBV cellen, analyseerden we EBNA1 eiwit expressie door Western blot (Figuur 4A) en EBV DNA kopie aantal door qPCR (Figuur 4B). EBNA1 werd gedetecteerd als een enkele laag abundantie bij de verwachte moleculaire massa (Figuur 4A). EBV kopieaantal werd gemeten door EBV Ori-Lyt DNA aan cellulaire GAPDH (figuur 4B). We vonden dat AGS-EBV bevatten ~ 50% minder kopieën van het virale genoom in vergelijking met EBV positieve LCL. Om te bepalen of EBNA1 de DNA bindingsactiviteit behouden in AGS-EBV, voerden we gebruikelijke ChIP assays (figuur 4C). We vonden dat EBNA1 gebonden aan de EBV dyade symmetrie (ds) DNA, en de GKN1 GKN2-bindingsplaats in AGS-EBV cellen. We volgende gevraagd of GKN1 of GKN2 mRNA niveaus werden getroffen door EBV latente infectie in AGS cellen door het vergelijken van RT-qPCR expressie niveaus in AGS ten opzichte van AGS-EBV-cellen (Figuur 4D). We vonden dat GKN1 en GKN2 werden onderdrukt ~ 3-8 vouw in AGS-EBV ten opzichte van AGS cellen, wat suggereert dat EBV latency bevordert of stabiliseert de transcriptie onderdrukking van GKN1 en GKN2. Figuur 3 Karakterisering van EBV genexpressie in AGS-EBV cellijnen. AGS, AGS-EBV positieve en EBV-LCL werden voor mRNA expressie geanalyseerd door qRT-PCR met primers voor EBNA1, BARF0, LMP2A, LMP1, EBNA2 of EBNA3C, zoals aangegeven. Error bars geven de standaarddeviatie van het gemiddelde (SDM) voor n = 3
Figuur 4 EBV infectie van AGS cellen onderdrukt GKN1 en GKN2 transcriptie. (A) Western blot analyse van EBNA1 eiwitexpressie in AGS-EBV cellen tegen EBV-negatieve AGS cellen werd uitgevoerd onder toepassing van antilichaam voor EBNA1 (boven) of actine (bodem). (B) DNA kopieaantal werd bepaald door real-time PCR van EBV Ori-Lyt DNA opzichte van het niveau van cellulaire GAPDH in AGS AGS-EBV en EBV-LCL cellen. (C) chip en real-time PCR-analyse van EBNA1 (rode balken) of controle IgG (blauwe staven) voor DNA binding bij de EBV sites zoals DS en Ori-Lyt of cellulaire sites zoals GKN1 /2 en GAPDH in AGS-EBV cellen. (D) RT-PCR werd uitgevoerd op mRNA niveau van GKN1 of GKN2 in AGS (blauwe staven) of AGS-EBV cellen (rode balken) geanalyseerd. ** Geeft p < 0,005. Error bars geven de standaarddeviatie van het gemiddelde (SDM) voor n = 3
EBV verhoogt DNA methylering afhankelijke repressie van GKN1 en GKN2 mRNA in cellijnen GC
GKN1 GKN2 en kan worden onderworpen aan epigenetische onderdrukking in GC en weefsels cultuur cellijnen. Om deze mogelijkheid te onderzoeken, hebben we getest of de behandeling met DNA demethyleringsmiddel 5 'azacytidine (Aza) of deacetyleren middel (NaB) in combinatie met forbolester (TPA) zou GKN1 of GKN2 in AGS-cellen (Figuur 5A) te activeren. We vonden dat Aza behandeling leidde tot een ~ 10-voudige toename GKN2 en ~ 4-voudige toename GKN1 transcriptie in AGS behandelde cellen. Daarentegen NaB /TPA behandeling produceerde slechts ~ 2 voudige activatie van transcriptie. Deze bevindingen suggereren dat zowel GKN1 en GKN1 zijn onder actieve epigenetische onderdrukking door middel van DNA-methylatie. Om te testen of EBV effect op Aza activatie van GKN1 of GKN2 hadden, vergeleken we de effecten van behandeling op de AGS Aza opzichte AGS-EBV cellen door qRT-PCR (Figuur 5B). We vonden dat GKN1 en GKN2 efficiënt werden geactiveerd door Aza behandeling AGS cellen, maar in mindere mate in AGS-EBV. In deze experimenten werd Aza-geïnduceerde activatie van GKN2 volledig geëlimineerd, terwijl activatie van GKN1 slechts gedeeltelijk verzwakte. Aza-behandeling leidde ook tot de ~ 8,4 voudige toename van EBNA1 mRNA niveaus, wat suggereert dat Aza behandeling stimuleert EBV lytische genexpressie in AGS-EBV cellijnen. Deze resultaten suggereren dat de EBV genproducten voorkomen GKN2, en in mindere mate GKN1 activatie na Aza behandeling. Figuur 5 EBV versterkt de onderdrukking van GKN1 en GKN2 genexpressie door DNA-methylatie. (A) AGS cellen werden behandeld met 10 uM Aza of 1 mM NaB en 20 ng /ml TPA gedurende 48 uur en geanalyseerd door RT-PCR voor GKN1 of GKN2 expressieniveau in vergelijking met onbehandelde AGS. (B) cellen of AGS AGS-EBV cellen werden behandeld of onbehandeld met 10 uM Aza gedurende 48 uur, daarna geanalyseerd voor GKN1, GKN2 mRNA of EBNA1 mRNA niveaus. (C) MeDIP bepaling van AGS of AGS-EBV cellen behandeld of onbehandeld met 10 uM Aza gedurende 48 uur bij verschillende DNA-gebieden van GKN1 en GKN2 loci. (D) MeDIP test van AGS of AGS-EBV cellen behandeld of onbehandeld met 10 uM Aza gedurende 48 uur bij cellulaire regio's voor alfa globine-2, GAPDH, Cdc7, FOXP2, HDAC3 of MAP3KIP2. (E) Genome positie van primers die voor GKN1-GKN2 chip en MeDIP assays. * Geeft p < 0,05, ** geeft p < 0,005. Error bars aangegeven SDM voor n = 3. Belgique Om beter te begrijpen van het mechanisme van GKN1 en GKN2 epigenetische onderdrukking, onderzochten we de DNA-methylatie niveaus met behulp van methyl cytosine-specifiek antilichaam gericht DNA immunoprecipitatie (MeDIP) assay. We getest verrijking van gemethyleerd DNA in de GKN1-GKN2 controlegebied in AGS en AGS-EBV cellen met of zonder Aza behandeling (figuur 5C). Wij namen een relatieve verrijking van gemethyleerde CpG in een gebied tussen de EBNA1 bindingsplaats en transcriptie startplaats GKN2 (GKN2_A). Aza behandeling leidde tot een afname van MeDIP signaal in de meeste gebieden waar signaal werd gedetecteerd, wat suggereert dat Aza behandeling leidde tot een algemene vermindering van DNA-methylatie. Vertaald verlies van CpG methylering bij de in de alfa-globine-gen (dat niet bindt EBNA1), en op verschillende EBNA1 bindingsplaatsen, zoals HDAC3 en MAP3K7IP (figuur 5D). We merkten ook op dat MeDIP signalen waren over het algemeen hoger in EBV-AGS dan in AGS cellen, wat suggereert dat EBV latente infectie kan bevorderen of stabiliseren van DNA-methylatie in het hele genoom van de gastheer.
EBNA1 uitputting activeert GNK1 en GKN2 mRNA expressie in EBV positieve epitheelcellen Belgique om te bepalen of EBNA1 bijgedragen aan de transcriptionele repressie van GKN1 en GKN2 we eerst getracht EBNA1 in AGS-EBV cellen middels siRNA (figuur 6) afbreken. We genereerden een siRNA gericht op de 3 'niet-coderende UTR van mRNA EBNA1, die gedeeltelijk EBNA1 eiwit waaruit AGS-EBV cellen (Figuur 6B). Uitputting van EBNA1 resulteerde in een ~ 5-voudige activatie van GKN2, met weinig detecteerbare activatie van GKN1 (figuur 6A). Deze bevindingen suggereren dat EBNA1 kan functioneren als een transcriptionele repressor van GKN2 in AGS-EBV cellen. Figuur 6 siRNA uitputting van EBNA1 veroorzaakt de repressie van de GKN1 en GKN2 in AGS-EBV cellen. siCtrl of siEBNA1 getransfecteerde AGS-EBV cellen werden geanalyseerd door RT-PCR voor GKN1 GKN2 of mRNA niveau ten opzichte van cellulaire GAPDH (A). Cellen werden geoogst 72 uur na transfectie met siRNA. Western blot die EBNA1 (bovenste paneel) en belastingsbegrenzing actine (onderste paneel) in AGS-EBV cellen (B). Fout balken geven de standaardafwijking van het gemiddelde (SDM) voor n = 3.
EBNA1 remt GKN1 en GKN2 transcriptie na DNA demethylering Belgique Om de bijdrage van EBNA1 aan GKN1 en GKN2 transcriptie regelgeving verder te onderzoeken, hebben we het effect van de geteste ectopische expressie van alleen EBNA1 op Aza-geïnduceerde niveaus van GKN1 of GKN2 transcriptie in cellen GC. AGS cellen werden getransduceerd met een EBNA1 expressie lentivirus. Stabiele AGS-EBNA1 (PLU-EBNA1) of AGS- controle vector (PLU-Vec) cellijnen werden geselecteerd en getest op GKN1 en GKN2 mRNA-niveaus. We zagen dat AGS-EBNA1 cellen had een ~ 2-3 maal hoger basaal niveau van GKN1 en GKN2 mRNA ten opzichte van de ouders AGS-cellen (Figuur 7A). Echter, Aza-geïnduceerde mRNA van GKN1 en GKN2 werden verzwakt in AGS-EBNA1 tegenover AGS cellen (Figuur 7B). Aza behandeling leidde ook tot een grote toename van EBNA1 mRNA (Figuur 7C). Om te bepalen of de effecten van EBNA1 op GKN1 en GKN2 specifiek waren AGS cellen getransduceerd we een EBV negatieve GC cellijn MKN74 met EBNA1 lentivirus (figuur 7D-F). Soortgelijke AGS cellen, vonden we dat EBNA1 verhoogde basale niveaus van GKN1 en GKN2, maar remde het vermogen van Aza tot GKN1 en GKN2 mRNA (Figuur 7D en E) verder induceren. We bevestigd dat Aza-behandeling was effectief door meting EBNA1 mRNA-niveaus, die ~ 7 voudig (Figuur 7F) verhoogd. Deze bevindingen suggereren dat ectopische expressie van EBNA1 basale kan verhogen, maar remt Aza-geïnduceerde niveaus van GKN1 en GKN2 transcriptie in EBV negatieve cellijnen GC. Figuur 7 EBNA1 remt GKN1 en GKN2 transcriptie na DNA demethylering GC cellen. (A) AGS-cellen werden getransduceerd met PLU-vector (Vec) of PLU-EBNA1 en dan onbehandelde (Untr) of behandeld met 10 uM 5'-azacytidine (Aza) voor 48 uur. GKN1 GKN2 en mRNA werden gekwantificeerd door qRT-PCR ten opzichte van GAPDH. (B) Vouw inductie van GKN1 en GKN2 mRNA door Aza werden gekwantificeerd van het paneel A. (C) qRT-PCR-analyse van EBNA1 mRNA-niveaus in AGS-cellen. (D) Hetzelfde als in A, behalve dat in plaats MKN74 AGS cellen. (E) Vouw inductie van GKN1 en GKN2 mRNA gekwantificeerd uit paneel D. (F) qRT-PCR-analyse van EBNA1 mRNA-niveaus in MKN74 cellen. * Geeft p < 0,05, ** geeft p < 0,005. Foutbalken aangegeven sdm voor n = 3.
Bespreking In deze studie identificeerden we een hoge bezettingsgraad EBNA1 bindingsplaats in de 5 'promoter controlegebied van het divergent getranscribeerde GKN1 en GKN2 genen. EBNA1 bindingsplaatsen werden waargenomen in twee onafhankelijke ChIP-Seq data sets van EBV positieve lymfatische BL cellen Raji en EBV positieve epitheliale nasofarynxcarcinoom cellen C666-1 (Figuur 1A). We bevestigden deze bindingsplaatsen met gebruikelijke ChIP-qPCR in beide cellijnen (figuur 1B en C). EBNA1 werd ook aangetoond dat rechtstreeks binden aan deze sites door het EMSA met gezuiverd recombinant EBNA1 DBD eiwit (figuur 1D). We tonen aan dat GKN1 en GKN2 mRNA sterk worden onderdrukt in de meeste cellijnen ten opzichte van primaire maagweefsel (figuur 2). Om de mogelijke rol van EBV en EBNA1 in de transcriptionele controle van GKN1 en GKN2 onderzoeken genereerden wij een EBV-positieve AGS maagcarcinoom cellijn. We laten zien dat EBV stelt een variant type I latentie patroon AGS cellen (figuur 3), en dat EBNA1 kan binden aan de GKN1 /GKN2 promotorgebied in het cellulaire chromosoom (figuur 4C). We vonden ook dat GKN1 en GKN2 mRNA verder werden onderdrukt in EBV positieve AGS cellen ten opzichte van EBV negatieve AGS-cellen (Figuur 4D) te controleren. Vervolgens bleek dat Aza-behandeling leidde tot de toename van expressie GKN1 en GKN2 (figuur 5A), en EBV latente infectie remt Aza activering van GKN2 (figuur 5B). We vonden dat siRNA depletie van EBNA1 in EBV positieve AGS cellen leidt tot transcriptie activatie van GKN2 (figuur 6). We tonen ook dat EBNA1 ectopische expressie matige verhoging basale, maar remt de Aza-geïnduceerde niveaus van GKN1 en GKN2 transcriptie (Figuur 7). Samengevat, deze bevindingen aan dat EBNA1 bindt aan de GKN1-GKN2 promoter controlegebied in meerdere celtypen en de mogelijkheid dat EBNA1 bijdraagt aan de transcriptionele en epigenetische onderdrukking van de GKN1 en GKN2 tumorsuppressorgenen in EBV positieve GC verhogen.
EBV latente infectie is bekend dat het tumorigene fenotype van gastrische carcinoomcellen [29-31] verhogen. GKN1 en GKN2 gerapporteerd gefunctioneerd als celgroei remmers en tumor suppressors in GC [20, 21, 23, 25-27]. Onze mRNA expressie gegevens waaruit blijkt hoog niveau mRNA expressie alleen in het primair normale maag weefsel in overeenstemming zijn met een rol van GKN1 en GKN2 als een tumor suppressor. Maar we waren niet in staat om aan te tonen dat overexpressie van één of beide GKN1 of GKN2 in AGS of AGS-EBV veroorzaken celcyclus of levensvatbaarheid te verminderen (gegevens niet getoond). Dit suggereert dat GKN1 en GKN2 functie in eerdere stadia in tumorcel evolutie, of in meer complexe tumor micro-omgevingen. We speculeren dat EBNA1 een meer uitgesproken effect op GKN1 en GKN2 expressie in situaties waarin EBV primaire maag cellen waarin basale expressie van GKN1 en GKN2 hoog en belangrijk voor tumorsuppressie kunnen infecteren kunnen hebben.
Vorige gepubliceerde studies hebben aangetoond dat GKN1 en GKN2 transcriptie onderworpen aan epigenetische onderdrukking van DNA methylatie in alle vormen van GC [21]. Onze studies zijn consistent met de rol van DNA methylering in de epigenetische onderdrukking van GKN1 en GKN2 in AGS cellen. Behandeling met Aza resulteerde in de 4-10-voudige toename GKN1 en GKN2 mRNA expressie (figuur 5A) en MeDIP onthulde verrijking van gemethyleerd DNA bij de promotergebieden (figuur 5C). AGS-EBV cellen toonde een toename van DNA methylatie op verschillende cellulaire locaties, waaronder gebieden rond de EBNA1 bindingsplaatsen op GKN1 promotorgebied (Figuur 5C), en de HDAC3 en MAP3K7IP2 genen (figuur 5D). Echter, de aanwezigheid van EBNA1 in AGS-EBV cellen niet voorkomen Aza-geïnduceerde demethylering in situ. Dit suggereert dat EBNA1 transcriptie kan onderdrukken van een aantal promoters, zoals GKN2, via een mechanisme verschillend van DNA methylatie. Echter, ectopische expressie van EBNA1 alleen produceerde een ingewikkelder fenotype, waardoor een kleine toename van de basale expressie, maar de effecten van Aza-geïnduceerde demethylering (figuur 7) beperkt. Dit kan erop wijzen dat EBNA1 anders functioneert bij ectopisch tot expressie gebracht, dan uitgedrukt in de context van het virale genoom. Niettemin, onze bevindingen suggereren dat EBNA1 verstoort de normale transcriptionele regulatie van de GKN1 en GKN2 genen. Ondernemingen De precieze functie van EBNA1 in transcriptie regulatie blijft onduidelijk. EBNA1 is betrokken bij de transcriptionele activering en onderdrukking van zowel virale als cellulaire genen [32, 33]. EBNA1 kan zijn eigen mRNA expressie van EBV Qp onderdrukken bij type III latency, waarbij repressie is gekoppeld sterische interferentie met RNA polymerase II binding aan de transcriptie-initiatieplaats [34]. Anderzijds kunnen EBNA1 Cp en LMP1 promoters activeren type III latency waar het kan functioneren als een versterker-achtige factor [35-37]. EBNA1 is betrokken bij transcriptie activeren van een aantal cellulaire genen, waaronder het gen voor Nox2 zuurstofradicalen vorming [19]. EBNA1 kan ook invloed hebben op de gastheer-cel transcriptie via een wereldwijd herinrichting van de gastheer chromosoom [38]. Aldus kan EBNA1 cellulaire transcriptie door meerdere directe en indirecte mechanismen veranderen.
Epigenetische modificaties zijn bekend een belangrijke rol in EBV geassocieerde maagcarcinoom [39] spelen. Interessant, AGS cellen die EBV bacmide genomen hadden hogere niveaus van gemethyleerd DNA op vele geteste sites (figuur 5D). Dit is consistent met de voorgestelde rol van EBV in de methylering van ontvangst tumorsuppressorgenen [40]. Dit komt ook overeen met de bevindingen dat EBV positieve GC DNA methylatie heeft verheven bij promotor regio's van een aantal belangrijke GC tumor suppressors, waaronder gastrokine genen [39, 41-45]. Terwijl EBNA1 gebonden in de buurt van DNA gemethyleerd regio's van de GKN2, waren we niet in staat om aan te tonen dat EBNA1 moduleert DNA methylatie op de GKN1 en GKN2 sites (gegevens niet getoond). Het is echter mogelijk dat EBNA1 in associatie met een ander viraal gecodeerde of geïnduceerde factor GKN1 en GKN2 transcriptionele repressie kan stabiliseren door een chromatine-afhankelijke en structureel mechanisme dat DNA methylatie versterkt. Het is ook mogelijk dat EBNA1 GKN1 of GNK2 kunnen zelf alleen in weefsel of tumor micro-omgevingen die niet gemakkelijk worden gekaderd celkweek. Terwijl de functie van EBNA1 binding aan chromosoom hosten blijft een belangrijk gebied van onderzoek, kan meer geavanceerde infectie modellen worden verlangd dat hij zijn mogelijke rol in het veranderen van gastheercel genexpressie en carcinogenese te helderen.
Methods
Cells, plasmiden, en lentivirus infectie
EBV-positieve Burkitt lymfoom Raji cellen, EBV positieve nasofarynxcarcinoom C666-1 cellen en maagcarcinoom cellijnen (een gift van Dr. Antonia R. Sepulveda, Columbia University), waaronder GTL, MKN28, MKN74, SNU638 werden in RPMI met 10% FBS gehouden, aangevuld met antibiotica (penicilline en streptomycine). Maagcarcinoom AGS-cellen (ATCC CRL-1739) werden in F-12K bevattende 10% FBS gehouden. Primaire mond epitheelcellen werden verstrekt door Dr. Manjunatha Benakanakere, University of Pennsylvania en gekweekt in Keratinocyte-SFM medium. EBV-LCL werd vastgesteld primaire infectie van perifere bloed mononucleaire cellen (PBMC) met EBV BAC virions geproduceerd door gestimuleerde 293-EBV-cellen [46, 47]. EBV-LCL bevat een hygromycine B resistente EBV bacmide in RPMI bevattende 10% FBS, hygromycine B (100 gg /ml), glutamax (Invitrogen) en antibiotica werden gehandhaafd. AGS-EBV cellen werden gegenereerd uit AGS cellen co-gekweekt met EBV-LCL door aanpassing van een eerder gepubliceerde co-cultivatie methode beschreven AGS cellen infectie met rEBV via cel-cel contact [48] met enkele wijzigingen. In het kort werd EBV-LCL geïnduceerd door 20 ng /ml 12-O
tetradecanoylforbol-13-acetaat (TPA) en 1 mM natriumbutyraat (NaB) 24 uur voor gelijktijdige kweek. De geïnduceerde EBV-LCL cellen werden tweemaal gewassen met PBS voor het verwijderen van het inducerende middelen, geresuspendeerd met volledig RPMI medium bij 10 6 cellen /ml voor de co-incubatie. AGS cellen werden uitgeplaat in 6-well platen 24 uur voor gelijktijdige kweek, vervolgens 60-70% confluente AGS cellen in 1 ml compleet F-12K medium geïncubeerd met 10 6 geïnduceerde en gewassen EBV-LCL cellen in 1 ml compleet RPMI. 24 uur later, werd 2 ml serumvrij F-12K medium aan elk putje toegevoegd om de FBS-concentratie te verlagen tot 5% naar cel overgroei te voorkomen. 3 dagen na co-incubatie werden EBV-LCL cellen van de co-kweken verwijderd en de AGS cellen werden grondig met PBS gewassen minstens 5 keer een van de donor EBV-LCL cellen te verwijderen. De geïnfecteerde AGS cellen werd vervolgens geïncubeerd met verse F-12K-medium met 10% FBS en 100 ug /ml hygromycine B en het selectiemedium werd elke 2 tot 3 dagen totdat de geïnfecteerde AGS cellen gevormd Hyg B selectie kolonies GFP expresseren (meestal 3 tot 4 weken na mede-kweek). De selectie kolonies werden vervolgens samengevoegd en getest op EBNA1 expressie en EBV genoom kopieaantal voor onder experimenten. AGS-EBV cellen werden in F-12K-medium met 10% FBS en 100 ug behouden /ml hygromycine B.
PLU-EBNA1 Lentivirus expressievector werd geconstrueerd door PCR amplificatie van EBNA1 met primers (GCGGGATCCTCTGACGAGGGGCCAGGTACAGGACCT en ATCGTCGACTCACTCCTGCCCTTCCTCACCCTCATC) inbrengen van een 5 ' BamH I en 3 'Sal I plaats gekloond in frame aan PLU-TCMV-FMCS-pPURO. AGS of MKN74 cellen werden geïnfecteerd met Lentivirus expressie PLU-EBNA1 of PLU controlevector vers gegenereerd uit 293T cellen. Geïnfecteerde AGS of MKN74 cellen werden vervolgens geselecteerd met 2,5 ug /ml Puromycine gedurende 10 tot 14 dagen. De geselecteerde cellen werden samengevoegd en behandeld met of zonder 5'-azacytidine gedurende 48 uur daarna onderworpen aan RT-PCR.
SiRNA tegen EBNA1 en siRNA controle (Cat. No. D-001810-01-20) werden allen aangekocht bij Dharmacon. siRNA gericht tegen EBNA1 3'UTR werden gesynthetiseerd met de doelsequentie CGGAGAUGACGGAGAUGAAUU. Transfectie van siRNA duplexen werd uitgevoerd met Oligofectamine (Dharmacon), na fabrikantenspecificaties.
Chromatine immunoprecipitatie (ChIP) assays
ChIP assays werden uitgevoerd zoals eerder [49] beschreven. Alle auteurs gelezen en goedgekeurd het definitieve manuscript.
 Voedselreacties worden bepaald door het darmmicrobioom,
Voedselreacties worden bepaald door het darmmicrobioom,
 Rotavirus speelt rol bij ontwikkeling van type 1 diabetes
Rotavirus speelt rol bij ontwikkeling van type 1 diabetes
 Nieuw medicijn kan helpen bij de behandeling van het prikkelbaredarmsyndroom
Nieuw medicijn kan helpen bij de behandeling van het prikkelbaredarmsyndroom
 Minderheidspatiënten op spoedeisende hulp krijgen minder kans op pijnstillers voor buikpijn
Minderheidspatiënten op spoedeisende hulp krijgen minder kans op pijnstillers voor buikpijn
 SIBO-vriendelijk rijstepapontbijtrecept
SIBO-vriendelijk rijstepapontbijtrecept
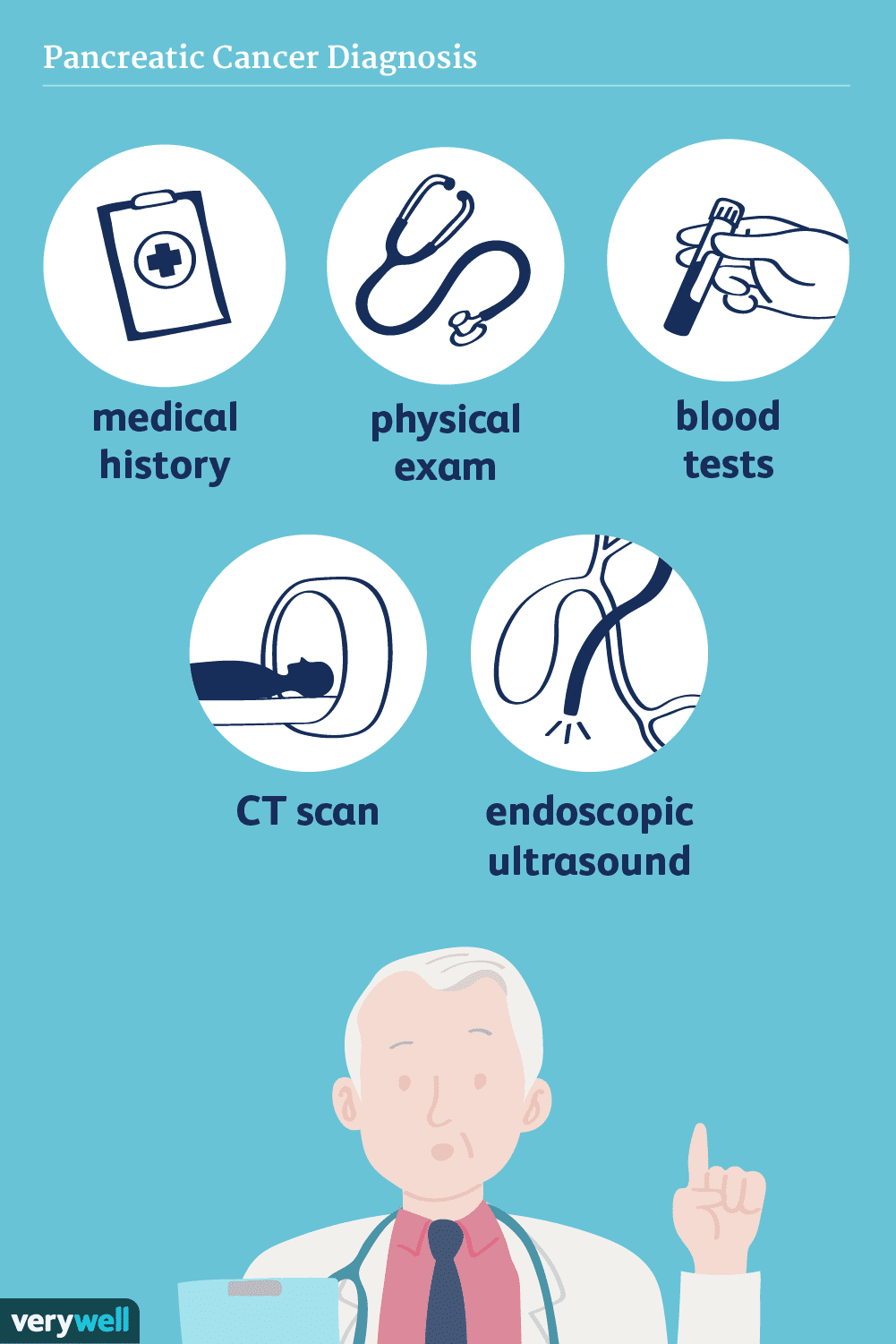 Hoe pancreaskanker wordt gediagnosticeerd
Hoe pancreaskanker wordt gediagnosticeerd
 3 vragen die u uzelf moet stellen voordat u met het SCD-dieet begint
Het is beter om de antwoorden op deze vragen met de hand te schrijven dan te typen, maar het is nog beter om uw antwoorden achter te laten in de opmerkingen hieronder, zodat u binnen 6 maanden terug k
3 vragen die u uzelf moet stellen voordat u met het SCD-dieet begint
Het is beter om de antwoorden op deze vragen met de hand te schrijven dan te typen, maar het is nog beter om uw antwoorden achter te laten in de opmerkingen hieronder, zodat u binnen 6 maanden terug k
 Stress kan zwaar zijn voor je maag
Je hebt waarschijnlijk gehoord dat stress schade kan veroorzaken aan zowat elk deel van je lichaam en geest. Chronische stress kan veel ernstige gezondheidsproblemen verergeren: Geestelijke gezondhei
Stress kan zwaar zijn voor je maag
Je hebt waarschijnlijk gehoord dat stress schade kan veroorzaken aan zowat elk deel van je lichaam en geest. Chronische stress kan veel ernstige gezondheidsproblemen verergeren: Geestelijke gezondhei
 Hoe veilig is het gebruik van Pepto-Bismo?
Veel mensen wenden zich tot Pepto Bismol (of Kaopectate) als ze maagklachten of diarree hebben. Deze problemen kunnen vaker voorkomen als u het prikkelbare darm syndroom (PDS) heeft en u zou Pepto Bis
Hoe veilig is het gebruik van Pepto-Bismo?
Veel mensen wenden zich tot Pepto Bismol (of Kaopectate) als ze maagklachten of diarree hebben. Deze problemen kunnen vaker voorkomen als u het prikkelbare darm syndroom (PDS) heeft en u zou Pepto Bis