Этот метод может ускорить идентификацию детерминант резистентности патогенов с множественной лекарственной устойчивостью (МЛУ) и разработку новых стратегий противодействия резистентности.
Исследование открыло новые возможности для геномного редактирования этих диких видов и изолятов бактерий. такие как те, которые имеют клиническое и экологическое значение, и те, которые образуют микробиом человека. Он также предоставил основу для использования других систем CRISPR-Cas, широко распространенных в прокариотических геномах, и расширения наборов инструментов на основе CRISPR. Исследование опубликовано в ведущем научном журнале. Исследования нуклеиновых кислот .
Система CRISPR-Cas включает в себя адаптивную иммунную систему прокариот, которая обезоруживает вторгшиеся вирусы, расщепляя их ДНК. Благодаря своей уникальной способности нацеливать и изменять последовательности ДНК, CRISPR-Cas использовался как метод редактирования генома нового поколения.
Метод основан на системе CRISPR / Cas9 класса 2 типа II, который произвел революцию в генетике и биомедицинских исследованиях множества организмов и был удостоен Нобелевской премии по химии 2020 года. Тем не мение, Системы CRISPR-Cas класса 2 представляют только ~ 10% систем CRISPR-Cas, которые в природе кодируются прокариотами. Их приложения для редактирования бактериальных геномов довольно ограничены.
Примечательно, что Системы CRISPR-Cas, принадлежащие к разным классам и типам, постоянно идентифицируются, и они служат глубоким резервуаром для расширения наборов инструментов на основе CRISPR. Самая разнообразная и широко распространенная система CRISPR-Cas - это система типа I, на которую приходится 50% всех идентифицированных систем CRISPR-Cas, и она имеет потенциал для расширения наборов инструментов на основе CRISPR с отличительными преимуществами, недоступными для систем класса 2, такая как высокая специфичность, минимальное отклонение от цели, и способна к удалению больших фрагментов.
Тем не мение, Система CRISPR-Cas типа I опирается на многокомпонентный эффекторный комплекс, называемый каскадом, для вмешательства в ДНК, которая не может быть легко передана гетерологичным хозяевам, препятствует широкому применению этих широко распространенных в природе CRISPR для редактирования генома и терапии.
Ранее, команда определила высокоактивную систему CRISPR-Cas типа I-F в клинической лекарственной устойчивости P. aeruginosa штамм PA154197, который был изолирован от случая инфекции кровотока в больнице Королевы Марии. Они охарактеризовали эту систему CRISPR-Cas и успешно разработали метод редактирования генома, применимый к изоляту MDR, на основе этой системы CRISPR-Cas нативного типа I-F. Этот метод позволил быстро идентифицировать детерминанты резистентности клинического изолята МЛУ и разработать новую стратегию противодействия резистентности ( Отчеты по ячейкам , 2019, 29, 1707-1717).
Чтобы преодолеть барьер передачи комплексного каскада типа I гетерологичным хозяевам, в этом исследовании, команда клонировала весь тип I-F cas оперон в способный к интеграции вектор mini-CTX и доставил кассету к гетерологичным хозяевам путем конъюгации, подход к переносу ДНК, распространенный в природе. Вектор mini-CTX позволил интегрировать весь каскад на консервативный attB генетический локус в геноме гетерологичных хозяев, позволяя им иметь «родную» систему CRISPR-Cas типа I-F, которая может быть стабильно выражена и функционировать.
Команда показала, что перенесенный каскад типа I-F демонстрирует значительно большую способность к интерференции ДНК и более высокую стабильность штаммов, чем переносимая система Cas9, и может использоваться для редактирования генома с эффективностью (> 80%) и простотой, то есть одностадийной трансформацией единственной редактирующей плазмиды.
Более того, они разработали усовершенствованную переносимую систему, которая включает как высокоактивный каскад типа I-F, так и рекомбиназу, чтобы способствовать применению системы в штаммах с плохой гомологичной рекомбинационной способностью, дикий P. aeruginosa изоляты без информации о последовательности генома, и в других Псевдомонады разновидность.
Наконец, введенные гены каскада типа I-F могут быть легко удалены из геномов хозяина посредством делеции больших фрагментов ДНК, опосредованной I-F каскадом, что приводит к безрубцовому редактированию генома в клетках-хозяевах. Также было продемонстрировано применение переносимой системы для репрессии генов. подчеркивая надежные и разнообразные приложения разработанной системы CRISPR I-F переносного типа.
Д-р Айсин Ян предсказала, что этот новый метод будет распространен на редактирование не только патогенов, но и микробиома для улучшения здоровья человека.
<цитата>Мы верим, что технологии и методы лечения на основе CRISPR принесут новые надежды на борьбу с супербактериями в будущем. . "
Д-р Айсинь ЯН, Доцент, Отдел исследований молекулярной и клеточной биологии, Факультет наук, Университет Гонконга
 15 триггеров воспаления, вызывающих вспышку диареи
15 триггеров воспаления, вызывающих вспышку диареи
 Миома матки (доброкачественные опухоли матки)
Миома матки (доброкачественные опухоли матки)
 Какие продукты лучше всего есть при ГЭРБ?
Какие продукты лучше всего есть при ГЭРБ?
 Как мы разработали успешную практику консультирования по вопросам здоровья
Как мы разработали успешную практику консультирования по вопросам здоровья
 Что такое холангиоскопия SpyGlass?
Что такое холангиоскопия SpyGlass?
 Жареная брюссельская капуста в масле авокадо с апельсином и гранатом
Жареная брюссельская капуста в масле авокадо с апельсином и гранатом
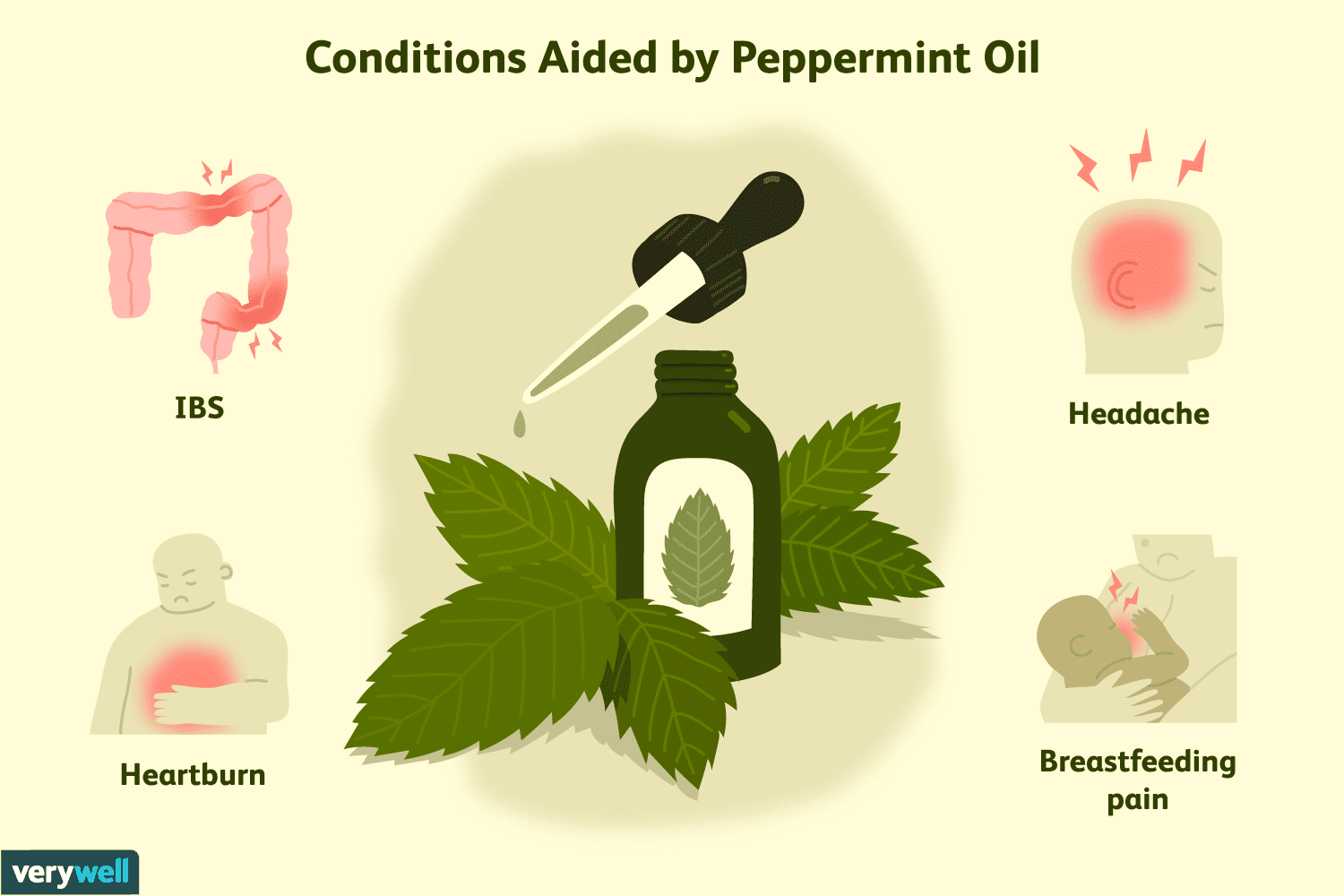 Полезные свойства мятного масла для здоровья
Мята перечная (Mentha piperita ) обычно используется для ароматизации пищи, особенно сладких угощений. Масло и листья мяты перечной также используются для лечения различных заболеваний, от изжоги до г
Полезные свойства мятного масла для здоровья
Мята перечная (Mentha piperita ) обычно используется для ароматизации пищи, особенно сладких угощений. Масло и листья мяты перечной также используются для лечения различных заболеваний, от изжоги до г
 Что такое дистальная резекция желудка?
Что такое дистальная гастрэктомия? Дистальная гастрэктомия или антрэктомия удаляет часть желудка, а остаток сшивает с отверстием в тонкой кишке. Антрэктомия (дистальная гастрэктомия) — это процеду
Что такое дистальная резекция желудка?
Что такое дистальная гастрэктомия? Дистальная гастрэктомия или антрэктомия удаляет часть желудка, а остаток сшивает с отверстием в тонкой кишке. Антрэктомия (дистальная гастрэктомия) — это процеду
 Специальная углеводная диета основана на 124-летнем опыте исследований и испытаний
В начале 1900-х годов исследователи лихорадочно работали над тем, чтобы понять роль жиров, белков и углеводов у пациентов с глютеновой болезнью. Сначала предполагалось, что проблема в белке; тогда жи
Специальная углеводная диета основана на 124-летнем опыте исследований и испытаний
В начале 1900-х годов исследователи лихорадочно работали над тем, чтобы понять роль жиров, белков и углеводов у пациентов с глютеновой болезнью. Сначала предполагалось, что проблема в белке; тогда жи