Ключевые моменты обновленного руководства NCCN по клинической практике рака почки, связанные с CABOMETYX, включают:
«CABOMETYX - единственный TKI, показанный для лечения распространенного рака почки с предпочтительным статусом NCCN для групп среднего и низкого риска в условиях первой линии, и единственный TKI с предпочтительным статусом для пациентов, которые прогрессировали на предыдущей терапии, "сказал Майкл М. Моррисси, Кандидат наук., Президент и главный исполнительный директор Exelixis. "Мы приветствуем эти обновленные рекомендации, которые признают важность данных испытаний CABOSUN, включенных в нашу этикетку, как важный шаг вперед в уходе за пациентами с этим заболеванием ».
Рекомендации NCCN по клинической практике являются признанным стандартом клинической политики в области лечения рака и разработаны на основе анализа доказательств и рекомендаций врачей и исследователей онкологии. Решение комиссии по раку почки NCCN включить CABOMETYX в качестве предпочтительного варианта Категории 2A для лечения пациентов с ранее нелеченным распространенным ПКР с заболеванием низкого или среднего риска было основано на результатах фазы 2 исследования CABOSUN.
Кроме того, в своем недавнем обновлении Руководства по клинической практике лечения рака печени и желчевыводящих путей, NCCN добавила кабозантиниб в категорию 1 для лечения пациентов с гепатоцеллюлярной карциномой (ГЦК) (только класс А по шкале Чайлд-Пью), которые ранее получали сорафениб. CABOMETYX не одобрен FDA для лечения ранее пролеченного распространенного ГЦК. 29 мая, 2018, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США приняло дополнительную заявку на новое лекарство для КАБОМЕТИКСА при ранее пролеченной поздней стадии ГЦК и назначило для нее дату действия Закона о плате за рецептурные препараты (PDUFA) 14 января, 2019.
 Можно ли жить с болезнью почек I стадии?
Поскольку вы можете остановить дальнейшее повреждение почек с помощью модификации диеты и поддерживающего лечения, пациенты могут прожить дополнительно 30 лет после лечения. Диагноз ХБП I стадии. Н
Можно ли жить с болезнью почек I стадии?
Поскольку вы можете остановить дальнейшее повреждение почек с помощью модификации диеты и поддерживающего лечения, пациенты могут прожить дополнительно 30 лет после лечения. Диагноз ХБП I стадии. Н
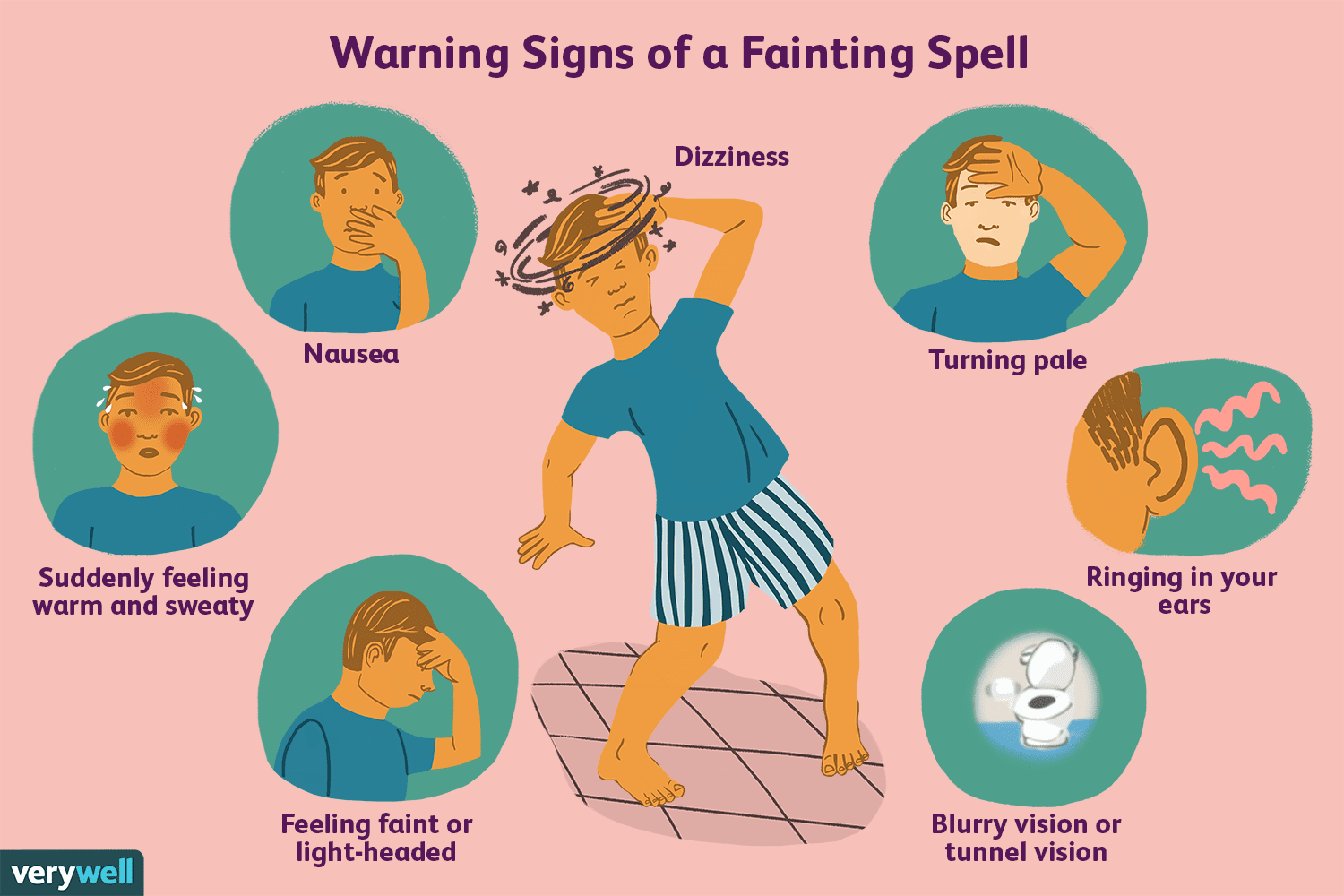 Обзор вазовагального рефлекса
Вы когда-нибудь начинаете потеть и чувствуете, что вот-вот потеряете сознание во время дефекации, или чувствуете слабость при виде крови? Возможно, это ощущение вызывает блуждающий нерв, который запус
Обзор вазовагального рефлекса
Вы когда-нибудь начинаете потеть и чувствуете, что вот-вот потеряете сознание во время дефекации, или чувствуете слабость при виде крови? Возможно, это ощущение вызывает блуждающий нерв, который запус
 Кишечные инфекции, которые могут вызвать болезнь Хашимото
Я могу быть предвзятым, но я думаю, что лучший практикующие - это те, кто сам болел... Они знают, каково это быть в окопах и каково это снова чувствовать себя хорошо. Доктор Изабелла Венц — одна из
Кишечные инфекции, которые могут вызвать болезнь Хашимото
Я могу быть предвзятым, но я думаю, что лучший практикующие - это те, кто сам болел... Они знают, каково это быть в окопах и каково это снова чувствовать себя хорошо. Доктор Изабелла Венц — одна из