Анализ PIK3CA мутаций в желудочной карциномы и metanalysis литературы позволяют предположить, что экзон-селективность является подпись типа рака
Аннотация
фон
PIK3CA
является одним из генов, наиболее часто мутировал в злокачественных опухолях человека, и это является потенциальной мишенью для персонализированной терапии. Цель данного исследования состояла в том, чтобы оценить частоту и тип PIK3CA
мутаций при раке желудка и сравнить их с клиническими патологическими коррелятам.
Методы
Мы проанализировали 264 рак желудка, в том числе 39 с микроспутника нестабильности (MSI ),
мутаций в двух PIK3CA
горячих точек в экзоны 9 и 20 путем прямого секвенирования ДНК, полученной из микродиссекции раковых клеток. Результаты
случаях, укрывательство мутации были 42 (16%). Все они были гетерозиготными миссенс одного замены оснований; наиболее распространенным был H1047R (26/42; 62%) в экзоне 20, а второй был Q546K (4/42; 9,5%) в экзоне 9. Все мутантные случаи MSI (8/39) нес мутацию H1047R. не было найдено ни одной другой связи между PI3KCA
мутаций и их клинических патологических ковариатами. Metanalysis мутаций, происходящих в тех же регионах, представленных в 27 публикациях, показали, что соотношение между экзона 20 и экзона 9 распространенностью составил 0,6 (95% ДИ: 0,5 -0,8) для толстой кишки, 1,6 (95% ДИ: 1,1 -2,3) для груди , 2,7 (95% ДИ: 1,6 -4.9) для желудка и 4,1 (95% ДИ: 1,9 -10.3). рака эндометрия
Выводы
общая распространенность PIK3CA
мутаций предполагает важную роль для PIK3CA
при раке желудка. Отсутствие совпадения с клинико-патологическое состояние позволяет предположить, что мутации в PIK3CA
происходят на ранних стадиях развития рака. Metanalysis показал, что экзон-селективность является важной сигнатура типа рака отражает различные контексты, в которых возникают опухоли.
Фон
рака желудка является второй причиной смерти рака в мире, хотя заболеваемость снизилась в западных странах , Несмотря на успехи в своей молекулярной характеристике, на сегодняшний день, единственным эффективным методом лечения является хирургическое вмешательство с лечебной целью и средней 5-летней выживаемости составляет 25% [1]
спорадических рак желудка может возникнуть по двум основным молекулярных путей:. Один включает в себя брутто хромосомные изменения с множественными потерями, а также доходы крупных хромосомных регионов; второй характеризуется широко распространенными соматическими изменениями в простых повторяющихся геномных последовательностей (микросателлитов), в результате дефектной ДНК репарации ошибочно спаренных комплекса. Эти последние определяются микросателлитных нестабильные опухоли (MSI), составляют около 15% всех опухолей желудка и связаны с более благоприятным прогнозом, большего размера, женский пол, пожилой возраст, менее поражения лимфатических узлов, кишечная histotype и антральных местонахождения [2 ]. Общие изменения нашли, связанные с MSI включают промотор метилирование MLH1
[3] и мутации TGFBR2, IGFR2
и Вах
[4].
Микроспутниковая стабильный (MSS) желудочные новообразованиями показывают различный набор изменения: несколько прото-онкогенов, в том числе MET
, FGFR2
и ERBB2
, часто усиливается [5] в то время как инактивация обоих аллелей TP53
потерей гетерозиготности и мутации является наиболее частой генетической событие, связанное с MSS фенотипа [6]. Кроме того, потеря TP73, APC, DCC
, FHIT
и TFF1
также часто обнаруживаемых [5, 7].
PIK3CA
представляет собой ген, который кодирует для P110 -альфа-субъединица фосфоинозитидного-3-киназы (PI3K). В последнее время, ключевую роль в качестве онкогена появляется для PIK3CA
, поскольку он является одним из генов, наиболее часто, пострадавших от соматических мутаций в нескольких типах рака человека [8, 9]. PI3K является частью семейства Ser-Thr-киназ, который взаимодействует с фосфатидилинозитол бисфосфат (4,5-PiP2) для получения фосфатидилинозитол трифосфата (3,4,5-PIP3), второй мессенджер с несколькими функциями. PIP3 основном связывает домен plekstrine гомологии (PH) числа молекул-мишеней и приводит к их активации через клеточную мембрану таргетинга или модуляции их активности. Одним из наиболее хорошо охарактеризованных мишеней PI3K липидных продуктов является протеинкиназы Akt. активация PI3K /Akt как было показано, участвует в регуляции нескольких клеточных функций, таких как выживание клеток, рост клеток и ангиогенеза стимуляции, ингибирование апоптоза, перевод нескольких белках и, следовательно, в развитии рака [10, 11].
из двадцати экзонов, которые составляют PIK3CA
ген, более 75% мутаций обнаружены в двух горячих точках, расположенных в экзоны 9 и 20, которые кодируют спиральными и киназы доменов, соответственно [8]. Выражение из наиболее распространенных вариантов (E542K, E545K и H1047R) связано с повышенной активностью киназы липидов и онкогенными как в клеточных coltures и в естественных условиях [12, 13]. Мутации, воздействующие на две горячие точки в последнее время было показано, что функционально различны [14] и их соответствующие нормы мутации были часто сообщают, как связанные с определенными типами рака или конкретных особенностей пациента [15, 16].
В этом исследовании , мы проанализировали 264 рак желудка на наличие мутаций в экзонов 9 и 20, с помощью прямого секвенирования, и коррелируют наличие мутаций с клинико-патологических признаков, в том числе MSI фенотипа. Кроме того, мы сравнили распространенность мутаций, происходящих в двух экзонов с другими исследованиями, расследующих первичные образцы рака у человека.
Методы
Пациенты и образцы
Наше исследование были включены 264 последовательных случаев поздних стадий рака желудка, полученные от пациентов проходит хирургическое вмешательство между 1989 и 2003 годах в университете Вероны. Все пациенты получали путем радикального хирургического удаления с резекции свободными микроскопического заболевания и не получали до или послеоперационной хемо- или лучевой терапии. Гистологическое классификация в соответствии с Lauren и единая система TNM 1997 для рака желудка был использован для патологического постановки. Клинические патологические особенности серии подробно описаны в таблице 1. Это исследование было представлено, рассмотрено и одобрено Комитетом по этике местного концерна Верона Больницы включить образцы, используемые для этого анализа путем. Образцы опухоли были получены с информированного согласия от insititutions, предоставивших в materials.Table 1 Клинические особенности 264 случаев рака желудка анализировали на наличие мутаций в PI3KCA.
Параметр
Категории
Главная Частота
Пол
F
89 (33,7%)
M
175 (66,3%)
Возраст
средний (сд)
67,4 (11,2)
Lauren
Кишечные
170 (65,4%)
Смешанной
27 (10,4%)
Диффузный
63 (24,2%)
пТл
2
99 (37,4%) страница 3
129 (48,7%)
4
36 (13,6%)
пН
0
53 (20,2%)
1
100 (38,0%) <бр> 2
80 (30,4%) страница 3
30 (11,4%)
рм 0
215 (87,4%)
1
31 (12,6%)
Опухоль Местоположение
Антрум
107 (40,5%)
Body
72 (27,3%)
Fundus
69 (26,1%)
Linitis
12 (4,5%)
культи желудка
4 (1,5%)
MSI
MSI
39 (14,8%)
MSS
225 (85,2%)
мутационный анализ
нормальной и опухолевой ДНК экстрагировали из вручную микродиссекции парафиновых срезах тканей, как описано [17]. Мононуклеотидных микросателлитами BAT25
и BAT26
(с местонахождением в интронов MSH2
и KIT
гены, соответственно) были исследованы с помощью ПЦР-амплификации с использованием флуоресцентного красителя-меченых праймеров, как описано [18]. ПЦР-амплификация и секвенирование PIK3CA
экзоны 9 и 20 были выполнены, как описано [19], с использованием следующих праймеров Exon9_Forward: GGGAAAAATATGACAAAGAAAGC; Exon9_Reverse: CTGAGATCAGCCAAATTCAGTT; Exon9_Sequencing: TAGCTAGAGACAATGAATTAAGGGAAA-3; Exon20_Forward: CTCAATGATGCTTGGCTCTG; Exon20_Reverse: TGGAATCCAGAGTGAGCTTTC; Exon20_Sequencing:.. TTGATGACATTGCATACATTCG
Последовательность отличия от эталонной последовательности NCBI были идентифицированы с помощью ручного досмотра выровненных электрофореграммы при содействии пакета программного обеспечения Мутация Surveyor (SoftGenetics, State College, PA)
Мета-анализ
чтобы исследовать модель PIK3CA
мутаций в других исследованиях, связанных с желудка, а также другие типы рака, мы проанализировали распространенность PIK3CA
мутаций в данных, уже имеющихся в литературе и /или КОСМИК базы данных [20]. Этапы, выполняемые для поиска, выберите документы и сбор данных подробно описаны в файле 1. Дополнительный Полный список ссылок включенных исследований приводится в дополнительный файл 2.
Статистический анализ
Для мета-анализа, объединенные оценки распространенности, коэффициенты распространенности и доверительные интервалы были рассчитаны с использованием фиксированных эффектов регрессии Пуассона, с поправкой на количество проанализированных случаев на исследование. Данных о распространенности и доверительные интервалы одиночных исследований оценивали с использованием Clopper и метод Пирсона [21]. Корреляция наличия мутации H1047R с клинико-патологических признаков, п-значений и доверительных интервалов были оценены с помощью логистического регрессионного анализа. Корреляция с выживаемостью оценивали с помощью лог-рангового. Для Кокса множественной регрессии, мы выбрали наиболее информативные переменные среди моделей, которые включали мутационный статус, используя «вперед» пошаговый метод. Р-значение меньше 0,05 считается значительным. Для всех вычислений и иллюстраций был использован пакет статистического программного обеспечения R [22].
Результаты Мы проанализировали последовательности экзонов 9 и 20 PIK3CA
гена в 264 на поздних стадиях рака желудка. Перечень и частота мутаций, обнаруженных подробно описаны в таблице 2. В общей сложности 42 случаев (15,9%; 95% ДИ 11,7% - 20,9%) питали по меньшей мере, одну мутацию в проанализированных регионах. Все мутации были найдены гетерозиготные миссенс одного замены оснований. Наиболее распространенная мутация H1047R происходит в активном центре kinasic домена в экзоне 20 и которые составляют 62% от всех мутаций. Второй наиболее распространенной мутация Q546K, которая включает аминокислотный изменения в геликазном домене в экзоне 9 и представляет собой 9,5% всех мутаций found.Table 2 Частота PI3KCA мутаций, обнаруженных в 264 рака желудка, по типу мутации.
<й>
Мутация
Общая частота
(MSI только)
Процент /всего случаев
<бр> Процент /мутантные случаи
Экзон 9
E542K 2
0,76%
4,76%
E545K 2
0,76%
4,76%
Q546K
4
1.52% 9.52%
Всего Мутации (напр. 9)
8
3,03%
Экзон 20
M1043V
1
0,38% 2,38%
H1047R
26 (8)
9,85%
61,90%
H1048T
1
0,38%
2,38%
G1050D 2
0,76%
4,76%
T1052I
1 <бр> 0,38% 2,38%
T1053I
1
0,38%
2,38%
D1056N 2
0,76%
4,76%
L1067F
1
0,38%
2,38%
Всего Мутации (ex.20)
35
13,26%
Всего Mutations
42
15,91%
Мы нашли две миссенс мутации, а именно T1052I и T1053I, которые никогда не были зарегистрированы ранее. Мутации были подтверждены с помощью второй пары праймеров (см дополнительный файл 1). Обе мутации связаны с собой аминокислотный изменение от треонином к изолейцин, что предполагает изменение гидрофобных свойств остатков и могут потенциально влиять на функцию белка. Один случай питали две мутации, а именно E545K и L1067F, в экзоны 9 и 20, соответственно.
В нашей серии случаев MSI только укрывал мутации H1047R. H1047R был, по сути, наблюдается в 8 из 39 случаев MSI и был в значительной степени связано со статусом MSI (OR 3,0; 95% ДИ 1,0 - 7,9; тест Фишера P
= 0,035). Наличие мутации H1047R не коррелировали ни с выживанием или других клинических патологических признаков, как правило, связанных с MSI, возможно, из-за небольшого числа случаев, несущих мутации. Кроме того, мы не наблюдали каких-либо значимая связь между наличием мутации и выживаемости при рассмотрении только тех случаев, MSI. Кроме того, мы не нашли никакой корреляции с клиническими патологических особенностей при рассмотрении вопроса о наличии мутаций в обоих экзонов (таблица 3) или в экзоне 9 и 20 отдельно. Многофакторный анализ выживаемости проводили для того, чтобы оценить влияние наличия мутации вместе с другими клинико-патологический переменных (таблица 4). После выбора оптимальной модели, ТНМ этап, возраст и местоположение опухоли были связаны с выживанием, в то время как лишь незначительное эффект наблюдался для MSI status.Table 3 Распределение клинико-патологическими ковариатов в соответствии с наличием PI3KCA
мутаций 264 рака желудка.
Параметр
Категории
Wt
Мутировавшая
отношение шансов
(95% ДИ)
P
Пол
F
74 (83,1%)
15 (16,9%)
1
0,766
M
148 (84,6%)
27 (15,4%)
0,9 (0,5 - 1,8)
Возраст
виду <бр>
67,47
66,81
0,771
пТл
2
88 (88,9%)
11 (11,1%)
1
0,077 <бр> 3
108 (83,7%)
21 (16,3%)
1,6 (0,7 - 3,5)
4
26 (72,2%)
10 ( 27,8%)
3.1 (1.2 - 8.1) пН
0
42 (80,8%)
10 (19,2%)
1
0,840
1
86 (86,0%)
14 (14,0%)
0,7 (0,3 - 1,7)
2
67 (83,8%)
13 (16,2 %)
0,8 (0,3 - 2,1) страница 3
26 (86,7%)
4 (13,3%)
0,6 (0,2 - 2,2)
пМ
0
182 (85,0%)
32 (15,0%)
1
0,298
1
24 (77,4%)
7 (22,6% )
1,7 (0,6 - 4,0)
Lauren
Кишечные
147 (86,5%)
23 (13,5%)
1
0,275
Смешанный
22 (81,5%)
5 (18,5%)
1,5 (0,5 - 4,0)
Диффузный
49 (77,8%)
14 (22,2%)
1,8 (0,9 - 3,8)
местоположение и др
Антрум
93 (86,9%)
14 (13,1%)
1
0,394
Тело <бр>
58 (79,5%)
15 (20,5%)
1,7 (0,8 - 3,9)
Fundus
59 (85,5%)
10 (14,5%)
1,1 (0,5 - 2,7)
Градация
G1
13 (86,7%)
2 (13,3%)
1
0,652
G2
76 (87,4%)
11 (12,6%)
0,9 (0,2 - 6,5)
G3
117 (83,0%)
24 (17,0%) <бр> 1,3 (0,3 - 8,9)
неустойчивость Микроспутниковая
MSI
31 (79,5%)
8 (20,5%)
1
0,408
MSS
191 (84,9%)
34 (15,1%)
0,7 (0,3 - 1,7)
Выживаемость на 2-х лет (95% ДИ)
46,7% (40,5% -53,9%)
46,9% (32,4% -67,8%)
0,941
Таблица 4 анализ выживаемости Мультивариантный Кокс 245 больных раком желудка.
Параметр
Категория
HR (95% ДИ)
P-Значение
PI3KCA статус
вес
1,0
0,630 <бр> мутировали
1.1 (0.7-1.7)
Этап I
1.0
≪ 0,001
II
3.1 (1.1-9.1 )
III
11.6 (4.2-31.8)
IV
19.1 (6.8- 53.2)
Возраст (10 лет прирост)
1.3 (1.1-1.5 )
&л; 0,001
опухолевые Локация
Антрум
1.0
0,004
Body
1.1 (0,7-1,5)
Fundus
1.8 (1.3-2.6)
MSI статуса
MSI
1.0
0,077
ПСС
1.7 (0.9-3.0)
Для систематически сравнивать наши результаты с имеющейся литературы для желудка и других раковых типов, мы выбрали 38 серий, описанной в 27 работах, анализирующих мутации в PIK3CA
локуса в первичных образцах рака (полный список ссылок приводится в дополнительный файл 2) , Мы ограничили анализ для мутаций, происходящих в аминокислотах 542-549 и 1043-1048, экзоны 9 и 20, соответственно, которые были проанализированы в общем между рядами. Эти области содержат значительное большинство мутаций, наблюдаемых в PIK3CA
[8].
Распространенность мутаций в экзонов 9 и 20 для каждой серии представлена на рисунке 1. Несмотря на то, что общие показатели мутации была переменной среди ряда , даже одного и того же типа рака, частота мутаций в экзоне 9 и 20 существенно коррелируют друг с другом (р Спирмена = 0,75, Р-значение &ЛТ; 0,001), что свидетельствует о том, что соотношение между экзоне 9 и экзона 20 мутаций зависит тип рака. Таким образом, мы оценили суммарное отношение распространенности между экзоне 20 и 9 в различных исследованиях, сгруппированных по типу рака, с помощью регрессии Пуассона анализа. Результаты представлены в таблице 5. Для рака молочной железы, учитывая большое количество исследований сообщили, мы разделили серию согласно histotype (протоковой и очаговая), где информация была доступна, и классифицировать ряд остаток как рак молочной железы с histotype неустановленный , Среди серии протоковой histotype, распространенность мутаций была значительно смещена в сторону экзона 20, в то время как более существенное предпочтение экзоне 9 наблюдалась очаговая серии histotype (см таблицу 5 и рисунок 1). Исследования по раку толстой кишки показали значительно более высокая распространенность мутаций в экзоне 9 со всеми сериями, имеющие аналогичную мутационный узор. Опухоли эндометрия были значительно больше, пострадавших от мутаций, влияющих на экзона 20. При раке желудка, настоящее серии, а также серии сообщает Сэмюэльс показал большую распространенность экзона 20, в то время как серия остаток показал практически никакой разницы между exons.Table 5 Общая частота и суммарное отношение распространенности мутаций, влияющих на две горячие точки PIK3CA
расположен в экзоне 9 и 20 экзоне в 36 серии, сгруппированных по типу рака
Опухоль Тип
NR.
серии
всего случаев
экзоне 9
Экзон 20
EX20 /EX9
Ratio Преобладание
(95% ДИ)
P-значение
Рак молочной железы (histotype не указано)
6
788
101
105
1,0 (0,8 -1,4)
0,7805
Рак молочной железы (очаговая histotype)
4
99
25
15
0,6 (0,3 -1,1)
0.1178
рак молочной железы (протоковой histotype )
страница 5 499
41
64
1.6 (1.1 -2.3)
0,0260
внутриматочного рака
страница 5 из 263
7
29
4,1 (1,9 -10,3)
0,0007
рак толстой кишки
6
1292
134
80
0.6 (0.5 -0,8)
0,0003
Рак желудка
страница 5 из 602
17
46
2,7 (1,6 -4,9)
0,0005
головы и шеи плоскоклеточный рак 3
175
7 страница 2 0.3 (0.0 -1.2)
0.1182
глиобластомы
4
203
3 страница 5 1,7 (0,4 -8,1)
0.4842 Рисунок 1
точка и 95% доверительный интервал оценок распространенности мутаций, влияющих на экзон 9 и 20 PI3KCA в 36 серии. Мутации, влияющие на экзон 9 и 20 показаны в виде твердых заполненных коробок и пустых алмазов, соответственно. Обобщенные оценки для каждой группы выделены серым цветом.
Обсуждение
Целью данного исследования было охарактеризовать мутационный статус PIK3CA
в большой серии рака желудка, с тем, чтобы определить его распространенность с адекватным точность и соотнести его с клинико-патологическими особенностями. Общая распространенность мутаций составила 15,9%, значение, которое находится в пределах имеющейся в настоящее время литературе [8, 23-25], тем не менее, наблюдаемые в распространенность различных серий неоднородны, в пределах от 4,5% до 25%. Причины такой неоднородности могут быть обусловлены специфическими взаимодействиями мутаций с экологических и генетических особенностей, хотя экспериментальные факторы не могут быть исключены.
Насколько нам известно, мутации с участием 1052 и аминокислоты 1053 (T1052I и T1053I) никогда не были опубликованы до, ни описаны в Космическом базе данных, несмотря на большое количество исследований, исследующих регион. Поскольку мутации предполагают изменение в гидрофобности аминокислотными остатка, функциональная роль не может быть исключена. Мутации были обнаружены в тех случаях, ПСС, которые не показывают какой-либо конкретной функции.
Мы также обнаружили, что наиболее распространенным PIK3CA
мутации (H1047R) была в значительной степени связано с MSI фенотипа. Ассоциация является умеренным и выиграют от подтверждения на серии Независимые. Связь между PIK3CA
мутаций и MSI сообщалось или, по крайней мере, предложил в обоих толстой кишки и рака желудка [8, 23, 24, 26]. В противоречии с нашими выводами, в двух исследованиях по поводу рака желудка и мутации отчетов по статусу MSI, экзон 9 и экзон 20 мутаций были равномерно распределены между подтипами [23, 24]. Тем не менее, небольшое количество мутировавших случаев MSI предотвращает статистическое сравнение. Тот факт, что только один тип мутации был обнаружен в нашей серии опухолей MSI не удивительно, так как узкий спектр изменений в MSI опухолей желудка может, в свою очередь, ограничивает тип PIK3CA
мутаций, которые являются онкогенными в этом контексте.
Несмотря на большие серии проанализированы, мы не обнаружили каких-либо корреляции PIK3CA
мутаций с клиническими патологическими особенностями рака желудка, кроме ассоциации между MSI и H1047R. Отсутствие ассоциаций предполагает, что изменение PIK3CA
это событие, которое происходит на ранних стадиях в подгруппе рака желудка, который прогрессирует в сторону злокачественной опухоли с помощью других механизмов. На самом деле, в многофакторной модели выживаемости не было никакого очевидного эффекта присутствия мутации на прогнозе.
На основе нашего мета-анализа, соотношение между мутацией распространенностью в экзонах 9 и 20 могут быть как правило, считается подпись типа рака , В частности, мы обнаружили значительное смещение экзонное для рака толстой кишки, рак молочной железы с протоковой histotype и рака эндометрия. В рака толстой кишки, экзон 9 значительно больше, чем удар экзона 20. Это подтверждает предложения из предыдущих исследований [8, 23, 27]. Противоположная картина мутационный последовательно обнаружен в исследованиях, касающихся рака эндометрия с экзона 20 в значительной степени больше, чем удар экзона 9. Эта особенность уже указывалось и предлагает конкретный механизм PI3KCA
участия для рака эндометрия [28-30].
менее ясно, существует ли предвзятость экзон при раке молочной железы, как много исследований, по-видимому, противоречат друг другу (см рисунок 1). Тем не менее, для исследований, которые сделали представить информацию о histotype каждого образца, мы наблюдали различное предпочтение экзонное между долек и протоковой histotypes, как уже было предложено [15]. Для протоковой histotype, экзон 20 был значительно больше ударил по сравнению с экзоне 9, в то время как небольшое, но обратная тенденция была обнаружена в серии очаговая рака молочной железы. Эта закономерность не наблюдается в исследованиях, где информация о histotype не доступна, возможно, в качестве результата смешения различных видов опухолей вместе.
Для плоскоклеточного головы и шеи опухоли незначительную тенденцию к большей распространенности экзон 9 мутаций наблюдалось среди рядов, хотя низкая частота PIK3CA
мутаций в этом виде новообразования, вероятно, предотвратить эту тенденцию выделяться. Для глиобластомы, не было никаких доказательств экзон-селективностью, в связи с тем, что высокий процент, не являющихся горячих точек мутации часто встречаются при этом заболевании [8, 31].
Наконец, в серии рака желудка, экзон 20 привели к более сложным, чем экзоне 9, хотя общая тенденция среди ряда была существенно отсутствует. Неоднородность как в общей распространенности и экзона селективности при раке желудка может быть связано с сильным влиянием, что специфические etio-патологические, генетические и экологические факторы оказывают на этой болезни.
Хотя некоторые из наблюдений, представленных в нашем мета-анализе были спорадически предложил или продемонстрировано в отдельных работах, этот подход позволяет собрать более убедительные доказательства путем объединения аналогичных исследований. Кроме того, мета-анализ имеет дополнительное преимущество, обеспечивая прогноз и оценку PIK3CA
экзон-селективность и стандартизованный коэффициент мутации в различных типах рака, хотя это может зависеть от ограничений, полученных из ретроспективных исследований. <Бр> ассоциация специфических мутаций с любым типом рака или подтипа в соответствии с последними выводами о различных механизмах, с помощью которых эти мутации оказывают свои онкогенные потенциал. На самом деле, было показано, что мутации, происходящие в kinasic домена зависят от связывания с р85, еще один компонент PI3K, чтобы быть полностью онкогенными, в то время как мутации в спиральном домене зависят от RAS-ГТФ связывание [14]. Зависимость PIK3CA
мутаций в других сигнальных компонентов находится в соответствии с тем, что генетический фон, в котором опухоли развиваются и могут потребовать выбирать конкретные измененными деятельности p110-альфа.
Выводы
Мы нашли относительно высокий распространенность PIK3CA
соматических мутаций дополнительно поддерживающих роль PIK3CA
как главный онкогена при раке желудка. Такая распространенность была высоко смещена в сторону экзона 20, в частности, в тех случаях, MSI, которые, как представляется, несут только один тип экзона 20 мутаций. Путем анализа мутаций, происходящих в двух стандартных горячих точек областей PIK3CA
в 27 опубликованных работ по шести основных типов рака (колоректальный рак, протоков молочной железы, молочной железы очаговая, желудка, слизистой оболочки матки, головы и шеи и глиобластомы), мы нашли
 Какое лучшее лекарство от язвенного колита?
Лекарства от язвенного колита различаются в зависимости от тяжести заболевания. Стратегии лечения язвенного колита (ЯК) варьируются от человека к человеку. Ваш врач будет основывать рекомендации по л
Какое лучшее лекарство от язвенного колита?
Лекарства от язвенного колита различаются в зависимости от тяжести заболевания. Стратегии лечения язвенного колита (ЯК) варьируются от человека к человеку. Ваш врач будет основывать рекомендации по л
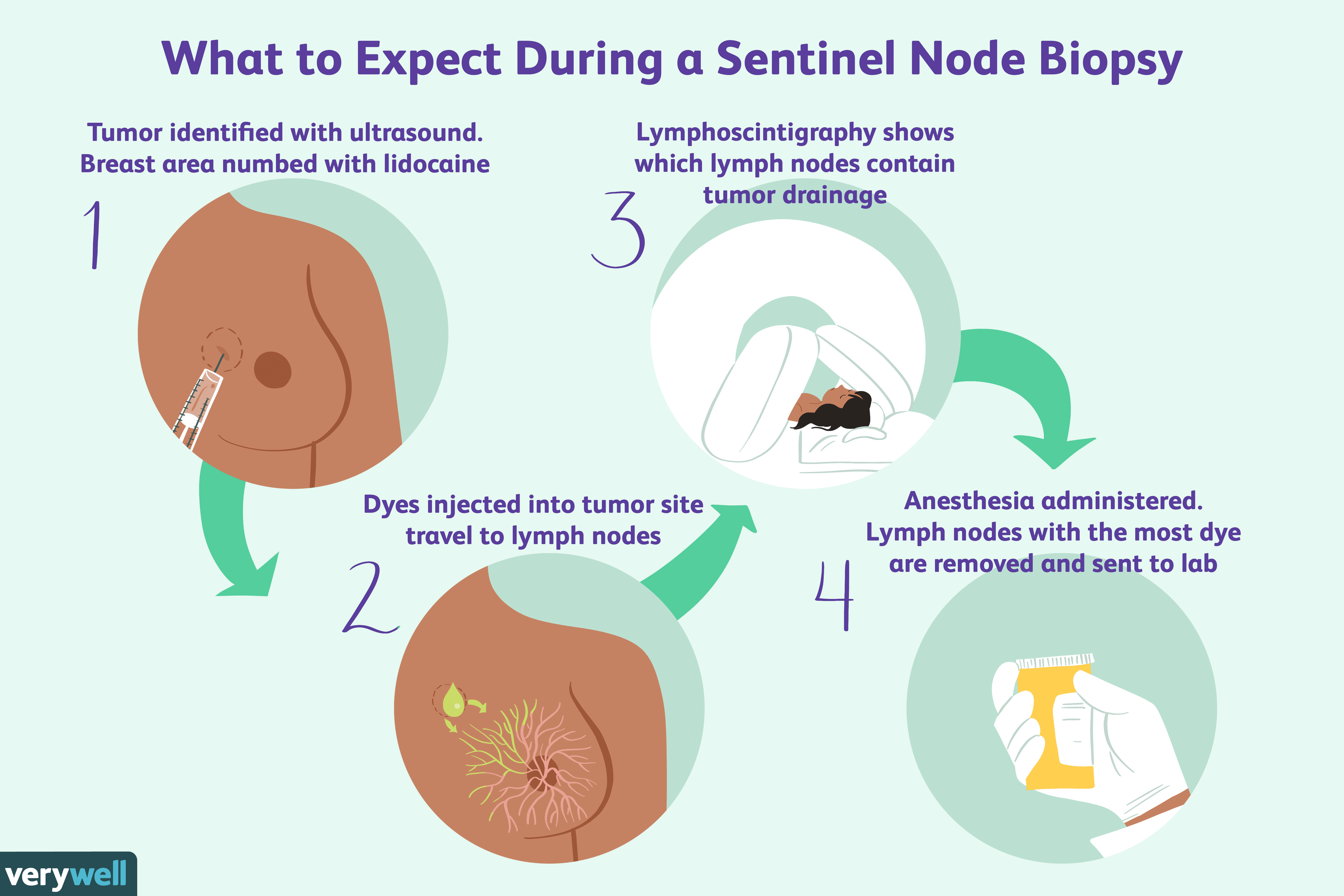 Обзор рака молочной железы с положительным поражением лимфатических узлов
Проверка лимфатических узлов является одним из предикторов прогноза рака молочной железы. Рак молочной железы с положительным поражением лимфатических узлов — это тип рака, который распространился из
Обзор рака молочной железы с положительным поражением лимфатических узлов
Проверка лимфатических узлов является одним из предикторов прогноза рака молочной железы. Рак молочной железы с положительным поражением лимфатических узлов — это тип рака, который распространился из
 Что делает селезенка?
Что такое селезенка? Селезенка поддерживает иммунную функцию. Селезенка представляет собой орган овальной формы, который находится под грудной клеткой на левой стороне тела. Он размером с человече
Что делает селезенка?
Что такое селезенка? Селезенка поддерживает иммунную функцию. Селезенка представляет собой орган овальной формы, который находится под грудной клеткой на левой стороне тела. Он размером с человече