leiomyosarcoma z sigmatu s mnohopočetnými metastázami do pečene a rakovina žalúdka: Správa o prípad
abstraktné
pozadia
leiomyosarcoma (LMS) gastrointestinálneho trakt je extrémne zriedkavé ušľachtilé nádor so zlou prognózou. Pre pokročilých LMS so vzdialenými metastázami, rozhodne sa o výber najvhodnejšieho liečebnej stratégie, vrátane chemoterapiou a chirurgii, je ťažké. Tu prezentujeme neobvyklý prípad LMS z sigmatu s metastázami do pečene a rakovina žalúdka. Prežitie tohto pacienta bola predĺžená kombinovaným modalít liečby zahŕňajúce chemoterapii a chirurgiu.
Case prezentácie
66-ročná žena, ktorá bol diagnostikovaný s pokročilou rakovinou žalúdka a viac pečeňových metastáz bola postúpená do našej nemocnice. Počiatočná liečba docetaxelom a S-1 významne znížilo ako rakovina žalúdka a nádorov pečene; V dôsledku toho sme vykonali chirurgickú resekciu. Patologické vyšetrenie ukázalo, že žiadne životaschopné nádorové bunky zostali v žalúdku a chemoterapia za následok kompletnú remisiu rakoviny žalúdka. Tieto nádory pečene boli imunohistochemicky diagnostikovaných ako LMS. Nádor sigmatu sa následne zistilo, a zistilo sa, že nádory pečene, aby sa opakovali. V chirurgicky operaciindikováni sigmatu a nádory pečene boli všetci imunohistochemicky diagnostikovaných ako LMS. Tieto nálezy ukázali, že viac pečeňové metastázy sa vynoril z LMS v sigmatu, a že boli sprevádzané pokročilou rakovinou žalúdka. Vykonali sme ďalšie chirurgickú resekciu a podávať chemoterapiu na liečbu opakujúce sa pečeňové metastázy. Pacient prežil počas 4 rokov a 10 mesiacov po úvodnom predstavení v našej nemocnici.
Záver
hrubého LMS je vzácna a jej joint výskyt rakoviny žalúdka je veľmi nezvyčajné. Hoci LMS je vysoko kvalitný novotvar, multimodálne liečebný prístup môže zvýšiť o pacientov čas prežitie, aj keď je prítomných viac pečeňové metastázy.
Kľúčové
Leiomyosarkom žalúdka Rakovina pečene metastázy chirurgia chemoterapii pozadia
leiomyosarcoma (LMS) z gastrointestinálne (GI) traktu je extrémne zriedkavé, a len pár správy boli uverejnené v recenziách GI mezenchymálnych nádorov [1, 2]. LMS často metastázuje do pečene a má zlú prognózu. Na rozdiel od gastrointestinálnom strómovými tumorom (GIST) efektívna molekulárnej liečba nie je k dispozícii pre LMS. To znamená, že rozhodnutie o výber optimálnej liečebnej stratégie pre pokročilých LMS s metastázami je ťažké [1, 3]. V tejto veci správe, popisujeme 66-ročná žena s LMS z sigmatu sprevádzaných niekoľkých pečeňových metastáz a pokročilou rakovinou žalúdka. Prežitie tohto pacienta bola predĺžená pomocou kombinácie troch chirurgickej resekcie a chemoterapii.
Prípad prezentácie
66-ročná žena diagnostikovaný s pokročilou rakovinou žalúdka a viac pečeňových metastáz bol odvolával sa na našej nemocnici v marci 2003. nebola nositeľom vírusu hepatitídy alebo alkoholik s predchádzajúcim ochorením pečene. Okrem toho, nemala v rodinnej anamnéze zhubné nádory. Gastrointestinálne fiberscopy pri príjme vykazovali nepravidelný ulcerózna léziu na prednej stene žalúdka korpusu (obrázok 1), a patologické diagnózy z biopsiou bolo zle diferencovaný adenokarcinóm (obrázok 2A, B). Brušný počítačová tomografia (CT), obrázky odhalili štyri priestorovo zaberať lézie o priemere 2-3 cm s vnútorným heterogénnosť vzhľadom k relatívny nedostatok účinku kontrastného prostriedku v pečeni (obrázok 3). To naznačuje prítomnosť metastáz z rakoviny žalúdka a žiadne zväčšené lymfatické uzliny okolo žalúdka. Klystír bárium nepriniesli žiadne dôkazy o šírenie či hrubého čreva nádory. Na základe týchto zistení, že pacient bol diagnostikovaný s Etapa IV rakoviny žalúdka u hematogénne metastázy podľa japonskej klasifikácie karcinómu žalúdka [4]. Obrázok 1 gastrointestinálneho zistenia fiberscope pri príjme pacienta. Šípky označujú pozíciu s ulcerózna lézií na prednej stene žalúdka korpusu.
Obrázok 2 mikroskopických nálezov z biopsie vzorky vyradených z ulcerózna lézií. Zle diferencovaný adenokarcinóm je evidentná. H & E škvrnu x 100 (A) a x 200 (B)
Obrázok 3 abdominálna nálezy CT kontrastnému po prijatí .. Šípky označujú polohy štyroch heterogénnych nádorov pečene.
Denne sme podávali chemoterapiu s docetaxelom a ústnej S-1 na liečbu karcinómu žalúdka a pečeňových metastáz [5]. Sedemnásť cyklov tohto režimu po dobu jedného roka podstatne znížila rakovinou žalúdka a nádorov pečene, a nepreukázalo, že by nové rakovinové lézie. Avšak nepriaznivé účinky zabránila pacienta pokračovať s týmto režimom. považovaná sme, že všetky lézie boli úplne resekabilní v tomto bode, a za predpokladu, že pacient písomný informovaný súhlas s operáciou na 14 mesiacov po začatí chemoterapie.
Ascites a peritoneálnej šírenie lézie neboli viditeľné počas postupu, ktorý zahŕňal celkom gastrektómia a parciálne resekciou pečene pre všetky nádory pečene. Patologické vyšetrenie ukázalo, že žiadne životaschopné nádorové bunky zostali v žalúdku a chemoterapia za následok kompletnú remisiu rakoviny žalúdka. Tieto nádory pečene boli imunohistochemicky pozitívna na aktínu hladkého svalstva (SMA), desmin a H-caldesmon a negatívne na c-kit, CD34 a S-100 (obrázok 4). Okrem toho, v priemere o 20 mitózy na 10 vysokých silových polí bolo pozorované u nádorov pečene, ktorý bol diagnostikovaný ako LMS s vysokou mitotickej aktivity. Až do tohto bodu, my za to, že nádory pečene boli metastázy, ktoré sa vyvinuli z rakoviny žalúdka. Avšak, histologický typ nádorov pečene bol LMS a nie adenokarcinóm. Preto sme museli predpokladať, že pečeňové LMS boli primárne nádory, ktoré sa vyvinuli z pečene alebo metastatických nádorov z neznámych primárnych LMS. Obrázok 4 Mikroskopické poznatky z resekcii pečene vzorky. proliferácie nádoru, je zrejmé, priľahlé k jazvy tkaniva (A) a má krížiace chumáče atypických vretena-buniek (B). Nádor bola imunohistochemicky pozitívna na SMA (C), desmin (D) a h-caldesmon (E), a negatívne na c-KIT (F), CD34 (G) a S-100 (H). Stena cieva bola pozitívna na CD34 (G). A a B, H & E; C, SMA; D, desmin; E, H-caldesmon; F, C-kit; G, CD34; a H S-100.
, sme sa podáva iba orálny S-1, ako je adjuvantná chemoterapia po operácii. Avšak, 11 mesiacov po tomto ošetrení, štyri nádory pečene vyvinula a sme zmenili chemoterapiu irinotekanu a cisplatiny. Tento režim bol neúčinný a nádory pečene postupne rozširovaný. Okrem toho hmotnosť tumoru ako v sigmoideu bola náhodne objavená na CT a pozitrónovej emisnej tomografie /počítačová tomografia (PET-CT) v priebehu tohto liečebného procesu; Tento postupne zvyšuje do veľkosti 3 cm v priemere. Kolonoskopia odhalila léziu vyčnievajúce z submukóze s normálnou sliznicou (obrázok 5). Aj keď sme podozrenie, že tento nádor môže byť osamelý peritoneálnej metastázy z rakoviny žalúdka, naše hodnotenie bolo, že úplné resekcii nádoru hrubého čreva a všetky pečeňových nádorov by bol možný. Obrázok 5 zistení kolonoskopia. Lézie možno vidieť vyčnievajúce z submukóze.
Druhou chirurgickú resekciu zo štyroch nádorov pečene a hrubého čreva čiastočnú resekciu si postupoval vo veku 2 roky a 5 mesiacov po začatí chemoterapie prvej línie. Sigmatu a nádory pečene boli všetci imunohistochemicky diagnostikované ako LMS (Obrázok 6). Toto zistenie vyplynulo, že LMS vznikol v sigmoideu, a že viac pečeňové metastázy vyplynuli z hrubého LMS, ktorá bola sprevádzaná pokročilého karcinómu žalúdka v čase prvého vstupu. Obrázok 6 Mikroskopické poznatky z vyňatých vzorky hrubého čreva. Nádor vyvinul zo svalovej vrstvy hrubého čreva (A). Histologické a imunohistochemické nálezy pre hrubého čreva a nádorov pečene bola podobná (B-H). Stenové a nervového tkaniva ciev boli pozitívne na CD34 (G) a S-100 (H), resp. A a B, H & E; C, SMA; D, desmin; E, H-caldesmon; F, C-kit; G, CD34; a H, S-100.
pacient podstúpil tretiu resekcii pečene na liečbu dvoch nových metastáz v pečeni, ktoré sa vyvinuli v 7 mesiacov po druhej postupe. To bolo preto, že sme k záveru, že by mohlo dôjsť len obmedzený šancu na dobré odpovede na chemoterapiu v prípade LMS, a všetky pečeňových metastáz boli tiež úplne resekabilní. Potom, napriek ifosfamidu a epirubicín chemoterapiu s následnou dakarbazín, viac pečene a pľúc metastázy nakoniec vyvinula a pacient zomrel na 4 roky a 10 mesiacov po prvej prezentácii v našej nemocnici.
Závery
výskytu LMS v GI trakt je extrémne zriedkavé a GIST účet pre väčšinu GI mezenchymálnych nádorov. Nedávne správy popisujú klasifikácii iba tri medzi 262 GI mezenchymálnych nádorov, podľa ktorého sú LMS [1], a len sedem z 253 mezenchymálnych nádorov ako sú zapojené s hrubého čreva [2]. Okrem toho je hlásená miera LMS je 3-6% u GI mezenchymálnych nádorov v iných oblastiach gastrointestinálneho traktu, ako je napríklad pažeráka, dvanástnika a anorekta [6-8].
Hlásené klinické príznaky LMS gastrointestinálneho traktu sú hrubé polypoidní a intramurální typy, ktoré môžu nastať buď svalové mukózy alebo propria [1, 2, 9]. Susedné infiltrácie tkanív a pečeňové metastázy sú bežné, ale lymphogenic spread je vzácny [1, 9]. LMS sú extrémne vysokého stupňa nádory s vysokým mitotické aktivity, a doba prežitia pacienta je obvykle krátka [2, 6-8]. Klystíru bárium a CT vyšetrenie nezistil LMS z sigmatu v našej pacienta pri prvom prijatí. To bolo preto, že vnútropodnikové nádor, pravdepodobne veľmi malé a skryté v hrubého čreva múru. Avšak, LMS mal vysokú mitotickú aktivitu a už spôsobil viac pečeňové metastázy do tej doby. Okrem toho sa v rámci pečeňových metastáz bola následne k recidíve cez úplnú resekcii primárneho servera a počiatočné pečeňových metastáz. LMS Zdá sa, že veľmi vysoký hematogenního metastatické potenciál.
Histogenetického, klinicko a imunohistochemických profily LMS a GIST sa líšia [1]. Vzhľadom k tomu, GIST vzniká z intersticiálnej bunky Cajal, LMS pochádza z buniek hladkého svalstva v muscularis sliznice alebo muscularis propria [1, 9], a to chýba KIT
mutácií [2, 6, 7]. Imunohistochemické analýza je nevyhnutná pre definitívne diagnózu LMS, ktorý je pravidelne negatívny pre c-kit a CD34 a pozitívne na markery hladkého svalstva, ako je napríklad aktínu, desmin a h-caldesmon [10, 11]. Imunohistochemické zistenie vzoriek získaných od nášho pacienta po resekcii hrubého čreva a nádorov pečene boli podobné. Okrem toho, vzorky boli tiež pozitívne na vimentin v ďalšej imunohistochemické analýzou (Obrázok 7A). Táto kombinácia veľmi špecifických imunohistochemických nálezoch za predpokladu, definitívne diagnózu hrubého čreva LMS a viac pečeňových metastáz. Obrázok 7 Ďalšie imunohistochemických analýz pečene a žalúdka nádoru. Nádor pečene bola imunohistochemicky pozitívna na vimentin (A). Gastrický nádor bol negatívny na SMA (B), desmin (C) a h-caldesmon (D), a pozitívne na AE1 /AE3 (E) a (F) CAM5.2. Steny krvných ciev a väzivové tkanivá, boli pozitívne na SMA (B), desmin (C) a h-caldesmon (D). A, vimentin; B, SMA; C, desmin; D, h-caldesmon; E, AE1 /AE3; a F, CAM5.2.
Okrem toho, v diagnostike danom prípade, LMS ako v pečeni a hrubého čreva boli možno metastatické nádory, ktoré vznikli z primárnych LMS v inom orgáne. V skutočnosti bola hlásená LMS na ľavom stehne, že metastázovať do pečene, hrubého čreva a lymfatických uzlín [12]. Avšak, v tejto štúdii, nádor mäkkých tkanív nebola detekovaná pomocou periodicky vykonávané CT a PET-CT vyšetrenia počas liečby. Okrem toho sme nedávno uskutočnilo ďalšie imunohistochemické analýzy pre žalúdočné lézie, aby sa odlíšili od LMS. Biopsia tkaniva žalúdočné lézie bola imunohistochemicky negatívny pre desmin, SMA a H-caldesmon, a pozitívne pre cytokeratin (AE1 /AE3 a CAM5.2) (Obrázok 7B-F). LMS a žalúdočné lézie predstavoval úplne iný histologický obraz a imunohistochemických profily. Tak, môžeme konštatovať, že v tomto prípade predstavuje kombináciu hrubého LMS, ktoré metastázovaných do pečene a rakoviny žalúdka.
Chirurgická resekcia je najčastejší prístup k liečbe LMS [2, 6-8]. Jedna správa opisuje metastatické sarkóm do pečene, ktorý tiež zahŕňal metastáz v pečeni z GIST a extra-črevné LMS, ukázali, že úplné resekcii pečeňových metastáz z sarkómu bolo spojené s predĺžením doby prežitia, a že interval, ktorý sa metachronních metastáz bol nezávislý prediktor výsledku [13].
Chemoterapia všeobecne hrá obmedzenú úlohu v liečbe LMS [13, 14]. Okrem toho, špecifické molekulárnej terapia je v súčasnej dobe k dispozícii pre GIST, ale nie pre LMS. Správy naznačujú, že 30 až 60% ceny klinickej odpovede môže byť dosiahnutá v liečbe LMS s použitím kombinácie docetaxelu a gemcitabínu [15], a v liečbe pokročilého sarkómu mäkkých tkanív pomocou ifosfamidu s antracyklínom a /alebo dakarbazín [16-18] , bol nájdený iba chemoterapiu prvej línie s docetaxelom a S-1, musí byť účinná proti obom rakovinou žalúdka a LMS v našej pacienta. Celková miera odozvy tohto režimu je údajne 56,3% na rakovinu žalúdka [5]. Bolo konštatované, že docetaxel, ktorý je tak často používaný a účinná proti obom LMS a rakovinou žalúdka, by mohol súčasne znížiť veľkosť týchto nádorov.
Pôvodne sme k záveru, že nádory pečene boli metastázy vyplývajúce z rakoviny žalúdka. Avšak sme resekcia žalúdka a nádorov pečene, pretože všetky nádory zostal malý. Oni sa ukázalo byť úplne resekabilním a de novo lézie nepreukázalo, že počas prvého roku chemoterapie. Sa prvý režim chemoterapie neúčinné a mal počet nádorov pečene a /alebo veľkosti rakovinou žalúdka zvýšené, by boli označené chirurgická resekcia v našej pacienta. Toto bolo kvôli tomu, že tieto faktory by poukázali na zníženú pravdepodobnosť úplnej resekcia bytia dosiahnuteľný.
Tumorigenezi žalúdočné rakoviny a LMS bolo hlásené, že zahŕňa rôzne faktory [19-22]. Spoločné faktory, ako je napríklad infekcia vírusom Epstein-Barrovej a molekulárnej zmeny v RASSF1A
, boli tiež uvedené v výskytu týchto nádorov [23, 24]. Okrem toho v experimentálnom modeli, súčasné expozíciu ako nitrosoguanidin a kyseliny acetylsalicylovej spôsobil synchrónny rozvoj ako rakovinou žalúdka a LMS [25]. Intragastrický aplikácie N-methylnitrosourea tiež ukázal, zvýšenú náchylnosť k tvorbe nádorov chemickej žalúdočné rakoviny a sarkómov v p53 knockout myší [26]. V tomto prípade, nie je jasné, v prípade, že asociácia je jednoduchá náhodná koexistencie, alebo v prípade, že dva typy lézie sú spojené príčinnú súvislosť, ktorá by mohla zahŕňať spoločnú etiológiu a tumorogénny mechanizmov.
Hrubého LMS je vzácna a jej výskyt v kombinácii s rakovinou žalúdka je veľmi nezvyčajné. Aj keď je diagnóza u našej chorej bola komplikovaná prítomnosťou oboch rakovinou žalúdka a LMS, Imunohistochemické štúdie chirurgických vzoriek potvrdila konečnú diagnózu LMS z sigmatu s viacerými pečeňových metastáz. Došli sme k záveru, že multimodálne prístup, ktorý zahŕňa chemoterapiu a kompletné chirurgickú resekciu riadené LMS, dokonca s niekoľkými pečeňových metastáz prítomných a zlepšila prežitie tohto pacienta.
Súhlas
písomný informovaný súhlas bol získaný od jedného z príbuzných pacientov ' pre zverejnenie tohto prípadu správu a sprievodných obrázkov. Kópia písomného súhlasu je k dispozícii na kontrolu zo strany radu editor tohto časopisu
Skratky
CT :.
Počítačová tomografia
GI:
gastrointestinálne
GIST:
gastrointestinálneho stromálny tumor
LMS:
leiomyosarkom
PET-CT:
pozitrónová emisná tomografia /počítačová tomografia
SMA :.
hladkého svalstva aktínu
deklaráciou
autorské originálne predložené súbory obrazov
Nižšie sú uvedené odkazy na autorov pôvodných predložených súborov pre obrázky. "Pôvodný súbor na obrázku 1 12876_2012_812_MOESM2_ESM.tiff autorského 12876_2012_812_MOESM1_ESM.tiff autorov pôvodného súboru pre" pôvodného súboru pre Obrázok 3 12876_2012_812_MOESM4_ESM.tiff autorského Obrázok 2 12876_2012_812_MOESM3_ESM.tiff autorského pôvodného súboru na Obrázok 4 pôvodného súboru 12876_2012_812_MOESM5_ESM.tiff autorského na obrázku 5 "pôvodný súbor na obrázok 6 12876_2012_812_MOESM7_ESM.tiff autorského 12876_2012_812_MOESM6_ESM.tiff autorov pôvodného súboru pre obrázok 7 protichodnými záujmami
autori vyhlasujú, že nemajú žiadne protichodné záujmy. príspevky
autorov
Všetky autorov Prečítal a schváli záverečnú rukopis. Dr YH bol zodpovedný za návrh a príprave rukopisu; Drs JH a KT boli zodpovedné za koncepciu a revízie rukopisu, a tiež patologické diagnózy; DRS ME a YA vykonáva na chirurgický zákrok a klinickú liečbu pacienta; Dr. KK ujal patologické diagnózy; a Dr MO bol zodpovedný za konečnú revíziu a revíziu rukopisu a dohľad nad štúdie.
 Novoobjavené veľké fágy stierajú hranicu života/neživota
Novoobjavené veľké fágy stierajú hranicu života/neživota
 Rychlé vyprážanie s nízkym obsahom FODMAP
Rychlé vyprážanie s nízkym obsahom FODMAP
 Čo spôsobuje reumatoidnú artritídu (a ako ju vypnúť)
Čo spôsobuje reumatoidnú artritídu (a ako ju vypnúť)
 Objav 100 nových génov môže pomôcť výskumu pigmentačných chorôb
Objav 100 nových génov môže pomôcť výskumu pigmentačných chorôb
 Probiotiká môžu v nasledujúcich dvoch desaťročiach pomôcť obmedziť podvýživu,
Probiotiká môžu v nasledujúcich dvoch desaťročiach pomôcť obmedziť podvýživu,
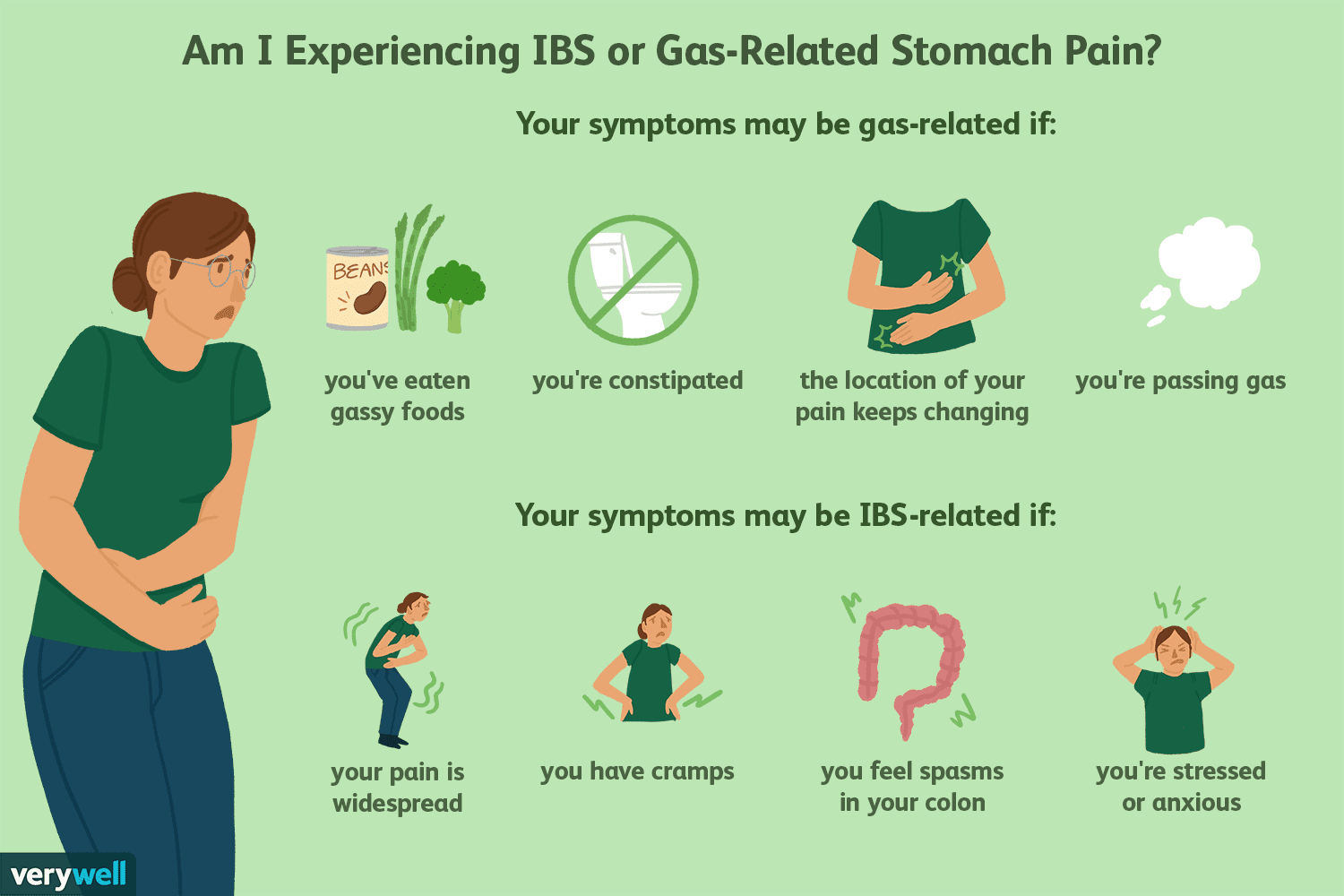 Bolesť so zachyteným plynom a iné zdroje bolesti brucha IBS
Bolesť so zachyteným plynom a iné zdroje bolesti brucha IBS
 Grilované krevety s nízkym obsahom FODMAP
Prejsť na recept Vytlačiť recept Konečne nastal ten čas v roku, keď oprášime staré grilovačky a uložíme stoličky na terasu! Prišlo leto a je čas nasať všetko slnečné lúče! Začať s diétou s nízkym ob
Grilované krevety s nízkym obsahom FODMAP
Prejsť na recept Vytlačiť recept Konečne nastal ten čas v roku, keď oprášime staré grilovačky a uložíme stoličky na terasu! Prišlo leto a je čas nasať všetko slnečné lúče! Začať s diétou s nízkym ob
 8 receptov na polievku SIBO na zahriatie
8 receptov na polievku SIBO na zahriatie Polievka je najlepšie pohodlné jedlo, ktoré vás v chladnej noci ľahko zahreje. Nielenže je výživný a ľahko sa pripravuje, ale je tiež skvelým doplnkom k zozna
8 receptov na polievku SIBO na zahriatie
8 receptov na polievku SIBO na zahriatie Polievka je najlepšie pohodlné jedlo, ktoré vás v chladnej noci ľahko zahreje. Nielenže je výživný a ľahko sa pripravuje, ale je tiež skvelým doplnkom k zozna
 Ako zastaviť análne svrbenie (pruritus Ani)
Definícia a fakty análneho svrbenia (pruritus ani) Obrázok konečníka Svrbenie konečníka je svrbenie okolo konečníka. Príklady možných príčin análneho svrbenia zahŕňajú hemoroidy, análne trhliny, če
Ako zastaviť análne svrbenie (pruritus Ani)
Definícia a fakty análneho svrbenia (pruritus ani) Obrázok konečníka Svrbenie konečníka je svrbenie okolo konečníka. Príklady možných príčin análneho svrbenia zahŕňajú hemoroidy, análne trhliny, če