Les macrophages sont des cellules de défense immunitaire, faisant partie du système immunitaire inné qui surveille les infections. Cependant, leur réponse aux agents pathogènes de toute sorte peut également déclencher une inflammation chronique ou excessive. Ce type d'activation anormale des macrophages est observé dans la polyarthrite rhumatoïde (PR) et d'autres maladies auto-immunes. L'un des objectifs du traitement de la PR est de moduler les états d'activation des macrophages et de réduire l'infiltration des macrophages dans le tissu enflammé.
Dans les poumons, trop, l'infection peut provoquer une inflammation induite par les macrophages, ce qui entraîne la destruction du tissu pulmonaire. Il peut également déclencher une tempête de cytokines, vu dans le syndrome de détresse respiratoire aiguë (SDRA). L'activation des macrophages dépend des récepteurs, qui à leur tour répondent à une variété de signaux externes. La plupart d'entre eux sont médiés par des cytokines et des antigènes présents sur les microbes.
L'interféron-γ (IFN-γ) est l'une des molécules activatrices de macrophages les plus connues et les plus importantes. Les macrophages amorcés par l'exposition à l'IFN-γ répondent plus puissamment à une stimulation ultérieure. Une autre classe d'activateurs similaire contient des agonistes du récepteur Toll-like (TLR), qui amorcent les macrophages de telle sorte qu'ils sécrètent des molécules qui forment le corps inflammatoire appelé inflammasome. L'activation des composants de l'inflammasome provoque la mort de la cellule par pyroptose avec la libération d'interleukine -1β (IL-1β).
Selon les mots des chercheurs, " Une composante importante de la réponse des macrophages à un signal primaire est la régulation à la hausse d'un récepteur super-activateur secondaire qui peut ensuite transformer ces macrophages amorcés en un explosif, état inflammatoire potentiellement pathogène . "
Les chercheurs ont exploré plusieurs conditions inflammatoires telles que la PR, Maladie de Crohn et COVID-19 sévère, trouver un nouveau récepteur macrophage super-activant secondaire appelé SLAMF7. Cette, ils disent, est la clé de la pathogenèse de ces affections.
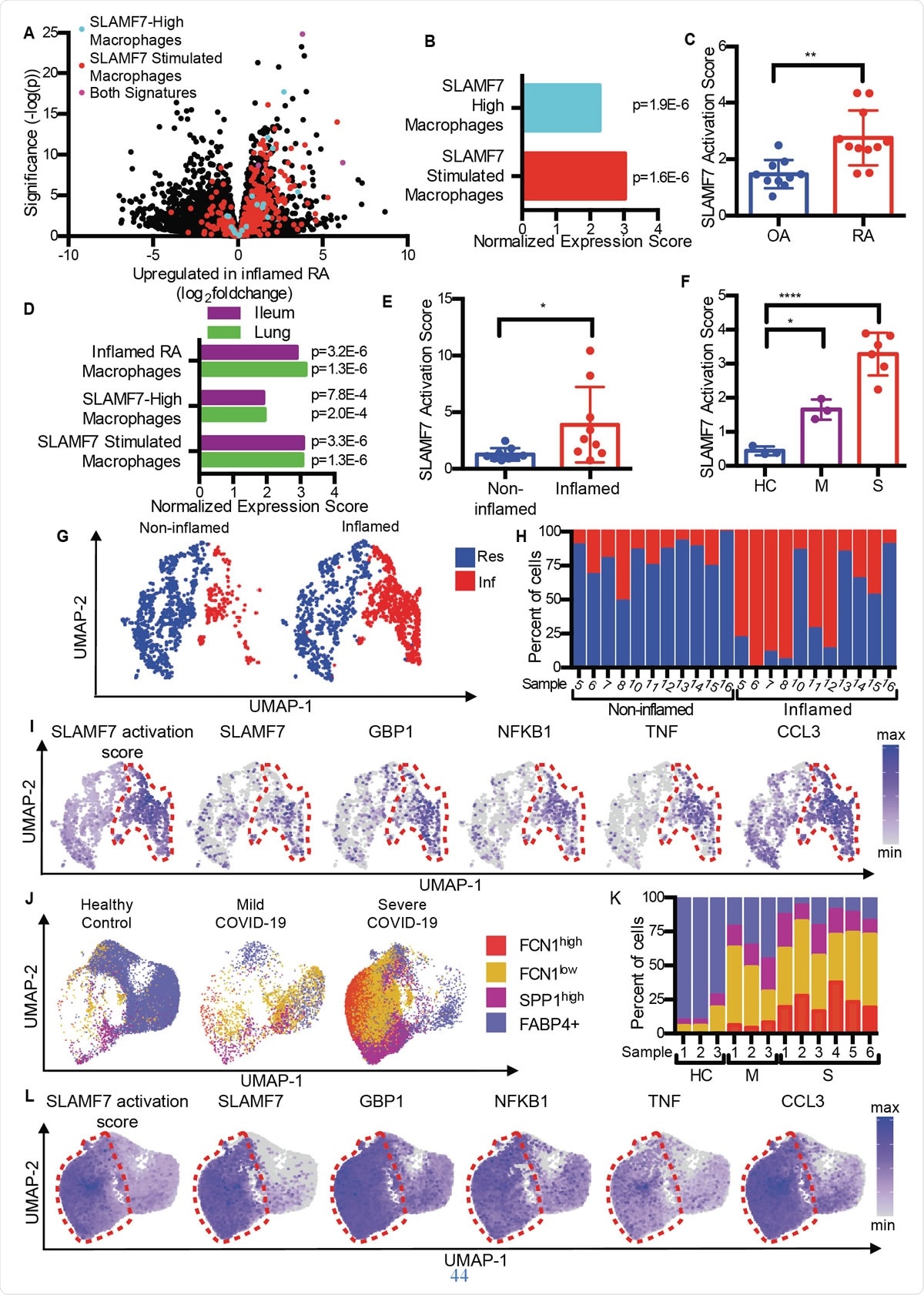 Les macrophages suractivés SLAMF7 entraînent l'inflammation dans les maladies auto-immunes et infectieuses. A) Graphique du volcan de la figure 1A mettant en évidence les gènes de la "SLAMF7-High Macrophage Signature, » la « Signature de stimulation macrophage SLAMF7, » et des gènes inclus dans les deux signatures. B) Analyse d'enrichissement de l'ensemble de gènes comparant l'expression différentielle des gènes dans la PR par rapport à l'arthrose à la «SLAMF7-High Macrophage Signature» et «Macrophage SLAMF7 Stimulation Signature». C) Score d'activation SLAMF7 pour les données RNA-seq en vrac sur les macrophages synoviaux de patients atteints d'arthrose (n =10) ou de PR (n =11). Les données représentent la moyenne ± SD. D) Analyse d'enrichissement de l'ensemble de gènes comparant l'expression génique à partir de macrophages de tissus iléaux enflammés chez des patients atteints de la maladie de Crohn ou des poumons de patients atteints de COVID-19 avec la « Inflamed RA Macrophage Signature », la « signature de macrophage SLAMF7-High » et la « signature de stimulation de macrophage SLAMF7 ». E) Score d'activation SLAMF7 pour les macrophages des tissus iléaux non enflammés (n =9) et enflammés (n =9). F) Score d'activation SLAMF7 pour les macrophages de lavage broncho-alvéolaire des témoins sains (n=3), ou les personnes atteintes de COVID-19 léger (n=3) ou sévère (n=6). Les données dans E-F représentent la moyenne ± SD. G) tracé UMAP des amas de macrophages des tissus iléaux impliqués et non impliqués. H) Pourcentage de macrophages de chaque donneur attribué à chaque cluster. I) Graphiques UMAP montrant l'expression des gènes des populations de macrophages iléaux. J) Graphique UMAP des populations de macrophages de lavage bronchoalvéolaire. K) Pourcentage de macrophages de chaque donneur attribué à chaque population. L) Graphiques UMAP montrant l'expression des gènes pour les populations de macrophages de lavage bronchoalvéolaire. Le test t apparié a été utilisé pour des comparaisons statistiques bidirectionnelles, et l'ANOVA à sens unique avec le test de comparaisons multiples de Dunnett a été utilisé pour comparer le COVID-19 léger et sévère à des témoins sains.*, p 0,05 ; **, p 0,01 ; ****, p <0,0001 ; Rés, Amas de macrophages résidents ; Inf, Amas de macrophages inflammatoires ; HC, contrôle sain; M, COVID-19 doux ; S, COVID-19 sévère.
Les macrophages suractivés SLAMF7 entraînent l'inflammation dans les maladies auto-immunes et infectieuses. A) Graphique du volcan de la figure 1A mettant en évidence les gènes de la "SLAMF7-High Macrophage Signature, » la « Signature de stimulation macrophage SLAMF7, » et des gènes inclus dans les deux signatures. B) Analyse d'enrichissement de l'ensemble de gènes comparant l'expression différentielle des gènes dans la PR par rapport à l'arthrose à la «SLAMF7-High Macrophage Signature» et «Macrophage SLAMF7 Stimulation Signature». C) Score d'activation SLAMF7 pour les données RNA-seq en vrac sur les macrophages synoviaux de patients atteints d'arthrose (n =10) ou de PR (n =11). Les données représentent la moyenne ± SD. D) Analyse d'enrichissement de l'ensemble de gènes comparant l'expression génique à partir de macrophages de tissus iléaux enflammés chez des patients atteints de la maladie de Crohn ou des poumons de patients atteints de COVID-19 avec la « Inflamed RA Macrophage Signature », la « signature de macrophage SLAMF7-High » et la « signature de stimulation de macrophage SLAMF7 ». E) Score d'activation SLAMF7 pour les macrophages des tissus iléaux non enflammés (n =9) et enflammés (n =9). F) Score d'activation SLAMF7 pour les macrophages de lavage broncho-alvéolaire des témoins sains (n=3), ou les personnes atteintes de COVID-19 léger (n=3) ou sévère (n=6). Les données dans E-F représentent la moyenne ± SD. G) tracé UMAP des amas de macrophages des tissus iléaux impliqués et non impliqués. H) Pourcentage de macrophages de chaque donneur attribué à chaque cluster. I) Graphiques UMAP montrant l'expression des gènes des populations de macrophages iléaux. J) Graphique UMAP des populations de macrophages de lavage bronchoalvéolaire. K) Pourcentage de macrophages de chaque donneur attribué à chaque population. L) Graphiques UMAP montrant l'expression des gènes pour les populations de macrophages de lavage bronchoalvéolaire. Le test t apparié a été utilisé pour des comparaisons statistiques bidirectionnelles, et l'ANOVA à sens unique avec le test de comparaisons multiples de Dunnett a été utilisé pour comparer le COVID-19 léger et sévère à des témoins sains.*, p 0,05 ; **, p 0,01 ; ****, p <0,0001 ; Rés, Amas de macrophages résidents ; Inf, Amas de macrophages inflammatoires ; HC, contrôle sain; M, COVID-19 doux ; S, COVID-19 sévère. En comparant l'arthrose (OA) avec la polyarthrite rhumatoïde, les chercheurs ont découvert que le tissu PR contient des macrophages avec une signature d'inflammation, y compris la régulation à la hausse des gènes induits par l'interféron ainsi que des gènes qui codent des produits chimiques inflammatoires dans le corps. Le gène avec la plus forte augmentation d'expression parmi ceux-ci était SLAMF7.
Cela a été trouvé à de faibles niveaux dans le tissu synovial articulaire des articulations enflammées par l'arthrose, mais à des niveaux élevés chez les patients atteints de PR. Il était présent dans 55% des macrophages chez ces derniers, mais <6% des patients souffrant d'arthrose. Il était présent à des niveaux deux fois plus élevés dans les macrophages du liquide synovial du groupe PR par rapport au groupe OA, et sur environ la moitié et un quart des macrophages de chaque groupe, respectivement. Cependant, ce n'était pas le cas d'un autre récepteur SLAM, indiquant que SLAMF7 est spécifique des macrophages inflammatoires dans la PR.
L'IFN-γ s'est avéré être le principal inducteur de ce récepteur sur les macrophages, avec l'IFN-β, IL-1β et TNF-α à des niveaux inférieurs. Cependant, la cytokine pro-inflammatoire IL-6 n'a pas réussi à induire l'expression de SLAMF7. De nouveau, les anciennes cytokines ont réduit les niveaux d'un autre récepteur SLAM, CD84, à la moitié.
Les chercheurs ont également confirmé que la voie JAK jouait un rôle important dans l'activation des macrophages médiée par SLAMF7. Le ruxolitinib, un inhibiteur de JAK, l'a supprimé efficacement. En réalité, ce médicament est utilisé pour traiter la myélofibrose, où, de nouveau, des macrophages exprimant SLAMF7 activés sont trouvés. Il double également les niveaux de CD84, ce qui peut signifier que l'IFN-γ a des effets opposés et réciproques sur ces deux récepteurs SLAM.
A l'étape suivante, L'expression de SLAMF7 a été induite à des niveaux élevés sur les macrophages, par l'IFN-γ. Ensuite, un anticorps monoclonal activateur ou une protéine SLAMF7 recombinante a été ajouté pour se lier aux récepteurs. Les chercheurs ont découvert que cet événement de liaison déclenchait des changements spectaculaires dans l'expression des gènes.
Près de 600 gènes ont été régulés à la hausse - la signature de stimulation du macrophage SLAMF7 - ainsi qu'une augmentation de plusieurs cytokines et chimiokines inflammatoires, même au-delà de l'augmentation provoquée par l'IFN-γ seul. Par exemple, Les niveaux de TNF-α et d'IL-6 augmentent de niveaux picomolaires à nanomolaires à ce moment-là. De plus, l'expression de SLAMF7 elle-même a encore augmenté, suggérant une boucle de rétroaction positive.
La liaison des macrophages à SLAMF7 déclenche également un cycle inflammatoire myéloïde, en plus d'amorcer l'inflammasome pour qu'il réponde fortement aux antigènes microbiens de liaison au TLR, ou aux cytokines, avec une libération massive d'IL-1β. D'autre part, lorsqu'une combinaison d'IFN-γ + LPS (une puissante molécule bactérienne) a été utilisée pour activer les macrophages, le profil de cytokine caractéristique de la liaison de SLAMF7 n'a pas été observé. Cependant, il y avait une similitude partielle entre la réponse des cytokines et le profil d'expression génique qui s'est produit lorsque l'IFN-γ a été utilisé pour la première fois, suivi d'une exposition au LPS.
Les chercheurs ont dit, " Ce programme d'activation de SLAMF7 repose sur et constitue une étape distincte après la stimulation primaire des macrophages par l'IFN-γ ou d'autres facteurs de différenciation et d'activation M1. . " La condition caractéristique de ce programme d'activation - l'état inflammatoire des macrophages suractivés induit par l'engagement de SLAMF7 (SAM7) - est une potentialisation initiale des macrophages par l'IFN-γ, par lequel SLAMF7 est considérablement régulé à la hausse. Les événements de liaison à ce récepteur complètent maintenant l'activation des macrophages amorcés pour produire un état hyper-inflammatoire d'activation des macrophages.
Cette voie semble être soutenue et encore amplifiée par une boucle de rétroaction autocrine, impliquant le TNF-α, qui est rapidement induit (dans les deux heures) après l'engagement du SLAMF7 et continue ensuite à s'accumuler au fil du temps. La preuve en est la réduction de moitié de l'expression du TNF-α par les anticorps anti-TNF, ou en inhibant les récepteurs du TNF par siRNA.
Ils ont constaté que le score d'activation SLAMF7 moyen dans la PR était presque le double de celui des personnes atteintes d'arthrose, indiquant que ce récepteur est étroitement impliqué dans l'inflammation chez les personnes atteintes de PR.
De la même manière, des profils de gènes d'activation des macrophages qui se chevauchent ont été générés à la fois dans les maladies inflammatoires de l'intestin (MICI) et dans COVID-19, par rapport à la RA. En réalité, Les cellules du liquide de lavage bronchoalvéolaire et les cellules du tissu intestinal enflammé dans COVID-19 et IBD ont montré les mêmes signatures d'activation des macrophages. Ils ont également noté un score d'activation SLAMF7 double dans l'intestin enflammé par rapport au tissu intestinal normal. Et en cas de COVID-19 sévère, Le score était six fois plus élevé par rapport au COVID-19 doux. Tout cela suggère la dominance du programme SAM7 d'activation des macrophages dans les conditions inflammatoires, d'autant plus que le récepteur SLAMF7 n'est pas trouvé sur les macrophages résidents dans les tissus normaux.
Explorer différents sous-ensembles de macrophages, ils ont découvert que les macrophages inflammatoires avaient des scores d'activation extrêmement élevés par rapport aux macrophages résidents. De nouveau, trois sous-ensembles distincts de macrophages chez les patients COVID-19 ont été étonnamment augmentés en proportion, avec deux de ces groupes montrant une expansion dans la maladie grave. De façon intéressante, ceux-ci avaient les scores d'activation les plus élevés, et les macrophages de patients COVID-19 gravement malades avaient des niveaux d'expression de SLAMF7 extrêmement élevés, ainsi que des niveaux très élevés de nombreux autres marqueurs et récepteurs inflammatoires et inductibles par l'interféron.
En bref, l'état SAM7 peut être une composante majeure de la réponse hyperinflammatoire observée dans la pneumonie COVID-19, ainsi qu'en RA, et IBD. Cependant, la manière séquentielle dont une telle activation est réalisée permet également l'utilisation de plusieurs contre-mesures thérapeutiques différentes. Ceux-ci incluent les inhibiteurs de JAK comme le ruxolitinib, les inhibiteurs du TNF-α, ou le blocage du SLAMF7 par l'Elotuzumab. La dernière catégorie est particulièrement utile en ce qu'elle peut permettre au programme SAM7 d'être inhibé de manière sélective tout en permettant aux macrophages d'exécuter leurs fonctions immunitaires essentielles normales.
bioRxiv publie des rapports scientifiques préliminaires qui ne sont pas évalués par des pairs et, donc, ne doit pas être considéré comme concluant, guider la pratique clinique/le comportement lié à la santé, ou traités comme des informations établies.
 Les messagers protéiques du microbiome humain font la lumière sur la santé humaine
Les messagers protéiques du microbiome humain font la lumière sur la santé humaine
 Les personnes présentant des symptômes du SCI sont susceptibles d'avoir de faibles niveaux de vitamine D,
Les personnes présentant des symptômes du SCI sont susceptibles d'avoir de faibles niveaux de vitamine D,
 Certaines espèces bactériennes peuvent augmenter le risque de VIH chez les femmes,
Certaines espèces bactériennes peuvent augmenter le risque de VIH chez les femmes,
 La composition et la structure du microbiome nasopharyngé sont liées à la gravité de la maladie COVID-19
La composition et la structure du microbiome nasopharyngé sont liées à la gravité de la maladie COVID-19
 Les bactéries intestinales les plus saines avec un régime à base de plantes ou méditerranéen
Les bactéries intestinales les plus saines avec un régime à base de plantes ou méditerranéen
 Des chercheurs identifient in vitro une bactérie à activité anti-SARS-CoV-2 :Dolosigranulum pigrum
Des chercheurs identifient in vitro une bactérie à activité anti-SARS-CoV-2 :Dolosigranulum pigrum
 E. coli superbactérie se propageant par une mauvaise hygiène des toilettes,
pas par la nourriture Une nouvelle étude publiée dans Les maladies infectieuses du Lancet le 22 octobre 2019, dit quun superbactérie commun qui cause plus de 5, 000 cas dintoxication alimentaire en
E. coli superbactérie se propageant par une mauvaise hygiène des toilettes,
pas par la nourriture Une nouvelle étude publiée dans Les maladies infectieuses du Lancet le 22 octobre 2019, dit quun superbactérie commun qui cause plus de 5, 000 cas dintoxication alimentaire en
 Cryptosporidiose aggravée par les probiotiques couramment utilisés
Les chercheurs ont découvert que linfection par le parasite intestinal Cryptosporidium parvum est aggravée chez les souris qui ont reçu un probiotique. Crédit dimage :Alpha Tauri 3D Grap
Cryptosporidiose aggravée par les probiotiques couramment utilisés
Les chercheurs ont découvert que linfection par le parasite intestinal Cryptosporidium parvum est aggravée chez les souris qui ont reçu un probiotique. Crédit dimage :Alpha Tauri 3D Grap
 Une étude décrit la base de données initiale de base sur le microbiome intestinal sain et le profil d'abondance
Une base de données initiale de base sur le microbiome intestinal sain et un profil dabondance sont décrits dans une étude publiée le 11 septembre. 2019 dans la revue en libre accès PLOS ONE par Charl
Une étude décrit la base de données initiale de base sur le microbiome intestinal sain et le profil d'abondance
Une base de données initiale de base sur le microbiome intestinal sain et un profil dabondance sont décrits dans une étude publiée le 11 septembre. 2019 dans la revue en libre accès PLOS ONE par Charl