Макрофаги - клетки иммунной защиты, является частью врожденной иммунной системы, которая следит за инфекциями. Тем не мение, их реакция на патогены любого типа также может вызвать хроническое или чрезмерное воспаление. Такой вид аномальной активации макрофагов наблюдается при ревматоидном артрите (РА) и других аутоиммунных состояниях. Одна из целей лечения РА - модулировать состояния активации макрофагов и уменьшить инфильтрацию макрофагов в воспаленную ткань.
В легких, тоже, инфекция может вызвать воспаление, вызванное макрофагами, что приводит к разрушению легочной ткани. Это также может вызвать цитокиновый шторм, наблюдается при остром респираторном дистресс-синдроме (ОРДС). Активация макрофагов зависит от рецепторов, которые, в свою очередь, реагируют на множество внешних сигналов. Большинство из них опосредовано цитокинами и антигенами, присутствующими в микробах.
Одной из наиболее известных и наиболее важных молекул активатора макрофагов является интерферон-γ (IFN-γ). Макрофаги, примированные воздействием IFN-γ, сильнее реагируют на последующую стимуляцию. Другой подобный класс активаторов содержит агонисты Toll-подобных рецепторов (TLR), которые заставляют макрофаги выделять молекулы, образующие воспалительное тело, называемое инфламмасомой. Активация компонентов инфламмасомы приводит к гибели клетки от пироптоза вместе с высвобождением интерлейкина -1β (IL-1β).
<цитата>По словам исследователей, « Важным компонентом реакции макрофагов на первичный сигнал является активация вторичного рецептора суперактиватора, который затем может преобразовывать эти примированные макрофаги во взрывчатое вещество, потенциально патогенное воспалительное состояние . »
Исследователи изучили несколько воспалительных состояний, таких как РА, Болезнь Крона и тяжелый COVID-19, обнаружение нового вторичного суперактивирующего рецептора макрофагов под названием SLAMF7. Этот, они говорят, является ключом к патогенезу этих состояний.
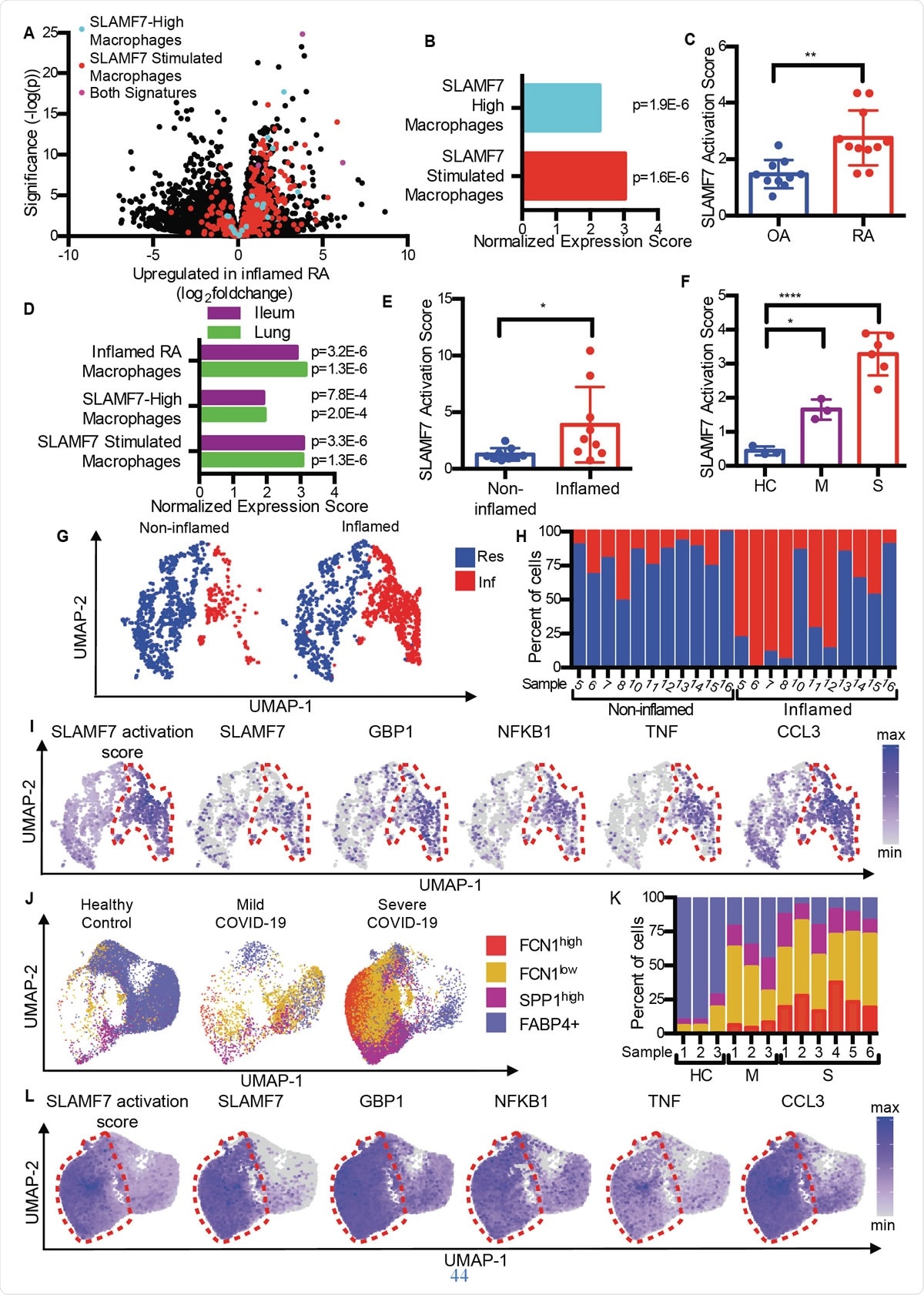 Суперактивированные макрофаги SLAMF7 вызывают воспаление при аутоиммунных и инфекционных заболеваниях. A) График вулкана с рис. 1A, выделяющий гены из «SLAMF7-High Macrophage Signature, «Сигнатура стимуляции макрофагов SLAMF7, »И гены, включенные в обе сигнатуры. B) Анализ обогащения набора генов, сравнивающий дифференциальную экспрессию генов при РА по сравнению с ОА с «сигнатурой макрофагов с высоким уровнем SLAMF7» и «сигнатурой стимуляции макрофагов SLAMF7». C) Оценка активации SLAMF7 для данных о совокупных последовательностях РНК синовиальных макрофагов от пациентов с ОА (n =10) или RA (n =11). Данные представляют собой среднее значение ± стандартное отклонение. D) Анализ обогащения набора генов, сравнивающий экспрессию генов макрофагов из воспаленных тканей подвздошной кишки у пациентов с болезнью Крона или легких пациентов с COVID-19 с «сигнатурой воспаленных макрофагов RA», «Сигнатура макрофагов с высоким уровнем SLAMF7» и «Сигнатура стимуляции макрофагов SLAMF7». E) Оценка активации SLAMF7 для макрофагов из невоспаленных (n =9) и воспаленных тканей подвздошной кишки (n =9). F) Оценка активации SLAMF7 для макрофагов бронхоальвеолярного лаважа от здоровых контролей (n =3), или люди с легкой (n =3) или тяжелой формой COVID-19 (n =6). Данные в E-F представляют собой среднее ± стандартное отклонение. G) График UMAP кластеров макрофагов из пораженных и не вовлеченных тканей подвздошной кишки. H) Процент макрофагов от каждого донора, отнесенного к каждому кластеру. I) Графики UMAP, показывающие экспрессию генов популяций макрофагов подвздошной кишки. J) График UMAP популяций макрофагов бронхоальвеолярного лаважа. K) Процент макрофагов от каждого донора, назначенный каждой популяции. L) Графики UMAP, показывающие экспрессию генов популяций макрофагов бронхоальвеолярного лаважа. Парный t-критерий использовался для двусторонних статистических сравнений, односторонний дисперсионный анализ ANOVA с тестом множественных сравнений Даннета был использован для сравнения легкой и тяжелой формы COVID-19 с контрольной группой здоровых людей. *, р ≤ 0,05; **, р ≤ 0,01; ****, р <0,0001; Res, Резидентный кластер макрофагов; Inf, Кластер воспалительных макрофагов; HC, здоровый контроль; М, COVID-19 в легкой форме; S, тяжелый COVID-19.
Суперактивированные макрофаги SLAMF7 вызывают воспаление при аутоиммунных и инфекционных заболеваниях. A) График вулкана с рис. 1A, выделяющий гены из «SLAMF7-High Macrophage Signature, «Сигнатура стимуляции макрофагов SLAMF7, »И гены, включенные в обе сигнатуры. B) Анализ обогащения набора генов, сравнивающий дифференциальную экспрессию генов при РА по сравнению с ОА с «сигнатурой макрофагов с высоким уровнем SLAMF7» и «сигнатурой стимуляции макрофагов SLAMF7». C) Оценка активации SLAMF7 для данных о совокупных последовательностях РНК синовиальных макрофагов от пациентов с ОА (n =10) или RA (n =11). Данные представляют собой среднее значение ± стандартное отклонение. D) Анализ обогащения набора генов, сравнивающий экспрессию генов макрофагов из воспаленных тканей подвздошной кишки у пациентов с болезнью Крона или легких пациентов с COVID-19 с «сигнатурой воспаленных макрофагов RA», «Сигнатура макрофагов с высоким уровнем SLAMF7» и «Сигнатура стимуляции макрофагов SLAMF7». E) Оценка активации SLAMF7 для макрофагов из невоспаленных (n =9) и воспаленных тканей подвздошной кишки (n =9). F) Оценка активации SLAMF7 для макрофагов бронхоальвеолярного лаважа от здоровых контролей (n =3), или люди с легкой (n =3) или тяжелой формой COVID-19 (n =6). Данные в E-F представляют собой среднее ± стандартное отклонение. G) График UMAP кластеров макрофагов из пораженных и не вовлеченных тканей подвздошной кишки. H) Процент макрофагов от каждого донора, отнесенного к каждому кластеру. I) Графики UMAP, показывающие экспрессию генов популяций макрофагов подвздошной кишки. J) График UMAP популяций макрофагов бронхоальвеолярного лаважа. K) Процент макрофагов от каждого донора, назначенный каждой популяции. L) Графики UMAP, показывающие экспрессию генов популяций макрофагов бронхоальвеолярного лаважа. Парный t-критерий использовался для двусторонних статистических сравнений, односторонний дисперсионный анализ ANOVA с тестом множественных сравнений Даннета был использован для сравнения легкой и тяжелой формы COVID-19 с контрольной группой здоровых людей. *, р ≤ 0,05; **, р ≤ 0,01; ****, р <0,0001; Res, Резидентный кластер макрофагов; Inf, Кластер воспалительных макрофагов; HC, здоровый контроль; М, COVID-19 в легкой форме; S, тяжелый COVID-19. Сравнение остеоартрита (ОА) с ревматоидным артритом, исследователи обнаружили, что ткань RA содержит макрофаги с характерным воспалением, включая активацию генов, индуцируемых интерфероном, а также генов, кодирующих воспалительные химические вещества в организме. Среди них геном с наибольшим увеличением экспрессии был SLAMF7.
Он был обнаружен в низких уровнях в синовиальной ткани суставов, воспаленных ОА, но на высоком уровне у пациентов с РА. В последних он присутствовал в 55% макрофагов, но <6% пациентов с ОА. Он присутствовал в макрофагах синовиальной жидкости в группе RA в два раза выше, чем в группе OA, и примерно на половине с четвертью макрофагов в каждой группе, соответственно. Тем не мение, это не было верно для другого рецептора SLAM, указывая на то, что SLAMF7 специфичен для воспалительных макрофагов при РА.
Было обнаружено, что IFN-γ является основным индуктором этого рецептора на макрофагах, вместе с IFN-β, IL-1β и TNF-α на более низких уровнях. Тем не мение, провоспалительный цитокин IL-6 не индуцирует экспрессию SLAMF7. Опять таки, первые цитокины снижали уровень другого рецептора SLAM, CD84, до половины.
Исследователи также подтвердили, что путь JAK играет важную роль в активации макрофагов, опосредованной SLAMF7. Ингибитор JAK руксолитиниб эффективно подавлял его. По факту, этот препарат используется для лечения миелофиброза, куда, опять таки, обнаружены активированные макрофаги, экспрессирующие SLAMF7. Он также удваивает уровни CD84, что может означать, что IFN-γ оказывает противоположное и взаимное действие на эти два рецептора SLAM.
На следующем этапе Экспрессия SLAMF7 индуцировалась на высоком уровне на макрофагах, по IFN-γ. Впоследствии активирующее моноклональное антитело или рекомбинантный белок SLAMF7 добавляли для связывания с рецепторами. Исследователи обнаружили, что это событие связывания вызвало драматические изменения в экспрессии генов.
Были активированы почти 600 генов - сигнатура стимуляции макрофагов SLAMF7 - наряду с увеличением ряда воспалительных цитокинов и хемокинов, даже за пределами повышения, вызванного одним IFN-γ. Например, В это время уровни TNF-α и IL-6 увеличиваются с пикомолярных до наномолярных. Кроме того, экспрессия самого SLAMF7 еще больше увеличилась, предлагая положительную обратную связь.
Связывание макрофагов с SLAMF7 также запускает миелоидный воспалительный цикл, помимо примирования инфламмасомы к сильному ответу на микробные TLR-связывающие антигены, или к цитокинам, с массовым высвобождением IL-1β. С другой стороны, когда комбинация IFN-γ + LPS (мощная бактериальная молекула) использовалась для активации макрофагов, цитокиновый профиль, характерный для связывания SLAMF7, не наблюдался. Тем не мение, было частичное сходство между цитокиновым ответом и профилем экспрессии гена, которое имело место при первом использовании IFN-γ, с последующим воздействием ЛПС.
Исследователи сказали:« Эта программа активации SLAMF7 основана на первичной стимуляции макрофагов IFN-γ или другими факторами дифференцировки и активации M1 и является отдельным этапом. . » Характерным условием этой программы активации - суперактивным воспалительным состоянием макрофагов, вызванным вовлечением SLAMF7 (SAM7), является начальная потенциация макрофагов IFN-γ, в результате чего SLAMF7 резко активируется. События связывания на этом рецепторе теперь завершают активацию примированных макрофагов, вызывая гипервоспалительное состояние активации макрофагов.
Этот путь, по-видимому, поддерживается и дополнительно усиливается автокринной петлей обратной связи, с участием TNF-α, который быстро индуцируется (в течение двух часов) после задействования SLAMF7, а затем продолжает нарастать с течением времени. Доказательства этого включают уменьшение вдвое экспрессии TNF-α антителами против TNF, или подавляя рецепторы TNF с помощью миРНК.
Они обнаружили, что средний балл активации SLAMF7 при РА был почти вдвое выше, чем у людей с ОА, что указывает на то, что этот рецептор принимает непосредственное участие в воспалении у пациентов с РА.
Сходным образом, перекрывающиеся профили генов активации макрофагов были созданы как при воспалительном заболевании кишечника (ВЗК), так и при COVID-19, по сравнению с РА. По факту, Клетки жидкости бронхоальвеолярного лаважа и клетки воспаленной ткани кишечника при COVID-19 и IBD показали одинаковые сигнатуры активации макрофагов. Они также отметили двойную оценку активации SLAMF7 в воспаленном кишечнике по сравнению с нормальной тканью кишечника. А при тяжелой форме COVID-19 оценка была в шесть раз выше по сравнению с легкой формой COVID-19. Все это говорит о преобладании программы активации макрофагов SAM7 при воспалительных процессах, особенно потому, что рецептор SLAMF7 не обнаруживается на резидентных макрофагах в нормальной ткани.
Изучение различных подмножеств макрофагов, они обнаружили, что воспалительные макрофаги имеют чрезвычайно высокие показатели активации по сравнению с резидентными макрофагами. Опять таки, три различных подгруппы макрофагов у пациентов с COVID-19 резко увеличились в пропорции, при этом две из этих групп демонстрируют рост в тяжелой форме болезни. Интересно, у них были самые высокие баллы активации, и макрофаги от тяжелобольных пациентов с COVID-19 имели чрезвычайно высокий уровень экспрессии SLAMF7, наряду с очень высокими уровнями многих других воспалительных и интерферон-индуцируемых маркеров и рецепторов.
Суммируя, состояние SAM7 может быть основным компонентом гипервоспалительного ответа, наблюдаемого при пневмонии COVID-19, как и в РА, и IBD. Тем не мение, Последовательный способ, которым достигается такая активация, также позволяет использовать множество различных терапевтических контрмер. К ним относятся ингибиторы JAK, такие как руксолитиниб, Ингибиторы TNF-α, или блокада SLAMF7 элотузумабом. Последняя категория особенно полезна тем, что позволяет избирательно подавлять программу SAM7, в то же время позволяя макрофагам выполнять свои нормальные основные иммунные функции.
bioRxiv публикует предварительные научные отчеты, не прошедшие рецензирование, и, следовательно, не следует рассматривать как окончательный, руководить клинической практикой / поведением, связанным со здоровьем, или рассматриваться как установленная информация.
 Молодая кровь восстанавливает жизненные силы у пожилых людей
Молодая кровь восстанавливает жизненные силы у пожилых людей
 Открытие узкого пищевода
Открытие узкого пищевода
 Микропластик впервые обнаружен в отходах жизнедеятельности человека
Микропластик впервые обнаружен в отходах жизнедеятельности человека
 Микробиом влагалища может влиять на эффективность профилактической терапии ВИЧ.
Микробиом влагалища может влиять на эффективность профилактической терапии ВИЧ.
 ВЗК встречается гораздо чаще, чем ожидалось,
ВЗК встречается гораздо чаще, чем ожидалось,
 Язвенный колит и отсутствие микробов в кишечнике
Язвенный колит и отсутствие микробов в кишечнике
 Этот пепто, вероятно, не поможет вашей язве
Язвенная болезнь - это язва или поражение, которое развивается в слизистой оболочке пищевода, желудок, или двенадцатиперстная кишка. Не так давно, Предполагалось, что язвы вызваны стрессом или просто
Этот пепто, вероятно, не поможет вашей язве
Язвенная болезнь - это язва или поражение, которое развивается в слизистой оболочке пищевода, желудок, или двенадцатиперстная кишка. Не так давно, Предполагалось, что язвы вызваны стрессом или просто
 Как массовые обследования помогли выявить больше случаев глютеновой болезни у детей
Новая программа массового обследования детей школьного возраста в Италии показала, что общая распространенность целиакии почти удвоилась за последние 25 лет. Инфографика целиакии. Кредит
Как массовые обследования помогли выявить больше случаев глютеновой болезни у детей
Новая программа массового обследования детей школьного возраста в Италии показала, что общая распространенность целиакии почти удвоилась за последние 25 лет. Инфографика целиакии. Кредит
 Perfectus Biomed примет участие в конференции IPS в Ливерпуле
Команда Perfectus Biomed примет участие в конференции Общества профилактики инфекций (IPS) в Ливерпуле в этом месяце. Конференция состоится в арене и конференц-центре Ливерпуля с 22 по 24 сентября 201
Perfectus Biomed примет участие в конференции IPS в Ливерпуле
Команда Perfectus Biomed примет участие в конференции Общества профилактики инфекций (IPS) в Ливерпуле в этом месяце. Конференция состоится в арене и конференц-центре Ливерпуля с 22 по 24 сентября 201