Makrofager är immunförsvarsceller, utgör en del av det medfödda immunsystemet som ser efter infektioner. Dock, deras svar på patogener av något slag kan också utlösa kronisk eller överdriven inflammation. Denna typ av onormal makrofagaktivering ses vid reumatoid artrit (RA) och andra autoimmuna tillstånd. Ett mål med RA -behandling är att modulera makrofagaktiveringstillstånd och minska makrofaginfiltrering i den inflammerade vävnaden.
I lungorna, för, infektion kan orsaka makrofaginducerad inflammation, vilket resulterar i förstörelse av lungvävnad. Det kan också utlösa en cytokinstorm, ses vid akut andningssyndrom (ARDS). Makrofagaktivering är beroende av receptorer, som i sin tur svarar på en mängd olika externa signaler. De flesta av dessa medieras av cytokiner och antigener som finns på mikrober.
En av de mest kända och viktigaste makrofagaktivatormolekylerna är interferon-γ (IFN-γ). Makrofager grundade på IFN-y-exponering svarar kraftfullare på efterföljande stimulering. En annan liknande aktivatorklass innehåller Toll-like receptor (TLR) agonister, som fyller makrofager så att de utsöndrar molekyler som bildar den inflammatoriska kroppen som kallas inflammasomen. Aktivering av inflammasomkomponenter gör att cellen dör av pyroptos tillsammans med frisättning av interleukin -1β (IL -1β).
Med forskarnas ord, “ En viktig komponent i makrofagsvaret till en primär signal är uppreglering av en sekundär superaktivatorreceptor som sedan kan omvandla dessa primade makrofager till ett explosivt, potentiellt patogent inflammatoriskt tillstånd . ”
Forskarna undersökte flera inflammatoriska tillstånd som RA, Crohns sjukdom och allvarlig COVID-19, hitta en ny sekundär superaktiverande makrofagreceptor kallad SLAMF7. Detta, de säger, är nyckeln till patogenesen av dessa tillstånd.
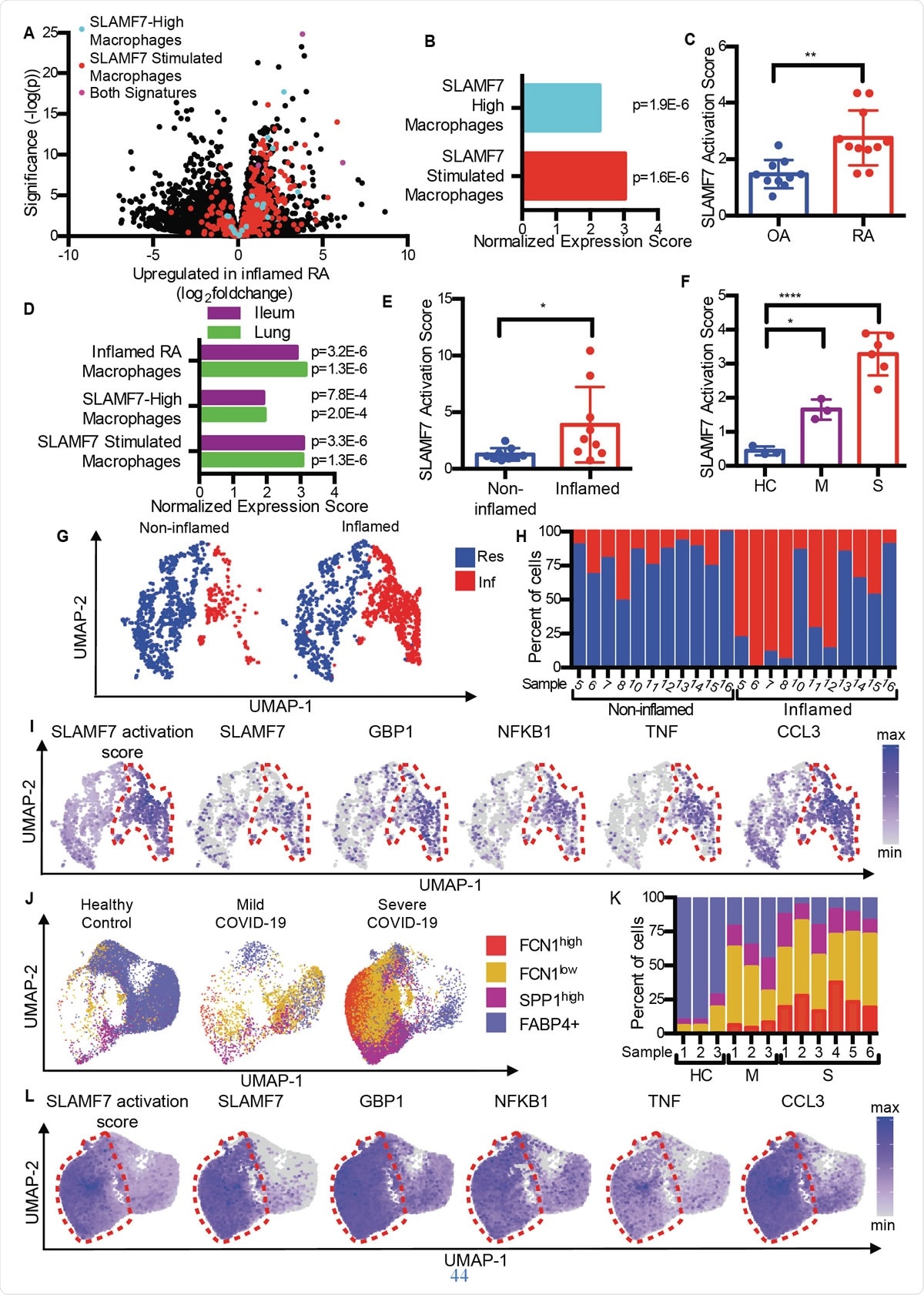 SLAMF7 superaktiverade makrofager driver inflammation vid autoimmun och infektionssjukdom. A) Vulkanplott från Fig. 1A som markerar gener från "SLAMF7-High Macrophage Signature, ”Macrophage SLAMF7 -stimuleringssignaturen, ”Och gener som ingår i båda signaturerna. B) Berikningsanalys av genuppsättningar som jämför differentiellt genuttryck i RA kontra OA med "SLAMF7-High Macrophage Signature" och "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringspoäng för bulk-RNA-seq-data om synoviala makrofager från patienter med OA (n =10) eller RA (n =11). Data representerar medelvärde ± SD. D) Berikningsanalys av genuppsättningar som jämför genuttryck från makrofager från inflammerade ilealvävnader hos patienter med Crohns sjukdom eller lungor hos patienter med COVID-19 med "Inflammerad RA-makrofagssignatur", "SLAMF7-High Macrophage Signature" och "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7 -aktiveringspoäng för makrofager från icke -inflammerade (n =9) och inflammerade ilealvävnader (n =9). F) SLAMF7 -aktiveringspoäng för bronkoalveolära sköljmakrofager från friska kontroller (n =3), eller personer med mild (n =3) eller svår COVID-19 (n =6). Data i E-F representerar medelvärde ± SD. G) UMAP -plot av makrofagkluster från involverade och oinvolverade ilealvävnader. H) Procent av makrofager från varje givare som tilldelats varje kluster. I) UMAP -diagram som visar genuttryck av ileala makrofagpopulationer. J) UMAP -diagram för bronkoalveolära sköljmakrofagpopulationer. K) Procent av makrofager från varje givare som tilldelats varje befolkning. L) UMAP -tomter som visar genuttryck för bronkoalveolära sköljmakrofagpopulationer. Det parade t-testet användes för tvåvägs statistiska jämförelser, och enkelriktad ANOVA med Dunnetts multipeljämförelsetest användes för att jämföra mild och svår COVID-19 med friska kontroller.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Bosatt makrofagkluster; Inf, Inflammatoriskt makrofagkluster; HC, hälsosam kontroll; M, mild COVID-19; S, allvarlig covid-19.
SLAMF7 superaktiverade makrofager driver inflammation vid autoimmun och infektionssjukdom. A) Vulkanplott från Fig. 1A som markerar gener från "SLAMF7-High Macrophage Signature, ”Macrophage SLAMF7 -stimuleringssignaturen, ”Och gener som ingår i båda signaturerna. B) Berikningsanalys av genuppsättningar som jämför differentiellt genuttryck i RA kontra OA med "SLAMF7-High Macrophage Signature" och "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringspoäng för bulk-RNA-seq-data om synoviala makrofager från patienter med OA (n =10) eller RA (n =11). Data representerar medelvärde ± SD. D) Berikningsanalys av genuppsättningar som jämför genuttryck från makrofager från inflammerade ilealvävnader hos patienter med Crohns sjukdom eller lungor hos patienter med COVID-19 med "Inflammerad RA-makrofagssignatur", "SLAMF7-High Macrophage Signature" och "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7 -aktiveringspoäng för makrofager från icke -inflammerade (n =9) och inflammerade ilealvävnader (n =9). F) SLAMF7 -aktiveringspoäng för bronkoalveolära sköljmakrofager från friska kontroller (n =3), eller personer med mild (n =3) eller svår COVID-19 (n =6). Data i E-F representerar medelvärde ± SD. G) UMAP -plot av makrofagkluster från involverade och oinvolverade ilealvävnader. H) Procent av makrofager från varje givare som tilldelats varje kluster. I) UMAP -diagram som visar genuttryck av ileala makrofagpopulationer. J) UMAP -diagram för bronkoalveolära sköljmakrofagpopulationer. K) Procent av makrofager från varje givare som tilldelats varje befolkning. L) UMAP -tomter som visar genuttryck för bronkoalveolära sköljmakrofagpopulationer. Det parade t-testet användes för tvåvägs statistiska jämförelser, och enkelriktad ANOVA med Dunnetts multipeljämförelsetest användes för att jämföra mild och svår COVID-19 med friska kontroller.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Bosatt makrofagkluster; Inf, Inflammatoriskt makrofagkluster; HC, hälsosam kontroll; M, mild COVID-19; S, allvarlig covid-19. Jämförelse med artros (OA) med reumatoid artrit, forskarna fann att RA -vävnad innehåller makrofager med en inflammatorisk signatur, inklusive uppreglering av gener som induceras av interferon samt gener som kodar för inflammatoriska kemikalier i kroppen. Genen med den högsta uttrycksökningen bland dessa var SLAMF7.
Detta hittades i låga nivåer i ledhinnevävnad från leder inflammerade av OA, men på höga nivåer hos RA -patienter. Det fanns i 55% av makrofagerna i det senare, men <6% av patienterna med OA. Det var närvarande på två gånger högre nivåer i makrofager i synovialvätska från RA -gruppen jämfört med OA -gruppen, och på ungefär hälften och en fjärdedel av makrofagerna i varje grupp, respektive. Dock, detta var inte sant för en annan SLAM -receptor, pekar på SLAMF7 som specifik för inflammatoriska makrofager vid RA.
IFN-γ befanns vara den primära induceraren av denna receptor på makrofager, tillsammans med IFN-β, IL-1β och TNF-a vid lägre nivåer. Dock, det proinflammatoriska cytokinet IL-6 lyckades inte inducera SLAMF7-uttryck. På nytt, de tidigare cytokinerna minskade nivåerna av en annan SLAM -receptor, CD84, till hälften.
Forskarna bekräftade också att JAK-vägen spelade en viktig roll vid SLAMF7-medierad makrofagaktivering. JAK -hämmaren ruxolitinib undertryckte det effektivt. Faktiskt, detta läkemedel används för att behandla myelofibros, var, på nytt, aktiverade SLAMF7-uttryckande makrofager hittas. Det fördubblar också CD84 -nivåerna, vilket kan innebära att IFN-γ har motsatta och ömsesidiga effekter på dessa två SLAM-receptorer.
I nästa steg, SLAMF7 -uttryck inducerades vid höga nivåer på makrofager, av IFN-γ. Senare, aktiverande monoklonal antikropp eller rekombinant SLAMF7 -protein tillsattes för att binda till receptorerna. Forskarna fann att denna bindande händelse utlöste dramatiska förändringar i genuttryck.
Nästan 600 gener uppreglerades - Macrophage SLAMF7 Stimulation Signature - tillsammans med en ökning av flera inflammatoriska cytokiner och kemokiner, även bortom ökningen orsakad av IFN-γ ensam. Till exempel, TNF-a- och IL-6-nivåerna ökar från picomolära till nanomolära nivåer vid denna tidpunkt. Dessutom, uttrycket av SLAMF7 i sig ökade ytterligare, föreslår en positiv återkopplingsslinga.
Bindning av makrofager till SLAMF7 sätter också igång en myeloid inflammatorisk cykel, förutom att prima inflammasomen att reagera starkt på mikrobiella TLR-bindande antigener, eller till cytokiner, med en massiv frisättning av IL-1β. Å andra sidan, när en kombination av IFN-γ + LPS (en potent bakteriell molekyl) användes för att aktivera makrofagerna, cytokinprofilen som är karakteristisk för SLAMF7 -bindning observerades inte. Dock, det fanns en partiell likhet mellan cytokinsvaret och genuttrycksprofilen som inträffade när IFN-γ först användes, följt av LPS -exponering.
Forskarna sa, “ Detta SLAMF7-aktiveringsprogram vilar på och är ett separat steg efter primär stimulering av makrofager med IFN-γ eller andra M1-differentierings- och aktiveringsfaktorer . ” Det karakteristiska tillståndet för detta aktiveringsprogram-det superaktiverade makrofaginflammatoriska tillståndet inducerat av SLAMF7-engagemang (SAM7)-är en initial förstärkning av makrofagerna med IFN-γ, varigenom SLAMF7 dramatiskt uppregleras. Bindningshändelser vid denna receptor slutför nu aktiveringen av de primade makrofagerna för att producera ett hyperinflammatoriskt tillstånd av makrofagaktivering.
Denna väg verkar fortsätta och förstärkas ytterligare av en autokrin återkopplingsslinga, som involverar TNF-α, som snabbt induceras (inom två timmar) efter SLAMF7 -engagemang och sedan fortsätter att bygga upp över tiden. Bevis för detta inkluderar halvering av TNF-α-uttryck med anti-TNF-antikropp, eller genom att tysta TNF -receptorer med siRNA.
De fann att den genomsnittliga SLAMF7 -aktiveringspoängen vid RA var nästan dubbelt så stor som hos personer med OA, indikerar att denna receptor är nära involverad i inflammation hos dem med RA.
Liknande, överlappande makrofagaktiveringsgenprofiler genererades både vid inflammatorisk tarmsjukdom (IBD) och vid COVID-19, jämfört med RA. Faktiskt, bronkoalveolära sköljvätskeceller och celler från inflammerad tarmvävnad i COVID-19 och IBD visade samma makrofagaktiveringssignaturer. De noterade också en tvåfaldig SLAMF7 -aktiveringspoäng i inflammerad tarm i förhållande till normal tarmvävnad. Och vid allvarlig COVID-19, poängen var sex gånger högre jämfört med mild COVID-19. Allt detta tyder på dominansen av SAM7 -programmet för makrofagaktivering vid inflammatoriska tillstånd, särskilt eftersom SLAMF7 -receptorn inte finns på bosatta makrofager i normal vävnad.
Utforska olika makrofagundermängder, de fann att inflammatoriska makrofager hade extremt höga aktiveringspoäng jämfört med bosatta makrofager. På nytt, tre distinkta undergrupper av makrofager hos COVID-19-patienter ökade påtagligt i proportion, med två av dessa grupper som visar expansion i svår sjukdom. Intressant, dessa hade de högsta aktiveringspoängen, och makrofager från svårt sjuka COVID-19-patienter hade extremt höga SLAMF7-uttrycksnivåer, tillsammans med mycket höga nivåer av många andra inflammatoriska och interferoninducerbara markörer och receptorer.
Kortfattat, SAM7-tillståndet kan vara en viktig komponent i det hyperinflammatoriska svaret som ses vid COVID-19-lunginflammation, liksom i RA, och IBD. Dock, det sekventiella sättet på vilket sådan aktivering uppnås möjliggör också användning av flera olika terapeutiska motåtgärder. Dessa inkluderar JAK -hämmare som ruxolitinib, TNF-α-hämmare, eller SLAMF7 -blockad av Elotuzumab. Den sista kategorin är särskilt användbar eftersom den kan tillåta att SAM7 -programmet selektivt hämmas samtidigt som makrofager fortfarande kan utföra sina normala viktiga immunfunktioner.
bioRxiv publicerar preliminära vetenskapliga rapporter som inte är fackgranskade och, därför, ska inte betraktas som avgörande, vägleda klinisk praxis/hälsorelaterat beteende, eller behandlas som etablerad information.
 Patienter med IBS kan dra nytta av vitamin D -tillskott,
Patienter med IBS kan dra nytta av vitamin D -tillskott,
 Forskare hoppas att blodprov som exakt diagnostiserar fibromyalgi kan vara tillgängligt inom fem år
Forskare hoppas att blodprov som exakt diagnostiserar fibromyalgi kan vara tillgängligt inom fem år
 Kan antivirala läkemedel som härrör från mikroalger bekämpa SARS-CoV-2 och andra virus?
Kan antivirala läkemedel som härrör från mikroalger bekämpa SARS-CoV-2 och andra virus?
 Spindelgiftpeptid kan hjälpa till att stoppa smärta vid irritabelt tarmsyndrom
Spindelgiftpeptid kan hjälpa till att stoppa smärta vid irritabelt tarmsyndrom
 Studie kopplar fermenterad grönsakskonsumtion till låg dödlighet av COVID-19
Studie kopplar fermenterad grönsakskonsumtion till låg dödlighet av COVID-19
 Patienter på immunterapier bör konsumera mer fiber,
Patienter på immunterapier bör konsumera mer fiber,
 Lungmikrober kan hjälpa till att förutsäga utfall hos allvarligt sjuka
En ny studie publicerad i American Journal of Respiratory and Critical Care Medicine visar att registrering av hur organismerna som lever i lungorna förändras i typ och antal kan återspegla den krit
Lungmikrober kan hjälpa till att förutsäga utfall hos allvarligt sjuka
En ny studie publicerad i American Journal of Respiratory and Critical Care Medicine visar att registrering av hur organismerna som lever i lungorna förändras i typ och antal kan återspegla den krit
 Forskare identifierar en bakterie med anti-SARS-CoV-2-aktivitet in vitro:Dolosigranulum pigrum
Det svåra akuta respiratoriska syndromet coronavirus 2 (SARS-CoV-2) har infekterat över 173,3 miljoner människor världen över. Av dessa, en betydande minoritet har varit allvarlig eller kritisk, vilke
Forskare identifierar en bakterie med anti-SARS-CoV-2-aktivitet in vitro:Dolosigranulum pigrum
Det svåra akuta respiratoriska syndromet coronavirus 2 (SARS-CoV-2) har infekterat över 173,3 miljoner människor världen över. Av dessa, en betydande minoritet har varit allvarlig eller kritisk, vilke
 Ungt blod återställer vitalitet hos äldre
Bram Stokers Dracula överlevde på blod av unga tjejer. Nu har forskare funnit att det kan ha funnits en viss sanning i denna bisarra teori! Enligt en genetiker vid University College London Dame Lin
Ungt blod återställer vitalitet hos äldre
Bram Stokers Dracula överlevde på blod av unga tjejer. Nu har forskare funnit att det kan ha funnits en viss sanning i denna bisarra teori! Enligt en genetiker vid University College London Dame Lin