Seu estudo intitulado, “As tiopurinas ativam uma resposta de proteína antiviral desdobrada que bloqueia o acúmulo de glicoproteína viral no modelo de infecção de cultura celular, ”Foi publicado online como uma pré-impressão no site bioRxiv * .
Os pesquisadores explicaram que os vírus que estão envolvidos, como o coronavírus, possuem material genético que pode codificar proteínas de membrana que podem ser sintetizadas e modificadas no retículo endoplasmático (RE) antes de serem transportadas para as áreas de montagem das partes do vírion.
Se a capacidade de dobramento da proteína ER for superada por muitas partículas de vírion, há uma sobrecarga de proteínas desdobradas no ER. Isso desencadeia uma resposta de proteína não dobrada (UPR). Isso ativa o fator de transcrição-6 (ATF6), inositol que requer enzima-1 (IRE1) e retículo endoplasmático quinase semelhante a PKR (PERK). Eles podem sentir que o ER está sob estresse, e há, portanto, uma síntese de fatores de transcrição do zíper de leucina básico (bZIP).
Conforme o UPR é ativado, a capacidade de dobramento de proteínas do ER é aumentada. Isso também aciona a degradação associada ao ER (ERAD). Todas as proteínas que não são dobradas adequadamente são retiradas do ER e degradadas por meio do proteassoma 26S.
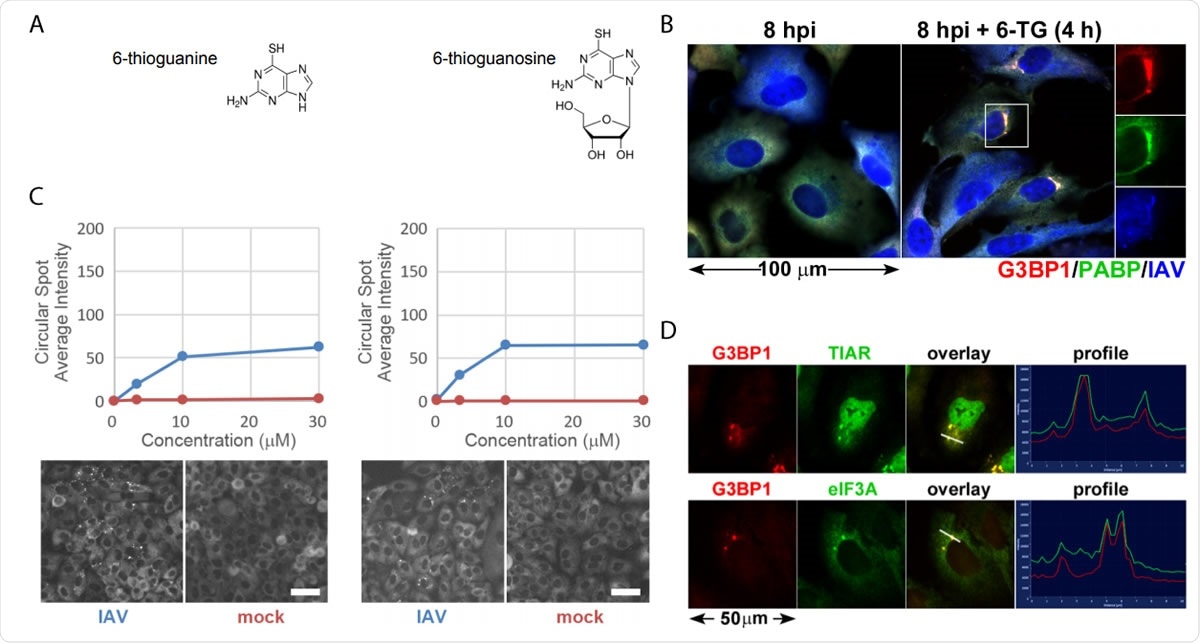 Os análogos de tiopurina 6-TG e 6-TGo induzem seletivamente grânulos de estresse em células infectadas com IAV. (A) Diagramas estruturais de pequenas moléculas identificadas na tela. (B) Quantificação da formação de focos de EGFP-G3BP em células infectadas com IAV-Udorn (azul) ou falsas (vermelho) tratadas com doses crescentes de 6-TG e 6-TGo (topo) e imagens representativas de Cellomics do canal EGFP das células tratadas com 6-TG e 6-TGo 30 µM (parte inferior). A 4 hpi, as células foram tratadas com 0, 1, Doses de 10 e 30 uM de análogos de tiopurina 6-tioguanina (6- TG) ou 6-tioguanosina (6-TGo). A 8 hpi, as células foram fixadas e coradas com Hoeschst 33342. A captura de imagem automatizada foi realizada usando um leitor Cellomics Arrayscan VTI HCS. 15 imagens foram capturadas para cada poço e a intensidade média do ponto EGFP-G3BP1 foi calculada. (C) As células A549 foram infectadas com IAV-CA / 07 em um MOI de 1. Em 4 hpi, as células foram tratadas com 6-TG ou tratadas de forma simulada. A 8 hpi, as células foram fixadas e imunocoradas com anticorpos direcionados às proteínas marcadoras de grânulos de estresse G3BP1 (vermelho), PABP (verde) e um anticorpo policlonal IAV (azul) que detecta antígenos de NP, M1, e HA, seguido de coloração com anticorpos secundários conjugados com Alexa. (D) As células A549 foram infectadas com IAV-CA / 07 em um MOI de 1. Em 4 hpi, as células foram tratadas com 6-TG (10 µM). A 8 hpi, as células foram fixadas e imunocoradas com anticorpos direcionados às proteínas marcadoras de grânulos de estresse G3BP1 (vermelho), TIAR (verde) e eIF3A (verde), seguido de coloração com anticorpos secundários conjugados com Alexa. Imagens capturadas em um microscópio fluorescente Zeiss Axioimager Z2. Imagens representativas mostradas. As barras de escala representam 20 µm.
Os análogos de tiopurina 6-TG e 6-TGo induzem seletivamente grânulos de estresse em células infectadas com IAV. (A) Diagramas estruturais de pequenas moléculas identificadas na tela. (B) Quantificação da formação de focos de EGFP-G3BP em células infectadas com IAV-Udorn (azul) ou falsas (vermelho) tratadas com doses crescentes de 6-TG e 6-TGo (topo) e imagens representativas de Cellomics do canal EGFP das células tratadas com 6-TG e 6-TGo 30 µM (parte inferior). A 4 hpi, as células foram tratadas com 0, 1, Doses de 10 e 30 uM de análogos de tiopurina 6-tioguanina (6- TG) ou 6-tioguanosina (6-TGo). A 8 hpi, as células foram fixadas e coradas com Hoeschst 33342. A captura de imagem automatizada foi realizada usando um leitor Cellomics Arrayscan VTI HCS. 15 imagens foram capturadas para cada poço e a intensidade média do ponto EGFP-G3BP1 foi calculada. (C) As células A549 foram infectadas com IAV-CA / 07 em um MOI de 1. Em 4 hpi, as células foram tratadas com 6-TG ou tratadas de forma simulada. A 8 hpi, as células foram fixadas e imunocoradas com anticorpos direcionados às proteínas marcadoras de grânulos de estresse G3BP1 (vermelho), PABP (verde) e um anticorpo policlonal IAV (azul) que detecta antígenos de NP, M1, e HA, seguido de coloração com anticorpos secundários conjugados com Alexa. (D) As células A549 foram infectadas com IAV-CA / 07 em um MOI de 1. Em 4 hpi, as células foram tratadas com 6-TG (10 µM). A 8 hpi, as células foram fixadas e imunocoradas com anticorpos direcionados às proteínas marcadoras de grânulos de estresse G3BP1 (vermelho), TIAR (verde) e eIF3A (verde), seguido de coloração com anticorpos secundários conjugados com Alexa. Imagens capturadas em um microscópio fluorescente Zeiss Axioimager Z2. Imagens representativas mostradas. As barras de escala representam 20 µm. Quando a partícula do vírus invade uma célula, ele tenta se replicar rápido, e isso onera o pronto-socorro. O vírus libera explosões de glicoproteínas que sobrecarregam o ER. O vírus, Contudo, é capaz de contornar o UPR e promove uma replicação eficiente.
O IAV pode codificar três proteínas de membrana integral:hemaglutinina (HA), neuraminidase (NA), e proteína da matriz 2 (M2). Enquanto a replicação do IAV causa ativação seletiva do UPR, mecanismos específicos podem ativar o UPR, mas depois contorná-lo para promover a replicação viral eficaz. A equipe explica que os efeitos das proteínas NA e M2 na UPR não são claros, mas HA pode promover UPR.
Vários coronavírus (CoVs) podem ativar o UPR. Isso inclui o “vírus da bronquite infecciosa (IBV), vírus da hepatite de camundongo (MHV), vírus da gastroenterite transmissível (TGEV), coronavírus humano (HCoV) -OC43, e SARS-CoV-1. ” Toda a sequência genética, Contudo, não reage de forma semelhante à replicação do CoV.
A equipe identificou dois análogos de tiopurina aprovados pela FDA, chamados “6-tioguanina (6-TG) e 6-tioguanosina (6-TGo)”. Descobriu-se que estes bloqueavam a replicação de IAV e HCoV-OC43 quando sua dose era aumentada de maneira gradativa.
Pateamine A e Silvestrol foram testados anteriormente. Essas duas tiopurinas, Contudo, foram encontrados para interromper o processo de acúmulo de glicoproteínas virais que poderiam ativar o UPR. Nas células que foram tratadas com 6-TG, a síntese da glicoproteína viral poderia ser parcialmente restaurada pela inibição química da UPR.
As proteínas CoV Spike (S) que são expressas na superfície do vírus mostraram ativação UPR. A proteína S do novo coronavírus ou SARS-CoV-2 S também causou a ativação de UPR. 6-TG inibiu o acúmulo de S0 de comprimento total ou proteínas de fusão S2 clivadas por furina, eles notaram. Não afetou o ectodomínio S1. 6-TG poderia induzir UPR que acelera a renovação mediada por ERAD de glicoproteínas S0 e S2 ancoradas na membrana, a equipe encontrou.
Os pesquisadores experimentaram e descobriram que um composto quimicamente semelhante tiopurina 6-mercaptopurina (6-MP) teve pouco efeito sobre a UPR e não afetou a replicação do IAV HCoV-OC43.
Ponderando sobre o mecanismo de indução de UPR pelos compostos de tiopurina 6-TG e 6-TGo, a equipe escreveu que esses efeitos não são provavelmente mediados pela incorporação de 6-TG no DNA ou RNA por vários motivos. A primeira razão é que o estresse associado à replicação viral não induz especificamente UPR. A segunda razão é que, entre as proteínas virais, o acúmulo de glicoproteínas e seu processamento foram interrompidos seletivamente. A terceira razão foi que os níveis de RNA mensageiro de HA e NA no IAV não foram significativamente afetados. 6-MP, por outro lado, pode ser convertido em trifosfato de 6-tioguanosina, mas não induziu UPR e não teve efeitos nas glicoproteínas IAV ou na replicação de OC43.
A equipe escreveu que seus dados revelam que “as moléculas indutoras de UPR podem ser antivirais direcionados ao hospedeiro eficazes contra vírus que dependem de processos ER para suportar uma replicação eficiente”. A indução de UPR por 6-TG e 6-TGo, portanto, poderia ser um novo método pelo qual um mecanismo antiviral poderia ser acionado pela própria célula hospedeira. Este tem sido um mecanismo de ação único não reconhecido anteriormente, a equipe escreveu.
Eles escreveram em conclusão, “... esses dados indicam que 6-TG e 6-TGo são antivirais direcionados ao hospedeiro eficazes que desencadeiam o UPR e interrompem o acúmulo de glicoproteínas virais.”
medRxiv publica relatórios científicos preliminares que não são revisados por pares e, Portanto, não deve ser considerado conclusivo, orientar a prática clínica / comportamento relacionado à saúde, ou tratadas como informações estabelecidas.
 Os bacteriófagos podem tratar E. coli sem danificar o intestino,
Os bacteriófagos podem tratar E. coli sem danificar o intestino,
 O microbioma intestinal muda com o cozimento de alimentos vegetais,
O microbioma intestinal muda com o cozimento de alimentos vegetais,
 Pessoas com sintomas de SII provavelmente têm baixos níveis de vitamina D,
Pessoas com sintomas de SII provavelmente têm baixos níveis de vitamina D,
 Os pesquisadores esperam que um exame de sangue que diagnostique com precisão a fibromialgia esteja disponível em cinco anos
Os pesquisadores esperam que um exame de sangue que diagnostique com precisão a fibromialgia esteja disponível em cinco anos
 Qual é o problema com a hepatite C?
Qual é o problema com a hepatite C?
 Micróbios intestinais podem estar ligados à depressão
Micróbios intestinais podem estar ligados à depressão
 Os probióticos podem ajudar a conter a desnutrição nas próximas duas décadas,
diz Bill Gates Probióticos ou bactérias boas têm se mostrado promissores no potencial de manter um intestino saudável. Muitos estudos forneceram evidências sobre os benefícios dos probióticos para a s
Os probióticos podem ajudar a conter a desnutrição nas próximas duas décadas,
diz Bill Gates Probióticos ou bactérias boas têm se mostrado promissores no potencial de manter um intestino saudável. Muitos estudos forneceram evidências sobre os benefícios dos probióticos para a s
 Microbiomas de primatas antigos podem fornecer mais informações sobre o desenvolvimento humano
Microbiomas humanos antigos estão sob o microscópio pelo que dizem aos cientistas sobre as pessoas de muito tempo atrás. Um novo estudo publicado na revista Fronteiras em Ecologia e Evolução em feve
Microbiomas de primatas antigos podem fornecer mais informações sobre o desenvolvimento humano
Microbiomas humanos antigos estão sob o microscópio pelo que dizem aos cientistas sobre as pessoas de muito tempo atrás. Um novo estudo publicado na revista Fronteiras em Ecologia e Evolução em feve
 Aumento dos riscos de biodefesa representados pela biologia sintética
Um estudo encomendado pelo Departamento de Defesa dos Estados Unidos descobriu que existem várias ferramentas de engenharia genética que podem ser usadas para desenvolver armas biológicas em um curto
Aumento dos riscos de biodefesa representados pela biologia sintética
Um estudo encomendado pelo Departamento de Defesa dos Estados Unidos descobriu que existem várias ferramentas de engenharia genética que podem ser usadas para desenvolver armas biológicas em um curto