Ud over de ofte omtalte BRCA-genmutationer er der et betydeligt antal andre arvelige genmutationer, der øger risikoen for at udvikle brystkræft. Faktisk menes det, at mutationer i over 100 gener bidrager til risikoen, og antallet af ikke-BRCA-genmutationer, der øger risikoen for brystkræft, forventes at vokse i takt med, at vores viden om kræftens genetik øges.
Ud over BRCA1- og BRCA2-genmutationer inkluderer nogle af disse mutationer i ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 og mere. Lad os se på, hvor vigtige disse ikke-BRCA1/BRCA2-mutationer er i familiær brystkræft, og nogle af karakteristikaene ved dem, der er mere almindeligt forekommende.
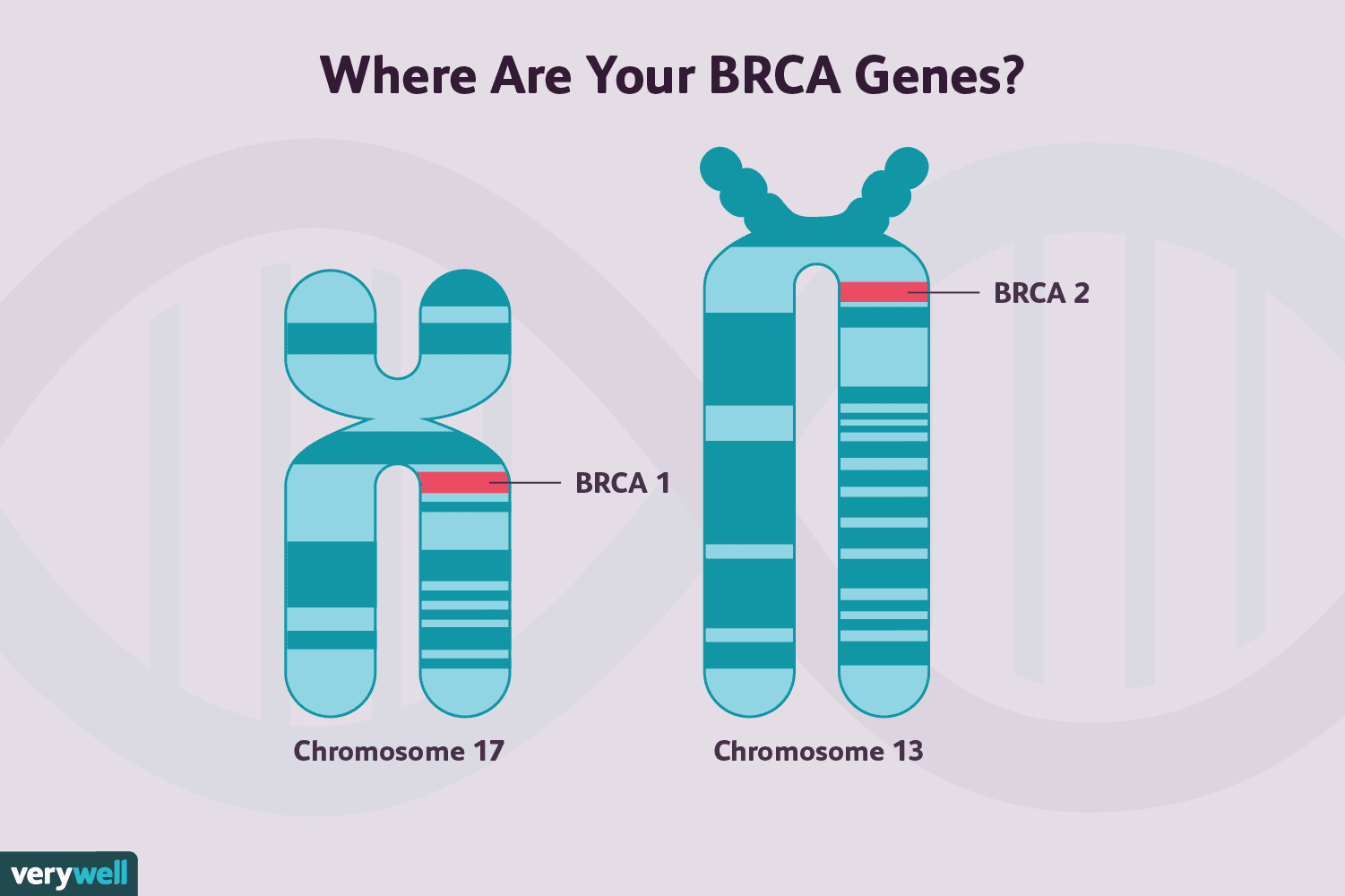
Det menes i øjeblikket, at 5 % til 10 % af brystkræfttilfældene er genetiske eller familiære ( selvom dette tal kan ændre sig, efterhånden som vi lærer mere), men ikke alle disse kræftformer skyldes BRCA-mutationer.
Højst 29 % (og sandsynligvis meget færre) arvelige brystkræfttilfælde tester positivt for BRCA1- eller BRCA2-genmutationer, og mange mennesker fortsætter med at teste for de andre kendte genetiske ændringer.
Eftersom videnskaben bag arvelig kræft er meget angstfremkaldende, for ikke at tale om forvirrende og ufuldstændig, er det nyttigt at begynde med at tale om biologien af genmutationer, og hvordan disse ændringer i DNA spiller en rolle i udviklingen af kræft.
Når man taler om mutationer, er det vigtigt at skelne mellem arvelige og erhvervede genmutationer.
Erhvervede eller somatiske genmutationer har fået stor opmærksomhed i de senere år, da disse mutationer forårsager ændringer, der driver væksten af kræft. Målrettede terapier, lægemidler, der er rettet mod specifikke veje relateret til disse ændringer, har væsentligt forbedret behandlingen af nogle kræftformer, såsom lungekræft.
Erhvervede mutationer er dog ikke til stede fra fødslen, men dannes snarere tid efter fødslen i færd med at en celle bliver til en kræftcelle. Disse mutationer påvirker kun nogle celler i kroppen. De er ikke arvet fra en forælder, men "erhvervet", da DNA'et i celler udsættes for skader fra miljøet eller som et resultat af kroppens normale metaboliske processer.
Narvede eller kimlinjemutationer er derimod genetiske ændringer, som mennesker er født med, og som er gået i arv fra en eller begge forældre. Disse mutationer påvirker alle kroppens celler. Det er disse arvelige mutationer (og andre genetiske ændringer), der kan øge chancen for, at en person udvikler kræft, og er årsag til, hvad der er kendt som arvelig eller familiær brystkræft.
Arvelige (kimlinje) vs. erhvervede (somatiske) genmutationerMange mennesker undrer sig over, hvordan præcis et unormalt gen eller kombinationer af gener kan føre til brystkræft , og en kort diskussion af biologien er nyttig til at forstå mange af spørgsmålene, såsom hvorfor ikke alle, der har disse mutationer, udvikler kræft.
Vores DNA er en plan eller kode, der bruges til at fremstille proteiner. Når kortet eller koden er forkert (såsom "bogstaverne" i et bestemt gen), giver det de forkerte anvisninger til at syntetisere et protein. Det unormale protein er så ude af stand til at udføre sit sædvanlige arbejde. Ikke alle genmutationer øger risikoen for kræft, og det gør de fleste faktisk ikke. Mutationer i gener, der er ansvarlige for vækst og deling af celler, eller "drivermutationer", er det, der driver væksten af kræftformer. Der er to hovedtyper af gener, som, når de muteres, kan føre til ukontrolleret vækst kendt som cancer:onkogener og tumorsuppressorgener.
Adskillige af generne forbundet med en højere risiko for brystkræft er tumorsuppressorgener. Disse gener koder for proteiner, der fungerer til at reparere skader på DNA i celler (skade fra toksiner i miljøet eller de normale metaboliske processer i celler), tjener til at eliminere celler, der ikke kan repareres, eller regulere vækst på andre måder. Generne BRCA1 og BRCA2 er tumorsuppressorgener.
Mange af disse gener er autosomalt recessive, hvilket betyder, at hver person arver en kopi af gen fra hver forælder, og begge kopier skal muteres for at øge kræftrisikoen. Forenklet betyder dette, at en kombination af genetiske og miljømæssige faktorer (en erhvervet mutation i det andet gen) skal virke sammen for at resultere i, at kræft udvikles. Derudover skal der normalt forekomme flere mutationer for at en celle kan blive en kræftcelle.
Hvad det vil sige at have en genetisk disposition for kræftIkke alle genmutationer eller genetiske ændringer øger risikoen for brystkræft i samme grad , og dette er et vigtigt koncept for alle, der overvejer genetisk testning, især da mange mennesker har hørt om den meget høje risiko, som BRCA-mutationer giver. Gengennemtrængning er defineret som andelen af mennesker med en mutation, der vil opleve tilstanden (i dette tilfælde udvikle brystkræft).
For nogle mutationer er risikoen for brystkræft meget høj. For andre kan risikoen kun øges med en faktor 1,5. Dette er vigtigt at forstå, når man taler om mulige forebyggende muligheder.
Et andet vigtigt koncept, der er vigtigt for at forstå genetik og kræft, selvom det er for komplekst til at udforske i detaljer her, er epigenetik. Vi har erfaret, at ændringer i DNA, der ikke involverer ændringer i baseparrene (nukleotider) eller de "bogstaver", der koder for et protein, kan være lige så vigtige i udviklingen af kræft. Med andre ord, i stedet for strukturelle ændringer i DNA's rygrad, kan der være molekylære ændringer, der ændrer, hvordan budskabet læses eller udtrykkes.
BRCA-genmutationer er den mest kendte genetiske abnormitet forbundet med brystkræft, men det er været klart, at der er kvinder, der er disponerede for brystkræft baseret på deres familiehistorie, som tester negativt.
En undersøgelse fra 2017 viste, at BRCA-mutationer kun udgjorde 9 % til 29 % af arvelige brystkræft. Selv når der blev testet for yderligere 20 til 40 kendte mutationer, testede kun 4% til 11% af kvinderne positive. Med andre ord testede 64 % til 86 % af kvinder, der mistænkes for at have arvelig brystkræft, negative for både BRCA-mutationer og 20 til 40 andre.
Vores viden om genmutationer, der øger risikoen for brystkræft, er stadig ufuldstændig, men vi har nu ved, at der er mindst 72 genmutationer forbundet med arvelig brystkræft. Disse mutationer (og andre endnu uopdagede) menes at være ansvarlige for de 70 % til 90 % af arvelige brystkræftformer, der tester negativt for BRCA-genmutationer. Akronymet BRCAX er blevet opfundet for at beskrive disse andre mutationer, der står for ikke-BRCA1- eller BRCA2-relateret familiær brystkræft.
72 Genetiske mutationer knyttet til arvelig brystkræftDe genetiske abnormiteter nedenfor er forskellige i deres hyppighed, mængden af risiko forbundet med, hvilken type brystkræft de er forbundet med, og andre kræftformer forbundet med mutationerne.
De fleste af disse brystkræftformer ligner hinanden i karakteristika (såsom kræfttype, østrogen- receptorstatus og HER2-status) til ikke-arvelige eller sporadiske brystkræftformer, men der er undtagelser. For eksempel er nogle mutationer stærkere forbundet med triple-negativ brystkræft, herunder mutationer iBARD1 , BRCA1 , BRCA2 , PALB2 , og RAD51D .
Ikke alle mennesker, der har følgende genmutationer, er ens. Generelt kan der være hundredvis af måder, hvorpå disse gener muteres. I nogle tilfælde vil genet producere proteiner, der undertrykker tumorvækst, men proteinerne vil ikke fungere så godt som det normale protein. Med andre mutationer produceres proteinet muligvis slet ikke.
BRCA 1-genmutationer og BRCA2-genmutationer er begge forbundet med en øget risiko for at udvikle brystkræft, såvel som nogle andre kræftformer, selvom de to adskiller sig noget i den risiko.
I gennemsnit vil 72 % af kvinder, der har BRCA1-mutationer og 69 %, der har muterede BRCA2-gener, udvikle brystkræft i en alder af 80 år.
Desuden kan de brystkræftformer, der er forbundet med disse mutationer, variere. Brystkræft hos kvinder, der har BRCA1-mutationer, er mere tilbøjelige til at være tredobbelt negative. Omkring 75 % er østrogenreceptornegative, og de er også mindre tilbøjelige til at være HER2-positive. De er også mere tilbøjelige til at have en højere tumorgrad. Brystkræft hos kvinder med BRCA2-mutationer ligner derimod kræft hos kvinder, der ikke er bærere af BRCA-genmutationer.
ATM-genet koder for proteiner, der hjælper med at kontrollere cellernes væksthastighed. De hjælper også med reparationen af beskadigede celler (celler, der har fået DNA-skade fra toksiner) ved at aktivere enzymer, der reparerer denne skade.
De, der har to kopier af det muterede gen, har et ualmindeligt autosomalt recessivt syndrom kendt som ataksi-telangiektasi. Med ataxia-telangiectasia øger de defekte proteiner ikke kun risikoen for kræft, men resulterer i, at nogle celler i hjernen dør for tidligt, hvilket resulterer i en progressiv neurodegenerativ lidelse.
Mennesker, der kun har én muteret kopi af genet (ca. 1 % af befolkningen) har en livstidsrisiko på 20 % til 60 % for at udvikle brystkræft.
Folk, der har denne mutation, menes at være disponeret for brystkræft i en tidlig alder , samt at udvikle bilateral brystkræft.
Brystkræftscreening med bryst-MRI anbefales fra 40 år, og kvinder kan ønske at overveje forebyggende mastektomi. Mennesker med ét muteret ATM-gen ser ud til også at være disponeret for kræft i skjoldbruskkirtlen og bugspytkirtlen og er mere følsomme over for stråling.
Mutationer i PALB2-genet er også en vigtig årsag til arvelig brystkræft. Genet PALB2 koder for et protein, der arbejder sammen med BRCA2-proteinet for at reparere beskadiget DNA i celler. Samlet set er livstidsrisikoen for brystkræft med en PALB2-mutation så høj som 58 %, selvom denne kan variere efter alder. Risikoen er 8 gange til 9 gange gennemsnittet for kvinder under 40 år, men omkring 5 gange gennemsnittet for kvinder over 60 år.
Blandt dem, der bærer en kopi af genet, vil 14 % udvikle brystkræft ved 50 års alderen og 35 % ved 70 års alderen (mindre end med BRCA-mutationer).
Folk, der har en PALB2-mutation og udvikler brystkræft, kan have en højere risiko for at dø fra sygdommen.
Folk, der arver 2 kopier af det muterede PALB2-gen, har en type Fanconi-anæmi karakteriseret ved ved meget lave antal røde blodlegemer, hvide blodlegemer og blodplader.
CHEK2-genet koder for et protein, der aktiveres, når der sker skade på DNA. Det aktiverer også andre gener involveret i cellereparation.
Livstidsrisici for bærere af CHEK2 trunkerende mutationer er 20 % for en kvinde uden berørt slægtning, 28 % for en kvinde med én andengradsslægtning berørt, 34 % for en kvinde med én førstegradsslægtning berørt, og 44 % for en kvinde med både en første- og andengradsslægtning berørt.
For både mænd og kvinder øger genet også risikoen for tyktarmskræft og ikke -Hodgkins lymfom.
Mutationer i CDH1 forårsager en tilstand kendt som arvelig gastrisk cancersyndrom.
Mennesker, der arver dette gen, har en livstidsrisiko på op til 80 % for at udvikle mavekræft og op til 52 % for at udvikle lobulær brystkræft.
Genet koder for et protein (epitelial cadherin), der hjælper celler med at klæbe til hinanden (en af forskellene mellem kræftceller og normale celler er, at kræftceller mangler disse adhæsionskemikalier, der får dem til at klæbe). Kræft hos mennesker, der arver denne mutation, er mere tilbøjelige til at metastasere.
Mutationer i PTEN-genet er en af de mere almindelige tumorsuppressorgenmutationer. Genet koder for proteiner, der regulerer cellernes vækst, og hjælper også celler med at holde sammen.
Mutationer i genet ser ud til at øge risikoen for, at kræftceller brækker af fra en tumor og metastasering. PTEN er forbundet med et syndrom kaldet PTEN hamartoma tumor syndrom såvel som Cowden syndrom.
Kvinder, der bærer en PTEN-mutation, har en livstidsrisiko for at udvikle brystkræft på op til 85 % og har også en øget risiko for godartede brystforandringer såsom fibrocystisk sygdom, adenose og intraduktal papillomatose.
Mutationerne er også forbundet med en øget risiko for livmoderkræft (og godartede uterusfibromer) ), skjoldbruskkirtelkræft, tyktarmskræft, melanom og prostatacancer.
Ikke-kræftrelaterede symptomer omfatter store hoveder (makrocefali) og tendensen til at dannes godartede tumorer kendt som hamartomer.
Mutationer i STK11 er forbundet med en genetisk tilstand kendt som Peutz-Jegher syndrom. STK11 er et tumorsuppressorgen involveret i cellevækst.
Ud over en øget risiko for brystkræft (med en livstidsrisiko på op til 50%), medfører syndromet en øget risiko for mange kræftformer, hvoraf nogle omfatter tyktarmskræft, bugspytkirtelkræft, mavekræft, ovariecancer, lungekræft, livmoderkræft og meget mere.
Ikke-kræftrelaterede tilstande forbundet med mutationen omfatter ikke-cancerøse polypper i fordøjelseskanalen og urinveje, fregner i ansigtet og indersiden af munden med mere. Brystkræftscreening anbefales ofte til kvinder, der begynder i 20'erne, og ofte med MR med eller uden mammografi.
TP53-genet koder for proteiner, der standser væksten af unormale celler.
Disse mutationer er ekstremt almindelige i cancer, mederhvervede mutationer i p53-genet findes i omkring 50 % af kræfttilfældene.
Arvelige mutationer er mindre almindelige og forbundet med tilstande kendt som Li-Fraumeni syndrom, eller Li-Fraumeni-lignende syndrom (der har en lavere kræftrisiko). Størstedelen af mennesker, der arver mutationen, udvikler kræft i en alder af 60 år, og er ud over brystkræft tilbøjelige til at udvikle knoglekræft, binyrekræft, bugspytkirtelkræft, tyktarmskræft, leverkræft, hjernetumorer, leukæmi og meget mere. Det er ikke ualmindeligt, at mennesker med mutationen udvikler mere end én primær cancer.
Arvede mutationer i p53-genet menes at udgøre omkring 1 % af tilfældene af arvelig brystkræft. Brystkræft, der er forbundet med mutationen, er ofte HER2-positive og har en høj tumorgrad.
Lynch syndrom eller arvelig non-polypose kolorektal cancer er forbundet med mutationer i flere forskellige gener inklusive PMS2, MLH1, MSH2, MSH6 og EPCAM.
Især PMS2 har været forbundet med dobbelt så stor risiko for brystkræft. Genet fungerer som et tumorsuppressorgen, der koder for et protein, der reparerer beskadiget DNA.
Ud over brystkræft medfører disse mutationer en høj risiko for kræft i tyktarmen , æggestok, livmoder, mave, lever, galdeblære, tyndtarm, nyre og hjerne.
Der er adskillige andre genmutationer forbundet med en øget risiko for at udvikle brystkræft, og det forventes, at mere vil blive opdaget i den nærmeste fremtid. Nogle af disse omfatter:
På nuværende tidspunkt er test tilgængelig for BRCA-genmutationer såvel som mutationer ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B og TP53, hvor dette område forventes at udvide sig dramatisk i den nærmeste fremtid.
At have disse test tilgængelige, rejser dog mange spørgsmål. Hvem kan for eksempel have arvelig brystkræft, og hvem bør testes? Hvad skal du gøre, hvis du tester positiv for et af disse gener?
Ideelt set bør enhver test kun udføres med vejledning og hjælp fra en genetisk rådgiver . Det er der to grunde til.
Den ene er, at det kan være ødelæggende at lære, at du bærer på en mutation, der kan øges din risiko, og vejledningen fra en person, der er opmærksom på anbefalet styring og screening, er uvurderlig.
Som nævnt tidligere giver nogle mutationer en høj risiko og andre en meget lavere risiko. Nogle mutationer kan være mere bekymrende tidligere i livet (f.eks. i dine 20'ere), mens andre måske ikke kræver tidlig screening. En genetisk rådgiver kan hjælpe dig med at lære om, hvad der i øjeblikket anbefales med hensyn til screening for netop din mutation, mens du tager højde for eventuelle andre risikofaktorer, du måtte have.
Den anden grund til, at genetisk rådgivning er så vigtig, er, at du kan have en betydelig risiko for udvikler brystkræft, selvom dine test er negative. Der er meget endnu at lære, og en genetisk rådgiver kan hjælpe dig med at se på din familiehistorie for at se, om du kan bære en høj risiko på trods af negative tests, og planlægge screening i overensstemmelse hermed.
Genetisk test for brystkræftLigesom mennesker, der er blevet diagnosticeret med brystkræft, har brug for støtte, de, der bærer gener der øger risikoen har brug for støtte. Heldigvis er der organisationer, der fokuserer specifikt på at støtte mennesker i denne situation.
Én organisation, FORCE, som er et akronym for Facing Our Risk of Cancer Empowered, tilbyder en hjælpelinje, opslagstavle og information til dem, der står over for arvelig kræft.
Andre organisationer og støttefællesskaber er tilgængelige for at hjælpe folk med at klare de beslutninger, der er relateret til en diagnosticering af arvelig brystkræft.
Udtrykket "previvor" blev opfundet af FORCE for at beskrive mennesker, der overlever en disposition til brystkræft. Hvis det er den situation, du står i, er du ikke alene, og ved at bruge hashtagget #previvor kan du finde mange andre på Twitter og andre sociale medier.
Det kan være overvældende at lære om de mange forskellige genmutationer, der øger risikoen for brystkræft ud over BRCA-mutationer, men disse "andre" mutationer er af væsentlig betydning, vel vidende at BRCA-mutationer tegner sig for en relativ minoritet af familiær brystkræft. Samtidig er videnskaben, der ser på arvelig brystkræft, stadig i sin vorden, og der er meget at lære. Hvis du er bekymret for, at du måske har en mutation eller har erfaret, at du gør det, er det nyttigt at lære så meget, du kan. Arvelige kræftorganisationer såsom FORCE kan ikke kun give dig yderligere information, men kan hjælpe dig med at komme i kontakt med andre, der står over for en rejse med lignende spørgsmål og bekymringer.
 Den bedste SCD-diættag-teampartner:lavdosis Naltrexon?
Mens min læge og jeg forfinede min tarmheling fra cøliaki med SCD-diæten, fandt vi noget mærkeligt. I de sidste fem år, og selv før jeg blev diagnosticeret med cøliaki, har jeg konsekvent modtaget blo
Den bedste SCD-diættag-teampartner:lavdosis Naltrexon?
Mens min læge og jeg forfinede min tarmheling fra cøliaki med SCD-diæten, fandt vi noget mærkeligt. I de sidste fem år, og selv før jeg blev diagnosticeret med cøliaki, har jeg konsekvent modtaget blo
 Beskæftiger sig med irritabel tarmsyndrom
Irritabel tarmsyndrom (IBS) menes at påvirke alt fra 25 til 45 millioner amerikanere, mest kvinder fra slutningen af teenageårene til begyndelsen af 40erne. Tilstanden er en blanding af ubehag i m
Beskæftiger sig med irritabel tarmsyndrom
Irritabel tarmsyndrom (IBS) menes at påvirke alt fra 25 til 45 millioner amerikanere, mest kvinder fra slutningen af teenageårene til begyndelsen af 40erne. Tilstanden er en blanding af ubehag i m
 Nyt lægemiddel kan hjælpe med at behandle irritabel tyktarm
Seneste fordøjelsesnyt Når nyretransplantation mislykkes, er det bedst at prøve igen Lad ikke halsbrand ødelægge din feriefest Efterspørgslen efter levertransplantation stiger kraftigt Lavdosis CT-sc
Nyt lægemiddel kan hjælpe med at behandle irritabel tyktarm
Seneste fordøjelsesnyt Når nyretransplantation mislykkes, er det bedst at prøve igen Lad ikke halsbrand ødelægge din feriefest Efterspørgslen efter levertransplantation stiger kraftigt Lavdosis CT-sc