Naast de vaak besproken BRCA-genmutaties, zijn er een aanzienlijk aantal andere erfelijke genmutaties die het risico op het ontwikkelen van borstkanker verhogen. Er wordt zelfs gedacht dat mutaties in meer dan 100 genen bijdragen aan het risico, en het aantal niet-BRCA-genmutaties die het risico op borstkanker verhogen, zal naar verwachting toenemen naarmate onze kennis van de genetica van kanker toeneemt.
Naast BRCA1- en BRCA2-genmutaties, omvatten sommige hiervan mutaties in ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 en meer. Laten we eens kijken naar hoe belangrijk deze niet-BRCA1/BRCA2-mutaties zijn bij familiale borstkanker, en eens kijken naar de kenmerken van de vaker gevonden mutaties.
Momenteel wordt aangenomen dat 5% tot 10% van de borstkankers genetisch of familiaal is ( hoewel dit aantal kan veranderen naarmate we meer leren), maar niet al deze kankers zijn te wijten aan BRCA-mutaties.
Hoogstens 29% (en waarschijnlijk veel minder) erfelijke borstkankers testen positief op BRCA1- of BRCA2-genmutaties, en veel mensen zijn bezig met testen op de andere bekende genetische veranderingen.
Omdat de wetenschap achter erfelijke kanker zeer angstwekkend is, om nog maar te zwijgen van verwarrend en onvolledig, is het nuttig om te beginnen met te praten over de biologie van genmutaties en hoe deze veranderingen in DNA een rol spelen bij de ontwikkeling van kanker.
Als we het over mutaties hebben, is het belangrijk om onderscheid te maken tussen erfelijke en verworven genmutaties.
Verworven of somatische genmutaties hebben de afgelopen jaren veel aandacht gekregen, omdat deze mutaties veroorzaken veranderingen die de groei van kanker stimuleren. Gerichte therapieën, geneesmiddelen die zich richten op specifieke routes die verband houden met deze veranderingen, hebben de behandeling van sommige vormen van kanker, zoals longkanker, aanzienlijk verbeterd.
Verworven mutaties zijn echter niet vanaf de geboorte aanwezig, maar worden gevormd tijd na de geboorte in het proces van een cel die een kankercel wordt. Deze mutaties beïnvloeden slechts enkele cellen in het lichaam. Ze zijn niet geërfd van een ouder, maar eerder "verworven" omdat het DNA in cellen wordt blootgesteld aan schade door de omgeving of als gevolg van de normale metabolische processen van het lichaam.
Geërfde of kiembaanmutaties zijn daarentegen genetische veranderingen die mensen geboren met, en die zijn doorgegeven van een of beide ouders. Deze mutaties tasten alle cellen van het lichaam aan. Het zijn deze erfelijke mutaties (en andere genetische veranderingen) die de kans kunnen vergroten dat een persoon kanker krijgt en verantwoordelijk zijn voor wat bekend staat als erfelijke of familiale borstkanker.
Erfelijke (kiemlijn) versus verworven (somatische) genmutatiesVeel mensen vragen zich af hoe een abnormaal gen of combinaties van genen precies tot borstkanker kunnen leiden , en een korte bespreking van de biologie is nuttig om veel van de vragen te begrijpen, zoals waarom niet iedereen met deze mutaties kanker krijgt.
Ons DNA is een blauwdruk of code die wordt gebruikt om eiwitten te maken. Wanneer de kaart of code verkeerd is (zoals de "lettering" in een bepaald gen), geeft het de verkeerde aanwijzingen voor het synthetiseren van een eiwit. Het afwijkende eiwit kan dan zijn gebruikelijke werk niet meer doen. Niet alle genmutaties verhogen het risico op kanker, en in feite doen de meeste dat ook niet. Mutaties in genen die verantwoordelijk zijn voor de groei en deling van cellen, of "driver-mutaties" zijn de drijvende krachten achter de groei van kankers. Er zijn twee belangrijke soorten genen die, wanneer ze gemuteerd zijn, kunnen leiden tot ongecontroleerde groei, ook wel kanker genoemd:oncogenen en tumorsuppressorgenen.
Verschillende genen die geassocieerd zijn met een hoger risico op borstkanker zijn tumorsuppressorgenen. Deze genen coderen voor eiwitten die functioneren om schade aan het DNA in cellen te herstellen (schade door toxines in de omgeving of de normale metabolische processen in cellen), om cellen te elimineren die niet kunnen worden gerepareerd of om de groei op andere manieren te reguleren. De genen BRCA1 en BRCA2 zijn tumorsuppressorgenen.
Veel van deze genen zijn autosomaal recessief, wat betekent dat elke persoon één kopie van de gen van elke ouder, en beide kopieën moeten worden gemuteerd om het risico op kanker te vergroten. Simpel gezegd betekent dit dat een combinatie van genetische en omgevingsfactoren (een verworven mutatie in het andere gen) moet samenwerken om kanker te veroorzaken. Bovendien moeten er meestal meerdere mutaties optreden voordat een cel een kankercel kan worden.
Wat het betekent om een genetische aanleg voor kanker te hebben?Niet alle genmutaties of genetische veranderingen verhogen het risico op borstkanker in dezelfde mate , en dit is een belangrijk concept voor iedereen die genetische tests overweegt, vooral omdat veel mensen hebben gehoord van het zeer hoge risico dat BRCA-mutaties met zich meebrengen. Genpenetrantie wordt gedefinieerd als het percentage mensen met een mutatie die de aandoening zullen ervaren (in dit geval borstkanker ontwikkelen).
Voor sommige mutaties is het risico op borstkanker erg hoog. Voor anderen kan het risico slechts met een factor 1,5 worden verhoogd. Dit is belangrijk om te begrijpen als we het hebben over mogelijke preventieve opties.
Een ander belangrijk concept dat belangrijk is voor het begrijpen van genetica en kanker, hoewel te complex om te onderzoeken in detail hier, is die van epigenetica. We hebben geleerd dat veranderingen in het DNA die geen veranderingen in de basenparen (nucleotiden) of de "letters" die coderen voor een eiwit met zich meebrengen, net zo belangrijk kunnen zijn bij de ontwikkeling van kanker. Met andere woorden, in plaats van structurele veranderingen in de ruggengraat van DNA, kunnen er moleculaire veranderingen zijn die de manier waarop de boodschap wordt gelezen of uitgedrukt, veranderen.
BRCA-genmutaties zijn de meest bekende genetische afwijking die wordt geassocieerd met borstkanker, maar het is het was duidelijk dat er vrouwen zijn die vatbaar zijn voor borstkanker op basis van hun familiegeschiedenis, die negatief testen.
Een onderzoek uit 2017 wees uit dat BRCA-mutaties slechts 9% tot 29% van de erfelijke borstkankers. Zelfs wanneer er werd getest op nog eens 20 tot 40 bekende mutaties, testte slechts 4% tot 11% van de vrouwen positief. Met andere woorden, 64% tot 86% van de vrouwen waarvan wordt vermoed dat ze erfelijke borstkanker hebben, testte negatief voor zowel BRCA-mutaties als 20 tot 40 andere.
Onze kennis over genmutaties die het risico op borstkanker verhogen, is nog steeds onvolledig, maar we kunnen nu weet dat er minstens 72 genmutaties zijn die verband houden met erfelijke borstkanker. Deze mutaties (en andere die nog niet zijn ontdekt) worden verondersteld verantwoordelijk te zijn voor de 70% tot 90% van de erfelijke borstkankers die negatief testen op BRCA-genmutaties. Het acroniem BRCAX is bedacht om deze andere mutaties te beschrijven, wat staat voor niet-BRCA1- of BRCA2-gerelateerde familiale borstkanker.
72 genetische mutaties die verband houden met erfelijke borstkankerDe onderstaande genetische afwijkingen verschillen in frequentie, de hoeveelheid risico die ermee gepaard gaat, het type borstkanker waarmee ze verband houden en andere kankers die met de mutaties zijn geassocieerd.
De meeste van deze borstkankers zijn vergelijkbaar in kenmerken (zoals kankertype, oestrogeen- receptorstatus en HER2-status) tot niet-erfelijke of sporadische borstkankers, maar er zijn uitzonderingen. Sommige mutaties zijn bijvoorbeeld sterker geassocieerd met triple-negatieve borstkanker, waaronder mutaties inBARD1 , BRCA1 , BRCA2 , PALB2 , en RAD51D .
Niet alle mensen met de volgende genmutaties zijn hetzelfde. Over het algemeen kunnen er honderden manieren zijn waarop deze genen worden gemuteerd. In sommige gevallen zal het gen eiwitten produceren die de tumorgroei onderdrukken, maar de eiwitten zullen niet zo goed functioneren als het normale eiwit. Bij andere mutaties wordt het eiwit mogelijk helemaal niet geproduceerd.
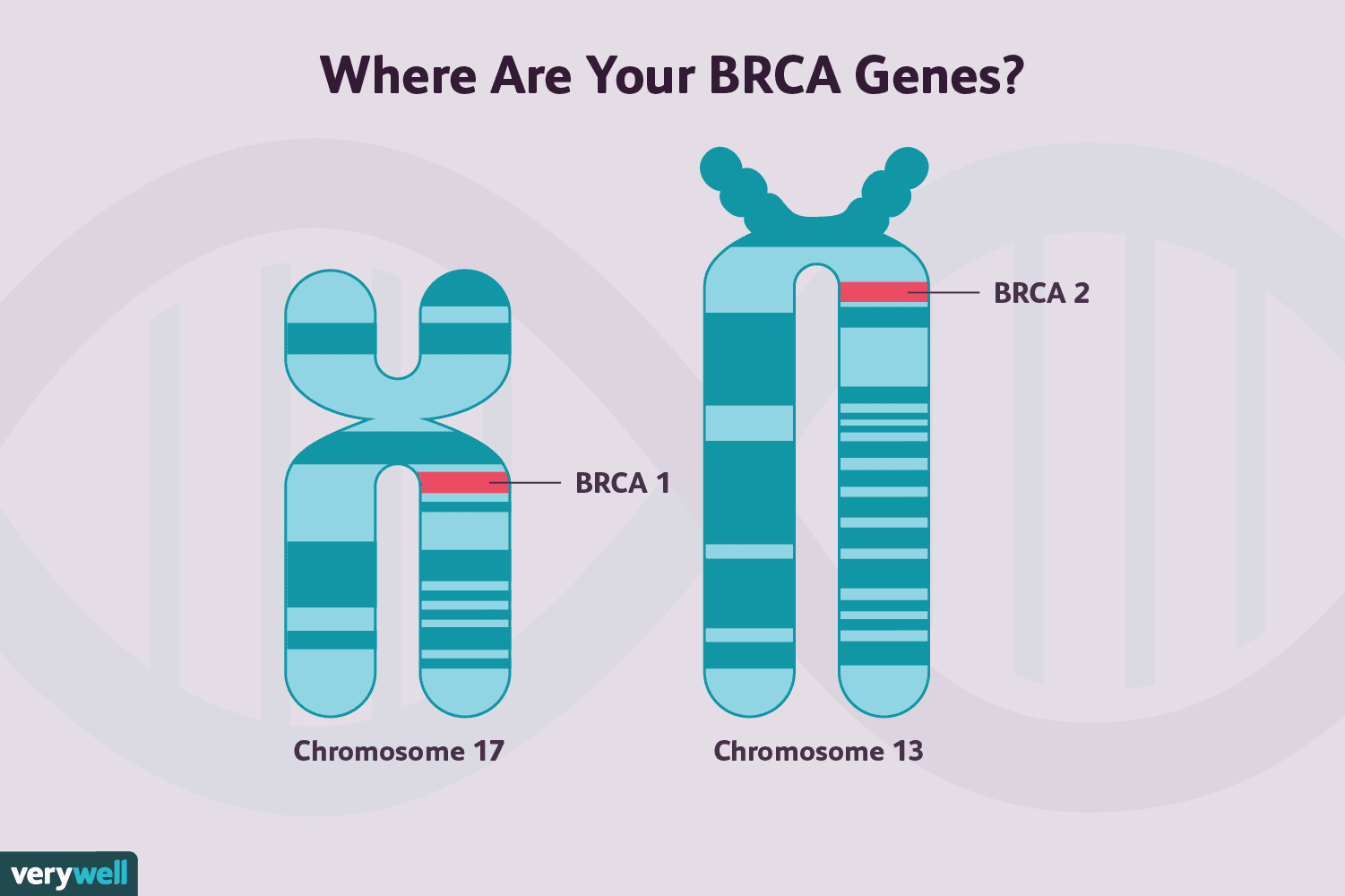
BRCA 1-genmutaties en BRCA2-genmutaties zijn beide geassocieerd met een verhoogd risico op het ontwikkelen van borstkanker, evenals enkele andere vormen van kanker, hoewel de twee wat dat risico betreft enigszins verschillen.
Gemiddeld zal 72% van de vrouwen met BRCA1-mutaties en 69% met gemuteerde BRCA2-genen op 80-jarige leeftijd borstkanker krijgen.
Bovendien kunnen de borstkankers die met deze mutaties gepaard gaan, verschillen. Borstkanker bij vrouwen met BRCA1-mutaties is meer kans drievoudig negatief te zijn. Ongeveer 75% is oestrogeenreceptor-negatief en het is ook minder waarschijnlijk dat ze HER2-positief zijn. Ze hebben ook meer kans op een hogere tumorgraad. Borstkankers bij vrouwen met BRCA2-mutaties zijn daarentegen vergelijkbaar met kankers bij vrouwen die geen BRCA-genmutatiedragers zijn.
Het ATM-gen codeert voor eiwitten die helpen de groeisnelheid van cellen te regelen. Ze helpen ook bij het herstel van beschadigde cellen (cellen die DNA-schade hebben opgelopen door toxines) door enzymen te activeren die deze schade herstellen.
Degenen die twee exemplaren van het gemuteerde gen hebben, hebben een ongewoon autosomaal recessief syndroom dat bekend staat als ataxie-telangiëctasie. Bij ataxie-telangiëctasie verhogen de defecte eiwitten niet alleen het risico op kanker, maar leiden ze er ook toe dat sommige cellen in de hersenen te snel afsterven, wat resulteert in een progressieve neurodegeneratieve aandoening.
Mensen die slechts één gemuteerde kopie van het gen hebben (ongeveer 1% van de bevolking) hebben een levenslange kans van 20% tot 60% om borstkanker te krijgen.
Van mensen met deze mutatie wordt aangenomen dat ze op jonge leeftijd aanleg hebben voor borstkanker , evenals voor het ontwikkelen van bilaterale borstkanker.
Borstkankerscreening met borst-MRI's wordt aanbevolen vanaf de leeftijd van 40 jaar, en vrouwen kunnen dat wensen preventieve borstamputaties te overwegen. Mensen met één gemuteerd ATM-gen lijken ook vatbaar te zijn voor schildklier- en pancreaskanker en zijn gevoeliger voor straling.
Mutaties in het PALB2-gen zijn ook een belangrijke oorzaak van erfelijke borstkanker. Het gen PALB2 codeert voor een eiwit dat samen met het BRCA2-eiwit werkt om beschadigd DNA in cellen te herstellen. Over het algemeen is het levenslange risico op borstkanker met een PALB2-mutatie maar liefst 58%, hoewel dit per leeftijd kan verschillen. Het risico is 8 tot 9 keer gemiddeld voor vrouwen jonger dan 40 jaar, maar ongeveer 5 keer gemiddeld voor vrouwen ouder dan 60 jaar.
Van degenen die één kopie van het gen dragen, zal 14% borstkanker krijgen op de leeftijd van 50 en 35% op de leeftijd van 70 (minder dan bij BRCA-mutaties).
Mensen die een PALB2-mutatie hebben en borstkanker krijgen, lopen mogelijk een hoger risico om te overlijden van de ziekte.
Mensen die 2 exemplaren van het gemuteerde PALB2-gen erven, hebben een type Fanconi-anemie die wordt gekarakteriseerd door zeer lage aantallen rode bloedcellen, witte bloedcellen en bloedplaatjes.
Het CHEK2-gen codeert voor een eiwit dat wordt geactiveerd wanneer er schade aan het DNA optreedt. Het activeert ook andere genen die betrokken zijn bij celherstel.
De levenslange risico's voor dragers van CHEK2-afknottingen zijn 20% voor een vrouw zonder getroffen familielid, 28% voor een vrouw met een getroffen familielid in de tweede graad, 34% voor een vrouw met één getroffen familielid in de eerste graad en 44% voor een vrouw met zowel een eerste- als tweedegraads familielid.
Voor zowel mannen als vrouwen verhoogt het gen ook het risico op darmkanker en niet -Hodgkin-lymfoom.
Mutaties in CDH1 veroorzaken een aandoening die bekend staat als erfelijk maagkankersyndroom.
Mensen die dit gen erven, hebben een levenslang risico tot 80% voor het ontwikkelen van maagkanker en tot 52% voor het ontwikkelen van lobulaire borstkanker.
Het gen codeert voor een eiwit (epitheliale cadherine) dat ervoor zorgt dat cellen aan elkaar blijven plakken (een van de verschillen tussen kankercellen en normale cellen is dat kankercellen deze adhesiechemicaliën missen waardoor ze blijven plakken). Kankers bij mensen die deze mutatie erven, hebben meer kans op uitzaaiing.
Mutaties in het PTEN-gen zijn een van de meest voorkomende tumorsuppressorgenmutaties. Het gen codeert voor eiwitten die de groei van cellen reguleren en helpt cellen ook bij elkaar te blijven.
Mutaties in het gen lijken het risico te vergroten dat kankercellen afbreken van een tumor en metastaseren. PTEN wordt geassocieerd met een syndroom dat PTEN-hamartomatumorsyndroom wordt genoemd, evenals het syndroom van Cowden.
Vrouwen met een PTEN-mutatie hebben een levenslang risico op het ontwikkelen van borstkanker tot 85%, en hebben ook een verhoogd risico op goedaardige borstveranderingen zoals fibrocystische ziekte, adenose en intraductale papillomatose.
De mutaties houden ook verband met een verhoogd risico op baarmoederkanker (en goedaardige vleesbomen ), schildklierkanker, darmkanker, melanoom en prostaatkanker.
Niet-kankergerelateerde symptomen zijn onder meer een groot hoofd (macrocefalie) en de neiging om zich te vormen goedaardige tumoren bekend als hamartomen.
Mutaties in STK11 zijn geassocieerd met een genetische aandoening die bekend staat als het Peutz-Jegher-syndroom. STK11 is een tumorsuppressorgen dat betrokken is bij celgroei.
Naast een verhoogd risico op borstkanker (met een levenslang risico tot 50%), heeft het syndroom een verhoogd risico op vele vormen van kanker, waaronder darmkanker, alvleesklierkanker, maagkanker, eierstokkanker, longkanker, baarmoederkanker en meer.
Niet-kankergerelateerde aandoeningen die verband houden met de mutatie omvatten niet-kankerachtige poliepen in het spijsverteringskanaal en urinewegen, sproeten op het gezicht en de binnenkant van de mond, en meer. Borstkankerscreening wordt vaak aanbevolen voor vrouwen die beginnen in de twintig, en vaak met MRI met of zonder mammogrammen.
Het TP53-gen codeert voor eiwitten die de groei van abnormale cellen stoppen.
Deze mutaties komen zeer vaak voor bij kanker, met verworven mutaties in het p53-gen worden gevonden in ongeveer 50% van de kankers.
Erfelijke mutaties komen minder vaak voor en zijn geassocieerd met aandoeningen die bekend staan als het Li-Fraumeni-syndroom, of Li-Fraumeni-achtig syndroom (dat een lager risico op kanker heeft). De meerderheid van de mensen die de mutatie erven, ontwikkelt kanker op de leeftijd van 60 jaar en is naast borstkanker vatbaar voor het ontwikkelen van botkanker, bijnierkanker, alvleesklierkanker, darmkanker, leverkanker, hersentumoren, leukemie en meer. Het is niet ongebruikelijk dat mensen met de mutatie meer dan één primaire kanker ontwikkelen.
Er wordt aangenomen dat erfelijke mutaties in het p53-gen verantwoordelijk zijn voor ongeveer 1% van de gevallen van erfelijke borstkanker. Borstkankers die geassocieerd zijn met de mutatie zijn vaak HER2-positief en hebben een hoge tumorgraad.
Lynch-syndroom of erfelijke niet-polyposis colorectale kanker wordt geassocieerd met mutaties in verschillende genen inclusief PMS2, MLH1, MSH2, MSH6 en EPCAM.
Vooral PMS2 is in verband gebracht met een verdubbeling van het risico op borstkanker. Het gen functioneert als een tumorsuppressorgen, dat codeert voor een eiwit dat beschadigd DNA herstelt.
Naast borstkanker hebben deze mutaties een hoog risico op kanker van de dikke darm , eierstok, baarmoeder, maag, lever, galblaas, dunne darm, nier en hersenen.
Er zijn verschillende andere genmutaties die in verband worden gebracht met een verhoogd risico op het ontwikkelen van borstkanker, en de verwachting is dat er in de nabije toekomst meer zal worden ontdekt. Enkele hiervan zijn:
Op dit moment zijn testen beschikbaar voor zowel BRCA-genmutaties als mutaties ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B en TP53, en dit gebied zal naar verwachting in de nabije toekomst drastisch uitbreiden.
Het beschikbaar hebben van deze tests roept echter veel vragen op. Wie kan bijvoorbeeld erfelijke borstkanker hebben en wie moet er getest worden? Wat moet je doen als je positief test op een van deze genen?
Idealiter zouden alle testen alleen moeten worden gedaan onder begeleiding en hulp van een genetisch adviseur . Hier zijn twee redenen voor.
Een daarvan is dat het verwoestend kan zijn om te horen dat je een mutatie hebt die kan toenemen uw risico, en de begeleiding van iemand die op de hoogte is van aanbevolen beheer en screening is van onschatbare waarde.
Zoals eerder opgemerkt, geven sommige mutaties een hoog risico en andere een veel lager risico. Sommige mutaties kunnen eerder in het leven van groter belang zijn (bijvoorbeeld in de twintig), terwijl andere mogelijk geen vroege screening vereisen. Een genetisch adviseur kan u helpen te weten te komen wat momenteel wordt aanbevolen met betrekking tot screening op uw specifieke mutatie, terwijl hij rekening houdt met eventuele andere risicofactoren die u heeft.
De andere reden waarom genetische counseling zo belangrijk is, is dat u een aanzienlijk risico loopt op borstkanker ontwikkelen, zelfs als uw tests negatief zijn. Er is nog veel te leren, en een genetisch adviseur kan u helpen uw familiegeschiedenis te bekijken om te zien of u ondanks negatieve tests een hoog risico loopt, en dienovereenkomstig de screening te plannen.
Genetische tests voor borstkankerNet zoals mensen bij wie borstkanker is vastgesteld, ondersteuning nodig hebben, hebben degenen die genen dragen die het risico verhogen, hebben ondersteuning nodig. Gelukkig zijn er organisaties die zich specifiek richten op het ondersteunen van mensen in deze situatie.
Eén organisatie, FORCE, wat een acroniem is voor Facing Our Risk of Cancer Empowered, biedt een hulplijn, een prikbord en informatie voor mensen die te maken hebben met erfelijke kanker.
Andere organisaties en ondersteunende gemeenschappen zijn beschikbaar om mensen te helpen bij het nemen van beslissingen met betrekking tot een diagnose van erfelijke borstkanker.
De term "previvor" is bedacht door FORCE om mensen te beschrijven die een aanleg overleven aan borstkanker. Als dit de situatie is waarmee u wordt geconfronteerd, bent u niet de enige, en door de hashtag #previvor te gebruiken, kunt u vele anderen vinden op Twitter en andere sociale media.
Het kan overweldigend zijn om meer te weten te komen over de vele verschillende genmutaties die het risico op borstkanker verhogen verder dan BRCA-mutaties, maar deze "andere" mutaties zijn van aanzienlijk belang wetende dat BRCA-mutaties verantwoordelijk zijn voor een relatieve minderheid van familiale borstkankers. Tegelijkertijd staat de wetenschap naar erfelijke borstkanker nog in de kinderschoenen en valt er nog veel te leren. Als je je zorgen maakt dat je een mutatie hebt of hebt geleerd dat je die hebt, is het nuttig om zoveel mogelijk te leren. Erfelijke kankerorganisaties zoals FORCE kunnen u niet alleen meer informatie geven, maar kunnen u ook helpen in contact te komen met anderen die op een reis staan met soortgelijke vragen en zorgen.
 geneesmiddelen tegen maagzuur kunnen het risico op maaginfecties verhogen:onderzoek
Laatste spijsverteringsnieuws Als niertransplantatie mislukt, is opnieuw proberen het beste Laat maagzuur je vakantiefeest niet verpesten Vraag naar levertransplantatie stijgt sterk Lage dosis CT-sca
geneesmiddelen tegen maagzuur kunnen het risico op maaginfecties verhogen:onderzoek
Laatste spijsverteringsnieuws Als niertransplantatie mislukt, is opnieuw proberen het beste Laat maagzuur je vakantiefeest niet verpesten Vraag naar levertransplantatie stijgt sterk Lage dosis CT-sca
 Wat betekent het als je een hoge ALT hebt?
8 oorzaken van hoge ALT-waarden Hier zijn 8 mogelijke oorzaken van hoge ALT-niveaus in het lichaam, waaronder leverziekte, alcoholisme, zwaarlijvigheid, spieren schade, hartfalen en meer. De art
Wat betekent het als je een hoge ALT hebt?
8 oorzaken van hoge ALT-waarden Hier zijn 8 mogelijke oorzaken van hoge ALT-niveaus in het lichaam, waaronder leverziekte, alcoholisme, zwaarlijvigheid, spieren schade, hartfalen en meer. De art
 Heet kruisbroodje recept
Met het paasweekend voor de deur, wat is er leuker dan een partij van deze smakelijke Hot Cross Buns op te zwepen? Dit zijn van die lekkernijen waarvan je misschien niet had gedacht dat je ervan zou g
Heet kruisbroodje recept
Met het paasweekend voor de deur, wat is er leuker dan een partij van deze smakelijke Hot Cross Buns op te zwepen? Dit zijn van die lekkernijen waarvan je misschien niet had gedacht dat je ervan zou g