Kalder dette afslutningen på "en årtiers lang kontrovers", forskerne foreslår, at dette kan muliggøre stimulering af fostermikrobiomet i tilfælde af forventet for tidlig fødsel kan bidrage til at opnå en højere vækstrate samt forhindre flere infektionsrelaterede komplikationer ved for tidlig fødsel. Dette kan gøres let og hurtigt ved at modulere moderens tarmmikrobiom, siger forskerne.
Mikrober er til stede og blomstrer på alle overflader af kroppen, både inde og ude. Disse kan findes på huden, slimhinden i næsen, tarmens slimhinde, og inde i øret.
Tarmmikrobiomet refererer til hele samlingen af levende væsner i tarmlumen, om bakterier, svampe eller vira. Disse spiller en række væsentlige eller i det mindste vigtige roller i forskellige fysiologiske processer, og i sundheden hos tarmforingscellerne, der er ansvarlige for fordøjelse og absorption af forskellige næringsstoffer. Der er mange titalls billioner af enkeltbakterielle organismer i tarmmikrobiomet, og bakterier er flere end menneskelige celler i kroppen mindst 10 til 1. Visse typer ændringer i tarmmikrobiomet medfører fare for forskellige tilstande, såsom fedme, allergiske tilstande, astma og diabetes og autoimmun sygdom. Flere kræftformer er også blevet sporet til specifikke ændringer i tarmmikrobiomets egenskaber.
 Enterobacteriaceae, gramnegative stavformede bakterier, del af tarmmikrobiom og forårsagende midler til forskellige infektioner, 3D illustration. - Illustrationskredit:Kateryna Kon / Shutterstock
Enterobacteriaceae, gramnegative stavformede bakterier, del af tarmmikrobiom og forårsagende midler til forskellige infektioner, 3D illustration. - Illustrationskredit:Kateryna Kon / Shutterstock Tidligere tænkte man, at fosteret i livmoderen befinder sig i et sterilt miljø, og den første introduktion til bakteriel og andet mikrobielt liv kommer fra kontakt med moderens fødselskanal under fødslen, amning, og andre kontakter efter fødslen. Den første bevislinje for, at dette ikke er tilfældet, kom fra resultaterne af næste generations DNA-sekventering, der viste tilstedeværelsen af genetisk stof fra en række bakterier, der vides at kolonisere mennesker, i prøver fra moderkagen, fostervand, og meconium eller føtale afføring. Dette syntes at bevise, at mikrober er til stede i fostermiljøet allerede før fødslen. Typen og tidspunktet for en sådan eksponering er stadig ikke klar, og forskere ved stadig ikke, om de samme bakterier er til stede i spædbarnsmikrobiomet.
Den foreliggende undersøgelse undersøgte par af mødre og afkom i både mennesker og mus for at forsøge at løse spørgsmålet. Findes bakterierne i fosterlivet virkelig fra den periode i livet, eller er de forurenende stoffer fra moderens og andre miljøers side?
For at besvare dette, forskerne undersøgte typer og antal bakterier i moderens skede, placenta og afføring, med dem i barnets mund og mekonium. 10 mor-spædbarn-par hos mennesker (5 for tidligt fødte og 5 fuldtids) blev undersøgt på tidspunktet for kejsersnit i en steril operationsstue. Mikrobiomet i fosterlivet blev undersøgt ved hjælp af flere metoder, nemlig, sekventering af bakterielt DNA, fluorescens in situ hybridisering (FISH), og bakteriekultur.
Undersøgelsen viste, at mikroberne, der var isoleret fra livmoderen og moderkagen, var forskellige fra dem, der blev opnået fra fostermembranen og fra moderens fækale organismer. Imidlertid, de lignede dem, der blev dyrket fra skeden, spædbarnets mund og spædbarnets mekonium. Fostervandskulturer lignede mere dem, der blev opnået fra moderens plasma.
Når den analyseres af en kildesporingssoftware, placenta -mikroberne blev forudsagt at være den almindelige kilde til mikrobiota i spædbarnets mund og meconium.
Da forsøget blev gentaget hos gravide mus leveret i forskellige graviditetsperioder ved operativ levering, de overordnede tendenser i midten af sen til sen graviditet viste, at kilden til mikrobiota i fostrets tarm primært kom fra moderkagen og derefter fra fostermembranen. I begyndelsen af graviditeten, resultaterne var mere forvirrede. Imidlertid, forskerne konkluderer, at fostrets tarmmikrobiom ændrer sig i sammensætning og oprindelse ved graviditet. Bakterier, der kan vokse og formere sig i fostervæv midt i graviditeten, kan ikke induceres til at vokse i kultur, når de testes i senere perioder af graviditeten. Dette kan skyldes ændringer i immunbarrieren i krydset mellem moderens og føtalvæv i senere graviditet.
Bakteriekulturer blev også opnået fra gravide mus og fostre, når der blev taget prøver fra fostrets tarm og livmoder, placenta og fostermembransteder, samt fra moderens vagina og afføring. Bakterier, der koloniserer den gravide mor i den tidlige graviditet, kan også påvises i og dyrkes fra prøver af fostervæv såvel som fra moderens tarm, livmoder og blod, men ikke fra skeden. Denne effekt ses ikke senere i graviditeten.
Det faktum, at fosteret viste sig at have et tarmmikrobiom, fik forskerne til at overveje muligheden for, at dette giver en kontrolleret eksponering af fostrets organisme for mikrober. Dette kan være en stor hjælp for at hjælpe det umodne og uudviklede immunsystem til at reagere på forskellige former for antigene udfordringer på en sund og nyttig måde. Det træner også fostrets metaboliske processer til at fortsætte i henhold til behovene hos den hurtigt voksende organisme.
Forsker Patrick Seed siger, "I modsætning til andre undersøgelser, der kun er baseret på næste generations DNA -sekventering, vi validerede vores sekventeringsresultater med mikroskopi og dyrkningsteknikker. Nu kan vi forfølge måder at øge udviklingen af fosterets immunsystem og metabolisme ved at stimulere mors mikrobiom. Vores resultater peger på mange lovende muligheder for langt tidligere indgreb for at forhindre fremtidig sygdom. ”
Imidlertid, dette er kun udgangspunktet, og forskerne påpeger, at der vil være behov for meget mere arbejde med at opdage, hvordan fostermikrobiomet nøjagtigt interagerer med og modulerer fostrets vækst og udvikling. Efterhånden som denne viden vokser, det vil forhåbentlig hjælpe dem til at "gribe ind for at forbedre børns sundhed i begyndelsen af livet og senere."
 Saltoverforbrug er dårligt – selv for din tarmmikrobiota
Saltoverforbrug er dårligt – selv for din tarmmikrobiota
 7 måder at få bedre søvn (og helbrede hurtigere)
7 måder at få bedre søvn (og helbrede hurtigere)
 SCD kyllingefyldte Portobello-svampe
SCD kyllingefyldte Portobello-svampe
 Kokain- og crackafhængighed
Kokain- og crackafhængighed
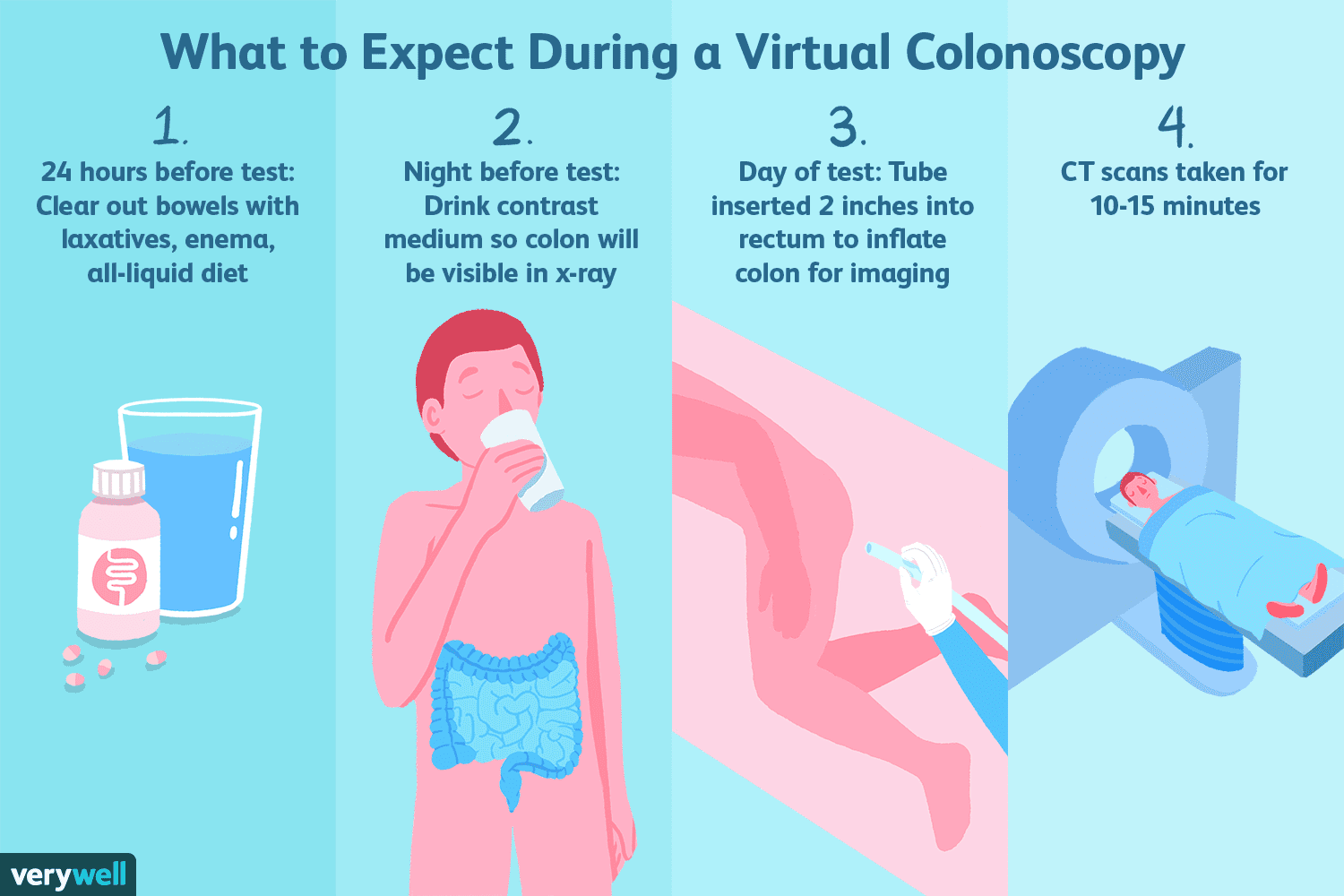 Hvad er en virtuel koloskopi?
Hvad er en virtuel koloskopi?
 At skære ned på disse fødevaretyper kan hjælpe dig med at reducere forekomsten af sure opstød i høj grad
At skære ned på disse fødevaretyper kan hjælpe dig med at reducere forekomsten af sure opstød i høj grad
 Meddelelse om Real Food Summit! 27 gratis præsentationer om mad, sundhed og velvære
Sean Croxton er i gang igen. Hvis du ikke har hørt om Sean Croxton, er han berømt for at kaste sandhedsbomber på Underground Wellness Radio og poope på youtube! Vi interviewede ham sidste efterår på
Meddelelse om Real Food Summit! 27 gratis præsentationer om mad, sundhed og velvære
Sean Croxton er i gang igen. Hvis du ikke har hørt om Sean Croxton, er han berømt for at kaste sandhedsbomber på Underground Wellness Radio og poope på youtube! Vi interviewede ham sidste efterår på
 7 tegn på, at din IBS kan være SIBO
7 tegn på, at din IBS kan være SIBO Denne måned er IBS (Irritable Bowel Syndrome) bevidsthedsmåned, og i dag dækker vi de 7 tegn på, at din IBS kan være SIBO. Så hvad er IBS, og hvorfor er vi interes
7 tegn på, at din IBS kan være SIBO
7 tegn på, at din IBS kan være SIBO Denne måned er IBS (Irritable Bowel Syndrome) bevidsthedsmåned, og i dag dækker vi de 7 tegn på, at din IBS kan være SIBO. Så hvad er IBS, og hvorfor er vi interes
 Kan fordøjelsesenzymtilskud hjælpe din fordøjelsesbesvær?
Fordøjelsesenzymtilskud er produkter designet til at efterligne virkningerne af naturligt forekommende fordøjelsesenzymer, der findes i vores kroppe, og som hjælper med at nedbryde og absorbere mad. D
Kan fordøjelsesenzymtilskud hjælpe din fordøjelsesbesvær?
Fordøjelsesenzymtilskud er produkter designet til at efterligne virkningerne af naturligt forekommende fordøjelsesenzymer, der findes i vores kroppe, og som hjælper med at nedbryde og absorbere mad. D