 10% pacijenata s GERB-om razvije Barrettov jednjak, čimbenik rizika za rak jednjaka.
10% pacijenata s GERB-om razvije Barrettov jednjak, čimbenik rizika za rak jednjaka.

Barrettov jednjak nema jedinstvene simptome. Pacijenti s Barrettovom bolesti imaju simptome GERB-a ili refluksa kiseline, uključujući sljedeće:
Barrettov jednjak je komplikacija kronične gastroezofagealne refluksne bolesti (GERB), prvenstveno u bijelih muškaraca. GERB je bolest u kojoj dolazi do refluksa kisele tekućine iz želuca u jednjak (cijev za gutanje). GERB najčešće uzrokuje žgaravicu.
Postoje dva zahtjeva za dijagnozu Barrettovog jednjaka. Zahtjevi zahtijevaju endoskopiju jednjaka. Tijekom endoskopije, duga fleksibilna cijev sa svjetlom i kamerom na vrhu (endoskop) se uvodi kroz usta i dolje u jednjak kako bi se pregledala i biopsija (uzorak tkiva iz) sluznice jednjaka. Dva zahtjeva su:
Barrettov jednjak službeno je šifrirao Kongresna knjižnica za elektroničko pretraživanje literature kao Barrettov jednjak, ali Barrettov jednjak (s apostrofom "s") je naziv koji se univerzalno koristi. Stanje je dobilo ime po kirurgu Normanu Barrettu koji je opisao stanje. Međutim, pokazalo se da njegova interpretacija nalaza nije bila točna. Godine 1953. liječnici Allison i Johnstone zapravo su opisali ovo stanje kako ga sada razumijemo, naime da se javljala metaplazija. (Metaplazija, o kojoj se govori u nastavku, izraz je koji se koristi kada jedno tkivo odrasle osobe zamijeni drugo.) Ipak, stanje je ovjekovječeno Barrettovim imenom.
U početku se smatralo da se Barrettov jednjak sastoji od tkiva želuca (želuca) koje zamjenjuje uobičajeno skvamozno tkivo koje oblaže jednjak. Međutim, sredinom 70-ih, dr. Paull i suradnici objavili su rad u kojem su opisali sluznicu (unutarnju sluznicu) Barrettova jednjaka detaljnije nego što je to bilo prije. Istaknuli su da se Barrettov jednjak sastoji od metaplazije u kojoj su normalne stanice koje oblažu jednjak zamijenjene mješavinom stanica želučane i crijevne sluznice. Stanice crijevnog tipa također se nazivaju specijalizirane stupaste stanice koje uključuju vrčaste stanice. Nekoliko godina neki su znanstvenici mislili da postoje dvije vrste Barrettova; jedan u kojem je normalna sluznica zamijenjen samo stanicama želučane (želučane) vrste, a drugi u kojem su bile prisutne crijevne stanice. Međutim, trenutačno je uvjerenje da samo prisutnost vrčastih stanica crijevnog tipa postavlja dijagnozu Barrettovog jednjaka, bez obzira na to koji su drugi tipovi stanica prisutni.
Razlog velikog interesa za Barrettov jednjak je taj što je povezan s povećanim rizikom od raka jednjaka. Vrsta raka koja se javlja u bolesnika s Barrettovom bolešću je adenokarcinom, koji nastaje iz metaplastičnog crijevnog tkiva. Uobičajeni karcinom jednjaka koji nije povezan s Barrettovim je skvamozni karcinom, koji nastaje iz pločaste stanične sluznice koja je normalno prisutna u jednjaku. Veza između adenokarcinoma jednjaka i Barrettovog jednjaka sada je jasna, a adenokarcinom jednjaka sve je učestaliji u većini zemalja zapadne hemisfere.
Dobra vijest je, međutim, da se rak javlja u relativno malo pacijenata s Barrettovim jednjakom. Ipak, glavni izazov u ovom stanju je paziti na rane upozoravajuće znakove raka uzimajući biopsije u redovitim intervalima tijekom endoskopije. Ova praksa se zove nadzor i u principu je slična nadzoru žena za rak cerviksa, pri čemu se PAP brisevi uzimaju u redovitim intervalima.
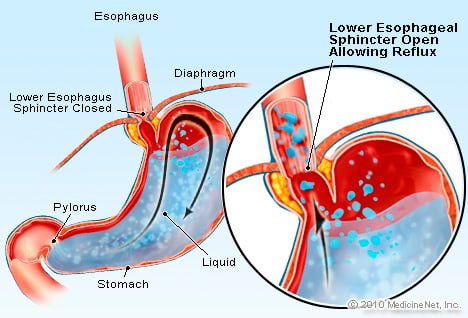
 GERB je stanje u kojem se prekomjerna tekućina koja sadrži kiselinu refluksira (teče) natrag u jednjak, dijelom zbog donji sfinkter jednjaka je slab.
GERB je stanje u kojem se prekomjerna tekućina koja sadrži kiselinu refluksira (teče) natrag u jednjak, dijelom zbog donji sfinkter jednjaka je slab. GERB uzrokuje Barrettov jednjak. Jednjak je mišićna cijev koja se nalazi u prsima i služi za prijenos hrane iz usta u želudac. Donji sfinkter jednjaka (LES) je zalistak koji se nalazi na spoju želuca s jednjakom. Njegova je funkcija spriječiti da se kiselina i drugi sadržaj želuca vrati natrag u jednjak. GERB je stanje u kojem se prekomjerna tekućina koja sadrži kiselinu refluksira (teče) natrag u jednjak, dijelom zato što je donji sfinkter jednjaka slab. Slabost LES-a može biti dijelom povezana s činjenicom da gotovo svi pacijenti s GERB-om imaju hijatalnu kilu. U bolesnika s hijatalnom hernijom, gornjih nekoliko centimetara želuca klizi naprijed-natrag između trbuha i prsa kroz dijafragmu. Ovo klizanje može ometati način na koji sfinkter radi kao prepreka refluksu iz želuca u jednjak.
Prije se termin hernija koristio umjesto GERB-a u objašnjavanju pacijentima osnove njihovih simptoma (obično žgaravice) jer gotovo svi pacijenti s GERB-om imaju hijatalnu kilu. GERB je, međutim, točniji izraz. Dok su hijatalne kile iznimno česte u populaciji, samo mali broj ljudi s hijatalnom hernijom razvija GERB. Drugim riječima, prisutnost hiatalne kile ne znači da će osoba razviti GERB. S druge strane, međutim, ako osoba ima GERB, hiatalna kila je gotovo uvijek prisutna.
Dakle, Barrettov jednjak je uzrokovan kroničnim (dugogodišnjim trajanjem) i obično teškim refluksom kiseline. U nekih bolesnika s GERB-om, jednjak reagira na ponovljene ozljede kisele tekućine promjenom vrste stanica koje ga oblažu iz skvamoznih (normalne stanice) u stupaste (stanice crijevnog tipa). Vjeruje se da je ova transformacija, nazvana metaplazija, zaštitni odgovor jer je specijalizirani stupčasti epitel (epitel znači sluznica) u Barrettovom jednjaku otporniji na ozljede kiselinom od skvamoznog epitela.
Tekućina u želucu sadrži kiselinu koju proizvodi želudac. Osim toga, međutim, tekućina može sadržavati žučne kiseline (iz žuči koju proizvodi jetra) i enzime (proizvedene od gušterače) koji su se vratili iz duodenuma u želudac. (Dvanaesnik je prvi dio tankog crijeva odmah iza želuca.) Kiselina koja refluksira iz želuca u jednjak štetna je za jednjak. Međutim, postoje neki dokazi da žučni i enzimi gušterače u kombinaciji s kiselinom mogu biti štetniji od same kiseline.
Značajan postotak osoba s kroničnim simptomima GERB-a razvija Barrettov jednjak, a najčešći je u muškoj populaciji bijele rase. Međutim, nemaju svi s GERB-om simptome GERB-a. Stoga neki ljudi s Barrettovom bolešću ne znaju da imaju Barrettov jer imaju GERB bez ikakvih simptoma ili imaju vrlo blage i rijetke simptome.
Nejasno je zašto je Barrettov jednjak tako nadmoćno češći u bijelih muškaraca nego u bilo kojoj drugoj skupini. Na primjer, iako se čini da žene i Afroamerikanci nisu zaštićeni od razvoja GERB-a, oni su u velikoj mjeri zaštićeni (osobito Afroamerikanci) od razvoja Barrettova jednjaka i Barrettova raka (adenokarcinoma). Postoje dokazi da se na zapadnoj hemisferi povećava učestalost raka jednjaka i raka gastroezofagealnog spoja (nazvanog kardiološkim karcinomom), možda više nego bilo koji drugi rak gastrointestinalnog trakta. (Međutim, rak debelog crijeva je još uvijek mnogo češći od raka jednjaka.)
Barrettov jednjak može se pojaviti u nekim obiteljima i biti genetski uvjetovan. Istraživanja su u tijeku kako bi se utvrdilo mogu li se u tim obiteljima pronaći neki geni ili markeri koji bi predvidjeli razvoj Barrettova jednjaka u općoj populaciji. U ovim obiteljima s Barrettovom, kao i s Barrettovom u općoj populaciji, GERB je zajednički nazivnik. Međutim, postavlja se pitanje zašto se Barrettova bolest češće javlja u tim obiteljima nego u drugim s usporedivo teškim GERB-om, ali bez obiteljske povezanosti.
Da ponovimo, prvi kriterij za dijagnozu Barrettovog jednjaka je endoskopski nalaz ružičaste sluznice u jednjaku gdje se ona inače ne vidi. Ova abnormalna sluznica može izgledati po obodu kao traka, nalik na jezik ili kao otoci. Drugi kriterij je da biopsije ružičaste sluznice otkrivaju karakterističnu crijevnu sluznicu (sluznica koja se normalno vidi u crijevima) s tipičnim vrčastim stanicama. Biopsije jednjaka dobivaju se tijekom endoskopije. Endoskopija gornjeg dijela gastrointestinalnog trakta je postupak u kojem liječnik ubacuje dugu fleksibilnu cijev (endoskop) kroz usta i dolje u jednjak kako bi se izravno vizualizirala sluznica jednjaka. Tijekom istog endoskopskog pregleda mogu se vizualizirati i želudac i duodenum. Preko endoskopa se može dobiti više malih uzoraka (biopsija) epitelnog tkiva sluznice.
Kao što je već spomenuto, proces zamjene jedne vrste obloge tkiva drugom naziva se metaplazija. U želucu i crijevima metaplazija je uobičajena reakcija na određene vrste ozljeda. Kao što je Henry Appelman, patolog, izjavio:"Kada su crijeva pod stresom, žele biti nešto drugo." Drugi primjeri metaplazije u kojoj jedna sluznica zamjenjuje drugu su:(1) u želucu gdje kronična upala (gastritis) može rezultirati crijevnom sluznicom koja zamjenjuje dijelove normalne želučane sluznice; i (2) u dvanaesniku (odmah iza želuca u crijevu) gdje se javljaju peptički ulkusi, a crijevna sluznica koja okružuje ulkus pretvara se u sluznicu želucanog tipa.
Vjerujemo da je proces metaplazije zaštitni ili adaptivni odgovor na ozljedu sluznice. Međutim, loša strana metaplazije je da u Barrettovom jednjaku nosi mali, ali definitivno povećanje rizika od nastanka raka. Nemaju sve metaplazije povećani rizik od raka. Na primjer, od dvije metaplazije iz prethodnog stavka, crijevna metaplazija u želucu može dovesti do raka, ali crijevna metaplazija u dvanaesniku ne.
Proces razvoja Barrettove bolesti počinje na spoju sluznice želuca i jednjaka. Jednjak je obično obložen skvamoznim epitelom ili slojem sluznice. Ovaj skvamozni epitel ima biserno bijeli izgled, dok sluznica u želucu i crijevima ima više lososovo ružičastu boju jer je to stupasti epitel, a ne pločasti epitel. Ploščati epitel se sastoji od ravnih pločastih stanica, koje su slične stanicama kože. Želučana ili želučana sluznica sastoji se od viših stupastih stanica kako se vidi pod mikroskopom. Spoj skvamoznog epitela jednjaka i želučanog stupastog epitela događa se na spoju jednjaka i želuca gdje se, kako se sjećate, nalazi donji sfinkter jednjaka. Zajednička granica (sučelje) ovih dviju obloga često se naziva Z linija, jer kada se pregleda tijekom endoskopije, ima cik-cak izgled.
Uz progresivnu ozljedu jednjaka, dolazi do metaplazije i metaplastično tkivo se pomiče prema jednjaku na udaljenosti koja varira od osobe do osobe, obično od oko 0,5 do 2,5 inča (oko 1 do 6 centimetara). Vrsta stanice koja stvara metaplastično tkivo nije poznata.
Barrettov jednjak se često kategorizira u Barrettov jednjak s kratkim ili dugim segmentima, na temelju duljine zahvaćenog jednjaka. Kratki segment Barrettov se općenito odnosi na zahvaćenost od 3 centimetra ili manje, dok dugi segment znači zahvaćenost više od 3 centimetra jednjaka. Zanimljivo je da nakon što se kod pacijenta dijagnosticira Barrettov jednjak, čini se da metaplastična sluznica ne napreduje dalje u jednjak ako se pacijent liječi od GERB-a. Stoga, tijekom vremena, duljina angažmana s Barrettovom općenito ostaje ista.
Ako se biopsije uzimaju od pacijenata s GERB-om koji imaju normalnu Z liniju (bez vidljivih dokaza Barrettovog jednjaka), do 30% će pokazati istu metaplaziju crijevnog tipa s vrčastim stanicama kao one koje se vide u Barrettovom jednjaku. Međutim, ne vršimo rutinsku biopsiju normalnog pojavljivanja Z linija kako bismo potražili ovu promjenu, niti vršimo nadzor kada je tamo pronađemo. Razlog je taj što se čini da se ograničena intestinalna metaplazija gastroezofagealnog spoja kod GERB-a javlja sa sličnom učestalošću kao i u bijelaca, ali je rizik od otvorenog Barrettova jednjaka mnogo manji nego u bijelaca.
Stoga, prisutnost metaplazije na rutinskoj biopsiji normalne Z linije u GERB-u ne bi trebala dovesti do bilo kakve promjene u liječenju. Štoviše, nalaz vrčastih stanica u ovom kontekstu ne bi trebao biti označen, kao što su neki sugerirali, kao Barrettov ultrakratki segment. Glavni razlog zašto ga ne označite kao Barrettov je taj što izraz Barrettov podrazumijeva povećani rizik od raka, a nema dokaza da je ovaj nalaz povezan s povećanim rizikom od raka.
Vrsta raka koja se javlja s Barrettovim jednjakom je adenokarcinom. Rak koji nastaje iz skvamozne sluznice jednjaka naziva se skvamozni karcinom ili karcinom. Među bijelcima, stopa (učestalost tijekom vremena) skvamoznog karcinoma se smanjuje u odnosu na adenokarcinom povezan s Barrettom. Druge rasne skupine (na primjer, Afroamerikanci) nisu doživjele istu stopu pada skvamoznog raka u odnosu na adenokarcinom.
Pušenje i prekomjerno konzumiranje alkohola definitivni su čimbenici rizika za skvamozne karcinome. Oni su također čimbenici rizika za adenokarcinom koji se vidi u Barrettovom jednjaku. U ovoj situaciji, međutim, nije jasno povećavaju li pušenje i alkohol rizik od adenokarcinoma čineći GERB težim ili ako pušenje i alkohol imaju izravniji učinak na rak, kao što se događa kod skvamoznog raka. Karcinom skvamoznih stanica sve je rjeđi, dok su dijagnoza adenokarcinoma porasla. Incidencija adenokarcinoma u bijelih muškaraca porasla je strmije nego u drugim etničkim skupinama.
U nastavku ovog odjeljka pojam karcinom jednjaka odnosit će se na adenokarcinom koji nastaje iz Barrettova jednjaka.
Rak gastroezofagealnog spoja naziva se i kardiom kardije jer se područje gdje se jednjak susreće sa želucem naziva kardija. Ovaj rak, poput adenokarcinoma povezanog s Barrettom, nalazi se pretežno u bijelih muškaraca, očito se povećava u učestalosti istom brzinom kao i rak jednjaka, a povezan je s kroničnim GERB-om. Stoga se nagađa da rak kardije počinje od kratkih Barrettovih segmenata (na primjer, 1-2 cm). Međutim, do trenutka kada se postavi dijagnoza raka, tumor se može proširiti izvan kratkog segmenta Barrettova i može se činiti da se nalazi u kardiji. Ovo nagađanje o podrijetlu raka kardije, međutim, tek treba dokazati.
Povećanje učestalosti adenokarcinoma jednjaka opaženo je najmanje 20 godina, prvenstveno u bijelih muškaraca. Jedan od naznaka razloga za ovaj trend može biti povezan sa smanjenjem učestalosti H. pylori infekcija želuca. Drugim riječima, čini se da ljudi s Barrettovim rakom, uključujući rak kardije, imaju nižu stopu H. pylori infekcija od drugih osoba iste dobi i spola u istoj populaciji.
H. pylori je vrsta bakterije koja je glavni uzročnik čira. To je vrlo česta infekcija u cijelom svijetu i ne uzrokuje nikakve simptome kod velike većine oboljelih ljudi. Međutim, neki ljudi s H. pylori razviti peptički ulkus želuca i dvanaesnika. Ti se ulkusi liječe eliminacijom bakterija, što zauzvrat sprječava ponovnu pojavu ulkusa.
Ako H. pylori ako se ne liječi, uzrokuje progresivnu upalu želuca (gastritis) koja je povezana sa smanjenjem lučenja kiseline i mogućim manjim refluksom kiseline u jednjak. U mnogim dijelovima svijeta ova infekcija se smanjuje, vjerojatno zbog boljih mjera javnog zdravlja. Stoga je moguće da zaštitni učinak (kao što je smanjena proizvodnja kiseline) kronične H. pylori infekcija se smanjila. Drugim riječima, s manje H. pylori gastritis, želudac proizvodi više kiseline i ima više kiseline za refluks u jednjak. Istodobno smo skloniji refluksu u starijim godinama. Iako ovo nije riješeno pitanje, smanjenje učestalosti H. pylori infekcija može biti jedan od razloga sve veće učestalosti adenokarcinoma povezanog s Barrettom.
Displazija je promjena u stanicama koje oblažu jednjak u kojoj stanice zapravo pokazuju abnormalne promjene u svojoj strukturi i izgledu. Kada te promjene postanu dovoljno ozbiljne (od displazije niskog stupnja do visokog stupnja), stanice počinju izgledati maligne (poput stanica raka). Međutim, za razliku od raka, ove stanice ostaju na mjestu i ne prodiru u tkiva izvan sluznice. Displazija se javlja kao niz staničnih promjena kako Barrettov jednjak napreduje do Barrettovog raka. Bolesnici s Barrettovom bolesti prate se endoskopijom i biopsijama (nadzor) kako bi se otkrile te stanične promjene (displazija) ili, u najgorem slučaju, rani rak kako bi se mogli liječiti. Trenutačno ne postoji način da se predvidi kod kojih pacijenata s Barrettovim jednjakom će se razviti displazija.
Displazija je također identificirana uz tumore gastrointestinalnog trakta osim adenokarcinoma jednjaka. Na primjer, displazija se nalazi u polovici slučajeva raka želuca i raka debelog crijeva, kod kojih je displazija vidljiva kao takozvani adenomatozni polipi. Osim toga, displazija je ista promjena stanica ranog upozorenja koju patolozi traže u PAP brisevima cerviksa koji predviđaju rak vrata maternice.
Displazija se smatra premalignom. To znači da ako je displazija dokazana u nekoliko navrata, vjeruje se da će pacijent razviti rak ako živi dovoljno dugo. Displazija je kategorizirana kao visoka ili niska. Kada se dijagnosticira displazija visokog stupnja, rak može već biti prisutan, a ako nije, rizik od razvoja raka prije je veći nego kod nižih stupnjeva displazije.
U naknadnim biopsijama pacijenata s displazijom, stanje se možda neće ponovno otkriti u nekih pacijenata, dok se u drugih nalaze niski stupnjevi displazije. Taj izostanak ili smanjenje displazije može biti posljedica čimbenika kao što su varijacije uzorkovanja, uklanjanje sitnih žarišta (skupina stanica) displazije s početnom biopsijom ili stvarni biološki preokret. Točan razlog(i) nije poznat.
Koristeći molekularne tehnike, neke promjene koje se nazivaju biomarkeri mogu se otkriti u uzorcima biopsije prije nego se razvije displazija. Te su promjene slične onima koje se uočavaju kod drugih karcinoma. Biomarkeri uključuju promjene u sadržaju DNK u stanicama, u genima i kromosomima te u faktorima rasta. Može se pokazati da se određeni broj ovih biomarkera pojavljuje prije i tijekom pojave displazije. Konačni cilj je pronaći čarobni biljeg koji nam može reći koji pacijenti među onima koji nemaju displaziju ili displaziju niskog stupnja imaju veću vjerojatnost da će razviti displaziju visokog stupnja ili rak. Takve pacijente tada može pratiti nadzor pomnije od ostalih.
Trenutno se svi pacijenti s Barrettovim jednjakom, sa stajališta nadzora, liječe na isti način. Dostupnost biomarkera bi odvojila (stratificirala) Barrettove pacijente na temelju njihovog rizika od raka. Takva bi stratifikacija omogućila liječnicima da češće rade nadzornu endoskopiju i biopsiju u manjine pacijenata koji su pod većim rizikom od raka i rjeđe u onih za koje se predviđa da će imati manji rizik od raka.
Još jedna upotreba dokazanih biomarkera bila bi potvrđivanje patologove interpretacije displazije na biopsijama.
Kada se pacijenti s Barrettovim jednjakom procjenjuju kao skupina, utvrđeno je da je rizik od raka samo jedan od 300 pacijenata godišnje. To znači da kada bismo pregledali 300 pacijenata godišnje, jedan pacijent bi svake godine imao rak. Ono što stvarno moramo znati je rizik od raka ako se ne pronađe displazija nakon jedne ili dvije godine nadzora. Vjerujemo da bi taj rizik bio mnogo manji od prethodno navedenih brojki o jednom od 300 pacijenata godišnje.
Kod pacijenata s displazijom visokog stupnja često se može otkriti da imaju rak. Stoga je prva mjera liječenja kada se pronađe displazija visokog stupnja isključiti prisutnost adenokarcinoma.
Displazija niskog stupnja je mnogo manje opasna od displazije visokog stupnja, ali ne znamo koliko manje. Zapravo, nemamo preciznih podataka koji bi ukazivali na to koliki je rizik od raka kod pacijenata s Barrettovom i niskom stupnjem displazije.
Dijagnoza displazije treba biti što preciznija jer ova dijagnoza može potaknuti promjenu u liječenju ili intenzitetu praćenja bolesnika s Barrettovim jednjakom. Potrebno je veliko iskustvo kako bi se mogla postaviti precizna dijagnoza prisutnosti i stupnja displazije. Stoga je uobičajena i korisna praksa zatražiti od drugog patologa (ili čak trećeg, ako je potrebno) da pregleda biopsije. Ideja je vidjeti postoji li dogovor između patologa i/ili dobiti iskusnije mišljenje o prisutnosti i stupnju displazije.
Ako osoba ima duži segment Barretta, moglo bi se pretpostaviti da je rizik od raka veći nego kod kraćeg segmenta Barretta. Podaci su, međutim, u tom pogledu kontroverzni. Iz tog razloga, dosadašnja praksa je da se endoskopski biopsijski nadzor sa sličnom učestalošću provodi u bolesnika s kratkim i dugim segmentom Barrettovog jednjaka.
Barrettov jednjak nema jedinstvene simptome. Bolesnici s Barrettovom bolesti imaju simptome GERB-a (na primjer, žgaravica, regurgitacija, mučnina itd.). Opći trend je da Barretovi pacijenti imaju teži GERB. Međutim, nemaju svi Barrettovi izrazite simptome GERB-a, a neki pacijenti se otkriju slučajno s minimalnim simptomima GERB-a ili bez njih.
Žgaravica je osjećaj pečenja iza prsne kosti, obično u donjoj polovici, ali se može proširiti sve do grla. Ponekad je popraćeno pečenjem ili bolom u jamici želuca neposredno ispod mjesta gdje završava prsna kost. Drugi najčešći simptom je regurgitacija (regurgitacija) tekućine gorkog okusa. Simptomi GERB-a često su gori nakon jela i kada ležite ravno.
Refluksirana, regurgitirana tekućina povremeno može ući u pluća ili glasovnu kutiju (larinks), što rezultira takozvanim ekstraezofagealnim (izvan jednjaka) simptomima (manifestacijama) GERB-a. Ovi simptomi uključuju:
Iz razloga koji nisu u potpunosti razumljivi, neki pacijenti s GERB-om imaju minimalnu žgaravicu, ali imaju druge simptome GERB-a, na primjer, ekstraezofagealne simptome.
GERB može rezultirati strikturama i ulceracijama jednjaka. Striktura ili suženje nastaje zbog ožiljaka (fibroze) jednjaka što može uzrokovati poteškoće pri gutanju (disfagija). Disfagija se osjeća kao zastoj (zaustavljanje) čvrste hrane u prsima (u jednjaku), a tekućine kada je suženje jako. Strikture se mogu liječiti istezanjem dilatatorima tijekom endoskopije. Neliječene, strikture mogu potaknuti više izlijevanja hrane i/ili želučane tekućine u pluća. Rijetko se može pojaviti masivno gastrointestinalno (GI) krvarenje uzrokovano upalom jednjaka. Takvo krvarenje rezultira povraćanjem krvi ili izlaskom crne ili kestenjaste stolice. Češće, međutim, upaljeni jednjak može uzrokovati sporo krvarenje koje se otkrije kada se pronađe anemija (nizak broj crvenih krvnih stanica) i/ili se u stolici testira krv.
Medicinski tretmani za simptome Barrettovog jednjaka isti su kao oni za GERB.
Supresija kiseline je okosnica liječenja GERB-a. Za blage simptome refluksa obično se koriste lijekovi koji se mogu kupiti bez recepta, u rasponu od antacida do niskih doza lijekova koji se nazivaju antagonisti H-2 receptora ili H2 blokatori. Primjeri H2 blokatora bez recepta su cimetidin (Tagamet) i famotidin (Pepcid, Zantac 360). Za trajnije simptome mogu se koristiti veće (prepisane) doze antagonista H-2 receptora, na primjer:
Međutim, za trajne simptome koji zahtijevaju terapiju održavanja (u tijeku) ili za komplicirani GERB sa strikturama ili krvarenjem, koriste se inhibitori protonske pumpe (PPI). Primjeri PPI-a su:
Neki pacijenti trebaju uzeti samo jednu pilulu dnevno, dok drugi trebaju dvije tablete (dvostruka doza) za kontrolu simptoma. Dvostruka doza se može uzeti kao jedna pilula dva puta dnevno ili 2 tablete jednom dnevno.
IPP su snažni inhibitori lučenja kiseline iz želuca. Učinkoviti su u ublažavanju žgaravice i liječenju upale jednjaka (ezofagitisa) i čira na jednjaku koji su izazvani refluksom kiseline. IPP se dobro podnose s malo nuspojava. Nakon prestanka uzimanja ovih lijekova, simptomi refluksa kiseline obično se ponavljaju, ponekad s povećanim intenzitetom. Ovo povećanje simptoma nastaje, dijelom, zbog ponovnog lučenja kiseline (hipersekrecija kiseline), što je odgovor potaknut oporavkom od inhibicije lučenja kiseline od strane PPI.
Dugoročna sigurnost PPI je važno razmatranje. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. To uključuje:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Simptomi GERB-a nakon vježbanja?
ARHIV LIJEČNIČKIH POGLEDA Tema:Sindrom iritabilnog crijeva (IBS), lipanj 2000. Dr. Lee: Gledatelj doživljava žgaravicu i nelagodu u prsima nakon vježbanja. Ovaj gledatelj želi znati mogu li njego
Simptomi GERB-a nakon vježbanja?
ARHIV LIJEČNIČKIH POGLEDA Tema:Sindrom iritabilnog crijeva (IBS), lipanj 2000. Dr. Lee: Gledatelj doživljava žgaravicu i nelagodu u prsima nakon vježbanja. Ovaj gledatelj želi znati mogu li njego
 Endoskopija vs. kolonoskopija
Endoskopija naspram kolonoskopije:Koja je razlika? Ponekad su endoskopi kamere na dugim cijevima, ali posljednjih godina tehnologija je liječnicima omogućila da montiraju kamere u male tablete kako b
Endoskopija vs. kolonoskopija
Endoskopija naspram kolonoskopije:Koja je razlika? Ponekad su endoskopi kamere na dugim cijevima, ali posljednjih godina tehnologija je liječnicima omogućila da montiraju kamere u male tablete kako b
 Što očekivati od fekalne transplantacije
Fekalna transplantacija, također poznata kao fekalna bakterioterapija ili transplantacija fekalne mikrobiote (FMT), je proces obnove bakterija koje se obično nalaze u probavnom traktu infuzijom izmeta
Što očekivati od fekalne transplantacije
Fekalna transplantacija, također poznata kao fekalna bakterioterapija ili transplantacija fekalne mikrobiote (FMT), je proces obnove bakterija koje se obično nalaze u probavnom traktu infuzijom izmeta