 10 % av pasientene med GERD utvikler Barretts esophagus, en risikofaktor for kreft i spiserøret.
10 % av pasientene med GERD utvikler Barretts esophagus, en risikofaktor for kreft i spiserøret.

Barretts spiserør har ingen unike symptomer. Pasienter med Barretts har symptomene på GERD eller acid reflux inkluderer følgende:
Barretts spiserør er en komplikasjon av kronisk gastroøsofageal reflukssykdom (GERD), først og fremst hos hvite menn. GERD er en sykdom der det oppstår refluks av sur væske fra magen til spiserøret (svelgerøret). GERD forårsaker oftest halsbrann.
Det er to krav for diagnosen Barretts øsofagus. Kravene krever endoskopi av spiserøret. Under endoskopi føres et langt fleksibelt rør med et lys og kamera på spissen (et endoskop) gjennom munnen og ned i spiserøret for å se og biopsi (prøvevev fra) slimhinnen i spiserøret. De to kravene er:
Barretts esophagus er offisielt kodet av Library of Congress for elektroniske søk i litteraturen som Barrett esophagus, men Barretts esophagus (med apostrof "s") er navnet som brukes universelt. Tilstanden er oppkalt etter en kirurg, Norman Barrett, som beskrev tilstanden. Det viser seg imidlertid at hans tolkning av funnene ikke var riktig. I 1953 beskrev Doctors' Allison og Johnstone faktisk denne tilstanden slik vi nå forstår den, nemlig at metaplasi foregikk. (Metaplasi, som diskuteres nedenfor, er betegnelsen som brukes når ett voksent vev erstatter et annet.) Likevel har tilstanden blitt udødeliggjort med Barretts navn.
Opprinnelig ble det antatt at Barretts spiserør besto av magevev (mage) som erstattet det vanlige plateepitelvevet i spiserøret. Men på midten av 70-tallet publiserte Dr. Paull og kollegaer en artikkel der de beskrev slimhinnen (den indre slimhinnen) i Barretts spiserør i større detalj enn det som hadde blitt gjort tidligere. De påpekte at Barretts spiserør besto av en metaplasi der de normale cellene i spiserøret ble erstattet av en blanding av mage- og tarmslimhinneceller. Foringscellene av tarmtypen kalles også spesialiserte søyleceller som inkluderer begerceller. I en årrekke trodde noen forskere at det fantes to typer Barretts; en der den normale slimhinnen ble erstattet med bare mageceller (gastriske), og den andre der tarmceller var tilstede. Den nåværende oppfatningen er imidlertid at bare tilstedeværelsen av begerceller av tarmtypen etablerer diagnosen Barretts spiserør, uavhengig av hvilke andre celletyper som finnes.
Årsaken til den store interessen for Barretts spiserør er at det er forbundet med økt risiko for kreft i spiserøret. Krefttypen som oppstår hos pasienter med Barretts er adenokarsinom, som oppstår fra det metaplastiske tarmvevet. Den vanlige kreften i spiserøret som ikke er assosiert med Barretts er plateepitelkarsinom, som oppstår fra plateepitelcelleforingen som normalt er tilstede i spiserøret. Sammenhengen mellom adenokarsinom i spiserøret og Barretts øsofagus er nå klar, og adenokarsinom i spiserøret øker i frekvens i de fleste land på den vestlige halvkule.
Den gode nyheten er imidlertid at kreften forekommer hos relativt få pasienter med Barretts øsofagus. Likevel er hovedutfordringen i denne tilstanden å se etter tidlige varseltegn på kreft ved å ta biopsier med jevne mellomrom under endoskopi. Denne praksisen kalles overvåking og ligner i prinsippet på overvåking hos kvinner for kreft i livmorhalsen, der PAP-utstryk tas med jevne mellomrom.
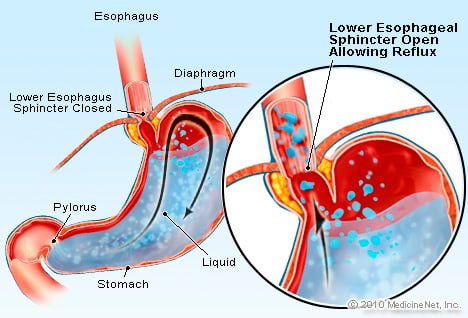
 GERD er en tilstand der overdreven syreholdig væske reflukser (flyter) tilbake i spiserøret, delvis fordi den nedre esophageal sphincter er svak.
GERD er en tilstand der overdreven syreholdig væske reflukser (flyter) tilbake i spiserøret, delvis fordi den nedre esophageal sphincter er svak. GERD forårsaker Barretts spiserør. Spiserøret er et muskelrør som er plassert i brystet og tjener til å overføre mat fra munnen til magen. Den nedre esophageal sphincter (LES) er en ventil som er plassert i krysset mellom magen og spiserøret. Dens funksjon er å forhindre at syre og annet innhold i magesekken kommer tilbake i spiserøret. GERD er en tilstand der overdreven syreholdig væske reflukser (strømmer) tilbake i spiserøret, delvis fordi den nedre esophageal sphincter er svak. Svakheten til LES kan delvis være relatert til det faktum at praktisk talt alle GERD-pasienter har hiatal brokk. Hos pasienter med hiatal brokk glir de øverste centimeterne av magen frem og tilbake mellom magen og brystet gjennom mellomgulvet. Denne glidningen kan forstyrre hvordan lukkemuskelen fungerer som en barriere for refluks fra magesekken til spiserøret.
Tidligere ble begrepet brokk brukt i stedet for GERD for å forklare pasientene grunnlaget for symptomene deres (vanligvis halsbrann) fordi praktisk talt alle GERD-pasienter har hiatal brokk. GERD er imidlertid det mer nøyaktige begrepet. Mens hiatal brokk er ekstremt vanlig i befolkningen, utvikler bare et lite antall personer med hiatal brokk GERD. Med andre ord, tilstedeværelsen av et hiatal brokk betyr ikke at personen vil utvikle GERD. På baksiden, men hvis en person har GERD, er hiatal brokk nesten alltid til stede.
Således er Barretts spiserør forårsaket av kronisk (av mange års varighet) og vanligvis alvorlig sure oppstøt. Hos noen pasienter med GERD reagerer spiserøret på den gjentatte skaden fra den sure væsken ved å endre celletypen fra plateepitel (normale celler) til søyleformede (tarm-type celler). Denne transformasjonen, kalt metaplasi, antas å være en beskyttende respons fordi det spesialiserte søyleepitelet (epitel betyr slimhinne) i Barretts spiserør er mer motstandsdyktig mot skade fra syre enn plateepitel.
Væsken i magen inneholder syre som produseres av magen. I tillegg kan imidlertid væsken inneholde gallesyrer (fra galle produsert av leveren) og enzymer (produsert av bukspyttkjertelen) som har refluksert tilbake fra tolvfingertarmen og inn i magen. (Tolvfingertarmen er den første delen av tynntarmen like utenfor magesekken.) Syren som reflukser fra magesekken til spiserøret er skadelig for spiserøret. Det er imidlertid noen bevis på at galle- og bukspyttkjertelenzymer kombinert med syren kan være mer skadelig enn syre alene.
En betydelig prosentandel av individer med kroniske symptomer på GERD utvikler Barretts esophagus, og det er mest vanlig i kaukasiske mannlige populasjoner. Ikke alle med GERD har imidlertid symptomer på GERD. Derfor er noen personer med Barretts uvitende om at de har Barretts fordi de har GERD uten noen symptomer i det hele tatt eller har svært milde og sjeldne symptomer.
Det er uklart hvorfor Barretts spiserør er så overveldende mer vanlig hos hvite menn enn i noen annen gruppe. For eksempel, selv om kvinner og afroamerikanere ikke ser ut til å være beskyttet mot å utvikle GERD, er de i stor grad beskyttet (spesielt afroamerikanere) mot å utvikle Barretts spiserør og Barretts kreft (adenokarsinom). Det er bevis for at på den vestlige halvkule øker kreft i spiserøret og kreft i gastroøsofageal-krysset (kalt hjertekreft) i hyppighet, kanskje mer enn noen annen kreft i mage-tarmkanalen. (Men tykktarmskreft er fortsatt mye mer vanlig enn kreft i spiserøret.)
Barretts spiserør kan forekomme i noen familier og være genetisk bestemt. Studier er i gang for å avgjøre om noen gener eller markører kan bli funnet i disse familiene som vil forutsi utviklingen av Barretts spiserør i den generelle befolkningen. I disse familiene med Barretts så vel som med Barretts i den generelle befolkningen, er GERD fellesnevneren. Spørsmålet er imidlertid hvorfor Barretts forekommer mer vanlig i disse familiene enn i andre med sammenlignelig alvorlig GERD, men uten familietilknytning.
For å gjenta, det første kriteriet for diagnosen Barretts spiserør er funnet ved endoskopi av en rosa slimhinne i spiserøret der den normalt ikke sees. Denne unormale foringen kan se ut som et bånd rundt omkretsen, tungelignende eller som øyer. Det andre kriteriet er at biopsier fra den rosa slimhinnen avslører den karakteristiske intestinaliserte slimhinnen (slimhinnen som normalt sees i tarmen) med de typiske begercellene. Øsofagusbiopsiene tas under en endoskopi. En øvre gastrointestinal endoskopi er en prosedyre der legen setter inn et langt fleksibelt rør (endoskop) gjennom munnen og ned i spiserøret for å direkte visualisere slimhinnen i spiserøret. Under den samme endoskopiske undersøkelsen kan også magen og tolvfingertarmen visualiseres. Flere små prøver (biopsier) av slimhinneepitelvevet kan fås gjennom endoskopet.
Som nevnt tidligere, kalles prosessen med å erstatte en type vevsfôr med en annen metaplasi. I mage og tarm er metaplasi en vanlig reaksjon på visse typer skader. Som Henry Appelman, en patolog, uttalte:"Når tarmen er under stress, vil den være noe annet." Andre eksempler på metaplasi der en slimhinne erstatter en annen er:(1) i magesekken hvor kronisk betennelse (gastritt) kan føre til at en tarmslimhinne erstatter deler av den normale mageslimhinnen; og (2) i tolvfingertarmen (like utenfor magesekken i tarmen) hvor magesår oppstår og tarmslimhinnen som omgir såret forvandles til mageslimhinne.
Vi tror at prosessen med metaplasi er en beskyttende eller adaptiv respons på skade på slimhinnen. Ulempen med metaplasi er imidlertid at i Barretts spiserør har den en liten, men klar økning i risikoen for å bli kreft. Ikke alle metaplasier har økt risiko for kreft. For eksempel, av de to metaplasiene nevnt i forrige avsnitt, kan intestinal metaplasi i magen føre til kreft, men intestinal metaplasi i tolvfingertarmen gjør det ikke.
Prosessen med å utvikle Barretts begynner ved krysset mellom magen og spiserøret. Spiserøret er normalt dekket av et plateepitel eller fôrlag. Dette plateepitelet har et perlehvitt utseende, mens slimhinnen i magen og tarmene har en mer lakserosa farge fordi det er et søyleepitel i stedet for et plateepitel. Plateepitelet består av flate plateepitelceller, som ligner på hudceller. Mageslimhinnen eller mageslimhinnen består av høyere kolonneformede celler sett under mikroskopet. Krysset mellom plateepitelet i spiserøret og det gastriske kolonneepitelet oppstår i krysset mellom spiserøret og magesekken, der, som du husker, den nedre esophageal sphincter befinner seg. Den felles grensen (grensesnittet) til disse to foringene blir ofte referert til som Z-linjen, fordi når den undersøkes under en endoskopi, har den et sikk-sakk-utseende.
Med progressiv skade på spiserøret oppstår metaplasi og det metaplastiske vevet beveger seg oppover i spiserøret i en avstand som varierer fra person til person, vanligvis fra omtrent 0,5 til 2,5 tommer (omtrent 1 til 6 centimeter). Hvilken type celle som gir opphav til det metaplastiske vevet er ikke kjent.
Barretts spiserør er ofte kategorisert i kort- eller langsegment Barretts, basert på lengden på spiserøret som er påvirket. Kort segment Barretts refererer vanligvis til involvering på 3 centimeter eller mindre, mens langt segment betyr involvering av mer enn 3 centimeter av spiserøret. Interessant nok, når Barretts spiserør er diagnostisert hos en pasient, ser det ikke ut til at den metaplastiske slimhinnen går videre opp i spiserøret hvis pasienten blir behandlet for GERD. Dermed forblir lengden på involvering med Barretts generelt den samme over tid.
Hvis det tas biopsier fra pasienter med GERD som har en normal Z-linje (ingen synlige bevis på Barretts øsofagus), vil opptil 30 % vise samme tarmtype metaplasi med begerceller som de som sees i Barretts øsofagus. Vi tar imidlertid ikke rutinemessig biopsi av normale Z-linjer for å se etter denne endringen, og vi overvåker heller ikke når vi finner den der. Årsaken er at begrenset intestinal metaplasi av gastroøsofageal junction-regionen i GERD ser ut til å forekomme med lignende frekvens hos kvinner og afroamerikanere som hos hvite menn, men risikoen for åpenbar Barretts spiserør er mye mindre enn hos hvite menn.
Derfor bør tilstedeværelsen av metaplasi på en rutinebiopsi av en normal Z-linje i GERD ikke føre til noen endring i behandlingen. Dessuten bør funnet av begerceller i denne sammenheng ikke merkes, som noen har foreslått, som ultrakort segment Barretts. Hovedgrunnen til å ikke merke det som Barretts er at begrepet Barretts innebærer økt risiko for kreft, og det er ingen bevis for at dette funnet er assosiert med økt kreftrisiko.
Krefttypen som oppstår med Barretts spiserør er adenokarsinom. Kreft som oppstår fra plateepitelslimhinnen i spiserøret kalles plateepitelkreft eller karsinom. Blant kaukasiere er frekvensen (frekvensen over tid) av plateepitelkreft synkende i forhold til Barretts-assosiert adenokarsinom. Andre rasegrupper (for eksempel afroamerikanere) har imidlertid ikke opplevd den samme nedgangen i plateepitelkreft i forhold til adenokarsinom.
Røyking og overdreven alkoholinntak er klare risikofaktorer for plateepitelkreft. De er også risikofaktorer for adenokarsinom sett i Barretts spiserør. I denne situasjonen er det imidlertid ikke klart om røyking og alkohol øker risikoen for adenokarsinom ved å gjøre GERD mer alvorlig eller om røyking og alkohol har en mer direkte kreftfremkallende effekt, slik det forekommer ved plateepitelkreft. Plateepitelkreft har blitt stadig mindre vanlig, mens adenokarsinomdiagnoser har økt. Adenokarsinomforekomsten hos hvite menn har økt kraftigere enn hos andre etniske grupper.
Gjennom resten av denne delen vil begrepet esophageal cancer referere til adenokarsinom som oppstår fra Barretts spiserør.
Kreft i gastroøsofageal-krysset kalles også hjertekreft fordi området der spiserøret møter magesekken kalles kardia. Denne kreften, som Barretts-assosiert adenokarsinom, finnes hovedsakelig hos hvite menn, øker tilsynelatende i frekvens i samme hastighet som spiserørskreft, og er assosiert med kronisk GERD. Derfor har det blitt spekulert i at hjertekreft starter fra korte segmenter (for eksempel 1-2 cm) av Barretts. Innen kreftdiagnosen stilles, kan imidlertid svulsten ha spredt seg utover det korte segmentet av Barretts og kan se ut til å være i cardia. Denne spekulasjonen om opprinnelsen til hjertekreft gjenstår imidlertid å bevise.
En økning i frekvensen av adenokarsinom i spiserøret har blitt observert i minst 20 år, primært hos hvite menn. En anelse om årsaken til denne trenden kan være relatert til en reduksjon i frekvensen av H. pylori infeksjon i magen. Med andre ord ser det ut til at personer med Barretts kreft, inkludert hjertekreft, har lavere forekomst av H. pylori infeksjon enn andre av samme alder og kjønn i samme befolkning.
H. pylori er en type bakterier som er en hovedårsak til sår. Det er en svært vanlig infeksjon over hele verden og forårsaker ingen symptomer hos de aller fleste berørte mennesker. Noen personer med H. pylori utvikle magesår i magen og tolvfingertarmen. Disse sårene behandles ved å eliminere bakteriene, som igjen forhindrer tilbakefall av sårene.
Hvis H. pylori går ubehandlet, forårsaker det progressiv betennelse i magen (gastritt) som er assosiert med reduksjon i syresekresjon og muligens mindre refluks av syre i spiserøret. I mange områder av verden avtar denne infeksjonen i frekvens, antagelig på grunn av bedre folkehelsetiltak. Derfor er det mulig at den beskyttende effekten (som redusert syreproduksjon) av kronisk H. pylori infeksjonen er redusert. Med andre ord, med mindre H. pylori gastritt, produserer magen mer syre og det er mer syre til å refluksere inn i spiserøret. Samtidig er vi mer disponert for refluks i seniorårene våre. Selv om dette ikke er et avgjort problem, er den synkende frekvensen av H. pylori infeksjon kan være en årsak til den økende frekvensen av Barretts-assosiert adenokarsinom.
Dysplasi er en endring i cellene langs spiserøret der cellene faktisk viser unormale endringer i struktur og utseende. Når disse endringene blir alvorlige nok, (går fra lavgradig til høygradig dysplasi) begynner cellene å virke ondartede (som kreftceller). Men i motsetning til kreft forblir disse cellene på plass og invaderer ikke vev utenfor slimhinnen. Dysplasi oppstår som en serie celleforandringer når Barretts spiserør utvikler seg til Barretts-assosiert kreft. Pasienter med Barretts overvåkes med endoskopi og biopsier (overvåking) for å oppdage disse celleforandringene (dysplasien) eller i verste fall tidlig kreft slik at de kan behandles. Foreløpig er det ingen måte å forutsi hvilke pasienter med Barretts øsofagus som vil utvikle dysplasi.
Dysplasi har også blitt identifisert ved siden av andre svulster i mage-tarmkanalen enn esophageal adenokarsinom. For eksempel finnes dysplasi i halvparten av tilfellene av magekreft og ved tykktarmskreft, hvor dysplasien er synlig som såkalte adenomatøse polypper. I tillegg er dysplasi den samme tidlige celleforandringen som patologer ser etter i PAP-utstryk av livmorhalsen som forutsier livmorhalskreft.
Dysplasi regnes som premalignt. Dette betyr at dersom det er påvist dysplasi ved flere anledninger, tror man at pasienten vil utvikle kreft dersom han eller hun lever lenge nok. Dysplasi er kategorisert som høy eller lav grad. Når høygradig dysplasi er diagnostisert, kan kreft allerede være tilstede, og hvis ikke, er risikoen for å utvikle kreft tidligere større enn med de lavere gradene av dysplasi.
I oppfølgingsbiopsier av pasienter med dysplasi kan det hende at tilstanden ikke oppdages igjen hos noen pasienter, mens det hos andre er lav grad av dysplasi. Dette fraværet eller reduksjonen av dysplasi kan skyldes faktorer som prøvetakingsvariasjoner, fjerning av små foci (cellegrupper) av dysplasi med den første biopsien, eller faktisk biologisk reversering. Den eksakte årsaken(e) er ukjent.
Ved hjelp av molekylære teknikker kan noen endringer referert til som biomarkører, oppdages i biopsiprøver før dysplasi utvikler seg. Disse endringene ligner de som er observert i andre kreftformer. Biomarkører inkluderer endringer i DNA-innholdet i celler, i gener og kromosomer, og i vekstfaktorer. En rekke av disse biomarkørene kan vises før og under forekomsten av dysplasi. Det endelige målet er å finne en magisk markør som kan fortelle oss hvilke pasienter blant de uten dysplasi eller lavgradig dysplasi som er mer sannsynlig å utvikle høygradig dysplasi eller kreft. Slike pasienter kan da følges av overvåking tettere enn andre.
For tiden behandles alle pasienter med Barretts øsofagus, sett fra et overvåkingssynspunkt, på samme måte. Tilgjengeligheten av biomarkører vil skille (stratifisere) Barretts pasienter basert på deres risiko for kreft. En slik stratifisering vil tillate leger å utføre overvåkingsendoskopi og biopsier oftere hos minoriteten av pasienter som har større risiko for kreft og sjeldnere hos de som er spådd å ha lavere risiko for kreft.
En annen bruk for påviste biomarkører vil være å hjelpe med å bekrefte patologens tolkning av dysplasi på biopsier.
Når pasienter med Barretts øsofagus vurderes som en gruppe, er risikoen for kreft funnet å være så lav som én av 300 pasienter årlig. Dette betyr at hvis vi undersøkte 300 pasienter årlig, ville en pasient bli funnet å ha kreft hvert år. Det vi virkelig trenger å vite er risikoen for kreft hvis det ikke blir funnet dysplasi etter ett eller to års overvåking. Vår tro er at denne risikoen vil være mye mindre enn de tidligere siterte tallene på én av 300 pasienter årlig.
Pasienter med høygradig dysplasi kan ofte vise seg å ha kreft. Derfor er den første behandlingsordenen når høygradig dysplasi oppdages, å utelukke tilstedeværelsen av et adenokarsinom.
Lavgradig dysplasi er mye mindre truende enn høygradig dysplasi, men vi vet ikke hvor mye mindre. Faktisk har vi ikke nøyaktige data som indikerer nøyaktig hva kreftrisikoen er hos pasienter med Barretts og lavgradig dysplasi.
Diagnosen dysplasi bør være så presis som mulig fordi denne diagnosen kan føre til en endring i behandlingen eller intensiteten av oppfølgingen av pasienter med Barretts øsofagus. Det krever mye erfaring for å kunne stille en presis diagnose av tilstedeværelse og grad av dysplasi. Derfor er det en vanlig og nyttig praksis å be en annen patolog (eller til og med en tredje, om nødvendig) om å gjennomgå biopsiene. Tanken er å se om det er enighet mellom patologene og/eller å få en mer erfaren mening om tilstedeværelse og grad av dysplasi.
Hvis en person har lengre segment Barretts, vil man gjette at kreftrisikoen er større enn med kortere segment Barretts. Dataene er imidlertid kontroversielle i denne forbindelse. Av den grunn er gjeldende praksis å utføre endoskopisk biopsiovervåking med lignende hyppighet hos pasienter med kort og langt segment Barretts øsofagus.
Barretts spiserør har ingen unike symptomer. Pasienter med Barretts har symptomene på GERD (for eksempel halsbrann, oppstøt, kvalme, etc.). Den generelle trenden er at Barretts pasienter har mer alvorlig GERD. Imidlertid har ikke alle Barretts markerte symptomer på GERD, og noen pasienter oppdages ved et uhell med minimale eller ingen symptomer på GERD.
Halsbrann er en brennende følelse bak brystbeinet, vanligvis i nedre halvdel, men kan strekke seg helt opp til halsen. Noen ganger er det ledsaget av svie eller smerter i magegropen rett under der brystbeinet slutter. Det nest vanligste symptomet er oppstøt (backup) av bitter smakende væske. GERD-symptomer er ofte verre etter måltider og når du ligger flatt.
Den reflukserte, oppstøte væsken kan av og til komme inn i lungene eller stemmeboksen (strupehodet), noe som resulterer i det som kalles ekstraøsofageale (utenfor spiserøret) symptomer (manifestasjoner) av GERD. Disse symptomene inkluderer:
Av årsaker som ikke er fullt ut forstått, har noen GERD-pasienter minimal halsbrann, men opplever andre GERD-symptomer, for eksempel ekstraøsofageale symptomer.
GERD kan føre til forsnevringer og sårdannelse i spiserøret. En innsnevring eller innsnevring skyldes arrdannelse (fibrose) i spiserøret som kan forårsake problemer med å svelge (dysfagi). Dysfagien sanses som en stikking (stopping) av fast føde i brystet (i spiserøret), og væsker når innsnevringen er alvorlig. Forstrekkninger kan behandles ved å strekke dem med dilatatorer under endoskopi. Ubehandlet kan strikturer fremme mer søl av mat og/eller magevæsker i lungene. Uvanlig kan massiv gastrointestinal (GI) blødning forårsaket av betennelse i spiserøret forekomme. Slike blødninger resulterer i oppkast av blod eller passasje av svart eller rødbrun avføring. Mer vanlig kan imidlertid en betent spiserør forårsake langsom blødning som oppdages når anemi (lavt antall røde blodlegemer) oppdages og/eller avføring testes for blod.
De medisinske behandlingene for symptomene på Barretts øsofagus er de samme som for GERD.
Undertrykkelsen av syre er ryggraden i behandlingen for GERD. For milde reflukssymptomer er reseptfrie medisiner ofte brukt, alt fra syrenøytraliserende midler til lave doser medikamenter kalt H-2-reseptorantagonister eller H2-blokkere. Eksempler på reseptfrie H2-blokkere er cimetidin (Tagamet) og famotidin (Pepcid, Zantac 360). For mer vedvarende symptomer kan høyere (reseptbelagte) doser av H-2-reseptorantagonistmedisiner brukes, for eksempel:
For vedvarende symptomer som krever vedlikeholdsbehandling (pågående) eller for komplisert GERD med strikturer eller blødninger, brukes protonpumpehemmere (PPI). Eksempler på PPI er:
Noen pasienter trenger kun å ta én pille daglig, mens andre trenger to piller (en dobbel dose) for å kontrollere symptomene. Den doble dosen kan tas som én pille to ganger daglig eller 2 piller én gang daglig.
PPI er potente hemmere av syresekresjon fra magen. De er effektive for å lindre halsbrann og helbrede esophageal betennelse (øsofagitt) og esophageal ulcers som er indusert av sur refluks. PPI-ene tolereres godt med få bivirkninger. Etter å ha stoppet disse medisinene, kommer symptomene på sure oppstøt vanligvis tilbake, noen ganger med økt intensitet. Denne økningen i symptomer oppstår delvis på grunn av en rebound-sekresjon av syre (syrehypersekresjon), som er en respons foranlediget av utvinning fra hemming av sekresjon av syre av PPI.
Den langsiktige sikkerheten til PPI-ene er en viktig faktor. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Disse inkluderer:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 GERD 101:Nutrition for Reflux
Hvis du noen gang har følt at det brenner i brystet ditt, kan det hende du har opplevd halsbrann – det er IKKE en behagelig følelse. For mange mennesker skjer dette regelmessig, og forstyrrer livene d
GERD 101:Nutrition for Reflux
Hvis du noen gang har følt at det brenner i brystet ditt, kan det hende du har opplevd halsbrann – det er IKKE en behagelig følelse. For mange mennesker skjer dette regelmessig, og forstyrrer livene d
 Del 4:Gjeninnføring av mat etter elementærdietten
I den tredje delen av bloggserien min Elemental Diet snakket jeg om hvordan du kan slutte med Elemental Diet og tingene du må vurdere før du introduserer mat igjen. Nå skal vi dykke dypere inn i gje
Del 4:Gjeninnføring av mat etter elementærdietten
I den tredje delen av bloggserien min Elemental Diet snakket jeg om hvordan du kan slutte med Elemental Diet og tingene du må vurdere før du introduserer mat igjen. Nå skal vi dykke dypere inn i gje
 9 grunner til at SIBO-en din ikke klareres
Jeg kommer aldri til å glemme frustrasjonen jeg følte da jeg trodde jeg hadde funnet svaret på helseproblemene mine – enten det var å finne ut at jeg hadde cøliaki og starte en glutenfri diett, eller
9 grunner til at SIBO-en din ikke klareres
Jeg kommer aldri til å glemme frustrasjonen jeg følte da jeg trodde jeg hadde funnet svaret på helseproblemene mine – enten det var å finne ut at jeg hadde cøliaki og starte en glutenfri diett, eller