 10 % des patients atteints de RGO développent un œsophage de Barrett, un facteur de risque de cancer de l'œsophage.
10 % des patients atteints de RGO développent un œsophage de Barrett, un facteur de risque de cancer de l'œsophage.

L'œsophage de Barrett n'a pas de symptômes uniques. Les patients atteints de la maladie de Barrett présentent les symptômes du RGO ou du reflux acide, notamment :
L'œsophage de Barrett est une complication du reflux gastro-œsophagien chronique (RGO), principalement chez les hommes blancs. Le RGO est une maladie caractérisée par un reflux de liquide acide de l'estomac vers l'œsophage (le tube de déglutition). Le RGO provoque le plus souvent des brûlures d'estomac.
Il y a deux exigences pour le diagnostic de l'œsophage de Barrett. Les exigences nécessitent une endoscopie de l'œsophage. Pendant l'endoscopie, un long tube flexible avec une lumière et une caméra à son extrémité (un endoscope) est inséré par la bouche et dans l'œsophage pour visualiser et biopsier (échantillon de tissu de) la muqueuse de l'œsophage. Les deux exigences sont :
L'œsophage de Barrett est officiellement codé par la Bibliothèque du Congrès pour les recherches électroniques de la littérature sous le nom d'œsophage de Barrett, mais l'œsophage de Barrett (avec l'apostrophe «s») est le nom utilisé universellement. La condition porte le nom d'un chirurgien, Norman Barrett, qui a décrit la condition. Cependant, il s'avère que son interprétation des conclusions n'était pas correcte. En 1953, les docteurs Allison et Johnstone ont en fait décrit cette condition telle que nous la comprenons maintenant, à savoir qu'une métaplasie se produisait. (La métaplasie, qui est discutée ci-dessous, est le terme utilisé lorsqu'un tissu adulte en remplace un autre.) Néanmoins, la condition a été immortalisée avec le nom de Barrett.
Au départ, on pensait que l'œsophage de Barrett était constitué de tissu gastrique remplaçant le tissu squameux habituel qui tapisse l'œsophage. Cependant, au milieu des années 70, le Dr Paull et ses collègues ont publié un article dans lequel ils décrivaient la muqueuse (paroi interne) de l'œsophage de Barrett de manière plus détaillée qu'auparavant. Ils ont souligné que l'œsophage de Barrett consistait en une métaplasie dans laquelle les cellules normales tapissant l'œsophage étaient remplacées par un mélange de cellules tapissant l'estomac et l'intestin. Les cellules de revêtement de type intestinal sont également appelées cellules cylindriques spécialisées qui comprennent des cellules caliciformes. Pendant un certain nombre d'années, certains scientifiques ont pensé qu'il existait deux types de Barrett; l'un dans lequel la muqueuse normale a été remplacée par des cellules de type estomac (gastrique) uniquement, et le second dans lequel des cellules intestinales étaient présentes. Cependant, la croyance actuelle est que seule la présence de cellules caliciformes de type intestinal établit le diagnostic d'œsophage de Barrett, quels que soient les autres types de cellules présents.
La raison du grand intérêt pour l'œsophage de Barrett est qu'il est associé à un risque accru de cancer de l'œsophage. Le type de cancer qui survient chez les patients atteints de la maladie de Barrett est l'adénocarcinome, qui provient du tissu intestinal métaplasique. Le cancer habituel de l'œsophage qui n'est pas associé à la maladie de Barrett est le carcinome épidermoïde, qui provient de la muqueuse épidermoïde normalement présente dans l'œsophage. Le lien entre l'adénocarcinome de l'œsophage et l'œsophage de Barrett est désormais clair, et la fréquence de l'adénocarcinome de l'œsophage augmente dans la plupart des pays de l'hémisphère occidental.
La bonne nouvelle, cependant, est que le cancer survient chez relativement peu de patients atteints de l'œsophage de Barrett. Pourtant, le principal défi dans cette condition est de surveiller les signes avant-coureurs du cancer en effectuant des biopsies à intervalles réguliers pendant l'endoscopie. Cette pratique est appelée surveillance et est similaire, en principe, à la surveillance chez les femmes du cancer du col de l'utérus, où des frottis PAP sont effectués à intervalles réguliers.
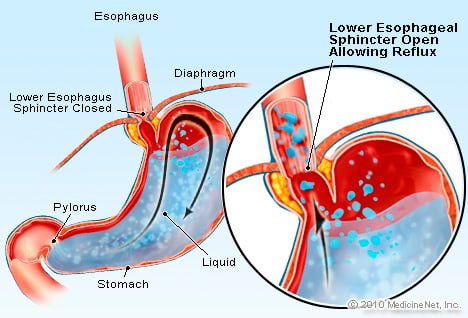
 Le RGO est une condition dans laquelle un excès de liquide contenant de l'acide reflue (reflue) dans l'œsophage, en partie parce que le sphincter inférieur de l'œsophage est faible.
Le RGO est une condition dans laquelle un excès de liquide contenant de l'acide reflue (reflue) dans l'œsophage, en partie parce que le sphincter inférieur de l'œsophage est faible. Le RGO provoque l'œsophage de Barrett. L'œsophage est un tube musculaire situé dans la poitrine et servant à transférer les aliments de la bouche à l'estomac. Le sphincter inférieur de l'œsophage (LES) est une valve située à la jonction de l'estomac avec l'œsophage. Sa fonction est d'empêcher l'acide et d'autres contenus de l'estomac de revenir dans l'œsophage. Le RGO est une affection dans laquelle un excès de liquide contenant de l'acide reflue (reflue) dans l'œsophage, en partie parce que le sphincter inférieur de l'œsophage est faible. La faiblesse du LES peut être liée, en partie, au fait que pratiquement tous les patients atteints de RGO ont une hernie hiatale. Chez les patients souffrant d'une hernie hiatale, les quelques centimètres supérieurs de l'estomac glissent entre l'abdomen et la poitrine à travers le diaphragme. Ce glissement peut interférer avec le fonctionnement du sphincter en tant que barrière au reflux de l'estomac vers l'œsophage.
Auparavant, le terme hernie était utilisé à la place de RGO pour expliquer aux patients la base de leurs symptômes (généralement des brûlures d'estomac) car pratiquement tous les patients atteints de RGO ont des hernies hiatales. RGO, cependant, est le terme le plus précis. Bien que les hernies hiatales soient extrêmement courantes dans la population, seul un petit nombre de personnes atteintes d'une hernie hiatale développent un RGO. En d'autres termes, la présence d'une hernie hiatale ne signifie pas que la personne développera un RGO. D'un autre côté, cependant, si une personne souffre de RGO, une hernie hiatale est presque toujours présente.
Ainsi, l'œsophage de Barrett est causé par un reflux acide chronique (d'une durée de plusieurs années) et généralement sévère. Chez certains patients atteints de RGO, l'œsophage réagit aux blessures répétées du liquide acide en changeant le type de cellules qui le tapissent de squameuses (cellules normales) à cylindriques (cellules de type intestinal). Cette transformation, appelée métaplasie, est considérée comme une réponse protectrice, car l'épithélium cylindrique spécialisé (épithélium signifie revêtement) de l'œsophage de Barrett est plus résistant aux lésions causées par l'acide que l'épithélium squameux.
Le liquide dans l'estomac contient de l'acide qui est produit par l'estomac. De plus, cependant, le liquide peut contenir des acides biliaires (provenant de la bile produite par le foie) et des enzymes (produites par le pancréas) qui ont reflué du duodénum dans l'estomac. (Le duodénum est la première partie de l'intestin grêle juste au-delà de l'estomac.) L'acide qui reflue de l'estomac vers l'œsophage est nocif pour l'œsophage. Il existe cependant des preuves que les enzymes biliaires et pancréatiques associées à l'acide peuvent être plus nocives que l'acide seul.
Un pourcentage important d'individus présentant des symptômes chroniques de RGO développent un œsophage de Barrett, et il est plus fréquent chez les hommes de race blanche. Cependant, toutes les personnes atteintes de RGO ne présentent pas de symptômes de RGO. Par conséquent, certaines personnes atteintes de la maladie de Barrett ne savent pas qu'elles sont atteintes de la maladie de Barrett, car elles souffrent de RGO sans aucun symptôme ou présentent des symptômes très légers et peu fréquents.
On ne sait pas pourquoi l'œsophage de Barrett est si massivement plus fréquent chez les hommes blancs que dans tout autre groupe. Par exemple, bien que les femmes et les Afro-Américains ne semblent pas être protégés contre le développement du RGO, ils sont largement protégés (en particulier les Afro-Américains) contre le développement de l'œsophage de Barrett et du cancer de Barrett (adénocarcinome). Il est prouvé que dans l'hémisphère occidental, le cancer de l'œsophage et le cancer de la jonction gastro-œsophagienne (appelé cancer du cardia) augmentent en fréquence, peut-être plus que tout autre cancer du tractus gastro-intestinal. (Cependant, le cancer du côlon est encore beaucoup plus fréquent que le cancer de l'œsophage.)
L'œsophage de Barrett peut courir dans certaines familles et être génétiquement déterminé. Des études sont en cours pour déterminer si des gènes ou des marqueurs peuvent être trouvés dans ces familles qui permettraient de prédire le développement de l'œsophage de Barrett dans la population générale. Dans ces familles avec Barrett ainsi qu'avec Barrett dans la population générale, le RGO est le dénominateur commun. Cependant, la question est de savoir pourquoi la maladie de Barrett survient plus fréquemment dans ces familles que dans d'autres avec un RGO relativement grave, mais sans association familiale.
Pour répéter, le premier critère pour le diagnostic de l'œsophage de Barrett est la découverte à l'endoscopie d'une muqueuse rose dans l'œsophage où elle n'est normalement pas vue. Cette muqueuse anormale peut apparaître circonférentiellement comme une bande, comme une langue ou comme des îles. Le deuxième critère est que les biopsies de la muqueuse rose révèlent la muqueuse intestinalisée caractéristique (la muqueuse normalement observée dans les intestins) avec les cellules caliciformes typiques. Les biopsies oesophagiennes sont obtenues lors d'une endoscopie. Une endoscopie gastro-intestinale supérieure est une procédure dans laquelle le médecin insère un long tube flexible (endoscope) dans la bouche et dans l'œsophage pour visualiser directement la muqueuse de l'œsophage. Au cours du même examen endoscopique, l'estomac et le duodénum peuvent également être visualisés. Plusieurs petits échantillons (biopsies) du tissu épithélial de revêtement peuvent être obtenus à travers l'endoscope.
Comme mentionné précédemment, le processus de remplacement d'un type de revêtement tissulaire par un autre est appelé métaplasie. Dans l'estomac et les intestins, la métaplasie est une réponse courante à certains types de blessures. Comme Henry Appelman, un pathologiste, l'a déclaré :"Lorsque l'intestin est stressé, il veut être autre chose." D'autres exemples de métaplasie dans laquelle une muqueuse en remplace une autre sont :(1) dans l'estomac où une inflammation chronique (gastrite) peut entraîner une muqueuse de type intestinal remplaçant des parties de la muqueuse normale de l'estomac; et (2) dans le duodénum (juste au-delà de l'estomac dans l'intestin) où les ulcères gastro-duodénaux se produisent et la muqueuse intestinale entourant l'ulcère se transforme en une muqueuse de type estomac.
Nous pensons que le processus de métaplasie est une réponse protectrice ou adaptative à une lésion de la muqueuse. Cependant, l'inconvénient de la métaplasie est que dans l'œsophage de Barrett, elle entraîne une augmentation faible mais certaine du risque de devenir cancéreuse. Toutes les métaplasies n'ont pas un risque accru de cancer. Par exemple, parmi les deux métaplasies mentionnées dans le paragraphe précédent, la métaplasie intestinale dans l'estomac peut entraîner un cancer, mais pas la métaplasie intestinale dans le duodénum.
Le processus de développement de Barrett commence à la jonction des muqueuses de l'estomac et de l'œsophage. L'œsophage est normalement tapissé par un épithélium squameux ou une couche de revêtement. Cet épithélium squameux a un aspect blanc nacré, tandis que la muqueuse de l'estomac et des intestins a une couleur plus rose saumon car il s'agit d'un épithélium cylindrique plutôt que d'un épithélium squameux. L'épithélium squameux est constitué de cellules squameuses plates, qui ressemblent aux cellules de la peau. L'estomac ou la muqueuse gastrique est constitué de cellules cylindriques plus hautes, comme on le voit au microscope. La jonction de l'épithélium squameux de l'œsophage et de l'épithélium cylindrique gastrique se produit à la jonction de l'œsophage et de l'estomac où, comme vous vous en souvenez, se trouve le sphincter inférieur de l'œsophage. La frontière commune (interface) de ces deux revêtements est souvent appelée la ligne Z, car lorsqu'elle est examinée lors d'une endoscopie, elle a un aspect en zigzag.
Avec une lésion progressive de l'œsophage, une métaplasie se produit et le tissu métaplasique remonte l'œsophage sur une distance qui varie d'une personne à l'autre, généralement d'environ 0,5 à 2,5 pouces (environ 1 à 6 centimètres). Le type de cellule qui donne naissance au tissu métaplasique n'est pas connu.
L'œsophage de Barrett est souvent classé en segments courts ou longs de Barrett, en fonction de la longueur de l'œsophage affecté. Le segment court de Barrett fait généralement référence à une atteinte de 3 centimètres ou moins, tandis que le segment long signifie une atteinte de plus de 3 centimètres de l'œsophage. Fait intéressant, une fois que l'œsophage de Barrett est diagnostiqué chez un patient, la muqueuse métaplasique ne semble pas progresser plus loin dans l'œsophage si le patient est traité pour un RGO. Ainsi, au fil du temps, la durée de l'implication avec Barrett reste généralement la même.
Si des biopsies sont prélevées sur des patients atteints de RGO qui ont une ligne Z d'apparence normale (aucune preuve visible de l'œsophage de Barrett), jusqu'à 30 % montreront la même métaplasie de type intestinal avec des cellules caliciformes que celles observées dans l'œsophage de Barrett. Cependant, nous ne biopsions pas systématiquement les lignes Z d'apparence normale pour rechercher ce changement, et nous ne faisons pas non plus de surveillance lorsque nous le trouvons là-bas. La raison en est que la métaplasie intestinale limitée de la région de la jonction gastro-œsophagienne dans le RGO semble se produire avec une fréquence similaire chez les femmes et les Afro-Américains que chez les hommes blancs, mais le risque d'œsophage manifeste de Barrett est bien moindre que chez les hommes blancs.
Par conséquent, la présence d'une métaplasie sur une biopsie de routine d'une ligne Z d'apparence normale dans le RGO ne devrait entraîner aucune modification de la prise en charge. De plus, la découverte de cellules caliciformes dans ce contexte ne devrait pas être qualifiée, comme certains l'ont suggéré, de segment ultracourt de Barrett. La raison principale pour ne pas l'étiqueter comme Barrett est que le terme Barrett implique un risque accru de cancer, et il n'y a aucune preuve que cette découverte soit associée à un risque accru de cancer.
Le type de cancer qui survient avec l'œsophage de Barrett est l'adénocarcinome. Le cancer provenant de la muqueuse squameuse de l'œsophage est appelé cancer squameux ou carcinome. Chez les Caucasiens, le taux (fréquence dans le temps) de cancer épidermoïde diminue par rapport à l'adénocarcinome associé à Barrett. Cependant, d'autres groupes raciaux (par exemple, les Afro-Américains) n'ont pas connu le même taux de déclin du cancer épidermoïde par rapport à l'adénocarcinome.
Le tabagisme et l'ingestion excessive d'alcool sont des facteurs de risque certains des cancers squameux. Ils sont également des facteurs de risque d'adénocarcinome observé dans l'œsophage de Barrett. Dans cette situation, cependant, il n'est pas clair si le tabagisme et l'alcool augmentent le risque d'adénocarcinome en rendant le RGO plus grave ou si le tabagisme et l'alcool ont un effet cancérigène plus direct, comme cela se produit dans le cancer squameux. Les cancers épidermoïdes sont devenus de moins en moins fréquents, tandis que les diagnostics d'adénocarcinome ont augmenté. L'incidence de l'adénocarcinome chez les hommes blancs a augmenté plus fortement que dans les autres groupes ethniques.
Dans le reste de cette section, le terme cancer de l'œsophage fera référence à l'adénocarcinome résultant de l'œsophage de Barrett.
Le cancer de la jonction gastro-œsophagienne est également appelé cancer du cardia parce que la région où l'œsophage rencontre l'estomac s'appelle le cardia. Ce cancer, comme l'adénocarcinome associé à Barrett, se trouve principalement chez les hommes de race blanche, sa fréquence augmente apparemment au même rythme que le cancer de l'œsophage et est associé au RGO chronique. Par conséquent, il a été spéculé que le cancer du cardia commence à partir de segments courts (par exemple, 1-2 cm) de Barrett. Au moment où le diagnostic de cancer est posé, cependant, la tumeur peut s'être propagée au-delà du segment court de Barrett et peut sembler se trouver dans le cardia. Cette spéculation sur l'origine du cancer du cardia reste cependant à prouver.
Une augmentation de la fréquence des adénocarcinomes de l'œsophage a été observée depuis au moins 20 ans, principalement chez les hommes de race blanche. Un indice de la raison de cette tendance peut être lié à une diminution de la fréquence de H. pylori infection de l'estomac. En d'autres termes, les personnes atteintes du cancer de Barrett, y compris le cancer du cardia, semblent avoir des taux inférieurs de H. pylori infection que les autres personnes du même âge et du même sexe dans la même population.
H. pylori est un type de bactérie qui est une cause majeure d'ulcères. Il s'agit d'une infection très courante dans le monde et ne provoque aucun symptôme chez la grande majorité des personnes touchées. Cependant, certaines personnes atteintes de H. pylori développer un ulcère peptique de l'estomac et du duodénum. Ces ulcères sont traités en éliminant les bactéries, ce qui, à son tour, empêche la rechute des ulcères.
Si H. pylori non traitée, elle provoque une inflammation progressive de l'estomac (gastrite) qui est associée à une réduction de la sécrétion d'acide et peut-être moins de reflux d'acide dans l'œsophage. Dans de nombreuses régions du monde, cette infection diminue en fréquence, probablement en raison de meilleures mesures de santé publique. Par conséquent, il est possible que l'effet protecteur (tel qu'une diminution de la production d'acide) de l'H. pylori l'infection a diminué. En d'autres termes, avec moins de H. pylori gastrite, l'estomac produit plus d'acide et il y a plus d'acide à refluer dans l'œsophage. En même temps, nous sommes plus prédisposés au reflux dans nos années seniors. Bien que ce ne soit pas un problème résolu, la fréquence décroissante de H. pylori l'infection peut être l'une des raisons de la fréquence croissante de l'adénocarcinome associé à Barrett.
La dysplasie est un changement dans les cellules tapissant l'œsophage dans lequel les cellules présentent en fait des changements anormaux dans leur structure et leur apparence. Lorsque ces changements deviennent suffisamment graves (passant d'une dysplasie de bas grade à une dysplasie de haut grade), les cellules commencent à apparaître malignes (comme les cellules cancéreuses). Cependant, contrairement au cancer, ces cellules restent en place et n'envahissent pas les tissus à l'extérieur de la muqueuse. La dysplasie survient sous la forme d'une série de changements cellulaires au fur et à mesure que l'œsophage de Barrett évolue vers un cancer associé à Barrett. Les patients atteints de la maladie de Barrett sont suivis par endoscopie et biopsies (surveillance) pour détecter ces changements cellulaires (la dysplasie) ou au pire, un cancer précoce afin qu'ils puissent être traités. Actuellement, il n'existe aucun moyen de prédire quels patients atteints de l'œsophage de Barrett développeront une dysplasie.
La dysplasie a également été identifiée adjacente à des tumeurs du tractus gastro-intestinal autres que l'adénocarcinome de l'œsophage. Par exemple, la dysplasie se retrouve dans la moitié des cas de cancer de l'estomac et dans le cancer du côlon, dans lesquels la dysplasie est visible sous la forme de polypes dits adénomateux. De plus, la dysplasie est le même changement cellulaire d'alerte précoce que les pathologistes recherchent dans les frottis PAP du col de l'utérus qui prédisent le cancer du col de l'utérus.
La dysplasie est considérée comme précancéreuse. Cela signifie que si la dysplasie a été démontrée à plusieurs reprises, on pense que le patient développera un cancer s'il vit assez longtemps. La dysplasie est classée comme étant de haut grade ou de bas grade. Lorsqu'une dysplasie de haut grade est diagnostiquée, le cancer peut déjà être présent, et si ce n'est pas le cas, le risque de développer un cancer plus tôt est plus élevé qu'avec les grades inférieurs de dysplasie.
Dans les biopsies de suivi de patients atteints de dysplasie, la condition peut ne pas être détectée à nouveau chez certains patients, alors que chez d'autres, de faibles grades de dysplasie sont trouvés. Cette absence ou diminution de la dysplasie peut être due à des facteurs tels que des variations d'échantillonnage, l'élimination de minuscules foyers (groupes de cellules) de dysplasie avec la biopsie initiale, ou une inversion biologique réelle. La ou les raisons exactes sont inconnues.
En utilisant des techniques moléculaires, certains changements appelés biomarqueurs peuvent être détectés dans des échantillons de biopsie avant que la dysplasie ne se développe. Ces changements sont similaires à ceux qui sont observés dans d'autres cancers. Les biomarqueurs comprennent les changements dans le contenu en ADN des cellules, dans les gènes et les chromosomes, et dans les facteurs de croissance. On peut montrer qu'un certain nombre de ces biomarqueurs apparaissent avant et pendant l'apparition de la dysplasie. Le but ultime est de trouver un marqueur magique qui peut nous dire quels patients parmi ceux qui n'ont pas de dysplasie ou de dysplasie de bas grade sont les plus susceptibles de développer une dysplasie de haut grade ou un cancer. Ces patients peuvent alors être suivis par une surveillance plus étroite que d'autres.
Actuellement, tous les patients atteints d'œsophage de Barrett, du point de vue de la surveillance, sont traités de la même manière. La disponibilité de biomarqueurs séparerait (stratifierait) les patients de Barrett en fonction de leur risque de cancer. Une telle stratification permettrait aux médecins d'effectuer des endoscopies de surveillance et des biopsies plus fréquemment chez la minorité de patients qui présentent un risque plus élevé de cancer et moins fréquemment chez ceux dont on prédit qu'ils ont un risque plus faible de cancer.
Une autre utilisation des biomarqueurs éprouvés serait d'aider à confirmer l'interprétation de la dysplasie par le pathologiste sur les biopsies.
Lorsque les patients atteints de l'œsophage de Barrett sont évalués en groupe, le risque de cancer s'est avéré être aussi faible qu'un patient sur 300 par an. Cela signifie que si nous examinions 300 patients par an, un patient serait atteint d'un cancer chaque année. Ce qu'il faut vraiment savoir, c'est le risque de cancer si aucune dysplasie n'est retrouvée après un ou deux ans de surveillance. Notre conviction est que ce risque serait bien inférieur aux chiffres précédemment cités d'un patient sur 300 par an.
Les patients atteints de dysplasie de haut grade peuvent souvent être atteints d'un cancer. Par conséquent, le premier ordre de prise en charge en cas de découverte d'une dysplasie de haut grade consiste à exclure la présence d'un adénocarcinome.
La dysplasie de bas grade est beaucoup moins menaçante que la dysplasie de haut grade, mais nous ne savons pas à quel point. En fait, nous ne disposons pas de données précises pour indiquer exactement quel est le risque de cancer chez les patients atteints de dysplasie de Barrett et de bas grade.
Le diagnostic de dysplasie doit être le plus précis possible car ce diagnostic peut entraîner une modification du traitement ou de l'intensité du suivi des patients atteints d'œsophage de Barrett. Il faut une grande expérience pour pouvoir poser un diagnostic précis de la présence et du grade de la dysplasie. Par conséquent, il est courant et utile de demander à un deuxième pathologiste (ou même à un troisième, si nécessaire) de revoir les biopsies. L'idée est de voir s'il y a un accord entre les pathologistes et/ou d'avoir un avis plus expérimenté sur la présence et le grade de la dysplasie.
Si une personne a un segment de Barrett plus long, on pourrait supposer que le risque de cancer est plus élevé qu'avec un segment de Barrett plus court. Les données, cependant, sont controversées à cet égard. Pour cette raison, la pratique actuelle consiste à effectuer une surveillance par biopsie endoscopique avec une fréquence similaire chez les patients atteints d'œsophage de Barrett à segments courts et longs.
L'œsophage de Barrett n'a pas de symptômes uniques. Les patients atteints de la maladie de Barrett présentent les symptômes du RGO (par exemple, brûlures d'estomac, régurgitations, nausées, etc.). La tendance générale est que les patients de Barrett ont un RGO plus sévère. Cependant, tous les Barrett ne présentent pas de symptômes marqués de RGO, et certains patients sont détectés accidentellement avec peu ou pas de symptômes de RGO.
Les brûlures d'estomac sont une sensation de brûlure derrière le sternum, généralement dans la moitié inférieure, mais peuvent s'étendre jusqu'à la gorge. Parfois, il s'accompagne de brûlures ou de douleurs dans le creux de l'estomac juste en dessous de l'endroit où se termine le sternum. Le deuxième symptôme le plus courant est la régurgitation (sauvegarde) de liquide au goût amer. Les symptômes du RGO sont souvent pires après les repas et en position couchée.
Le liquide reflué et régurgité peut parfois pénétrer dans les poumons ou la boîte vocale (larynx), entraînant ce qu'on appelle des symptômes extra-œsophagiens (à l'extérieur de l'œsophage) (manifestations) du RGO. Ces symptômes incluent :
Pour des raisons qui ne sont pas entièrement comprises, certains patients atteints de RGO ont des brûlures d'estomac minimes, mais présentent d'autres symptômes de RGO, par exemple des symptômes extra-œsophagiens.
Le RGO peut entraîner des rétrécissements et une ulcération de l'œsophage. Un rétrécissement ou un rétrécissement est dû à une cicatrisation (fibrose) de l'œsophage qui peut entraîner des difficultés à avaler (dysphagie). La dysphagie est ressentie comme un blocage (arrêt) d'aliments solides dans la poitrine (dans l'œsophage), et de liquides lorsque le rétrécissement est sévère. Les rétrécissements peuvent être traités en les étirant avec des dilatateurs pendant l'endoscopie. Non traitées, les sténoses peuvent favoriser le déversement d'aliments et/ou de liquides gastriques dans les poumons. Peu fréquemment, des saignements gastro-intestinaux (GI) massifs causés par une inflammation de l'œsophage peuvent survenir. De tels saignements entraînent des vomissements de sang ou le passage de selles noires ou marron. Plus fréquemment, cependant, un œsophage enflammé peut provoquer des saignements lents qui sont détectés lorsqu'une anémie (faible nombre de globules rouges) est détectée et/ou que les selles sont testées pour le sang.
Les traitements médicaux des symptômes de l'œsophage de Barrett sont les mêmes que ceux du RGO.
La suppression de l'acide est l'épine dorsale du traitement du RGO. Pour les symptômes de reflux légers, des médicaments en vente libre sont couramment utilisés, allant des antiacides à de faibles doses de médicaments appelés antagonistes des récepteurs H-2 ou anti-H2. Des exemples de bloqueurs H2 en vente libre sont la cimétidine (Tagamet) et la famotidine (Pepcid, Zantac 360). Pour des symptômes plus persistants, des doses plus élevées (sur ordonnance) des médicaments antagonistes des récepteurs H-2 peuvent être utilisées, par exemple :
Cependant, pour les symptômes persistants nécessitant un traitement d'entretien (continu) ou pour le RGO compliqué avec des sténoses ou des saignements, des inhibiteurs de la pompe à protons (IPP) sont utilisés. Voici des exemples de PPI :
Certains patients n'ont besoin de prendre qu'un seul comprimé par jour, tandis que d'autres ont besoin de deux comprimés (une double dose) pour contrôler les symptômes. La double dose peut être prise sous la forme d'un comprimé deux fois par jour ou de 2 comprimés une fois par jour.
Les IPP sont de puissants inhibiteurs de la sécrétion acide de l'estomac. Ils sont efficaces pour soulager les brûlures d'estomac et guérir l'inflammation de l'œsophage (œsophagite) et les ulcères de l'œsophage induits par le reflux acide. Les IPP sont bien tolérés avec peu d'effets secondaires. Après l'arrêt de ces médicaments, les symptômes de reflux acide réapparaissent généralement, parfois avec une intensité accrue. Cette augmentation des symptômes se produit, en partie, en raison d'un rebond de la sécrétion d'acide (hypersécrétion d'acide), qui est une réponse déclenchée par la récupération de l'inhibition de la sécrétion d'acide par l'IPP.
La sécurité à long terme des IPP est une considération importante. Bien que certaines tumeurs de l'estomac (carcinoïdes) aient été signalées lors d'expériences avec des rats femelles plus âgés, des tumeurs similaires n'ont pas été observées chez les personnes après plus de 15 ans d'utilisation d'IPP. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Ceux-ci incluent :
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Giardiase (Giardia Lamblia)
Giardiase (Giardia Lamblia)
 Comment savoir quand des selles pâles ou argileuses peuvent être un problème
Comment savoir quand des selles pâles ou argileuses peuvent être un problème
 Comment traiter une hémorroïde qui saigne ?
Comment traiter une hémorroïde qui saigne ?
 Pourquoi mon pipi sent-il si mauvais ?
Pourquoi mon pipi sent-il si mauvais ?
 Prolifération bactérienne de l'intestin grêle (SIBO)
Prolifération bactérienne de l'intestin grêle (SIBO)
 Aliments fermentés et santé intestinale :que dit la science aujourd'hui ?
Aliments fermentés et santé intestinale :que dit la science aujourd'hui ?
 Qu'est-ce qui cause la douleur abdominale supérieure gauche ?
Quest-ce quune douleur abdominale en haut à gauche ? La douleur dans labdomen supérieur gauche peut être intense. Elle peut être causée par une série de problèmes, le plus souvent des problèmes des
Qu'est-ce qui cause la douleur abdominale supérieure gauche ?
Quest-ce quune douleur abdominale en haut à gauche ? La douleur dans labdomen supérieur gauche peut être intense. Elle peut être causée par une série de problèmes, le plus souvent des problèmes des
 Un microbiome fort au début de la vie lié à moins d'infections respiratoires
Il existe des colonies de bactéries microscopiques dans différentes parties du corps humain, y compris le nez, bouche, intestins, et les poumons. Collectivement, ces bactéries sont connues comme le mi
Un microbiome fort au début de la vie lié à moins d'infections respiratoires
Il existe des colonies de bactéries microscopiques dans différentes parties du corps humain, y compris le nez, bouche, intestins, et les poumons. Collectivement, ces bactéries sont connues comme le mi
 Qu'est-ce que l'épiploon ?
Lépiploon est le tissu adipeux qui fixe les intestins et les autres organes abdominaux en place, leur fournissant du sang ainsi que les protéger physiquement. Lépiploon (policier de labdomen) est une
Qu'est-ce que l'épiploon ?
Lépiploon est le tissu adipeux qui fixe les intestins et les autres organes abdominaux en place, leur fournissant du sang ainsi que les protéger physiquement. Lépiploon (policier de labdomen) est une