 10 % av patienterna med GERD utvecklar Barretts esofagus, en riskfaktor för cancer i matstrupen.
10 % av patienterna med GERD utvecklar Barretts esofagus, en riskfaktor för cancer i matstrupen.

Barretts matstrupe har inga unika symtom. Patienter med Barretts har symtom på GERD eller sura uppstötningar inkluderar följande:
Barretts matstrupe är en komplikation av kronisk gastroesofageal refluxsjukdom (GERD), främst hos vita män. GERD är en sjukdom där sur vätska återflöde från magsäcken till matstrupen (sväljslangen). GERD orsakar oftast halsbränna.
Det finns två krav för diagnos av Barretts esofagus. Kraven kräver endoskopi av matstrupen. Under endoskopi förs ett långt flexibelt rör med ett ljus och en kamera i spetsen (ett endoskop) in genom munnen och ner i matstrupen för att se och biopsi (provvävnad från) matstrupens slemhinna. De två kraven är:
Barretts esophagus är officiellt kodad av Library of Congress för elektroniska sökningar i litteraturen som Barrett esophagus, men Barretts esophagus (med apostrof "s") är det namn som används universellt. Tillståndet är uppkallat efter en kirurg, Norman Barrett, som beskrev tillståndet. Det visar sig dock att hans tolkning av fynden inte var korrekt. 1953 beskrev doktorernas Allison och Johnstone faktiskt detta tillstånd som vi nu förstår det, nämligen att metaplasi inträffade. (Metaplasi, som diskuteras nedan, är termen som används när en vuxen vävnad ersätter en annan.) Ändå har tillståndet förevigats med Barretts namn.
Till en början trodde man att Barretts matstrupe bestod av magvävnad (magvävnad) som ersatte den vanliga skivepitelvävnaden som kantade matstrupen. Men i mitten av 70-talet publicerade Dr. Paull och hans kollegor en artikel där de beskrev slemhinnan (innerslemhinnan) i Barretts matstrupe mer detaljerat än vad som tidigare gjorts. De påpekade att Barretts esofagus bestod av en metaplasi där de normala cellerna i matstrupen ersattes av en blandning av mag- och tarmslemhinneceller. De beklädnade cellerna av tarmtyp kallas också specialiserade kolumnära celler som inkluderar bägareceller. Under ett antal år trodde vissa forskare att det fanns två typer av Barretts; en där den normala slemhinnan ersattes med endast magceller (magceller), och den andra där tarmceller fanns. Men den nuvarande uppfattningen är att endast närvaron av bägareceller av tarmtyp fastställer diagnosen Barretts matstrupe, oavsett vilka andra celltyper som finns.
Anledningen till det stora intresset för Barretts matstrupe är att det är förknippat med en ökad risk för cancer i matstrupen. Den typ av cancer som uppstår hos patienter med Barretts är adenokarcinom, som uppstår från den metaplastiska tarmvävnaden. Den vanliga cancern i matstrupen som inte är förknippad med Barretts är skivepitelcancer, som uppstår från skivepitelcellfodret som normalt finns i matstrupen. Sambandet mellan adenokarcinom i matstrupen och Barretts matstrupe är nu tydligt, och adenokarcinom i matstrupen ökar i frekvens i de flesta länder på västra halvklotet.
Den goda nyheten är dock att cancern förekommer hos relativt få patienter med Barretts matstrupe. Ändå är den största utmaningen i detta tillstånd att se efter tidiga varningstecken på cancer genom att ta biopsier med jämna mellanrum under endoskopi. Denna praxis kallas övervakning och liknar i princip övervakning hos kvinnor för cancer i livmoderhalsen, där PAP-utstryk tas med jämna mellanrum.
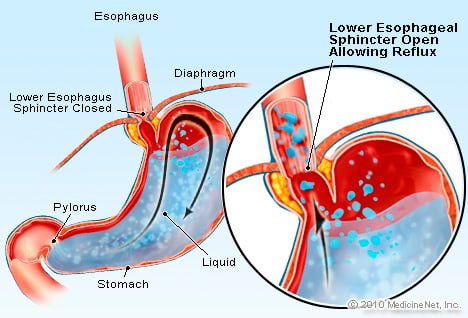
 GERD är ett tillstånd där överdrivna syrahaltiga vätskor återlopp (strömmar) tillbaka in i matstrupen, delvis pga. den nedre esofagusfinktern är svag.
GERD är ett tillstånd där överdrivna syrahaltiga vätskor återlopp (strömmar) tillbaka in i matstrupen, delvis pga. den nedre esofagusfinktern är svag. GERD orsakar Barretts matstrupe. Matstrupen är ett muskelrör som sitter i bröstet och tjänar till att överföra mat från munnen till magen. Den nedre esofagussfinktern (LES) är en ventil som är belägen vid förbindelsen mellan magen och matstrupen. Dess funktion är att förhindra syra och annat innehåll i magsäcken från att komma tillbaka till matstrupen. GERD är ett tillstånd där överdriven syrahaltig vätska återflödet (strömmar) tillbaka in i matstrupen, delvis på grund av att den nedre esofagusfinktern är svag. Svagheten hos LES kan delvis vara relaterad till det faktum att praktiskt taget alla GERD-patienter har hiatalbråck. Hos patienter med hiatalbråck glider de övre centimeterna av magen fram och tillbaka mellan buken och bröstkorgen genom diafragman. Denna glidning kan störa hur sfinktern fungerar som en barriär mot reflux från magsäcken till matstrupen.
Tidigare användes termen bråck istället för GERD för att förklara för patienter grunden för deras symtom (vanligtvis halsbränna) eftersom praktiskt taget alla GERD-patienter har hiatalbråck. GERD är dock den mer exakta termen. Medan hiatal bråck är extremt vanliga i befolkningen, utvecklar bara ett litet antal personer med hiatal bråck GERD. Med andra ord, förekomsten av ett hiatalbråck betyder inte att personen kommer att utveckla GERD. Å andra sidan, om en person har GERD, är hiatalbråck nästan alltid närvarande.
Således orsakas Barretts matstrupe av kronisk (av många års varaktighet) och vanligtvis svår sura uppstötningar. Hos vissa patienter med GERD reagerar matstrupen på den upprepade skadan från den sura vätskan genom att ändra typen av celler som täcker den från skivepitelformade (normala celler) till kolumnära (tarmceller). Denna transformation, som kallas metaplasi, tros vara ett skyddande svar eftersom det specialiserade kolumnära epitelet (epitel betyder foder) i Barretts matstrupe är mer motståndskraftigt mot skador från syra än skivepitelet.
Vätskan i magen innehåller syra som produceras av magen. Dessutom kan vätskan dock innehålla gallsyror (från galla som produceras av levern) och enzymer (producerade av bukspottkörteln) som har återflödet från tolvfingertarmen till magsäcken. (Tolvfingertarmen är den första delen av tunntarmen strax bortom magsäcken.) Syran som återflödet från magsäcken till matstrupen är skadlig för matstrupen. Det finns dock vissa bevis för att gall- och bukspottkörtelenzymerna i kombination med syran kan vara mer skadliga än enbart syra.
En betydande andel av individer med kroniska symtom på GERD utvecklar Barretts matstrupe, och det är vanligast i kaukasiska manliga populationer. Inte alla med GERD har dock symtom på GERD. Därför är vissa personer med Barretts omedvetna om att de har Barretts eftersom de har GERD utan några symtom alls eller har mycket milda och sällsynta symtom.
Det är oklart varför Barretts matstrupe är så överväldigande vanligare hos vita män än i någon annan grupp. Till exempel, även om kvinnor och afroamerikaner inte verkar vara skyddade från att utveckla GERD, är de till stor del skyddade (särskilt afroamerikaner) från att utveckla Barretts matstrupe och Barretts cancer (adenokarcinom). Det finns bevis för att matstrupscancer och cancer i den gastroesofageala korsningen (kallad hjärtcancer) ökar i frekvens på västra halvklotet, kanske mer än någon annan cancer i mag-tarmkanalen. (Dock är tjocktarmscancer fortfarande mycket vanligare än matstrupscancer.)
Barretts matstrupe kan förekomma i vissa familjer och vara genetiskt betingad. Studier pågår för att avgöra om några gener eller markörer kan hittas i dessa familjer som skulle förutsäga utvecklingen av Barretts matstrupe i den allmänna befolkningen. I dessa familjer med Barretts såväl som med Barretts i den allmänna befolkningen är GERD den gemensamma nämnaren. Frågan är dock varför Barretts uppträder vanligare i dessa familjer än i andra med jämförelsevis svår GERD, men utan familjeförband.
För att upprepa, det första kriteriet för diagnosen Barretts matstrupe är fyndet vid endoskopi av ett rosa foder i matstrupen där det normalt inte ses. Detta onormala foder kan se ut periferiellt som ett band, tungliknande eller som öar. Det andra kriteriet är att biopsier från det rosa slemhinnan avslöjar den karakteristiska intestinaliserade slemhinnan (den slemhinna som normalt ses i tarmarna) med de typiska bägarecellerna. Matstrupsbiopsierna erhålls under en endoskopi. En övre gastrointestinal endoskopi är en procedur där läkaren för in ett långt flexibelt rör (endoskop) genom munnen och ner i matstrupen för att direkt visualisera matstrupens slemhinna. Under samma endoskopiska undersökning kan även magsäcken och tolvfingertarmen visualiseras. Flera små prover (biopsier) av beklädnadens epitelvävnad kan erhållas genom endoskopet.
Som nämnts tidigare kallas processen att ersätta en typ av vävnadsfoder med en annan metaplasi. I magen och tarmarna är metaplasi ett vanligt svar på vissa typer av skador. Som Henry Appelman, en patolog, sa:"När tarmen är under stress vill den vara något annat." Andra exempel på metaplasi där en slemhinna ersätter en annan är:(1) i magsäcken där kronisk inflammation (gastrit) kan resultera i att en slemhinna av tarmtyp ersätter delar av den normala magslemhinnan; och (2) i tolvfingertarmen (strax bortom magsäcken i tarmen) där magsår uppstår och tarmslemhinnan som omger såret förvandlas till slemhinna av magsäck.
Vi tror att processen med metaplasi är ett skyddande eller adaptivt svar på skada på slemhinnan. Nackdelen med metaplasi är dock att den i Barretts matstrupe medför en liten men tydlig ökning av risken att bli cancer. Inte alla metaplasier har en ökad risk för cancer. Till exempel, av de två metaplasierna som nämns i föregående stycke, kan intestinal metaplasi i magen leda till cancer, men intestinal metaplasi i tolvfingertarmen.
Processen att utveckla Barretts börjar vid föreningspunkten mellan magsäcken och matstrupen. Matstrupen är normalt kantad av ett skivepitel eller foderskikt. Detta skivepitel har ett pärlvitt utseende, medan slemhinnan i magen och tarmarna har en mer laxrosa färg eftersom det är ett kolumnärt epitel snarare än ett skivepitel. Skivepitelet är uppbyggt av platta skivepitelceller, som liknar hudceller. Magsäcken eller magslemhinnan består av högre kolumnära celler som ses under mikroskopet. Förbindelsen mellan matstrupens skivepitel och magsäckskolumnära epitelet sker i korsningen mellan matstrupen och magsäcken där, som du minns, den nedre matstrupssfinktern är belägen. Den gemensamma gränsen (gränssnittet) för dessa två foder kallas ofta för Z-linjen, eftersom den har ett sicksack-utseende när den undersöks under en endoskopi.
Med progressiv skada på matstrupen uppstår metaplasi och den metaplastiska vävnaden rör sig uppåt i matstrupen ett avstånd som varierar från person till person, vanligtvis från cirka 0,5 till 2,5 tum (cirka 1 till 6 centimeter). Vilken typ av cell som ger upphov till den metaplastiska vävnaden är inte känd.
Barretts matstrupe kategoriseras ofta i kort- eller långsegment Barretts, baserat på längden på matstrupen som påverkas. Kort segment Barretts hänvisar i allmänhet till involvering av 3 centimeter eller mindre medan lång segment betyder involvering av mer än 3 centimeter av matstrupen. Intressant nog, när Barretts matstrupe har diagnostiserats hos en patient, verkar det metaplastiska fodret inte gå vidare upp i matstrupen om patienten behandlas för GERD. Med tiden förblir alltså längden av engagemang med Barretts i allmänhet densamma.
Om biopsier tas från patienter med GERD som har en normal Z-linje (inga synliga bevis för Barretts matstrupe), kommer upp till 30 % att visa samma tarmtypsmetaplasi med bägareceller som de som ses i Barretts matstrupe. Däremot tar vi inte rutinmässigt en biopsi av normala Z-linjer för att leta efter denna förändring, och vi gör inte heller övervakning när vi hittar den där. Anledningen är att begränsad intestinal metaplasi av den gastroesofageala korsningsregionen vid GERD verkar förekomma med liknande frekvens hos kvinnor och afroamerikaner som hos vita män, men risken för öppen Barretts matstrupe är mycket mindre än hos vita män.
Därför bör förekomsten av metaplasi på en rutinbiopsi av en normalt förekommande Z-linje i GERD inte leda till någon förändring i hanteringen. Dessutom bör fyndet av bägareceller i detta sammanhang inte märkas, som vissa har föreslagit, som det ultrakorta segmentet Barretts. Det främsta skälet till att inte märka det som Barretts är att termen Barretts innebär en ökad risk för cancer, och det finns inga bevis för att detta fynd är associerat med en ökad cancerrisk.
Den typ av cancer som uppstår med Barretts matstrupe är adenokarcinom. Cancer som uppstår från skivepitelvävnaden i matstrupen kallas skivepitelcancer eller karcinom. Bland kaukasier minskar frekvensen (frekvensen över tid) av skivepitelcancer i förhållande till Barretts-associerat adenokarcinom. Andra rasgrupper (till exempel afroamerikaner) har dock inte upplevt samma minskningstakt av skivepitelcancer jämfört med adenokarcinom.
Rökning och överdrivet alkoholintag är klara riskfaktorer för skivepitelcancer. De är också riskfaktorer för adenokarcinom som ses i Barretts matstrupe. I den här situationen är det dock inte klart om rökning och alkohol ökar risken för adenokarcinom genom att göra GERD svårare eller om rökning och alkohol har en mer direkt cancerframkallande effekt, som förekommer vid skivepitelcancer. Skivepitelcancer har blivit allt mindre vanliga samtidigt som adenokarcinomdiagnoserna har ökat. Adenocarcinomincidensen hos vita män har ökat kraftigare än hos andra etniska grupper.
Under resten av detta avsnitt kommer termen matstrupscancer att hänvisa till adenokarcinom som uppstår från Barretts matstrupe.
Cancer i den gastroesofageala korsningen kallas också hjärtcancer eftersom regionen där matstrupen möter magsäcken kallas cardia. Denna cancer, liksom Barretts-associerade adenocarcinom, finns främst hos vita män, ökar tydligen i frekvens i samma takt som matstrupscancer och är associerad med kronisk GERD. Därför har det spekulerats i att hjärtcancer börjar från korta segment (till exempel 1-2 cm) av Barretts. När cancerdiagnosen ställs kan dock tumören ha spridit sig utanför det korta segmentet av Barretts och kan tyckas vara i cardia. Dessa spekulationer om ursprunget till cancer i cardia återstår dock att bevisa.
En ökning av frekvensen av esofagusadenokarcinom har observerats i minst 20 år, främst hos vita män. En ledtråd till orsaken till denna trend kan vara relaterad till en minskning av frekvensen av H. pylori infektion i magen. Med andra ord verkar personer med Barretts cancer, inklusive hjärtcancer, ha lägre andel H. pylori infektion än andra av samma ålder och kön i samma befolkning.
H. pylori är en typ av bakterier som är en viktig orsak till sår. Det är en mycket vanlig infektion över hela världen och orsakar inga symtom hos de allra flesta drabbade. Vissa personer med H. pylori utveckla magsår i magen och tolvfingertarmen. Dessa sår behandlas genom att eliminera bakterierna, vilket i sin tur förhindrar återfall av såren.
Om H. pylori går obehandlat, orsakar det progressiv inflammation i magen (gastrit) som är förknippad med minskad syrasekretion och eventuellt mindre återflöde av syra i matstrupen. I många områden i världen minskar denna infektion i frekvens, förmodligen på grund av bättre folkhälsoåtgärder. Därför är det möjligt att den skyddande effekten (såsom minskad syraproduktion) av kronisk H. pylori infektionen har minskat. Med andra ord, med mindre H. pylori gastrit, producerar magsäcken mer syra och det finns mer syra att återflöda i matstrupen. Samtidigt är vi mer benägna för reflux i våra äldre år. Även om detta inte är en löst fråga, är den minskande frekvensen av H. pylori infektion kan vara en orsak till den ökande frekvensen av Barretts-associerat adenokarcinom.
Dysplasi är en förändring i cellerna som kantar matstrupen där cellerna faktiskt visar onormala förändringar i sin struktur och utseende. När dessa förändringar blir tillräckligt allvarliga (som går från låggradig till höggradig dysplasi) börjar cellerna verka maligna (som cancerceller). Men till skillnad från cancer förblir dessa celler på plats och invaderar inte vävnader utanför slemhinnan. Dysplasi uppstår som en serie cellförändringar när Barretts matstrupe utvecklas till Barretts-associerad cancer. Patienter med Barretts övervakas med endoskopi och biopsier (övervakning) för att upptäcka dessa cellförändringar (dysplasin) eller i värsta fall tidig cancer så att de kan behandlas. För närvarande finns det inget sätt att förutsäga vilka patienter med Barretts esofagus som kommer att utveckla dysplasi.
Dysplasi har också identifierats intill tumörer i mag-tarmkanalen andra än esofagusadenokarcinom. Till exempel finns dysplasi i hälften av fallen av magcancer och vid tjocktarmscancer, där dysplasin syns som så kallade adenomatösa polyper. Dessutom är dysplasi samma tidiga varningscellförändring som patologer letar efter i PAP-utstryk i livmoderhalsen som förutsäger livmoderhalscancer.
Dysplasi anses vara premalignt. Det betyder att om dysplasi har påvisats vid flera tillfällen, tror man att patienten kommer att utveckla cancer om han eller hon lever tillräckligt länge. Dysplasi kategoriseras som höggradig eller låggradig. När höggradig dysplasi diagnostiseras kan cancer redan vara närvarande, och om inte är risken att utveckla cancer tidigare större än med de lägre graderna av dysplasi.
I uppföljningsbiopsier av patienter med dysplasi kan tillståndet inte upptäckas igen hos vissa patienter, medan det hos andra finns låga grader av dysplasi. Denna frånvaro eller minskning av dysplasi kan bero på faktorer som provtagningsvariationer, avlägsnande av små foci (cellgrupper) av dysplasi med den initiala biopsin, eller faktisk biologisk reversering. Den exakta orsaken är okända.
Med hjälp av molekylära tekniker kan vissa förändringar som kallas biomarkörer detekteras i biopsiprover innan dysplasi utvecklas. Dessa förändringar liknar de som observeras i andra cancerformer. Biomarkörer inkluderar förändringar i DNA-innehållet i celler, i gener och kromosomer och i tillväxtfaktorer. Ett antal av dessa biomarkörer kan visas före och under uppkomsten av dysplasi. Det slutliga målet är att hitta en magisk markör som kan berätta för oss vilka patienter bland dem som inte har någon dysplasi eller låggradig dysplasi som är mer benägna att utveckla höggradig dysplasi eller cancer. Sådana patienter kan då följas av övervakning närmare än andra.
För närvarande behandlas alla patienter med Barretts esofagus, ur övervakningssynpunkt, på samma sätt. Tillgången till biomarkörer skulle separera (stratifiera) Barretts patienter baserat på deras risk för cancer. En sådan stratifiering skulle göra det möjligt för läkare att göra övervakningsendoskopi och biopsier oftare hos minoriteten av patienter som löper större risk för cancer och mer sällan hos dem som förutspås ha en lägre risk för cancer.
En annan användning för beprövade biomarkörer skulle vara att hjälpa till att bekräfta patologens tolkning av dysplasi på biopsier.
När patienter med Barretts matstrupe bedöms som en grupp har risken för cancer visat sig vara så låg som en av 300 patienter årligen. Det betyder att om vi undersökte 300 patienter årligen, skulle en patient visa sig ha cancer varje år. Det vi verkligen behöver veta är risken för cancer om ingen dysplasi hittas efter ett eller två års övervakning. Vår övertygelse är att denna risk skulle vara mycket mindre än de tidigare citerade siffrorna på en av 300 patienter årligen.
Patienter med höggradig dysplasi kan ofta visa sig ha cancer. Därför är den första behandlingen när höggradig dysplasi konstateras att utesluta förekomsten av ett adenokarcinom.
Låggradig dysplasi är mycket mindre hotfull än höggradig dysplasi, men vi vet inte hur mycket mindre. Faktum är att vi inte har exakta data för att indikera vad cancerrisken är hos patienter med Barretts och låggradig dysplasi.
Diagnosen dysplasi bör vara så exakt som möjligt eftersom denna diagnos kan leda till en förändring av behandlingen eller intensiteten i uppföljningen av patienter med Barretts matstrupe. Det krävs stor erfarenhet för att kunna ställa en exakt diagnos av förekomst och grad av dysplasi. Därför är det en vanlig och användbar praxis att be en andra patolog (eller till och med en tredje, om nödvändigt) att granska biopsierna. Tanken är att se om det finns en överenskommelse mellan patologerna och/eller att få en mer erfaren uppfattning om förekomst och grad av dysplasi.
Om en person har längre segment Barretts, skulle man gissa att cancerrisken är större än med kortare segment Barretts. Uppgifterna är dock kontroversiella i detta avseende. Av den anledningen är den nuvarande praxis att göra endoskopisk biopsiövervakning med liknande frekvens hos patienter med korta och långa segment Barretts matstrupe.
Barretts matstrupe har inga unika symtom. Patienter med Barretts har symtom på GERD (till exempel halsbränna, uppstötningar, illamående, etc.). Den allmänna trenden är att Barretts patienter har svårare GERD. Men inte alla Barretts har tydliga symtom på GERD, och vissa patienter upptäcks av misstag med minimala eller inga symtom på GERD.
Halsbränna är en brännande känsla bakom bröstbenet, vanligtvis i den nedre halvan, men kan sträcka sig hela vägen upp till halsen. Ibland åtföljs det av sveda eller smärta i maggropen precis nedanför där bröstbenet slutar. Det näst vanligaste symtomet är uppstötningar (backup) av bittert smakande vätska. GERD-symtom är ofta värre efter måltider och när man ligger platt.
Den refluxade, uppstötade vätskan kan ibland komma in i lungorna eller röstlådan (struphuvudet), vilket resulterar i vad som kallas extraesofageala (utanför matstrupen) symtom (manifestationer) av GERD. Dessa symtom inkluderar:
Av skäl som inte helt förstås har vissa GERD-patienter minimal halsbränna men upplever andra GERD-symtom, till exempel extraesofageala symtom.
GERD kan resultera i förträngningar och sårbildning i matstrupen. En förträngning eller förträngning beror på ärrbildning (fibros) i matstrupen som kan orsaka svårigheter att svälja (dysfagi). Dysfagin upplevs som att fast föda fastnar (stoppar) i bröstet (i matstrupen) och vätskor när förträngningen är kraftig. Förträngningar kan behandlas genom att sträcka ut dem med dilatatorer under endoskopi. Obehandlad kan strikturer främja mer spill av mat och/eller magvätskor i lungorna. I sällsynta fall kan massiv gastrointestinal (GI) blödning orsakad av inflammation i matstrupen förekomma. Sådan blödning resulterar i kräkningar av blod eller passage av svart eller rödbrun avföring. Vanligare är dock att en inflammerad matstrupe kan orsaka långsam blödning som upptäcks när anemi (ett lågt antal röda blodkroppar) upptäcks och/eller avföring testas för blod.
De medicinska behandlingarna för symtomen på Barretts matstrupe är desamma som för GERD.
Undertryckandet av syra är ryggraden i behandlingen av GERD. För milda refluxsymtom används vanligen receptfria läkemedel, allt från antacida till låga doser av läkemedel som kallas H-2-receptorantagonister eller H2-blockerare. Exempel på receptfria H2-blockerare är cimetidin (Tagamet) och famotidin (Pepcid, Zantac 360). För mer ihållande symtom kan högre (receptbelagda) doser av H-2-receptorantagonistläkemedel användas, till exempel:
För ihållande symtom som kräver underhållsbehandling (pågående) eller för komplicerad GERD med strikturer eller blödning, används protonpumpshämmare (PPI). Exempel på PPI:er är:
Vissa patienter behöver bara ta ett piller dagligen, medan andra behöver två piller (en dubbel dos) för att kontrollera symtomen. Den dubbla dosen kan tas som ett piller två gånger dagligen eller 2 piller en gång dagligen.
PPI är potenta hämmare av syrasekretion från magen. De är effektiva för att lindra halsbränna och läka esofagusinflammation (esofagit) och esofagusår som induceras av sura uppstötningar. PPI:erna tolereras väl med få biverkningar. Efter att ha slutat med dessa mediciner återkommer symtom på sura uppstötningar vanligtvis, ibland med ökad intensitet. Denna ökning av symtomen uppstår delvis på grund av en rebound-utsöndring av syra (syrahypersekretion), vilket är ett svar som föranleds av återhämtning från hämningen av utsöndringen av syra av PPI.
Den långsiktiga säkerheten för PPI är en viktig faktor. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Dessa inkluderar:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Förstoppning – det är dags att träffa en läkare | Arshad Malik, MD
Alla bajsar. Men på sistone har du haft problem på det området. Långa resor till toaletten på jobbet eller avskildheten i ditt eget badrum – men ingenting händer, och det gör dig orolig. Du kan känna
Förstoppning – det är dags att träffa en läkare | Arshad Malik, MD
Alla bajsar. Men på sistone har du haft problem på det området. Långa resor till toaletten på jobbet eller avskildheten i ditt eget badrum – men ingenting händer, och det gör dig orolig. Du kan känna
 En vegansk kost kan öka tarmmikrober som hjälper viktminskning
Att byta till en vegansk kost kan hjälpa människor att gå ner nästan ett kilo i vikt varje vecka och avsevärt minska risken för diabetes, enligt en studie som nyligen presenterades vid årets årsmöte i
En vegansk kost kan öka tarmmikrober som hjälper viktminskning
Att byta till en vegansk kost kan hjälpa människor att gå ner nästan ett kilo i vikt varje vecka och avsevärt minska risken för diabetes, enligt en studie som nyligen presenterades vid årets årsmöte i
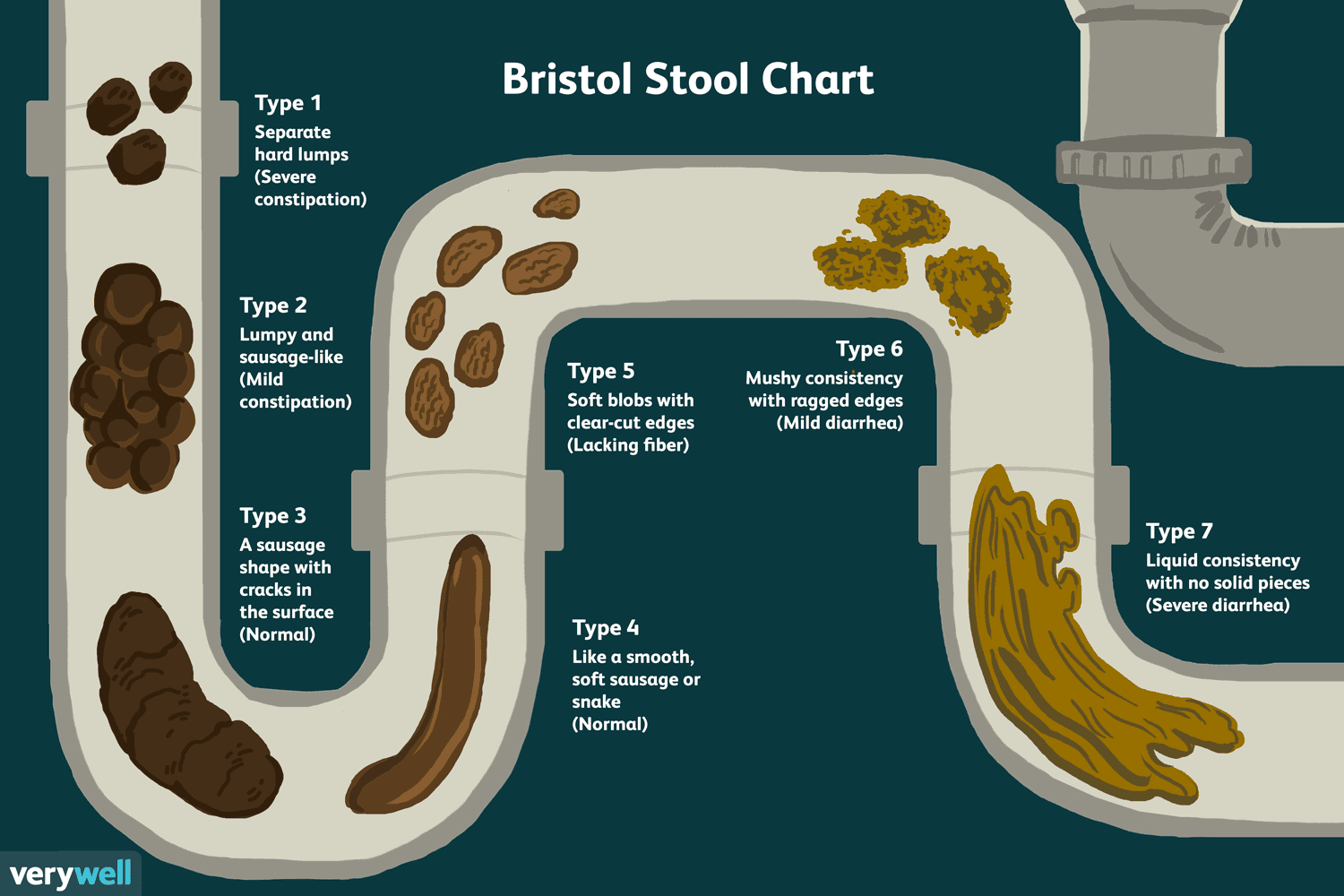 En översikt över Bristol Stool Chart
Bristol Stool Chart är ett verktyg som används för att bedöma mänsklig avföring (bajs) baserat på dess form och hur formad eller lös den är. Du kan också höra verktyget som kallas: Bristol pallvåg Br
En översikt över Bristol Stool Chart
Bristol Stool Chart är ett verktyg som används för att bedöma mänsklig avföring (bajs) baserat på dess form och hur formad eller lös den är. Du kan också höra verktyget som kallas: Bristol pallvåg Br