La technique peut accélérer l'identification des déterminants de la résistance des agents pathogènes multirésistants (MDR) et le développement de nouvelles stratégies anti-résistance.
La recherche a ouvert une nouvelle voie pour modifier génomiquement ces espèces et isolats de bactéries sauvages, tels que ceux ayant une importance clinique et environnementale et ceux formant le microbiome humain. Il a également fourni un cadre pour exploiter d'autres systèmes CRISPR-Cas répandus dans les génomes procaryotes et étendre les boîtes à outils basées sur CRISPR. La recherche a été publiée dans la principale revue scientifique Recherche sur les acides nucléiques .
Le système CRISPR-Cas comprend le système immunitaire adaptatif des procaryotes qui désarme les virus envahissants en clivant leur ADN. En raison de sa capacité unique de cibler et de modifier des séquences d'ADN, CRISPR-Cas a été exploité comme méthode d'édition du génome de nouvelle génération.
La méthode est basée sur le système CRISPR/Cas9 de classe 2 type II, qui a révolutionné la génétique et la recherche biomédicale dans une pléthore d'organismes et a reçu le prix Nobel de chimie 2020. Cependant, les systèmes CRISPR-Cas de classe 2 ne représentent que ∼10 % des systèmes CRISPR-Cas encodés naturellement chez les procaryotes. Leurs applications pour éditer des génomes bactériens sont plutôt limitées.
Remarquablement, Les systèmes CRISPR-Cas appartenant à différentes classes et types sont identifiés en permanence, et ils servent de réservoir profond pour l'expansion des boîtes à outils basées sur CRISPR. Le système CRISPR-Cas le plus diversifié et le plus largement distribué est le système de type I qui représente 50% de tous les systèmes CRISPR-Cas identifiés et a le potentiel d'étendre les boîtes à outils basées sur CRISPR avec des avantages distinctifs non accessibles avec les systèmes de classe 2, comme une haute spécificité, hors-ciblage minimal, et capable de délétions de grands fragments.
Cependant, Le système CRISPR-Cas de type I repose sur un complexe effecteur à plusieurs composants appelé Cascade pour interférer avec l'ADN qui n'est pas facilement transférable à des hôtes hétérologues, entravant l'application généralisée de ces CRISPR naturellement abondants pour l'édition du génome et la thérapeutique.
Précédemment, l'équipe a identifié un système CRISPR-Cas de type I-F hautement actif dans un laboratoire clinique multirésistant P. aeruginosa souche PA154197 qui a été isolée d'un cas d'infection sanguine à l'hôpital Queen Mary. Ils ont caractérisé ce système CRISPR-Cas et développé avec succès une méthode d'édition du génome applicable dans l'isolat MDR basée sur ce système CRISPR-Cas de type I-F natif. La méthode a permis une identification rapide des déterminants de la résistance de l'isolat clinique MDR et le développement d'une nouvelle stratégie anti-résistance ( Rapports de cellule , 2019, 29, 1707-1717).
Pour surmonter la barrière du transfert de la cascade complexe de type I vers des hôtes hétérologues, dans cette étude, l'équipe a cloné tout le type I-F cas opéron dans un vecteur mini-CTX capable d'intégration et délivré la cassette dans des hôtes hétérologues par conjugaison, une approche de transfert d'ADN commune dans la nature. Le vecteur mini-CTX a permis l'intégration de l'ensemble de la Cascade sur le attB locus génétique dans le génome des hôtes hétérologues, leur permettant d'héberger un système CRISPR-Cas de type I-F "natif" qui peut s'exprimer et fonctionner de manière stable.
L'équipe a montré que le type I-F Cascade transféré affiche une capacité d'interférence d'ADN significativement plus grande et une stabilité de souche plus élevée que le système Cas9 transférable et peut être utilisé pour l'édition du génome avec efficacité (> 80%) et simplicité, c'est-à-dire par une transformation en une étape d'un seul plasmide d'édition.
Par ailleurs, ils ont développé un système transférable avancé qui comprend à la fois une cascade de type I-F hautement active et une recombinase pour favoriser l'application du système dans des souches ayant une faible capacité de recombinaison homologue, sauvage P. aeruginosa isolats sans information sur la séquence du génome, et dans d'autres Pseudomonas espèce.
Dernièrement, les gènes de type I-F Cascade introduits peuvent être facilement retirés des génomes de l'hôte grâce à la délétion médiée par I-F Cascade de gros fragments d'ADN, résultant en une édition du génome sans cicatrice dans les cellules hôtes. L'application du système transférable pour la répression génique a également été démontrée, mettant en évidence les applications robustes et diverses du système transférable développé de type I-F CRISPR.
Le Dr Aixin Yan a prédit que cette nouvelle méthode sera étendue à l'édition non seulement des agents pathogènes mais aussi du microbiome pour promouvoir la santé humaine.
Nous pensons que la technologie et les thérapies basées sur CRISPR apporteront de nouveaux espoirs dans la lutte contre les superbactéries à l'avenir ."
Docteur Aixin YAN, Professeur agrégé, Division de la recherche pour la biologie moléculaire et cellulaire, Faculté des sciences, L'Université de Hong Kong
 7 avantages pour la santé des abats (et conseils pour les rendre tolérables)
7 avantages pour la santé des abats (et conseils pour les rendre tolérables)
 À quelle fréquence devez-vous faire caca ?
À quelle fréquence devez-vous faire caca ?
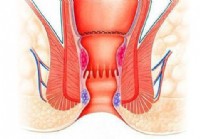 Quelles sont les différences entre l'hémorroïdopexie agrafée et l'hémorroïdectomie ?
Quelles sont les différences entre l'hémorroïdopexie agrafée et l'hémorroïdectomie ?
 Comment la méditation de pleine conscience atténue les symptômes du SCI
Comment la méditation de pleine conscience atténue les symptômes du SCI
 Coliques chez les bébés
Coliques chez les bébés
 La qualité du sommeil pourrait être un indicateur des découvertes ultérieures de la maladie d'Alzheimer
La qualité du sommeil pourrait être un indicateur des découvertes ultérieures de la maladie d'Alzheimer
 Quand devriez-vous aller chez le médecin pour les hémorroïdes ?
Que sont les hémorroïdes ? Si vous avez des hémorroïdes, vous devriez consulter votre médecin si vous présentez des saignements du rectum, qui peuvent être un signe dune affection médicale plus gra
Quand devriez-vous aller chez le médecin pour les hémorroïdes ?
Que sont les hémorroïdes ? Si vous avez des hémorroïdes, vous devriez consulter votre médecin si vous présentez des saignements du rectum, qui peuvent être un signe dune affection médicale plus gra
 Bilirubine et test sanguin de bilirubine
Que dois-je savoir sur la bilirubine et le test sanguin ? Photo dun résultat danalyse sanguine indiquant les taux de bilirubine, dAST et dALT.par iStock La bilirubine est un pigment jaune rougeâtre
Bilirubine et test sanguin de bilirubine
Que dois-je savoir sur la bilirubine et le test sanguin ? Photo dun résultat danalyse sanguine indiquant les taux de bilirubine, dAST et dALT.par iStock La bilirubine est un pigment jaune rougeâtre
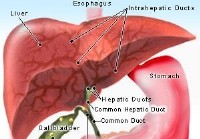 Kyste du cholédoque
Quest-ce quun kyste du cholédoque ? Image du foie, de la vésicule biliaire et de lestomac La bile produite dans le foie sécoule à travers des canaux (canaux) de plus en plus grands dans le foie et
Kyste du cholédoque
Quest-ce quun kyste du cholédoque ? Image du foie, de la vésicule biliaire et de lestomac La bile produite dans le foie sécoule à travers des canaux (canaux) de plus en plus grands dans le foie et