La pancreatite acuta (AP), in particolare una grave pancreatite acuta provoca spesso complicazioni extra pancreatiche, come acuta della mucosa gastrointestinale lesione (AGML) che è accompagnato da un notevole alto tasso di mortalità, ma la patogenesi di AP AGML indotta non è ancora del tutto chiaro. In questo rapporto, abbiamo studiato le alterazioni dei componenti del siero ed endocrine gastrica e le funzioni esocrine nei ratti con pancreatite acuta sperimentale, e studiato i possibili contributi di queste alterazioni nella patogenesi della AGML. Inoltre, abbiamo esplorato gli effetti di intervento del recettore dei cannabinoidi agonisti HU210 e antagonista AM251 su stomaco di ratto isolato e siero-perfusione. I nostri risultati hanno mostrato che il AGML avvenuta dopo 5 h di replicazione AP, e il corpo omeostasi stato disturbato nel AP ratto, con aumento dei livelli di enzimi pancreatici, lipopolisaccaride (LPS), citochine proinflammtory e chemochine nel sangue, e uno squilibrio del gastrica funzione di secrezione. Perfusione l'isolato di ratto stomaco con il siero di ratto AP causato cambiamenti morfologici nello stomaco, accompagnato da un incremento significativo di pepsina e il rilascio [H +], e l'aumento di gastrina e diminuzione della secrezione somatostatina. HU210 invertito i ratti alterazioni patologiche AP-siero indotta, compresa l'inversione della trasformazione della morfologia gastrico certo grado. I risultati di questo studio dimostrano che le risposte infiammatorie e lo squilibrio della secrezione gastrica durante lo sviluppo di AP sono responsabili della patogenesi della AGML, e suggeriscono il potenziale terapeutico di HU210 per AGML associata a pancreatite acuta. citazione: Cao Mh, Li YY, Xu J, Feng Yj, Lin Xh, Li K, et al. (2012) cannabinoidi HU210 Protegge stomaco ratto isolato contro pregiudizio causati dal siero di ratti con Sperimentale pancreatite acuta. PLoS ONE 7 (12): e52921. doi: 10.1371 /journal.pone.0052921 Editor: Vinod K. Yaragudri, Nathan Kline Institute for Psychiatric Research e New York School of Medicine, Stati Uniti d'America Ricevuto: 9 maggio 2012; Accettato: 21 novembre 2012; Pubblicato: 28 dicembre 2012 Copyright: © 2012 Cao et al. Questo è un articolo ad accesso libero distribuito sotto i termini della Creative Commons Attribution License, che permette l'uso senza restrizioni, la distribuzione e la riproduzione con qualsiasi mezzo, a condizione che l'autore originale e la fonte sono accreditati Finanziamento:. Questo lavoro è stata sostenuta dalla National Science Foundation naturale della Cina (Grant No. 81.270.477 e 81.141.050 di Dr. Yong-yu Li). http://www.nsfc.gov.cn/. I finanziatori avevano alcun ruolo nel disegno dello studio, la raccolta e l'analisi dei dati, la decisione di pubblicare, o preparazione del manoscritto Competere interessi:.. Gli autori hanno dichiarato che non esistono interessi in competizione Introduzione la pancreatite acuta (AP), particolarmente grave AP, è una malattia infiammatoria potenzialmente letale del pancreas, che spesso conduce a complicazioni extra pancreatica, anche più sistemici disfunzioni d'organo. E 'stato riportato che il 52% dei pazienti con pancreatite acuta sviluppare lesione acuta gastrointestinale mucosa (AGML) o stress ulcera [1], [2]. Anche se l'osservazione endoscopica mostra che la maggior parte dei soggetti semplicemente hanno più erosioni superficiali nel tratto gastrointestinale, l'intervento farmacologico ottimale continua ad essere materia di dibattito, e la patogenesi della AGML rimane poco chiaro. Alcuni ricercatori riportano che la condizione di stress con pancreatite acuta provoca l'afflusso di sangue diminuita o ipoperfusione nella mucosa gastrica, e la contro-diffusione di ioni idrogeno gastrica (H +) è un fattore importante per AGML così [3], [4]. Altre indagini hanno scoperto che il siero e liquido ascitico di pazienti AP e animali da esperimento conteneva una grande quantità di sostanze tossiche, come gli enzimi pancreatici, endotossine, mediatori infiammatori [5], [6], che può contribuire alle molteplici disfunzioni di organi in acuta pancreatite [7], [8]. per secoli, piante di cannabis e suoi estratti sono stati utilizzati per alleviare i sintomi di malattie infiammatorie gastrointestinali. È stato stabilito che D 9-tetraidrocannabinolo, il principale componente psicoattivo della cannabis, esercita le sue azioni cellulari primarie se due recettori accoppiati a proteine G, dei cannabinoidi 1 (CB1) e cannabinoidi 2 (CB2) recettori [9] - [ ,,,0],11]. Da allora, questi due recettori sono stati riconosciuti come i principali regolatori di processi fisiologici e patologici [12]. I cannabinoidi possono ridurre la secrezione gastrointestinale [13], e l'attivazione dei recettori CB1 presenta ruolo protettivo contro AGML indotta da stress [14], [15], ma i meccanismi della loro azione rimangono sfuggente. Lo scopo del presente lavoro è stato quello di esplorare, sia in vivo che in vitro, le variazioni delle componenti del siero, le alterazioni delle funzioni endocrine e esocrine gastrici in modello murino di AP, e le possibili contributi di queste alterazioni nella patogenesi della AGML. Inoltre sono stati sondati gli effetti interventistiche di CB1 utilizzando la sua HU210 agonisti e antagonisti AM251, nel tentativo di chiarire meglio i meccanismi fisiopatologici di AGML AP-associata e le potenzialità antiulcera di questi agenti cannabinoidi. Animali ratti maschi Sprague-Dawley (220-250 g) sono stati ottenuti dal Centro Sperimentale di animali di Fudan University, Shanghai, Cina. Prima degli esperimenti, tutti gli animali sono stati alloggiati per 1 settimana in condizioni standard con libero accesso all'acqua e di laboratorio chow. Tutte le procedure sperimentali di seguito erano in accordo con le linee guida internazionali per la cura e l'uso di animali da laboratorio e sono stati approvati dal Comitato Etico degli animali di Tongji University, Shanghai, Cina. I ratti sono stati assegnati in modo casuale in due gruppi: AP e il gruppo sham-operazione con 24 animali in ciascun gruppo. I ratti sono stati tenuti a digiuno durante la notte con sola acqua permesso prima dell'intervento chirurgico. Modello AP è stata indotta secondo il metodo sviluppato da Aho et al [16]. Brevemente, i ratti ottenuto laparotomia (~3 cm addominale-incisione mediana) seguendo la procedura asettica standard e in anestesia generale con iniezione intraperitoneale di 20% carbammato di etile a 10 ml /kg. Il condotto biliopancreatico stato temporaneamente occluso all'ilo fegato con una multa morsetto morbido microvascolare per impedire il reflusso del materiale infuso al fegato. Una iniezione retrograda di desossicolato di sodio al 3% nel condotto biliopancreatico stata poi eseguita (0,1 mL /100 g di peso corporeo). La pinza è stato rimosso dopo l'iniezione. Sham-operazione è stata eseguita di conseguenza senza l'iniezione di sodio desossicolato, e l'intervento si è concluso con la chiusura stratificata addominale. Nella quinta ora dopo l'intervento chirurgico, il sangue è stato raccolto dalla puntura dell'aorta addominale sotto anestesia. Tutti i campioni di sangue sono stati centrifugati e il sovranatante (siero) è stato raccolto, aliquotati e conservati a -20 ° C per le applicazioni successive. Il pancreas è stato rimosso, diviso in due parti, ed una parte è stata messa in Trizol immediatamente e conservare a -20 ° C per l'analisi genechip, come l'altra parte è stata fissata con il 10% paraformaldeide. Lo stomaco è stato inoltre rimosso, aperto lungo la grande curva, e fissato con il 10% paraformaldeide per conseguente esame patologico. valutazione istologica è stata effettuata su pancreas di ratto e lo stomaco che sono stati fissati in 10% paraformaldeide e inclusi in paraffina. Da allora in poi, 5 sezioni micron di spessore sono stati tagliati con un microtomo Leica RM2126 (Leica, Shanghai, Cina) e colorati con ematossilina (0,5%) e eosina (0,5%), seguiti da osservazione al microscopio Motic BA300 (Motic Cina Group Co. Ltd ., Xiamen, Cina). Istologico punteggio è stato valutato su sezioni pancreatiche utilizzando un criterio modificato da Nathan JD, et al [17]. La valutazione è stata fatta in dieci campi microscopici scelti a caso di scivoli di ogni animale, e ripetuto in tre ratti /gruppo in modo cieco. E il punteggio istologico totale (0-9) è stato espresso come la somma di edema (0-3), l'infiltrazione di cellule infiammatorie (0-3), e necrosi tissutale (0-3). analisi microarray è stata utilizzata per identificare i profili di trascrizione di alcuni indici infiammatori nel pancreas dal ratto con pancreatite acuta. ibridazioni Array sono stati effettuati utilizzando tre repliche biologiche di campioni di RNA estratti dal pancreas di ratti AP e controllo. Preparazione della sonda, chip di ibridazione, e l'analisi dei dati primari sono stati eseguiti da Capital Bio Corporation (una società con licenza e autorizzato da Affymetrix ad operare a Pechino, Cina). Gli array sono stati digitalizzati utilizzando il GeneChip Scanner 3000 7G (Affymetrix, Santa Clara, CA, USA). L'analisi quantitativa è stata effettuata utilizzando Affymetric MicroArray Suite Termini 5.0-specifici (statistica Algoritmi) GCOS (Affymetrix GeneChip Operating Software) versione 1.4. I geni differenzialmente espressi sono stati identificati utilizzando il software SAM (Analisi significativo di microarray), e selezionati sulla base delle loro variazioni piega (> 2 volte) rispetto ai campioni di controllo L'immunoistochimica colorazione su sezioni di paraffina dello stomaco e del pancreas di ratto sono stati eseguiti utilizzando il coniglio policlonale anti-CB1 e CB2 anticorpi anti-(Cat. No: ALX-210-314 per l'anti-CB1 e Cat. No: ALX-210-315 per anti-CB2, Enzo, Plymouth Meeting, PA, USA), come descritto in precedenza [18]. I vetrini con sezioni di stomaco di ratto e nel pancreas sono state incubate overnight a 4 ° C con anti-CB1 o anti-CB2, e la biotina capra anti-IgG di coniglio fluido di lavoro (Cat. SP0023; biosintesi Biotechnology Co. Ltd ., Pechino, Cina) è stata poi applicata su ciascun vetrino e incubato a 37 ° C per 15 minuti, seguita da incubazione con una soluzione di lavoro streptavidina HRP marcata a 37 ° C per 15 minuti, e vetrini sono stati sciacquati. Infine, i vetrini sono stati DAB-macchiati e nucleare ri-colorate con ematossilina. Le diapositive del controllo negativo sono stati elaborati attraverso i passaggi identici, ma l'anticorpo primario è stato sostituito con PBS. L'analisi delle immagini è stata compiuta utilizzando digitale Motic Med immagine 6.0 sistema di analisi. (Motic, Cina Group Co. Ltd., Xiamen, Cina): Western Blotting per la misurazione CB1 e CB2 Espressione CB1 e CB2 espressione della proteina nel pancreas e dello stomaco sono stati valutati mediante western blotting. Come descritto in precedenza [19], dopo incubazione con gli anticorpi primari in un 1:250 di diluizione singolarmente (policlonale di coniglio anti-CB1 e CB2 anticorpi anti-, Cat:.. ALX-210-314 per anti-CB1 e Cat: ALX-210-315 per l'anti-CB2, Enzo, Plymouth Meeting, PA, USA), le membrane Blotted nitrocellulosa (Whatman, Dassel, Germania) sono stati risciacquati a fondo, e l'anticorpo secondario appropriato coniugato con perossidasi di rafano è stata incubata per 1 ora a temperatura ambiente. Per riferimento interno, è stato utilizzato policlonale di coniglio anti-topo β-actina anticorpo (1:2,000 diluizione) (Abmart, Shanghai, Cina). Infine, legame dell'anticorpo è stato rilevato da esposizione a ECL assorbente reagenti di rilevamento occidentale (Cat. No: SC-2048, Santa Cruz Biotechnology, Santa Cruz, CA, USA) e registrato su pellicola Preparazione di Isolated- vascularly. perfuso Rat stomaco ratto è stato anestetizzato e l'isolato, stomaco di ratto vascularly perfuso è stato preparato come descritto in precedenza [20]. In breve, l'addome è stato aperto con un'incisione mediana in condizioni sterili. Dopo legatura dell'aorta addominale appena sopra la ramificazione dell'arteria celiaca, una cannula è stata inserita nell'arteria celiaca attraverso un'incisione posto sul dell'aorta. Due millilitri di soluzione salina contenente 600 U di eparina sono state iniettate in arteria gastrica tramite la cannula arteriosa. Successivamente, una calda (37 ° C) modifica soluzione di Krebs-Ringer gorgogliare con una miscela di 95% O 2 e 5% CO 2 è stato introdotto. L'effluente venoso sono stati raccolti tramite una cannula vena porta. Un tubo in polietilene per gastrico perfusato lumen stato inserito nell'esofago e la punta posizionata nella porzione luminale dello stomaco. In seguito, la giunzione piloroduodenale stato esposto, e un altro tubo di polietilene è stato introdotto nello stomaco attraverso un'incisione sul duodeno, e poi fissato con una legatura intorno piloro. Il ratto stomaco perfuso è stato isolato e posto in un ambiente caldo (37 ° C), piccola camera con soluzione di Krebs-Ringer. L'isolato stomaco era vascularly perfuso con modificata soluzione di Krebs-Ringer per 30 minuti equilibrazione prima degli esperimenti formali. La perfusione è stata poi realizzata in modo sequenziale con tre fluidi e ciascun fluido per 20 minuti, per un totale di 60 minuti. Il gruppo di controllo ha: 1) soluzione di Krebs-Ringer, 2) siero di normali ratti di controllo, 3) soluzione di Krebs-Ringer. Il gruppo AP ottenuto: 1) Krebs-Ringer soluzione, 2) siero di ratti AP, 3) soluzione di Krebs-Ringer. Il gruppo di AP + HU ottenuto: 1) soluzione di Krebs-Ringer + HU210 (10 -7M), 2) AP siero + HU210 (10 -7M), 3) la soluzione di Krebs-Ringer. E il gruppo di AP + AM ottenuto: 1) soluzione di Krebs-Ringer + AM251 (10 -7M), 2) AP siero + AM251 (10 -7M), 3) la soluzione di Krebs-Ringer. Il lume gastrici dello stomaco isolato è stato perfuso con soluzione salina normale (pH 7,0). Tutti i fluidi di perfusione correva a una velocità costante di 1 ml /min utilizzando pompe di micro-infusione. Nel frattempo, le soluzioni e gli organi isolati sono stati tenuti a 37 ° C da unità termostatiche tutto l'esperimento. I campioni di effluenti venosa o da gastrica effluenti lume stati raccolti, al termine di ogni 20 minuti, in provette refrigerati che sono stati immediatamente conservati a -80 ° C per esperimenti di misura successivi. I saggi dei livelli di lipopolisaccaride (LPS) nel siero di ratti AP o di controllo amilasi e sono stati eseguiti in base al produttore raccomandato procedure (Cat No: C016 per il kit di analisi amilasi, Jiancheng Tecnologia, Nanjing, Cina; e. Cat. No:. CE32545 per kit di analisi LPS, cinese Limulo reagente Co. Ltd., Xiamen, Cina): saggi per mediatori infiammatori I livelli di interleuchina-6 (IL-6 ) e citochine indotta neutrofili chemiotattico 1 (CINC1 /KC) nel siero di ratto e nell'effluente venoso dal stomaco di ratto isolati sono stati quantificati usando l'iL-6 e kit KC ELISA ratto base al produttore raccomandato protocolli (Cat. n : F01731D per ratto interleuchina 6 kit ELISA; Cat. No: F01723D per ratto kit ELISA KC. H-Y biologica Co. Ltd., Shanghai, Cina). La densità ottica è stata determinata a 490 nm per assorbanza in uno strumento saggio immunoabsorbent enzimatico (lettore di micropiastre, modello Elx800; BioTek, Winooski, VT, USA). Ogni campione è stato misurato tre volte e la misurazione è stata ripetuta in 6 campioni di ratto di ciascun gruppo. I dati nell'effluente venoso dal stomaco di ratto isolati sono stati rappresentati con la differenza di IL-6 o KC livello tra la perfusione e l'effluente, essere considerato come il rilascio di IL-6 e KC dallo stomaco di ratto. gastrina e somatostatina livelli di esemplari di animali gastrina e somatostatina livelli nel siero degli animali e negli effluenti venoso isolato stomaco sono stati misurati utilizzando disponibili in commercio di gastrina e somatostatina Kit radioimmunologici (gastrina Kit: Cat. No. G01PJB , Istituto Nord di Biologic Tecnologia, Pechino, Cina somatostatina Kit:. Cat. No. S111013, seconda Università medica militare, Shanghai, Cina). Procedure di misurazione si sono basate sulle raccomandazioni dei costruttori come descritto in precedenza [21]. Come stessi come sopra, ciascun campione è stata misurata tre volte e la misurazione è stata ripetuta in 6 campioni di ratto di ciascun gruppo. I dati nel effluenti venoso dal ratto stomaco isolato è stato presentato con le differenze di livello di gastrina o somatostatina tra la perfusione e l'effluente, essere considerato come il rilascio di gastrina e somatostatina dallo stomaco di ratto. I saggi di livello pepsina nel succo gastrico ratto e nel effluenti lume gastrico dal ratto stomaco isolato sono stati effettuati utilizzando il produttore consiglia di protocolli (Cat. No. A081- 1, Jiancheng Tecnologia, Nanjing, Cina), come [H +] in questi campioni sono stati misurati da Delta 320 pH-metro (Mettler-Toledo Inc. Zurigo, Svizzera) e le letture sono stati poi convertiti in [H +]. Soluzioni e prodotti chimici HU210 [(6AR) -TRANS-3- (1,1-dimetileptile) -6a, 7,10,10a-tetraidro-1-idrossi -6,6-dimetil -6h-dibenzo [b, d] piran-9-metanolo], AM251 [(N- (piperidin-1-il) -5- (4-iodofenil) -1- (2,4- diclorofenil) - 4-metil-1H-pirazolo-3-carbossamide)], sono stati acquistati da Tocris (Tocris-Bioscience, Ellisville, MO, USA). Entrambi i prodotti sono stati disciolti in un solvente consisteva di etanolo, Tween80 e soluzione salina normale (NS), rapporto in volume 01:01:18, alla concentrazione 10 -2M, a 37 ° C utilizzando un ultrasonicatore, e poi sono stati ulteriormente diluiti in NS 10 -5 M, e di nuovo a 10 -7M con liquido di perfusione al momento dell'uso nelle condizioni che sono stati determinati in studio pilota [22]. La soluzione di Krebs-Ringer modificato era composta da 117,5 mM NaCl, 4,7 mm KCl, 2,4 mm CaCl 2, 1,1 mm MgCl 2, 1,1 mm NaH 2PO 4, 25 mM NaHCO 3, 11,1 mM di glucosio, 0,05% di albumina di siero bovino, e il 4% destrano. Altri agenti, se le fonti non sono stati menzionati sopra, sono stati acquistati dalla Sigma (Shanghai, Cina). Tutti i dati sono espressi come media ± SEM. di Student t-test o singola analisi fattoriale della varianza (ANOVA) è stata eseguita utilizzando il software SPSS 13.0 (SPSS Co. Ltd., Shanghai, Cina). P-valori di < 0,05 sono stati considerati statisticamente significativi Risultati Risultati da Esperimento In Vivo cambiamenti patologici nel pancreas di topi AP. . al microscopio ottico, era evidente che dopo il trattamento con taurocolato di sodio, i ratti hanno sviluppato pancreatite acuta grave con evidente edema, vacuolizzazione e necrosi gravi nelle cellule acinari dei tessuti pancreatici. E i punteggi istologici nei ratti AP erano molto superiori a quelli dei ratti di controllo (Fig. 1). In combinazione con l'aumento del livello di attività amilasi nel siero di ratti AP, i risultati hanno dimostrato che la replica del modello AP nei ratti ha avuto successo. stomaco dei ratti con pancreatite acuta, gravi alterazioni patologiche emerse, esibendo mucosa edema, erosione e emorragie come dimostrato da entrambi macrografia (Fig 2A e 2B.) ed esami microscopici (Fig. 2D); e queste lesioni riuniti principalmente nel gastrico. analisi GeneChip. Come mostrato in fig. 3A, i diagrammi di dispersione rappresentati geni con duplice ed espressione superiore erano nel limite superiore (rosso), mentre geni con duplice e lower espressione in (verde) limite inferiore; ei geni modificati strettamente legate alla pancreatite acuta sono stati mostrati negli schemi di clustering (Fig. 3B). Era ovvio che nel profilo di espressione, i geni con differenziale significativamente espressioni (≥2 volte, P < 0,05) sono soprattutto quelli che erano in relazione con gli enzimi digestivi pancreatici, mediatori infiammatori e le vie di trasduzione del segnale, che sono stati individuati e elencati con il loro gene Nome e Genebank ID nella tabella 1. Modifiche di iL-6, i livelli di KC e LPS in AP siero. Entrambi i livelli di iL-6 e KC nel siero di AP ratti esposti aumenti significativi rispetto a quelli dei ratti di controllo, con slanci di 145% e 186%, rispettivamente (P < 0,05; Fig. 4). Un aumento simile ma più importante è stata osservata nel livello LPS nel siero di ratti AP, con un aumento fino a 231 volte di quella del gruppo di controllo (P < 0,01; Fig. 4A) modifiche. dei livelli di gastrina e somatostatina nel siero di ratti AP. Nel siero di ratti AP, livelli di gastrina e somatostatina aumentati significativamente rispetto a quelli dei ratti di controllo, con slanci di 169% e 147% rispettivamente ( in entrambi i casi, P < 0,05;. Fig. 4B) modifiche dei livelli di pepsina e [H +] nel succo gastrico di ratti AP Per valutare i cambiamenti di gastrico. funzione esocrina, test per il livello di pepsina e [H +] sono state eseguite utilizzando il succo gastrico di ratti AP e controllo. Sia livello pepsina e [H +] nel succo gastrico mostrato un netto aumento ratti AP rispetto a quelli dei ratti di controllo, con slanci di 177% e 347%, rispettivamente (Fig. 4C). L'espressione di recettori CB1 e CB2 nel pancreas di ratto e dello stomaco sono state esaminate le caratteristiche di espressione di recettori CB1 e CB2 nel pancreas di ratto e dello stomaco. I risultati hanno dimostrato che gli esemplari di animali nel gruppo di controllo hanno presentato solo debole colorazione immunohistological per recettori CB1 e CB2 nel pancreas, mentre i campioni di ratti AP avevano mostrato un aumento di espressione di recettori CB1 e CB2. Principalmente, i forti segnali positivi di tintura marrone raggruppati nella acini pancreatici (Fig. 5 A punte di freccia). L'UP-regolamentazione dei recettori CB1 e CB2 nei tessuti del pancreas di ratti AP sono stati ulteriormente dimostrato da analisi Western Blot e presentati in Fig.5 B. Le caratteristiche simili di espressione dei recettori CB1 e CB2 sono stati trovati anche nello stomaco dei ratti AP , come dimostrano sia la colorazione immunoistochimica e occidentale blot (Fig. 5 e C 5 D). Le forti segnali positivi di tintura marrone erano principalmente nella mucosa gastrica (Fig. 5 C, punte di freccia). Effetto dei cannabinoidi su gastrico alterazioni patologiche su gastrina e somatostatina rilascio. Per studiare l'effetto di CB1 agonista del recettore HU210 sulla funzione endocrina dello stomaco isolato di ratto stimolate con AP siero di ratto, abbiamo esaminato le alterazioni dei livelli di gastrina e somatostatina nella effluente venosa dello stomaco, con o senza l'intervento di recettori CB1 agonisti HU210 ed antagonista AM251. I risultati hanno mostrato che, rispetto al gruppo di controllo, lo stomaco di ratto trattato con AP sierica provocato un aumento del rilascio di gastrina (P < 0,05), ma un rilascio diminuita somatostatina (P < 0,05), HU210 invertiti gastrina e somatostatina cambiamenti indotti dal siero ratti AP (P < 0,05) (Fig. 6)., mentre AM251 non ha mostrato l'impatto rilevabile sulla liberazione dei due ormoni effetti dei cannabinoidi sulle attività di pepsina e [H +] nella gastrica effluente lumen. gli effetti degli agenti HU210 e AM251 sull'attività pepsina e [H +] nel lume effluente gastrica dello stomaco di ratto isolati sono stati presentati in Fig. 7. Rispetto alle controparti del gruppo di controllo, AP sierica stimolata la secrezione di pepsina e secrezione acida dello stomaco nel ratto isolato (P < 0,05). L'intervento di CB1 /2 agonista dei recettori HU210 attenuato l'AP modifiche siero-indotta di secrezione di pepsina e secrezione acida (P < 0,05)., Mentre l'antagonista del recettore AM251 non è riuscito ad esporre effetto evidente su questi due parametri Effetti dei cannabinoidi sui livelli di iL-6 e KC negli scarichi venosa gastrica di ratto. Dopo che i ratti hanno ricevuto il trattamento del siero AP, livelli iL-6 e KC significativamente elevati nell'effluente venoso dalla isolato di ratto stomaco; HU210 invertito i cambiamenti IL-6 e KC indotte da siero di ratti AP (P < 0,05)., Mentre AM251 avuto alcun impatto rilevabile sui livelli di citochine e chemochine nell'effluente venosa (Fig. 8) Discussione In clinica, i pazienti con pancreatite acuta, specialmente con grave pancreatite acuta, spesso soffrono AGML o ulcera stress, una complicanza comune di AP. I fattori causali per le lesioni stomaco includono, ma non limitati a, lo stress dallo stimolo infiammatorio che può indurre l'attivazione del sistema midollare locus ceruleus-norepinefrina /simpatico-surrenale e il sistema corticale ipotalamo-ipofisi-surrene. Gli aumenti segreti di catecolamine e ormoni glucocorticoidi sono i fattori più importanti di stress del corpo, per questi componenti provocano acido gastrico iper-secrezione e lo spostamento del flusso sanguigno che causano gastrointestinale ischemia della mucosa. È importante sottolineare che l'ischemia sequenzialmente peggioramento della capacità della mucosa gastrica di disporre di acido back-diffondente, con una conseguente diminuzione di pH intramurale e l'attivazione della proteasi, e successiva ulcerazioni [3], [4], [23]. Altri meccanismi, tra cui i radicali liberi dell'ossigeno-derivati e di alcuni fattori incerti, anche svolgere un ruolo nella lesione gastrointestinale in relazione con pancreatite acuta. indagini precedenti hanno scoperto che AP plasma e AP-correlati liquido ascitico contengono una grande quantità di sostanze tossiche nocive per il corpo [5], [6], [8], causando il danno del fegato, rene, polmone e del sistema circolatorio, e disfunzioni gastrointestinali, ecc [24] - [28]. Il nostro precedente studio ha scoperto che le cellule acinose pancreatiche sofferto sovraccarico di calcio e ridotta vitalità, come essere incubate con AP siero o liquido ascitico [8]. In questo studio, abbiamo prima indotti sperimentalmente AP nei ratti e dimostrato l'induzione di modello animale AP ha avuto successo, dimostrando cambiamento patologico della morfologia pancreatica e l'aumento di enzimi pancreatici nel siero di ratto dopo l'induzione. Al momento l'affermazione del modello, abbiamo continuato a stabilire un profilo di espressione genica per illustrare l'espressione genica alterata di enzimi pancreatici e mediatori infiammatori, nel tentativo di rintracciare i geni sottolineatura che hanno giocato ruoli più importanti nella patogenesi della AGML associati ad AP. E i risultati di ratti AP e controllo profilati utilizzando l'analisi gene chip erano coerenti con quelli di saggi biochimici. Inoltre, abbiamo testato se ci fossero effetti benefici degli antagonisti dei cannabinoidi e /o agonisti negli animali affetti da pancreatite acuta sperimentale. In base ai risultati di cui sopra, abbiamo affrontato la questione se la secrezione gastrica, sia per il sistema endocrino o esocrino funzioni, verrebbero alterati nei ratti AP. È noto che gastrina stimola la secrezione acida e la secrezione di pepsina, come somatostatina contrasta gli effetti della gastrina. Quando gastrina o la secrezione di somatostatina non riesce a mantenere un equilibrio di base, il surplus di pepsina e il rilascio di acido sproporzionato, con conseguente danni e disfunzioni dello stomaco durante la pancreatite acuta. Come dimostrato in questo rapporto, abbiamo trovato un livello sensibilmente innalzato gastrina nel siero e livelli di pepsina ed acido elevati nel succo gastrico di ratti AP, che ha confermato che le funzioni endocrine e esocrine dello stomaco sono stati disturbati nel modello di AP. Inoltre, i circolanti enzimi proteolitici attivati, proteine vasoattivi e endotossine specifici per la patogenesi della pancreatite acuta possono essere responsabili di AGML pure. Pertanto, abbiamo esplorato gli effetti del siero di ratti AP sul stomaco di ratto isolato e perfuso tale che l'organo poteva ignorare lo stress sistemico e impatti. L'isolato di ratto stomaco stimolato da siero di AP ratto ha mostrato non solo la lesione della mucosa oculare visibile, ma ha anche presentato una serie di anomalie biochimiche, tra cui i livelli più elevati di gastrina, citochina IL-6, chemochine KC, e il livello di somatostatina nel effluenti gastrica venosa, così come pepsina sollevato e secrezione acida nell'effluente lume gastrico. È ragionevole dedurre che vi è uno squilibrio tra il fattore aggressivo e il fattore di protezione della mucosa gastrica durante pancreatite acuta. In particolare, l'aumento della gastrina, uscita di acido gastrico e pepsina svolgere congiuntamente un ruolo importante nella patogenesi della AGML, aggravando il danno dello stomaco e innescando circoli viziosi durante pancreatite acuta. Nel corso dell'ultimo decennio, un certo numero di pubblicazioni hanno dimostrato gli effetti anti-infiammatori di cannabinoidi [29] - [32]. Diversi studi hanno dimostrato che i cannabinoidi inibiscono la secrezione di acido gastrico e ridurre le citochine infiammatorie e altro mediatore nel plasma degli animali con AP [33], [34]. I nostri risultati non solo confermano queste scoperte precedenti, ma dimostrano anche che un HU210 chimica, presumibilmente un agonista del recettore cannabinoide, servono funzioni allo stesso modo come cannabinoidi nel ridurre le citochine infiammatorie e altri mediatori, quindi migliorano i sintomi di AGML AP-associata. È interessante notare che i risultati di questo studio dimostrano che HU210 può attenuare le endocrine e esocrine gastrici cambiamenti nello stomaco di ratto isolato irritato da AP siero, invertire i livelli anormalmente gonfiati di gastrina, acido gastrico e pepsina e attutire l'effetto di questi fattori dannosi. D'altro lato, HU210 eleva il livello di somatostatina che inibisce la secrezione di gastrina e acido gastrico, quindi esercita un'azione protettiva sulla mucosa gastrica. I risultati dello studio forniscono coerenza armonica di analisi del gene-chip e biochimico dati del saggio utilizzando campioni dal modello animale, suggerendo un nuovo meccanismo che l'insorgenza di AGML è, almeno in parte, a causa della gastrina e acido gastrico /squilibrio somatostatina innescata dalle tossine nel siero AP; e cannabinoide agonista HU210 ristabilisce l'equilibrio, quindi la protezione. I risultati confermano che HU210 è benefico per il trattamento di pancreatite acuta a causa del suo ruolo di anti-infiammazione e l'effetto prevenzione sul AGML relazione con pancreatite acuta. I risultati che l'antagonista del recettore CB1 AM251 non riesce a riprodurre alcun ruolo nel sostegno danno gastrico AP indotto la nostra Postulazione, confermando i ruoli positivi di CB1 /2 recettori. In uno studio prospettico esperimento per indagare se gli inibitori della pompa protonica (IPP) può proteggere gli animali con pancreatite acuta sperimentale, abbiamo omeprazolo somministrato (OME, ip, 40 mg /kg di peso), un agente rappresentante PPI, ad un gruppo di ratti nello stesso momento in cui è stata eseguita AP induzione. I risultati preliminari hanno mostrato che OME ha aumentato il tasso di sopravvivenza dei ratti AP (dati non riportati). Tuttavia, potrebbe essere necessario studio multicentrico per chiarire se PPI sono utili come opzione terapeutica in pancreatite acuta degli esseri umani. Prendendo tutti sopra, i risultati della nostra indagine sperimentale rivelano che le risposte infiammatorie e disturbi del gastrica funzioni di secrezione, sia il sistema endocrino e esocrine, sono i risultati di pancreatite acuta, che a loro volta contribuiscono alla patogenesi della AGML. Inoltre, i risultati suggeriscono che cannabinoide HU210, il CB1 /2 agonista dei recettori, ha il potenziale terapeutico per AGML nella pancreatite acuta attenuando l'infiammazione e ristabilisce l'equilibrio gastrina /somatostatina, e quindi diminuendo la secrezione di acido gastrico e pepsina.
Materiali e Metodi
Induzione di pancreatite acuta in ratti
istologica valutazione
microarray Ibridazione Assay
analisi immunoistochimica.
Trattamento della isolato Rat stomaco
amilasi e lipopolisaccaride Livelli
pepsina e H + livelli in Animal campioni
Data Analysis
alterazioni patologiche nello stomaco dei ratti AP.
.
Risultati da Esperimento in vitro
 Gas intestinali e dolore gassoso
Definizione e fatti relativi ai gas intestinali e al dolore da gas Una donna con gas intestinale doloroso Lintestino normalmente contiene gas che viene rapidamente trasmesso attraverso lintestino t
Gas intestinali e dolore gassoso
Definizione e fatti relativi ai gas intestinali e al dolore da gas Una donna con gas intestinale doloroso Lintestino normalmente contiene gas che viene rapidamente trasmesso attraverso lintestino t
 Che cos'è un altro disturbo specifico dell'alimentazione e dell'alimentazione (OSFED)?
Altri disturbi alimentari e alimentari specificati (OSFED), precedentemente noto come disturbo alimentare non altrimenti specificato (EDNOS), è una classificazione dei disturbi alimentari in cui una p
Che cos'è un altro disturbo specifico dell'alimentazione e dell'alimentazione (OSFED)?
Altri disturbi alimentari e alimentari specificati (OSFED), precedentemente noto come disturbo alimentare non altrimenti specificato (EDNOS), è una classificazione dei disturbi alimentari in cui una p
 Sindrome di Marfan:sintomi, cause e trattamento
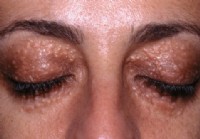
Definizione e fatti sulla sindrome di Marfan* Siringomi sulle palpebre di un paziente con sindrome di Marfan. La sindrome di Marfan colpisce persone diverse in modi diversi. I sistemi corporei pi
Sindrome di Marfan:sintomi, cause e trattamento
Definizione e fatti sulla sindrome di Marfan* Siringomi sulle palpebre di un paziente con sindrome di Marfan. La sindrome di Marfan colpisce persone diverse in modi diversi. I sistemi corporei pi