mogelijke immunologische gevolgen van farmacologische onderdrukking van maagzuurproductie bij patiënten met multiple sclerose
De abstracte Corticosteroïden zijn standaardbehandeling voor patiënten met multiple sclerose met een acute terugval. Omdat dyspeptische pijn is een veel voorkomende bijwerking van deze interventie kunnen patiënten krijgen een histamine-receptor-2 antagonist, protonpompremmer of antacid te voorkomen of te verbeteren deze verstoring. Daarnaast kunnen patiënten met multiple sclerose te nemen van deze medicijnen onafhankelijk van de behandeling met corticosteroïden. Interventies voor maag storingen kan de activatie status van het immuunsysteem, een belangrijkste mediator van pathologie in multiple sclerose beïnvloeden. Hoewel histamine-afgifte bevordert ontsteking, kan activering van de histamine receptor-2 een pro-inflammatoire immuunrespons onderdrukken en blokkeren histamine receptor-2 met een antagonist zou de balans verschuiven naar meer immuunstimulatie. Studies met behulp van een diermodel voor multiple sclerose die histamine receptor-2 antagonisten potentieel versterken ziekteactiviteit bij patiënten met multiple sclerose. In tegenstelling protonpompremmers lijken onderdrukking van het immuunsysteem te bevorderen, maar zijn niet onderzocht in modellen van multiple sclerose. Antacida, histamine receptor-2-antagonisten en protonpompremmers kan ook de darmflora, die indirect kan leiden tot immuun stimulatie veranderen. Bovendien kan verhoogde pH in de maag vitamine B12 deficiëntie dat patiënten met multiple sclerose risico op het ontwikkelen bevorderen. Hier bespreken we mogelijke rollen van maagzuurremmers op immunopathogene mechanismen geassocieerd met multiple sclerose.
Sleutelwoorden
Antacid auto dyspepsie experimentele auto-immune encephalomyelitis GERD histamine receptor-2-antagonisten multiple sclerose protonpompremmer Inleiding
Het gebruik van medicijnen om verminderen zuurproductie in de maag is uitgegroeid tot een steeds dagelijkse praktijk in de patiëntenzorg. Chronische pijn, ongemak en slikken problemen met gastro-oesofageale refluxziekte (GERD) of maagzweer zijn wijdverspreid in de populatie. Het gebruik van zuur-reducerende verbindingen heeft meer gemeengoed geworden en de mensen zijn begonnen met het nemen van hen routinematig voor maagzuur of dyspepsie. Niet-steroïdale anti-inflammatoire geneesmiddelen en andere geneesmiddelen kunnen dyspepsie en peptische zweren die kunnen worden geassocieerd met verhoogde zuursecretie veroorzaken [1]. Corticosteroïden die worden toegediend aan patiënten met multiple sclerose (MS) aan de oplossing van acute exacerbaties [2] bevorderen kunnen ook leiden dyspeptische pijn in de bovenbuik geassocieerd met een verhoogde maagzuurafscheiding [3]. Gastric storingen worden regelmatig beheerd met een histamine-receptor-2 (H2R) antagonist, protonpompremmer (PPI) of een maagzuurremmer. Deze middelen kunnen profylactisch of in antwoord op dyspeptische pijn worden toegediend wanneer de patiënt krijgt een cursus van hoge dosis corticosteroïden [2, 4-6]. Patiënten met MS kunnen ook deze drugs te nemen als onderdeel van hun dagelijkse routine te wijten aan aanhoudende dyspepsie, GERD of bijkomende ziekte. Veel van deze middelen worden voorgeschreven door de huisarts van de patiënt en zijn beschikbaar als over-the-counter medicijnen voor indigestie of gerelateerde aandoeningen. Deze maatregelen worden in het algemeen als veilig beschouwd. Wij stellen dat het gebruik van deze middelen ongewenste gevolgen voor het ziekteproces kan hebben bij patiënten met MS, en misschien in andere auto-immuunaandoeningen.
H2r protonpompremmers en antacida kunnen direct of indirect de ontstekingsreactie in patiënten met MS beïnvloeden. H2R antagonisten (zoals cimetidine, famotidine, nizatidine en ranitidine) te handelen in de maag door verlaging van de basale zuursecretie pariëtale cel-food gestimuleerd. H2R antagonisten eveneens op andere celtypen, inclusief endotheelcellen van de bloed-hersenbarrière (BBB), mestcellen en cellen van het immuunsysteem (bijvoorbeeld, T-lymfocyten, monocyten en dendritische cellen (DC's)), die centraal spelen rollen in orkestreren immuun-gemedieerde pathologie in MS. Hoewel histamine afgifte bemiddelen acute ontstekingen, kan ook van invloed zijn chronische ontstekingstoestanden [7], en aanwijzingen dat activatie van H2R onderdrukt de immuunreactie. Zo kunnen de effecten van H2R antagonisten leiden tot verbetering van een pro-inflammatoire toestand die kan resulteren in verhoogde ziekteactiviteit bij patiënten met MS. PPI (bijvoorbeeld, lansoprazol, omeprazol, dexlansoprazole, esomeprazol, pantoprazol en rabeprazol) irreversibel remmen de H
+ /K + ATPase in de pariëtale cellen, die wordt gebruikt om protonen te pompen in de gastrische lumen. Bovendien kunnen deze remmers werken op andere celtypen waaronder cellen van het immuunsysteem. In tegenstelling tot de H2R antagonisten, zou protonpompremmers onderdrukking van het immuunsysteem te promoten. Maagzuurremmers, H2R antagonisten en protonpompremmers alle leiden tot een verhoogde pH in de maag. Een langdurige verhoging gastrische pH kan leiden tot verhoogde niveaus van bacteriën in de maag en dunne darm, die in theorie ontsteking kan verergeren bij patiënten met MS. In deze review zullen we de immunologische effecten van verschillende modaliteiten gericht op het onderdrukken van maagzuur te vergelijken, en bespreken de mogelijke gevolgen voor het ziekteproces bij MS.
Histamine receptor-2-antagonisten
Histamine niveaus in de cerebrospinale vloeistof (CSF ) zijn hoger bij patiënten met relapsing-remitting MS en progressieve MS in vergelijking met de controlegroep patiënten [8, 9]. Activering van histamine receptoren kunnen zowel pro- en anti-inflammatoire trajecten, die worden gemedieerd door de differentiële activering van de vier G-eiwit gekoppelde receptoren, histamine receptor-1 (H1R), H2r, H3R en H4R [7, 10] stimuleren. Bij genetisch gemanipuleerde muizen niet histamine [11] te maken, of in muizen die histamine produceren mestcellen [12], klinische en pathologische symptomen van experimentele autoimmune encefalomyelitis (EAE), een diermodel van MS, beduidend ernstiger dan in wild-type muizen met EAE. Dit suggereert het totale effect van histamine tot een beperking autoimmuun hersenontsteking, die in tegenstelling tot de rol van histamine bij andere ontstekingen, zoals een allergische reactie. Vanwege activering van H2R blijkt een belangrijk mechanisme voor histamine gemedieerde immunosuppressie gaat, stelt het de vraag of H2R antagonisten verergeren ziekteactiviteit bij patiënten met MS. H2R wordt uitgedrukt door diverse cellen, waaronder endotheel- en systemische inflammatoire cellen [7] en H2R is in EAE uitgedrukt door CNS inflammatoire infiltraten en eventueel microglia en astrocyten [13]. Omdat H2R antagonisten is aangetoond dat de toegang tot de hersenen [14] te verkrijgen, kunnen zij effecten op inflammatoire cellen in het CNS en systemisch uitoefenen.
Histamine-receptor 2 activatie bevordert een T helpercel respons
2 Actief ziekte MS algemeen wordt aangenomen geassocieerd met een overactieve T-helpercel (Th) 1 respons en een traag Th2 respons. Bijvoorbeeld, perifere mononucleaire cellen van patiënten met MS afscheiden verhoogde hoeveelheden van pro-inflammatoire cytokinen geassocieerd met Th1 respons (bijvoorbeeld, IFN-γ, IL-12 en TNF-α) eenmaal op verlaagde hoeveelheden van het ontstekingsremmende cytokine IL 10, geassocieerd met Th2 en regulatoire T-cel activiteit [15-17]. Daarentegen wordt immuuntolerantie en /of remissie van de ziekte geassocieerd met een opregulatie van de Th2 cytokines (bijvoorbeeld IL-4 en IL-10) en TGF-β in knaagdieren met EAE [18-22]. De verhoogde ziekteactiviteit EAE bij muizen deficiënt histamineproductie gepostuleerd worden vanwege het ontbreken van onderdrukking via H2r activatie resulteert in een verhoogde Th1 respons [11]. Activering van H2R door dimaprit, een selectieve agonist H2r, bleek klinische en pathologische symptomen ernst van de ziekte in EAE (zoals ataxie en CNS macrofaag accumulatie) [23] te verminderen en encefalitogene T celresponsen [24]. Omgekeerd gebruikt cimetidine H2R blokkeren tijdens EAE inductie bij cavia leidde tot een hogere incidentie van de ziekte in vergelijking met de incidentie bij cavia's zoutoplossing [25]. Cimetidine bevorderde ook een Th1-gemedieerde vertraagd type overgevoeligheidsreactie, een inflammatoire staat met een aantal overeenkomsten met EAE [25-27].
In vitro studies tonen aan dat
H2R agonisten bootsen de acties van histamine [28], die remt de secretie van pro-inflammatoire cytokines en stimuleert de productie van anti-inflammatoire cytokines in humane perifere mononucleaire cellen [28-31] (Tabel 1). Verder werden de effecten geïnduceerd door histamine voornamelijk gemedieerd door H2r, blijkt uit het feit dat deze effecten geblokkeerd door cimetidine [29, 30, 32]. Bovendien, de H2R medieert onderdrukking van TNF-α productie door mestcellen [33]. Aldus histamine, via stimulatie van H2r, kan leiden tot een verschuiving van Th1 /Th2 balans richting van Th2-dominantie (Tabel 1). Tezamen bieden deze studies doen de vraag rijzen? - heeft selectieve H2R antagonisme negatieve invloed een auto-toestand door het bevorderen van Th1 reacties Tabel 1 Voorbeelden van het immuunsysteem effecten geïnduceerd door histamine of histamine receptor-2 agonisten
Agent
Organism /celtype
Response
Reference
dimaprit
Muizen
Verzwakt experimentele auto-immune encefalomyelitis ziekte-activiteit
[23]
dimaprit
Histamine
muis geactiveerde T-cellen
onderdrukt T-cel proliferatie, IL-6, IL-10, IL-17 en IFN-γ productie
[24]
H2 agonist
Histamine (omgekeerd door H2R antagonist)
Menselijke neutrofielen
Verlaagt neutrofielchemotaxis reactie
[44]
H2 agonist
Histamine (omgekeerd door H2R antagonist)
humane T-cellen
Verlaagt de proliferatie van T-cellen
[44]
H2R agonisten
Histamine (omgekeerd door H2R antagonist)
menselijke perifere mononucleaire bloedcellen
Remt afscheiding van IL-1 en IL -12 en stimuleert de productie van IL-10 | [28, 29, 31]
Histamine
(omgekeerd door H2R antagonist)
menselijke perifere mononucleaire cellen remt
uitscheiding van TNF-α
[30]
Histamine
(omgekeerd door H2R antagonist)
Human DCs
onderdrukt IL-12 productie na lipopolysaccharide stimulatie van DCs
[73]
Histamine
(omgekeerd door H2R antagonist)
Human DCs
Bevordert Th2 reactie, dat wil zeggen, opregulatie van Th2 chemokine productie, onrijpe DC
[74]
Histamine
(omgekeerd door H2R antagonist)
Rat mestcellen
onderdrukt TNF-α productie
[33]
Histamine
(omgekeerd door H2R antagonist)
Menselijke navelstrengader endotheelcellen
Stimuleert de productie van IL-6
[39]
DC: dendritische cel; H2R: histamine receptor-2; IFN-γ: interferon gamma; IL: interleukine; Th: T-helper cel; TNF-α. Tumor necrose factor-alfa
Histamine receptor-2 activering onderdrukt pro-inflammatoire T-cel reacties
Activering van en handel in T-cellen in het centraal zenuwstelsel zijn belangrijke stappen in MS pathogenese. In feite, geneesmiddelen die deze stappen gericht (bijvoorbeeld copolymeer 1, fingolimod en natalizumab) verminderen de ernst en frequentie van klinische terugval in MS [34-36]. -H2R overgebrachte acties kan een intrinsiek mechanisme vertegenwoordigt dat zelf-grenzen T-cel activatie, proliferatie en illegale handel, met name in de omgeving van de auto-immuniteit. Bijvoorbeeld, in vitro
toediening van histamine of een agonist H2R remt proliferatie en IFN-γ productie van muizen T-cellen geactiveerd met een encefalitogene peptide voor EAE-inductie [24].
In een intravitale microscopie model nabootst begin stadia van ontsteking in EAE, zowel H1R en H2R activering verminderde het vermogen van myeline autoreactieve T-cellen te hechten aan ontstoken hersenvaten in vivo
, een cruciale stap in de ontwikkeling van MS [24]. In een allergische model, H2R activering leidde tot neerwaartse regulatie van infiltratie van leukocyten in ontstoken weefsel [37]. Sommige studies suggereren dat H2R BBB lekkage bevorderen terwijl H1R kan onderdrukken [38], alhoewel H2R of H1R activatie geassocieerd zijn met een toename van endotheliale celproductie van IL-6 [39] en IL-6 kan optreden om de bevordering van de BBB [40, 41].
Als H2R activering leidt tot de onderdrukking van de T-cel responsen, daarna selectieve blokkering van H2R heeft de potentie om de T-cel immuunrespons te bevorderen. Inderdaad, antagonisme van H2R, onafhankelijk van het veranderen histamine niveaus, veroorzaakt immuunstimulatie en amplificatie van een bestaande inflammatoire gebeurtenis (tabel 2). In studies op humane of muizen cellen, cimetidine verhoogt mitogeen gestimuleerde lymfocyt activering [42, 43], vermindert histamine-geïnduceerde onderdrukking van T-celproliferatie [44], vermindert de histamine geactiveerde suppressor-T-celreactie in aanwezigheid of afwezigheid van mitogeen [45, 46], maakt de omzetting van monocyten tot macrofagen [47] en keert de histamine-geïnduceerde onderdrukking van pro-inflammatoire cytokine synthese [29, 30, 32] (tabellen 1 en 2). Cimetidine verhoogde antilichaam-afhankelijke cellulaire cytotoxiciteit van T-cellen van MS-patiënten tegen primaire rat oligodendrocyten [48]. Cimetidine remt regulatoire T-cel-achtige activiteit [49] en verbetert de ontstekingsreactie, een DNA-vaccin bijvoorbeeld door bevordering humorale en T-cel gemedieerde reacties en het induceren van IL-12 productie tijdens remmen van de productie van anti-inflammatoire cytokines [50 ]. Cimetidine kan ook toenemen productie en proliferatie van mitogeen gestimuleerde splenocyten antilichaam in respons op een immunogen [51]. Ranitidine veroorzaakt activering van het immuunsysteem bij patiënten met een hoofdletsel [52], keert de ingreep veroorzaakte immuunsuppressie [53-55] en werd gemeld in een case study naar lymfocytische colitis [56] verergeren. Bovendien, H2R aanwezig op basofielen en mestcellen en functie om het vrijkomen van histamine en proinflammatoire cytokines [33, 57] te onderdrukken. Tezamen ondersteunen deze gegevens een immunostimulerend rol H2r antagonisten, hetgeen waarschijnlijk te wijten aan de blokkade van H2R geïnduceerde inhibitie trajecten (tabellen 1 en 2) .table 2 Voorbeelden van immune effecten van histamine-receptor-antagonisten 2
Agent
Cell /hele dier
Response
Reference
Cimetidine
Proefkonijnen
Verhogingen activiteit van vertraagd type overgevoeligheid en experimentele auto-immune encephalomyelitis incidentie
[25]
Cimetidine
Mouse T-cellen
Remt de inductie van T-suppressor cellen
[45]
Cimetidine
muis splenocyten
Verhoogt de productie van antilichamen, en proliferatie van mitogeen-geactiveerde splenocyten in reactie op tetanustoxoïd
[51]
Cimetidine
Mouse T-cellen
Remt regulatoire T-cel-achtige activiteit
[49 ]
Cimetidine
menselijke T-cellen
Vermindert suppressor T-cel respons
[46]
Cimetidine
menselijke lymfocyten
Verhoogt de mitogeen geactiveerde T-cel respons
[42 , 43]
Cimetidine
menselijke DCs
Verhoogt de capaciteit van antigen presentatie door DCs van immuungecompromitteerde kankerpatiënten
[75]
Ranitidine
menselijke T-cellen
Verhoogt CD4 + T-cellen en mitogen gestimuleerde IFN-γ productie van patiënten met hoofdletsel
[52]
Ranitidine
Menselijke monocyten, neutrofielen, natural killer cellen, vertraagde overgevoeligheidsreacties
Keert-operatie veroorzaakte onderdrukking van het immuunsysteem
[54, 55]
DC: dendritische cel; IFN-γ. Interferon gamma
Histamine receptor-2 activering polariseert dendritische cellen en monocyten functie ten opzichte van een T-helper cel 2 antwoord
DCs zijn professionele antigeen presenterende cellen die gespecialiseerd zijn in de opname van antigenen en hun transport vanuit perifere weefsels de lymfoïde organen. Zij kunnen ook migreren in het CNS en /of onderscheiden van microglia [58, 59] en kunnen aanwezig zijn in CSF [60] zijn. Vanwege hun vermogen om naïeve T-cellen te stimuleren, DCs een centrale rol bij de initiatie van een primaire immuunrespons. Opkomende gegevens aan dat DC's spelen een belangrijke rol bij het ontstaan van auto-aanvallen EAE en MS. Specifiek worden DC-afgeleid cytokine signalen betrokken bij de differentiatie en proliferatie van autoreactieve T-cellen. Ondernemingen De profiel en niveau van cytokinen uitgescheiden door de stimulerende DCs bepaald of naïeve T cel een Th1, Th2 of Th17 cel worden. Th1 CD4 + T-helpercellen scheiden proinflammatoire cytokines zoals IL-1, IFN-γ en TNF-β, terwijl Th2 CD4 + T-cellen scheiden IL-4, IL-5, IL-13 en granulocyt koloniestimulerende factor. Th1-cellen en Th17 cellen die IL-17 afscheiden te bevorderen ontsteking in MS [61, 62]. Experimentele studies hebben aangetoond dat DC-afgeleide signalen kritisch geworven en handhaven van de activiteit van Th1 en Th17 cellen [63]. Tijdens ziekteactiviteit of terugval bij MS, is een groter deel van circulerende DCs die scheiden IL-12 en IL-23 [64, 65]. Verhoogde afscheiding van IL-12 en IL-23 door DCs zijn beurt samen met aanzienlijke verhogingen van pathogene Th1 [66] en Th17 [67, 68] activiteit, respectievelijk. Zo werden, tijdens terugval, Th1 en Th17 cellen zijn overactief en Th2 activiteit neerwaarts gereguleerd. Omgekeerd, tijdens perioden van remissie van de ziekte, waarschijnlijk een verandering in DC-afgeleide signalen bevordert een vermindering van het aantal cellen Th17 lage niveaus [69] en CD4 +
cellen polariseren in effector IL-4 en IL 10 produceren Th2-cellen, hetgeen tot een anti-inflammatoire omgeving [66, 70].
Histamine beïnvloedt het profiel van cytokineproductie door DCs rijpen [71]. H2R lijkt een dominante rol spelen in de regulering van de DC-functie [71] als meerdere DC subsets uiten hoge niveaus van H2R, terwijl H1R en H4R differentieel uitgedrukt [72]. Activering van H2R op DCs resulteert in polariseren DCs naar een Th2-klimaat wordt via onderdrukking van IL-12 [71, 73] en een toename van IL-10 synthese [71, 72]. Cimetidine is aangetoond dat de effecten van histamine blokkeren reguleren van IL-12 productie en Th2-polarisatie [73, 74]. Een recente studie toonde ook aan dat H2R activering leidde tot onderdrukking van het bloed monocyt-afgeleide CD1a + cellen, een subset van DCs bezitten groter inflammatoire eigenschappen dan de CD1a - deelverzameling en famotidine was in staat om deze actie te blokkeren [72 ].
Directe regulering van de DC-functie door H2R-antagonisten is niet aangetoond bij MS. Echter, cimetidine bleek de antigen presenterende capaciteit en mogelijk IL-12 secretie van DC geïsoleerd uit immuungecompromitteerde patiënten met colorectale kanker [75] te verhogen. Dit impliceerde ontmaskering onderdrukte functie van DC cimetidine in cellen van deze patiënten. Bij MS kunnen glucocorticoïden en INF-β IL-12 secretie te verminderen door rijpe humane DCs [76, 77], die de mogelijkheid van een omkering van DC onderdrukking van cimetidine bij patiënten met MS Soortgelijke immuungecompromitteerde patiënten met colorectale kanker verhoogt. De acties van cimetidine bij patiënten met kanker werden niet per se uitsluitend gemedieerd door H2R, aangezien soortgelijke effecten niet werden gezien met famotidine [75].
Gevolgen van histamine-receptor-2-antagonisten voor patiënten met multiple sclerose
Hoewel H2R antagonisten de mogelijkheden om in te grijpen met immunosuppressieve paden, is het onzeker of ze invloed op het ziekteverloop bij patiënten met MS. De bevindingen van EAE studies ondersteunen een rol voor H2R antagonisten ziekteprogressie mogelijk niet vertalen naar MS, dat wil zeggen, kunnen de effecten van H2R antagonisten verschillende effecten tussen muis en mens. Verder zijn er verschillende concurrerende factoren die bepalen of de immuunrespons worden geactiveerd pathologie bevorderen MS en histamine is slechts één van vele mediatoren beïnvloeden van het immuunsysteem pathogene balans en natuurlijk. Aldus is het mogelijk dat, in de opzet van een complexe ziekte, blokkering van immunosuppressie trajecten via H2R antagonisten geen invloed ontstekingsbevorderende voorwaarden of tegen het immunosuppressieve eigenschappen van corticosteroïden. Acute exacerbatie van ziekteactiviteit na inname van H2R antagonisten onwaarschijnlijk is; anders zou zijn te verwachten zijn verschillende rapporten beschrijven van deze gebeurtenissen. Echter, kan de mogelijkheid dat H2R blokkers bevorderen een algemene verhoging van ziekteactiviteit blijft, omdat sommige pathologie subklinisch kan in MS [78, 79] en het samengestelde effect van meerdere laesies jaren duren beïnvloeden de klinische presentatie van MS [80 ]. Hoewel magnetic resonance imaging (MRI) scans vaak verhoogde activiteit vertonen in aanwezigheid van stabiele klinische kenmerken, het omgekeerde is ook waar; met andere woorden, geleidelijke klinische veranderingen worden vaak niet zichtbaar met MRI. Zo zou H2R antagonisten aanhoudende pathologie verergeren op subklinisch niveau of beneden de detectielimieten van MRI. Voorts geldt reeks histamine reacties in het systeem, en het aantal gemeenschappelijke geneesmiddelen die enige invloed uitoefenen op de histamine paden kan H2R antagonisten beïnvloeden ziekteactiviteit alleen onder een specifieke set van voorwaarden of enkel samen met andere medicijnen, waardoor de effecten moeilijk herkenbaar. Om de zaken nog ingewikkelder, sommige uitkomstmaten bleek een verschil slechts met één H2R antagonist maar niet met een tweede antagonist [43, 75]. Met het grote aantal patiënten die H2R antagonisten, een kleine, maar mogelijk significant effect kan gemakkelijk worden gemist.
Een paar gevallen van verhoogde auto-immuun reacties zijn gemeld met deze middelen. Deze hebben een geval van auto-immune hepatitis in een patiënt met MS geassocieerd met opnieuw toedienen van ranitidine [81] nieuwe huidlaesies aan patiënten met systemische lupus erythematosus geassocieerd met cimetidine [82], lymfocytische infiltratie bij patiënten met borstkanker geassocieerd met famotidine [ ,,,0],83], en verergering van psoriasis in verband met H2R antagonisten [84].
protonpompremmers
PPI's worden routinematig gebruikt om zuur-peptische aandoeningen. Zij werken door het blokkeren van de maagzuursecretie via remming van de H + /K + ATPase, de proton pomp van de maag pariëtale cellen [85]. PPI's kunnen eveneens op monocyten, neutrofielen en endotheelcellen met als resultaat verbetering van de immuunrespons [86, 87]. Omeprazol [87] en eventueel andere PPI's steken de BBB. PPI kan de activiteit van reactieve zuurstofsoorten [88], die vermoedelijk ziekteactiviteit bevorderen in het CZS van MS patiënten [89] blokkeren. De rollen van PPI's in MS of in een diermodel van MS hebben niet voldoende bestudeerd, maar, zoals hieronder wordt besproken, is het theoretisch mogelijk dat hun actie is voorstander van een onderdrukkende rol op ziekte-activiteit.
Protonpompremmers kan leiden tot onderdrukking van het immuunsysteem
Verschillende in vitro en in vivo
studies hebben aangetoond dat PPI ontstekingsremmende effecten los van de remming van de maagzuurproductie [90] kan uitoefenen. Deze anti-inflammatoire effecten worden waargenomen via hun antioxidanten activiteit cytokine modulatie en vermogen om de expressie van adhesiemoleculen te wijzigen via directe werking op ontstekingscellen zoals neutrofielen, monocyten en endotheliale cellen [88]. Deze effecten kunnen aanhouden, zelfs na de korte termijn levering. Zoals vermeld in de vorige paragrafen, veranderde cytokine secretie en adhesiemoleculen uitdrukkingen in ontstekingscellen spelen een belangrijke rol in MS pathogenese. Aldus is het mogelijk dat de anti-inflammatoire eigenschappen van de PPI kan bijdragen aan de gunstige werkingen van andere anti-ontstekings- of immunomodulerende geneesmiddelen bij gelijktijdige toediening in MS.
Protonpompremmers onderdrukken ontstekingsreacties door neutrofielen en perifere bloedmonocyten
Neutrofielen zijn voorgesteld om de ziekte activiteit te bevorderen in EAE en MS [91-96]. In EAE, zijn neutrofielen aangetroffen in CNS ontstekingsinfiltraten [93, 94] en neutrofielen uitputting verbeterd EAE activiteit [94]. Neutrofielen werden gepostuleerd BBB lekkage veroorzaken tijdens de ontwikkeling van EAE [96] en kunnen betrokken zijn bij het ontstaan van axonale pathologie [95]. De rol van neutrofielen bij MS is minder duidelijk. Ze zijn voorgesteld om deelnemers bij de vroege ziekte in het centrale zenuwstelsel [95], maar kunnen niet in latere stadia. In relapsing-remitting MS, perifere neutrofielen in een gespannen toestand, wat kan leiden tot verhoogde activatie na infectie. Verhoogde effector mechanismen neutrofielen in relapsing-remitting MS omvatten verhoogde degranulatie, verhoogde oxidatieve uitbarsting en hogere niveaus van neutrofielen extracellulaire vallen [97].
PPI onderdrukken van de productie van reactieve zuurstofverbindingen door neutrofielen en monocyten in cultuur, het verminderen van hun expressie van adhesiemoleculen en verminderen hun interacties met endotheelcellen [86, 88, 98-101], die noodzakelijk is voor toegang tot het CNS. Met name, geneesmiddelen die interfereren met celadhesie aan het endotheel worden gebruikt om het optreden van terugval MS onderdrukken bijvoorbeeld natalizumab [35]. Bovendien, lansoprazol verminderde de in vitro
productie van de pro-inflammatoire cytokinen TNF-α en IL-1β door perifere bloedmonocyten [102]. Daarentegen cimetidine blokkeerde de remming van neutrofiel chemotaxis, geïnduceerd door histamine [44].
Protonpompremmers kan de inflammatoire toestand van microglia
verminderen Aangezien bepaalde protonpompremmers zoals omeprazol de BBB snel binnen te dringen [87], zouden ze het vermogen om te interageren met microgliacellen. Cellen van het immuunsysteem een belangrijke rol in de regulatie van auto-ontsteking in EAE en MS [103, 104] spelen. Geactiveerde microglia worden verondersteld om de toxiciteit aan neuronen via de productie van potentieel neurotoxische moleculen zoals pro-inflammatoire cytokines en superoxide radicalen [105] oefenen. Bijvoorbeeld, lipopolysaccharide (LPS) - en IFN-γ-gestimuleerde menselijke microglia tonen significante toxiciteit jegens neuronen in kweek [106]. Wanneer echter LPS- en IFN-γ-geactiveerde humane microgliacellen werden blootgesteld aan lansoprazol of omeprazol, toonden zij minder toxiciteit jegens neuroblastoma cellen in kweek [107]. Microglia kunnen ook beschermende functies, zoals secretie van neurotrofe factoren en beschermende cytokinen TGF-β en IL-10 [103], waardoor de rol van protonpompremmers volgende functies verdient verder onderzoek uitgevoerd.
Verhoging van de intragastrische pH
basisfunctie van alle verbindingen besproken is de gastrische pH direct of indirect te verhogen. Maagzuurremmers handelen rechtstreeks door het neutraliseren van maagzuur, terwijl H2R antagonisten en PPI's werken door het verminderen van de zuurproductie. Gemeenschappelijke antacida omvatten calciumcarbonaat, magnesiumcarbonaat, natriumbicarbonaat of aluminium hydroxide en dergelijke H2R antagonisten en protonpompremmers deze beschikbaar over-the-counter in een aantal preparaten. Ongeacht het mechanisme waardoor de pH wordt verhoogd, kan een lagere maagzuur negatieve gevolgen voor patiënten met MS. Zo is er een grotere overleving van bacteriën in de maag en dunne darm na langdurige behandeling met een zuur onderdrukkende agens [108-110]. Interessant is dat een lagere bacteriële flora in het maagdarmkanaal bleek de ernst van EAE ontwikkeling [111] verminderen. De darm microflora is aangetoond dat de aangeboren immuunrespons [112] en patiënten met MS aantasten overactieve neutrofielen [97]. Verhoogde neutrofielen activiteit is voorgesteld om te versterken en verlengen ontsteking tijdens een infectie bij patiënten met relapsing-remitting MS en kan weefselbeschadiging en ontsteking te bevorderen tijdens MS [97]. Dus een hoger niveau van bacteriën in het darmkanaal na een stijging in pH in de maag kan, in theorie, verergeren de neutrofielenrespons in MS. Anderzijds is een verhoging in pH in de maag in verband gebracht met een verhoogd risico op voedselallergieën door het bevorderen van Th2 responsen [113-116] en aluminium gebaseerde antacidum sucralfaat kan Th2 effect [117, 118] verbeteren. In dit voorbeeld zou een groter Th2-reactie als gevolg van een hogere pH in de maag worden voorspeld ziekteactiviteit in MS.
Verminderen wanneer deze gedurende langere tijd, middelen die de pH in de maag verhogen kan leiden tot een tekort aan vitamine B12, vooral bij oudere mensen [119, 120]. Patiënten met MS kunnen lage niveaus van vitamine B12 [121, 122] hebben, suggereert dat medicijnen die maagzuurproductie blokkeren zou bijdragen aan deze deficiënte toestand.
Conclusies
Een groot aantal factoren de immuunrespons gedurende verschillende moduleren fasen van MS; behandeling van dyspeptische pijn is een factor die het potentieel om de immuunrespons kunnen beïnvloeden. Het beheren van maagzuur kan een terugkerend probleem geconfronteerd gedurende de levensduur van de patiënten met MS. Hoewel niet bewezen, sommige interventies de kans op ziekte verergering terwijl anderen ziektewerendheid bevoordelen of relatief neutrale (tabel 3) kan zijn. Hoewel histamine-afgifte kan leiden tot ontsteking, wordt activering van de H2R geassocieerd met immunosuppressie; toediening van een antagonist H2R tijdens een reeds bestaande pro- inflammatoire aandoening, zoals voorkomt in MS, kan leiden tot verdere immuunstimulatie. Zo is het theoretisch mogelijk dat H2R antagonisten verergeren pathogenese of verminderen van de effecten van immunosuppressieve geneesmiddelen. Een afwezigheid van openlijke veranderingen in de klinische symptomen na toediening van H2R antagonisten mogelijk niet voldoende om de mogelijke negatieve effecten van deze geneesmiddelen te ontslaan, omdat een groot deel van de aanhoudende pathologie klinisch stil kan blijven. Naast H2R antagonisten, protonpompremmers en maagzuurremmers kunnen worden toegediend voor dyspeptic pijn. In tegenstelling tot H2r antagonisten kunnen protonpompremmers immunosuppressieve eigenschappen hebben, maar ze kunnen ook ongewenste bijwerkingen, bijvoorbeeld, verhoogd risico op infectie van de maag hebben. Antacida en H2R antagonisten en protonpompremmers kan ook indirect invloed op het immuunsysteem doordat versterkte bacteriegroei in de maag en dunne darm.
 Resistent zetmeel 101
Tenzij u een ketogeen dieet volgt, is de kans groot dat uw dieet veel koolhydraten bevat. De meeste van deze koolhydraten bestaan uit zetmelen, die zijn samengesteld uit lange glucoseketens. Terwijl
Resistent zetmeel 101
Tenzij u een ketogeen dieet volgt, is de kans groot dat uw dieet veel koolhydraten bevat. De meeste van deze koolhydraten bestaan uit zetmelen, die zijn samengesteld uit lange glucoseketens. Terwijl
 Gids voor galzuurmalabsorptie, symptomen, diagnose en behandeling
Galzuurmalabsorptie is een weinig bekende aandoening, maar een onderzoek uit 2014 wees uit dat 1 op de 3 mensen met de diagnose PDS-D en functionele diarree galzuurmalabsorptie heeft. Gal is een zuur
Gids voor galzuurmalabsorptie, symptomen, diagnose en behandeling
Galzuurmalabsorptie is een weinig bekende aandoening, maar een onderzoek uit 2014 wees uit dat 1 op de 3 mensen met de diagnose PDS-D en functionele diarree galzuurmalabsorptie heeft. Gal is een zuur
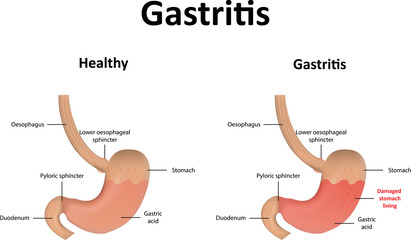 Gastritis
Gastritis is zuurschade aan het maagslijmvlies leidend tot voorbijgaande ontsteking omdat er een breuk is in het epitheel van het slijmvlies na erosie van de slijmlaag boven het slijmvliesepitheel. Ga
Gastritis
Gastritis is zuurschade aan het maagslijmvlies leidend tot voorbijgaande ontsteking omdat er een breuk is in het epitheel van het slijmvlies na erosie van de slijmlaag boven het slijmvliesepitheel. Ga