Baggrund
lymfeknudemetastase (LNM) har vist sig at være relateret til prognosen af tidlig gastrisk cancer (EGC). Valget af den optimale behandling er afhængig af en nøjagtig præoperativ vurdering af LNM status i EGC patienter. Men i Kina, hvor EGC tilfælde kun udgør en lille del af gastrisk kræft (GC) tilfælde, der er ikke nok data til at foretage en nøjagtig vurdering. Derfor er denne undersøgelse, som omfattede et relativt stort antal af EGC patienter, havde til formål at undersøge forholdet mellem klinisk-patologiske karakteristika og LNM i EGC.
klinisk-patologisk data fra 205 EGC patienter, der gennemgik kirurgisk resektion på Sun Yat-Sen University Cancer center fra januar 2000 til december 2011 er efterfølgende analyseret. Klinisk-patologisk karakteristika blev vurderet til at finde effektive prædiktive faktorer for LNM og samlet overlevelse
Resultater
LNM forekom i 52 (25,37%) EGC sager.; af disse tilfælde, 18 fandt sted i intra-slimhinde kræftformer (13 N1, 4 N2 og en N3), og 34 fandt sted i sub-slimhinde kræftformer (22 N1, 7 N2 og fem N3). Logistisk regressionsanalyse viste, at tumor differentiering (P = 0,002), dybde tumor infiltration (P = 0,004), fartøj invasion (P = 0,012), tumorstørrelse (P = 0,020) og køn (P = 0,022) var risikofaktorer forbundet med LNM i EGC, opført i prioriteret rækkefølge. Den samlede overlevelsesrate var 90,2%. Kaplan-Meier overlevelse analyse viste, at den generelle overlevelse af EGC patienter var signifikant korreleret med LNM (P = 0,001), N staging (P < 0,001) og invasion af lymfe- eller blodkar (P = 0,010), men det var ikke korreleret med tumor størrelse, dybde af tumor infiltration eller tumorcelledifferentiering. Desuden er en multipel Cox regressionsanalyse viste, at kun N iscenesættelse (P = 0,001) kunne tjene som en selvstændig prognostisk indikator i EGC patienter.
Fordi LNM uafhængigt forudsiger prognosen for EGC, endoskopisk slimhinde resektion (EMR) eller endoskopisk submucosa dissektion (ESD) og laparoskopisk partiel gastrektomi bør forsigtighed anvendes i højrisiko EGC patienter. En præoperativ vurdering af LNM status på basis af klinisk-patologiske faktorer kan være nyttig til planlægning terapi
Henvisning:. Zhao BW, Chen YM, Jiang SS, chen YB, Zhou ZW, Li YF (2015) lymfeknudemetastase , en unik Uafhængig Prognostisk faktor i Early Gastric Cancer. PLoS ONE 10 (7): e0129531. doi: 10,1371 /journal.pone.0129531
Redaktør: Yves St-Pierre, INRS, CANADA
Modtaget: Marts 4, 2015; Accepteret: 11 maj 2015; Udgivet: 8 jul 2015
Copyright: © 2015 Zhao et al. Dette er en åben adgang artiklen distribueres under betingelserne i Creative Commons Attribution License, som tillader ubegrænset brug, distribution og reproduktion i ethvert medie, forudsat den oprindelige forfatter og kilde krediteres
Data Tilgængelighed: Alle relevante data er inden papiret
finansiering:.. forfatterne har ingen støtte eller finansiering til at rapportere
konkurrerende interesser:. forfatterne har erklæret, at der ikke findes konkurrerende interesser
Introduktion
Tidlig gastrisk cancer (EGC) er en gastrisk cancer, hvor læsionen er begrænset til mucosa og submucosa, uanset tumorens størrelse eller status for lymfeknudemetastase (LNM) [1]. Sammenlignet med avanceret gastrisk cancer (AGC), EGC patienter har en bedre post-operation prognose, med en samlet overlevelse så højt som 90% [1]. EGC behandling består af endoskopisk slimhinde resektion (EMR) eller endoskopisk sub-slimhinde dissektion (ESD) og gastrektomi plus D1 eller D2 lymphadenectomy gennem laparoskopisk eller åben operation [2-4]. Som rapporteret i tidligere studier, LNM sjældent forekommer i intramucosal gastrisk kræft (som regel i mindre end 6% af disse tilfælde). Men når tumoren invaderer ind i sub-slimhinde lag af maven væg, hvor lymfekar er rigelige, satsen for LNM øger til over 10% [5], og prognosen er relativt fattige (fig 1 og 2). I visse store undersøgelser i Japan og Korea, den samlede overlevelsesrate for lymfeknude-positiv EGC faldt til 70% -80%, og tilbagefald steg til 8% [6-8]. Brugen af radikale indgreb afhænger af status for LNM. Således er det vigtigt at sammenfatte de klinisk-patologiske karakteristika EGC patienter til at finde de risikofaktorer for LNM og angive en effektiv behandling for EGC patienter.
Kina har en relativt høj forekomst af mavekræft, men der er ikke tilstrækkelige data om EKG, på grund af forsinkede diagnoser. Den foreliggende undersøgelse omfattede et relativt stort antal EGC patienter og retrospektive undersøgelser forholdet mellem de clinicopathologic faktorer af disse EGC patienter og LNM. Vi ser frem til at demonstrere risikofaktorer for LNM i EGC patienter og vælge den optimale drift metode (med eller uden lymphadenectomy) baseret på disse faktorer.
Etik erklæring
Denne forskning blev godkendt af den etiske komité i Sun Yat-sen University Cancer center, og skriftligt informeret samtykke blev opnået fra hver patient involveret i undersøgelsen.
Patienter
fra januar 2000 til december 2011 blev retrospektivt analyseret klinisk-patologiske data fra 2.264 mavecancerpatienter, som blev behandlet på Sun Yat-sen University Cancer center. Alle 2264 sager blev diagnosticeret ved rutinemæssig patologisk undersøgelse ,. To hundrede otte (9,18%) af disse sager blev diagnosticeret som T1 mavekræft (GC). Af T1 patienter blev 3 sager (1,44% af det samlede beløb) udelukket som følge af fjernmetastaser (2 levermetastaser og en peritoneal knude). I alt, som 205 EGC patienter opfyldte følgende kriterier var involveret i denne undersøgelse: (1) diagnose af tidlig mavekræft (dvs. T1A eller T1b, N0-3, M0) identificeret ved histopatologisk undersøgelse i henhold til den 7. udgave af den Internationale Union Against Cancer (UICC) Tumor-Node-Metastase (TNM) iscenesættelse system (2) kirurgisk historie, der omfattede gastrektomi plus lymphadenectomy (D1 eller D2); (3) tilgængeligheden af komplette opfølgende data (opfølgningsbesøg sluttede den 31 december 2012, og overlevelse periode blev beregnet fra tidspunktet for kirurgi til slutningen af opfølgningen eller datoen for død på grund af tilbagefald eller metastase); (4) ingen præoperativ behandling, såsom kemoterapi eller strålebehandling; (5) ingen historie familiær malignitet eller anden synkron malignitet (såsom GIST, kræft i spiserøret, eller colorectal cancer); (6) ingen tilbagevendende gastrisk kræft eller rest mavekræft; og (7) ingen død i den perioperative periode. Tumor resektion og lymphadenectomy blev udført af erfarne kirurger, og de kirurgiske procedurer, som fulgte den japanske Gastric Cancer Association (JGCA) retningslinjer, var ens i alle patienter, som gennemgik radikale resektioner.
Den mediane alder var 54 ± 13 år (interval 18-86). Der var 130 mænd og 75 kvinder (mandlige: kvinde = 1,733); medianen mandlige alder var 54 ± 12 år, og den mediane kvindelige alder var 54 ± 14 år.
Statistisk analyse
Statistisk analyse blev udført ved hjælp af SPSS 13.0 statistisk software. De målte data blev betegnet som den gennemsnitlige standardafvigelse (SD) og kontrolleres ved hjælp af t-tests. De numeriske data blev analyseret ved hjælp af Pearsons Chi-square og Fishers eksakte sandsynlighed tests. Alle 205 EGC sager blev inkluderet i Chi-square test og logistisk regressionsanalyse for at undersøge sammenhængen mellem klinisk-patologiske parametre og LNM. Endvidere blev overlevelsesdata analyseres ved hjælp af Kaplan-Meier og multipel Cox regressionsanalyse. Overlevelseskurverne blev tegnet, og forskellene blev verificeret ved hjælp af log-rank test. Forskellene blev betragtet som signifikante ved P. ≪ 0,05
Resultater
Kirurgi og lymfeknude dissektion
Et hundrede enoghalvfjerds patienter gennemgik distal gastrektomi. Atten patienter gennemgik total gastrektomi, og 16 gennemgik proksimal gastrektomi. Lymfeknude dissektioner var D2 i 181 tilfælde, og de var D1 i de resterende 24 tilfælde. De overordnede overlevelsesrater i D2 og D1 grupper var ikke signifikant forskellige (P = 0,479). I alt 4.499 lymfeknuder blev resektion, og 145 blev fundet at være positive for kræft. Stratificeret analyse viste, at den samlede overlevelse hos patienter med højst 15 resektion lymfeknuder var samme som hos patienter med mere end 15 resektion lymfeknuder (P = 0,360).
postoperativ patologisk undersøgelse identificeret 97 (47,3%) tilfælde af intra-slimhinde kræft og 108 (52,7%) tilfælde af sub-slimhinde kræft. LNM fandt sted i 52 (25,37%) tilfælde, med 35 (17,07%) tilfælde iscenesat som N1, 11 (5,37%) tilfælde som N2 og 6 (2,93%) tilfælde som N3. Derudover fandt vi 18 LNM tilfælde forekom i intramucosal kræftformer (13 N1, 4 N2 og en N3), mens 34 fandt sted i submukøse kræftformer (22 N1, 7 N2 og fem N3). Der var 8 (3,90%) tilfælde af lymfekar invasion og 2 (0,98%) tilfælde af blodkar invasion. Med hensyn til tumoren position, blev 141 (68,78%) tumorer placeret i det gastriske antrum, 39 (19,02%) i det gastriske legeme og 25 (12,20%) i det gastriske fundus eller cardia. Halvfjerds-otte (37,05%) tilfælde, havde tumorer større end 3 cm, mens 127 (61,95%) tilfælde, havde tumorer mindre end 3 cm i diameter. Blandt de sidstnævnte blev to tilfælde diagnosticeret som one-point cancer, og ingen mikro-fokus mindre end 0,5 cm i diameter blev fundet. Ifølge histologisk klassifikation, der var 66 veldifferentieret (12 tilfælde) og mid-opdelte adenocarcinom (54 tilfælde), mens de resterende 139 prøver blev diagnosticeret som dårligt differentierede adenokarcinomer (98 sager) eller signetring celle carcinom (41 tilfælde) . Ifølge de standarder for den japanske Society of Gastrointestinal Endoskopi (1962) og den japanske sammenslutning af gastrisk kræft (1998), kan de generelle former klassificeres i tre typer: 9 (4,39%) tilfælde af den fremspringende type (type I), 66 (32,20%) tilfælde af den flade type, og 130 (63,41%) tilfælde af den udgravede type (type III). Den flade form omfattede 3 (4,54% af alle type II) tilfælde af den forhøjede type (type IIa), 30 (45,45%) tilfælde af den overfladiske flad-type (type IIb), og 33 (50%) tilfælde af den overfladiske udgravet type (type IIc).
Forholdet mellem klinisk-patologiske parametre og LNM
EGC er hyppigst hos patienter i alderen mellem 41 og 60 år. Den mediane alder af LNM-positive gruppe var 52 ± 13 år ingen signifikant forskel i alder blev observeret i LNM-negative gruppe (P = 0,242, t-test). Forekomsten af LNM korrelerede signifikant med køn (P = 0,046), tumorstørrelse (P = 0,017), dybde tumor infiltration (T1A eller T1b, P = 0,034), tumorcelledifferentiering (P = 0,001) og lymfe eller blodkar invasion (P = 0,003), men det var ikke korreleret med alder, tumor placering, præoperativ status CEA, CA724 og CA199, eller generelle form (tabel 1). Logistisk regressionsanalyse viste, at tumor celledifferentiering (P = 0,002) og dybden af tumor infiltration (P = 0,004) var de vigtigste faktorer i forbindelse med EGC lymfeknudemetastase, efterfulgt af fartøj invasion (P = 0,012), tumorstørrelse (P = 0,020) og køn (P = 0,022), der er anført i prioriteret rækkefølge (tabel 2).
Forholdet mellem klinisk-patologiske parametre og EGC prognose
Den samlede overlevelse var 90,2%. Kaplan-Meier overlevelse analyse viste, at den samlede overlevelse var signifikant korreleret med LNM (P = 0,001) eller N mellemstationer (P < 0,001) og invasioner af lymfe- eller blodkar (P = 0,010), men det var ikke korreleret med alder, køn, tumorstørrelse, tumor position, dybde af tumor infiltration, tumorcelledifferentiering eller generelle form. Som med behandling, den generelle overlevelse for patienter viste ingen tydelig sammenhæng med omfanget af gastrisk resektion (P = 0,856), D1 eller D2 operation (P = 0,353) eller antallet af lymphadenectomies (< 15 eller ≥15, P = 0,269). Desuden multipel Cox regressionsanalyse identificeret, kun N staging (P = 0,001) kunne tjene som en uafhængig prognostisk indikator i EGC patienter (tabel 3). De overordnede overlevelsesrater for LNM-negative og LNM-positive grupper var 94,1% og 78,8%, henholdsvis (P = 0,001, log-rank test); den gennemsnitlige samlede overlevelsestid var 144.142 og 113.876 måneder. Kaplan-Meier plot er vist i figurerne 3, 4, 5 og 6.
Diskussion
mavekræft (GC) er en almindelig ondartet svulst på verdensplan. Med et anslået antal på en million nye tilfælde hvert år, GC rangerer som den fjerde mest almindelige kræftform [9]. EGC, defineret som en intra- og sub-mucosa tumor med eller uden LNM, har en relativt højere samlet overlevelse (mere end 90%) end fremskreden mavekræft (ACG) [1]. Adachi et al rapporteret i deres gennemgang [4], at LNM forekom hyppigere i sub-slimhinde GC end i intra-slimhinde GC (15% VS 3%). Desuden har de demonstreret den prognostiske værdi af LNM i EGC patienter. I de seneste årtier, mange post-operation overlevelse analyser på EGC viste, at intra-slimhinde kræft uden LNM kunne blive helbredt ved endoskopisk slimhinde resektion (EMR), mens andre EGC patienter krævede gastrektomi med D1 eller D2 lymphadenectomy [7,10]. Disse data antydede, at i klinisk praksis, præcise pre-operation vurderinger af EGC patienter (hovedsageligt dybden af tumor infiltration og LNM) var kritiske i at vælge optimale behandlinger. Derfor er denne undersøgelse sigter finde en effektiv metode til at forudsige eksistensen af LNM i EGC patienter til at støtte nye beviser for at angive den bedste behandling.
Vi analyserede efterfølgende klinisk-patologiske data fra 205 EGC patienter, som gennemgik kirurgisk resektion på Sun Yat-sen University Cancer center fra januar 2000 til december 2011. De vigtigste klager over disse patienter inkluderet øvre mavesmerter (75,12%), oppustethed (21.95), sure opstød (11,22%) og opstød (7,32%). Ifølge vores data, mest gastrisk cancer patienter har en forsinket diagnose, som et resultat af mangel på generelle gastroskopi undersøgelse. Tumoren invaderet dybere eller skred ind AGC uden åbenlyse kliniske manifestationer. Derfor sub-slimhinde cancer udgør en større del af EGC i vores center (108/205), end det gør i Japan og Korea [11-12].
Vores resultater viste, at LNM fandt sted i 52 205 EGC sager (25,37%). Af disse 52 blev 18 fundet i de 97 T1A tilfælde (18,56%), og 34 blev fundet i de 108 T1B tilfælde (31,48%). Disse forekomster er væsentligt højere end de 10% lymfeknude positivitet ratio, som blev rapporteret af Saka et al [13] baseret på en analyse af 2.368 EGC tilfælde registreret i Japan National Cancer Center. Vi kan hypotesen, at EGC i Kina har sine egne funktioner, såsom dybere tumor invasion og mere LNM. Så vi yderligere analyseret sammenhængen mellem LNM og klinisk-patologiske faktorer af disse patienter og fandt, at køn (P = 0,046), tumorstørrelse (P = 0,017), dybde tumor infiltration (T1A eller T1b, P = 0,034), tumor celle differentiering (P = 0,001) og lymfe eller blodkar invasion (P = 0,003) korreleret med LNM. Desuden er en logistisk regressionsanalyse viste, at tumor celledifferentiering (P = 0,002) og dybden af tumor infiltration (P = 0,004) var de vigtigste faktorer i forbindelse med EGC lymfeknudemetastase, efterfulgt af fartøj invasion (P = 0,012), tumorstørrelse (P = 0,020) og køn (P = 0,022). Kvindelige EGC patienter lidt en højere LNM ratio end de mandlige EGC patienterne gjorde (33,33% mod 20,77%); LNM var mere tilbøjelige til at korrelere med store tumorer. Derudover 21 af de 41 tilfælde med tumorer større end 4 cm var positive for LNM (47,73%), mens kun 1 af de 13 tilfælde med tumorer mindre end 1 cm var positiv for LNM. Som med tumor differentiering, 13 af de 34 (38,24%) signetring celle kræft var positive for LNM. Svarende til vores undersøgelse, de fleste tidligere undersøgelser [14-16], at dybden af tumor infiltration eller T1A /T1b, er den vigtigste faktor korreleret med LNM. Vores data var i overensstemmelse med denne konklusion, og vi yderligere opdaget, at der var 13 N1 sager, 4 N2 tilfælde og kun 1 N3 tilfælde af t1A, mens der var 22 N1, 7 N2 og 5 N3 tilfælde af T1b. Disse data viste, at dybden af tumorinvasion blev korreleret ikke kun med forekomsten af LNM men også med graden eller antallet af metastatiske lymfeknuder. Men LNM forekomst viste ingen signifikante forskelle med hensyn til alder, tumor placering, generel form eller de præ-operative status for CEA, CA199 og CA724. I alle, dårligt differentierede celler, tumor invaderer ind i sub-slimhinden lag, tumorstørrelse større end 3 cm, invasion fartøj og være kvinde var risikofaktorer for LNM, der er anført i prioriteret rækkefølge. Fire af disse risikofaktorer (ekskl fartøj invasion) er påviselige, og kan bruges til at forudsige LNM. Ifølge vores resultater, EGC patienter med kun én risikofaktor havde en 31,5-34,6% incidensrate for LNM, patienter med to risikofaktorer havde en 38,9-47,1% sats, patienter med tre risikofaktorer havde en 53,8-66,7% sats og patienter med alle fire risikofaktorer havde en mere end 80% incidensrate af LNM. Interessant i denne undersøgelse, 15 patienter havde ingen risikofaktor (herunder fartøj invasion), og 6 patienter havde alle fire risikofaktorer. Ingen af patienterne 15 risikofrie havde LNM, mens alle 6 risikopatienter højeste havde LNM. Disse data kan give en reference for præoperativ vurdering og et optimalt valg til EGC behandling.
EGC har en bedre prognose end AGC. En nylig undersøgelse rapporterede, at de 5- og 10-årige overlevelsesrater for EGC er mere end 90% og 80%, henholdsvis [17]. Den aktuelle undersøgelse identificerede den mediane overlevelse (MS) tid til EGC patienter som 136.445 måneder (95CI: 128,688 til 144,201). Brug Kaplan-Meier overlevelsesanalyse, viste vi, at fartøj invasion og N iscenesættelse (lymfeknude metastaser) er vigtige prognostiske prædiktorer for EGC. Multipel Cox regressionsanalyse viste, at kun N staging uafhængigt kunne forudsige prognosen for EGC patienter. Modstrid med tidligere undersøgelser [18], fandt vi, at N iscenesættelse var den eneste uafhængige prognostiske faktor og at tumorstørrelse, tumor celledifferentiering og dybden af tumor infiltration kunne ikke uafhængigt forudsige EGC patient prognose. De fire ovennævnte klinisk-patologiske faktorer korreleret med LNM og derfor ikke kunne direkte forudsige EGC prognose. Der var ingen signifikant forskel i den samlede overlevelse t1A og T1B patienter (139,251 vs. 132,644). Desuden er alle patienter i denne undersøgelse undergik D1 eller D2 lymfeknude dissektion, og vi fandt ingen signifikante forskelle i deres overlevelse. Der var heller ingen signifikant forskel i overlevelseschancerne for patienter, som gennemgik lymphadenectomy (< 15 eller ≥15).
Hvordan at gøre det bedste valg blandt de mulige behandlinger for EGC, herunder EMR /ESD [19] , laparoskopisk gastrectom [20] og traditionalD1 eller D2 radikal resektion [21], er fortsat diskutabel. Præoperativ LNM status vil helt sikkert være nyttig information, når de foretager en klinisk beslutning. Dog kan kliniske risikofaktorer kun anvendes til groft evaluere forekomsten af LNM. Udviklingen af præcise metoder kræver nye biomarkører. I de seneste årtier har flere undersøgelser relateret til opdagelsen af nye biomarkør blevet udført. Tamura Y viste, at MUC4 og MUC1 blev korreleret med LNM og havde potentialet til at være nye markører til forudsigelse af LNM i EGC [22].
Bedre overlevelse afhænger af tidlig diagnose og nøjagtig præoperativ vurdering af EGC. Resultaterne af den nuværende undersøgelse tyder på, at kvindelige patienter med sub-mucosa invasion, tumorer større end 3 cm i diameter, dårligt differentierede celler og lymfe eller invasion blodkar er i høj risiko for LNM og har dårlig prognose. Behandling, herunder kirurgisk resektion og andre adjuverende behandlinger bør forsigtigt planlagt, og disse klinisk-patologiske faktorer bør overvejes.
 Menneskelige coronavirus har brug for organiske materialer for effektivt at overføre mellem overflader
Menneskelige coronavirus har brug for organiske materialer for effektivt at overføre mellem overflader
 Kvinder født med kejsersnit har større risiko for fedme og diabetes
Kvinder født med kejsersnit har større risiko for fedme og diabetes
 Lungemikrobiom forudsiger sværhedsgraden af COVID-19 sygdom
Lungemikrobiom forudsiger sværhedsgraden af COVID-19 sygdom
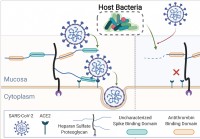 Humant mikrobiom beskærer slimhindeglykaner,
Humant mikrobiom beskærer slimhindeglykaner,
 Langsigtet antibiotikabrug i præemier fremmer lægemiddelresistente tarmbakterier
Langsigtet antibiotikabrug i præemier fremmer lægemiddelresistente tarmbakterier
 Genetisk risiko for autoimmunitet kan være forbundet med forskelle i tarmmikrobiom
Genetisk risiko for autoimmunitet kan være forbundet med forskelle i tarmmikrobiom
 Fiskeslim kan være en potentiel kilde til antibiotika, finder undersøgelse
Med fremkomsten af multilægemiddelresistente bakterier og mangel på nye antibiotika, forskere har været på udkig efter nye molekyler, der kan bekæmpe disse patogener. Et team af forskere har nu iden
Fiskeslim kan være en potentiel kilde til antibiotika, finder undersøgelse
Med fremkomsten af multilægemiddelresistente bakterier og mangel på nye antibiotika, forskere har været på udkig efter nye molekyler, der kan bekæmpe disse patogener. Et team af forskere har nu iden
 Nanoteknologi og COVID-19 diagnose og behandling
Udviklingen af nano-biosensorer og nanopartikelbaserede vacciner og medicin har åbnet en ny vej mod bedre håndtering af coronavirus-sygdommen 2019 (COVID-19) pandemi. I en nyligt offentliggjort arti
Nanoteknologi og COVID-19 diagnose og behandling
Udviklingen af nano-biosensorer og nanopartikelbaserede vacciner og medicin har åbnet en ny vej mod bedre håndtering af coronavirus-sygdommen 2019 (COVID-19) pandemi. I en nyligt offentliggjort arti
 Genetik kan påvirke sammensætningen af mikrobiomet mere end miljøfaktorer
Forskere, der studerer mus ved Technion-Israel Institute of Technology, har fundet ud af, at mikrobiomet er påvirket af genetik meget mere, end det er af moderens fødselsmiljø. Kateryna Kon
Genetik kan påvirke sammensætningen af mikrobiomet mere end miljøfaktorer
Forskere, der studerer mus ved Technion-Israel Institute of Technology, har fundet ud af, at mikrobiomet er påvirket af genetik meget mere, end det er af moderens fødselsmiljø. Kateryna Kon