Die randomisierte, Die globale Phase-2-Studie ALTA wurde entwickelt, um die Wirksamkeit und Sicherheit von ALUNBRIG bei Patienten mit lokal fortgeschrittenem oder metastasiertem ALK+ NSCLC zu untersuchen, die unter Crizotinib eine Progression hatten. Die Patienten wurden randomisiert einer von zwei ALUNBRIG-Schemata zugeteilt:90 mg ALUNBRIG einmal täglich (n =112) oder 180 mg einmal täglich mit einer siebentägigen Einführung von 90 mg einmal täglich (n =110).
„ALK+ NSCLC ist eine schwere und lebensbedrohliche Erkrankung, von der etwa 40 Menschen betroffen sind. 000 Menschen weltweit jedes Jahr, und viele Patienten werden bei der Erstlinienbehandlung Fortschritte machen oder nicht mehr darauf ansprechen, " sagte Stefania Vallone, Präsident, Lungenkrebs Europa. "Für europäische Menschen mit ALK+ NSCLC, Es besteht weiterhin ein erheblicher ungedeckter Bedarf an neuen und wirksamen Behandlungsoptionen."
"Während ALK-Inhibitoren in diesem Behandlungsfeld in den letzten zehn Jahren ein enormes Wachstum gezeigt haben, mit Spannung erwartet wird, dass eine zusätzliche gezielte Therapieoption für die Behandlung von ALK+ NSCLC verfügbar ist, “ sagte Enriqueta Felip, M. D., Doktortitel, Leiter der thorakalen Onkologie, Onkologische Abteilung des Universitätskrankenhauses Vall d'Hebron in Barcelona. „Bei einem medianen progressionsfreien Überleben von 16,7 Monaten und einem Gesamtüberleben von 34,1 Monaten ALUNBRIG hat beeindruckende Ergebnisse gezeigt, Dies stellt einen neuen Fortschritt für die Behandlung von ALK+ NSCLC in diesem Umfeld dar."
„Die ALTA-Studie hat ALUNBRIG als potenzielle Zweitlinien-Behandlungsoption für ALK+ NSCLC etabliert. durch den Nachweis einer signifikanten Wirksamkeit mit einem überschaubaren Sicherheitsprofil, " sagte Jesús Gómez-Navarro, M. D., Vizepräsident, Leiter Klinische Forschung und Entwicklung Onkologie, Takeda. „Mit einem medianen progressionsfreien Überleben von 16,7 Monaten, der längste von allen ALK-Inhibitoren, der in dieser Situation gemeldet wurde, ALUNBRIG bietet großes Potenzial für Patienten, die unter Crizotinib Fortschritte gemacht haben. Die heutige positive Stellungnahme bringt uns dem endgültigen Ziel näher, das Behandlungsparadigma für die beträchtliche Anzahl von in Europa lebenden, mit Crizotinib behandelten ALK+ NSCLC-Patienten voranzutreiben. Wir freuen uns auf die Überprüfung der positiven Stellungnahme des CHMP durch die Europäische Kommission und auf die Einführung von ALUNBRIG bei Patienten und Angehörigen der Gesundheitsberufe in der Europäischen Union, falls dies genehmigt wird."
Im Rahmen dieser Einreichung der CHMP überprüfte auch Daten aus der ersten Zwischenanalyse der Phase-3-Studie ALTA-1L, das seinen primären Endpunkt erreicht hat, als unterstützender Beweis. Bei ALTA-1L, Die Behandlung mit ALUNBRIG führte zu einer statistisch und klinisch signifikanten Verbesserung des PFS gegenüber Crizotinib, wie von einem verblindeten unabhängigen Prüfungsausschuss beurteilt. Das mit ALUNBRIG verbundene Sicherheitsprofil stimmte im Allgemeinen mit früheren Studien und der genehmigten US-amerikanischen und kanadischen Kennzeichnung überein.
Die positive Stellungnahme des CHMP für ALUNBRIG wird nun von der Europäischen Kommission geprüft. die befugt ist, Arzneimittel zur Verwendung in den 28 Mitgliedstaaten der Europäischen Union zuzulassen, sowie Norwegen, Liechtenstein und Island.
 Behandlung von Bauchschmerzen bei Reizdarmsyndrom (IBS)
Bauchschmerzen sind ein häufiges Symptom des Reizdarmsyndroms (IBS). Laut einer Umfrage der International Foundation for Functional Gastrointestinal Disorders unter 1.966 Personen mit Reizdarmsyndrom
Behandlung von Bauchschmerzen bei Reizdarmsyndrom (IBS)
Bauchschmerzen sind ein häufiges Symptom des Reizdarmsyndroms (IBS). Laut einer Umfrage der International Foundation for Functional Gastrointestinal Disorders unter 1.966 Personen mit Reizdarmsyndrom
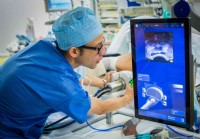 Wie Prostatakrebs behandelt wird
Die Behandlungsoptionen für Prostatakrebs können aufgrund vieler Faktoren variieren, einschließlich der Aggressivität des Tumors, des Krankheitsstadiums, persönlicher Vorlieben und mehr. Zu den kurati
Wie Prostatakrebs behandelt wird
Die Behandlungsoptionen für Prostatakrebs können aufgrund vieler Faktoren variieren, einschließlich der Aggressivität des Tumors, des Krankheitsstadiums, persönlicher Vorlieben und mehr. Zu den kurati
 Verdauungskrankheiten:Sodbrennen und gastroösophageale Refluxkrankheit (GERD)
Wie fühlt sich Sodbrennen an? Was verursacht Sodbrennen? Wie wird Sodbrennen behandelt? Tipps zur Linderung Ihrer Sodbrennen-Symptome Freiverkäufliche Behandlungen für Sodbrennen und GERD Verschreibun
Verdauungskrankheiten:Sodbrennen und gastroösophageale Refluxkrankheit (GERD)
Wie fühlt sich Sodbrennen an? Was verursacht Sodbrennen? Wie wird Sodbrennen behandelt? Tipps zur Linderung Ihrer Sodbrennen-Symptome Freiverkäufliche Behandlungen für Sodbrennen und GERD Verschreibun