risultati di sopravvivenza chirurgica e lungo termine a breve termine dopo laparoscopica gastrectomia distale con D
2 linfoadenectomia per il cancro gastrico
Abstract
sfondo
laparoscopica gastrectomia distale (LDG) per cancro gastrico è progressivamente guadagnato popolarità. Tuttavia, raramente sono stati riportati i risultati oncologici a lungo termine di LDG. Questo studio ha lo scopo di indagare gli esiti di sopravvivenza di LDG, e valutare i primi risultati chirurgici di laparoscopia assistita gastrectomia distale (LADG) e totalmente laparoscopica gastrectomia distale (TLDG).
Metodi
esiti clinici di 240 pazienti consecutivi con gastrica cancro che ha subito LDG presso il nostro istituto tra ottobre 2004 e aprile 2013 sono stati analizzati. risultati chirurgici precoci di LADG e TLDG sono stati confrontati ed esperienze operative sono stati valutati.
Risultati La rosa della 240 pazienti, 93 sono stati sottoposti a LADG e 147 sono stati sottoposti a TLDG. Ci sono stati 109 T1, T2 36, 31 T3, e 64 lesioni T4a. Il periodo mediano di follow-up è stata di 31,5 mesi (range: 4-106 mesi). Tumore recidiva è stata osservata in 40 pazienti e recidiva peritoneale è stata osservata più comunemente. La sopravvivenza a 5 anni libera da malattia (DFS) e la sopravvivenza globale tariffe (OS) a seconda dello stadio del tumore erano 90,3% e il 93,1% in stadio I, 72,7% e 67,6% in stadio II, e il 34,8% e il 41,5% in stadio III rispettivamente. Non ci sono differenze significative nei risultati chirurgici precoci sono stati notati come il tempo di funzionamento, perdita di sangue e il recupero post-operatorio tra LADG e TLDG (P
> 0,05).
Conclusioni
LDG per cancro gastrico aveva accettabile oncologica a lungo termine risultati. I primi risultati chirurgici dei due metodi LDG comunemente usati erano simili.
Parole
neoplasie dello stomaco gastrectomia Laparoscopia linfoadenectomia sopravvivenza Sfondo
cancro gastrico è una delle più comuni cause di morte per cancro in tutto il mondo [1]. Anche se, la chemioterapia adiuvante migliora la sopravvivenza di questi pazienti [2, 3], gastrectomia radicale con regionale dissezione dei linfonodi rimane l'unico trattamento potenzialmente curativo disponibile per adenocarcinoma gastrico [4, 5].
Da quando è stato segnalato la prima volta nel 1994 [ ,,,0],6], laparoscopica gastrectomia distale (LDG) per cancro gastrico ha subito un rapido sviluppo e ha guadagnato popolarità negli ultimi 20 anni, grazie ai vantaggi ben noti, tra cui un corso meno dolorosa di recupero, in precedenza il recupero, una migliore cosmesi, e migliorato breve qualità -term della vita sulla gastrectomia aperto [7-10]. Anche se l'effetto minimamente invasiva di LDG è eccellente, gli effetti terapeutici di adenocarcinoma manca ancora il supporto di studi di follow-up a lungo termine. La versione più comune di LDG è gastrectomia laparoscopia assistita distale (LADG) e gastrectomia distale totalmente laparoscopica (TLDG). In entrambe queste tecniche, linfadenectomia perigastrica viene eseguita in laparoscopia. Tuttavia, il primo richiede un'incisione ausiliario epigastrica per sicuro en l'estrazione in blocco del campione, e per finire la ricostruzione del tratto digestivo. Quest'ultimo è caratterizzato da una anastomosi intracorporea senza incisione ausiliario ed è considerato "incisionless", con l'eccezione delle ferite trequarti. Se queste due diverse procedure di anastomosi influenzare l'esito a breve termine di questo tipo di chirurgia rimane controverso [11-13].
Lo scopo di questo studio era quello di valutare i risultati a lungo termine oncologici di pazienti che hanno subito LDG, concentrandosi su ricorrenza e tassi di sopravvivenza post-operatorie. Inoltre, le variabili e gli esiti di LADG e TLDG chirurgici a breve termine sono stati confrontati per valutare i vantaggi e gli svantaggi di queste procedure.
Metodi
pazienti
Tra ottobre 2004 e aprile 2013, 251 pazienti consecutivi sottoposti LDG con D 2 linfoadenectomia per il cancro gastrico a Sir Run Run Shaw Hospital sono stati inclusi in questo studio. I criteri di esclusione comprendevano: (1) l'invasione delle strutture adiacenti; (2) la resezione palliativa o nessuna resezione R0; (3) metastasi a distanza (per esempio metastasi peritoneali o peritoneale citologia lavanda positivo per cellule di carcinoma, metastasi epatiche); e (4) non ha confermato patologicamente come adenocarcinoma
. Gli esami del sangue, radiografia del torace, una maggiore scansioni di tomografia computerizzata dell'addome e del bacino, e l'endoscopia gastrica sono stati eseguiti prima dell'intervento chirurgico. Questo protocollo di studio è stato approvato dal comitato etico del nostro ospedale e il consenso informato è stato firmato da ogni paziente prima dell'intervento.
Procedura chirurgica
Il paziente è stato posto in posizione supina in anestesia generale. Il chirurgo si trovava sul lato destro del paziente. Un assistente stava sul lato destro del paziente e tenuto il laparoscopio, e un altro si trovava sul lato sinistro del paziente. L'anidride carbonica pneumoperitoneo è stato istituito attraverso un ago di Veress e fissato a 15 mmHg. Un iniziale di 10 mm trequarti è stato inserito per la laparoscopia sotto l'ombelico e altri quattro trocar (uno dei 12 mm, tre su 5 mm) sono stati inseriti nel fianco sinistro superiore, fianco sinistro, fascia in alto a destra, e quadranti fianco destro, rispettivamente; un totale di cinque trocars sono stati inseriti, e disposti in una forma a V [14, 15]. D 2 linfadenectomia è stata eseguita secondo le linee guida di cancro gastrico giapponesi che comprendeva No. 7, 8, 9, 10, 11p, 11d e 12a, e 14v oltre a D 1 dissezione. metodi anastomosi inclusi Billroth I o II Billroth gastrodigiunostomia. La procedura dettagliata linfoadenectomia e la ricostruzione sono stati descritti nei nostri articoli precedentemente pubblicati [16, 17]
. La raccolta dei dati e di valutazione di follow-up
Demografia e dati perioperatorie sono stati retrospettivamente raccolti da registri ospedalieri e analizzati. stadiazione clinica e patologica sono stati determinati secondo il Joint Committee on Cancer (7a edizione), utilizzando lo schema di classificazione del tumore-node-metastasi (TNM). La chemioterapia adiuvante con 5-fluorouracile (5-FU) a base di regimi (per lo più 5-FU con cisplatino) è stato raccomandato a tutti i pazienti eleggibili, ad eccezione di quelli in stadio I tumori. i dati di follow-up sono stati raccolti per almeno 3 anni, di cui si alternano semestrale addomino TAC o esami ecografici. Una sorveglianza endoscopica è stata eseguita ogni anno o prima se il paziente ha avuto sintomi o non c'era alcun sospetto di recidiva. modelli di ricorrenza compresi peritoneale, locoregionale, dei linfonodi e ematogena. ricorrenze peritoneale inclusi piantine peritoneale o tumori del Krukenberg. recidive locoregionali inclusi tumori in organi adiacenti, lo stomaco residuo o di anastomosi. recidive ematogena inclusi tumori in altri siti distanti, come il fegato, polmoni, ossa e cervello. Analisi statistica
dati quantitativi sono stati espressi come media ± deviazione standard (SD). Le differenze tra i dati di misura sono stati confrontati utilizzando il test t
di Student, e il confronto tra i gruppi sono state testate utilizzando la χ 2 test o il test esatto di Fisher probabilità. La sopravvivenza libera da malattia (DFS) e il tasso di sopravvivenza globale (OS) sono stati calcolati con il metodo Kaplan-Meier utilizzando il software SPSS, versione 18.0 (SPSS Inc., Chicago, Stati Uniti). DFS è stato definito come il tempo dalla chirurgia al tempo di reiterazione del cancro gastrico originale o sviluppo di un tumore secondario. OS è stato definito come il tempo da un intervento chirurgico alla data di morte per qualsiasi causa. P
< . 0.05 è stato considerato statisticamente significativo
Risultati
demografici e le caratteristiche clinico-patologiche
Tra i 251 pazienti, sono stati esclusi 11: cinque non poteva subire R0 resezione (tre con tumore invasione delle strutture adiacenti, due con conglomerato di linfonodi ), tre avevano metastasi a distanza, e tre non hanno avuto l'adenocarcinoma (due carcinomi neuroendocrini, un linfoma). Dopo aver escluso questi 11 pazienti, 240 con intento curativo sono stati inclusi in questo studio
caratteristiche demografiche e clinicopatologici sono elencate nella Tabella 1. L'età media dei pazienti era di 59,3 anni (range 30-81 anni) e il maschio.: rapporto femminile era 2.5: 1 (171 maschi). Medio indice di massa corporea (BMI) dei pazienti era di 22,7 kg /m 2 (range 14.5-32.9 kg /m 2). Poco più di un terzo (83/240; 34,6%) dei pazienti avevano comorbidità, l'essere più comune di ipertensione. Di questi 240 pazienti, 93 sono stati sottoposti LADG e 147 sottoposti a TLDG. Dai risultati patologici, il 45,4% dei pazienti ha avuto lesioni che sono stati in scena come T1, il 50,8% è stato messo in scena come N0, e il 53,3% ha avuto fase I neoplasie. Circa il 55% dei pazienti aveva il cancro gastrico avanzato, definita come l'invasione del tumore nella corretta layer.Table muscolare 1 caratteristiche cliniche e caratteristiche patologiche
variabili
Valori
di genere (maschio /femmina)
171/69
Età (anni)
59,3 ± 10,7
BMI (kg /m2)
22,7 ± 3,0
ASA classificazione (I /II /III)
118 /108/14
comorbidità
83
Ipertensione
mellito 52 diabete
19
cardiovascolare
16
polmonare
9
Fegato
7
Altri
8
Le dimensioni del tumore (cm)
3.6 ± 2.0
Istologia (differenziato /indifferenziato)
131/109
stadio T (T1 /T2 /T3 /T4a)
109/36/31/64
fase N (N0 /N1 /N2 /N3)
122/57/36/25 fase
TNM (I /II /III /IV)
128/45/67/0
risultati operativi e postoperatoria decorso clinico
I risultati operativi e dati postoperatori decorso clinico sono riportati nella tabella 2. Il tempo di funzionamento medio è stato di 231,1 min (range 150- 380 min), con una perdita di sangue medio di 136,3 mL (range 20-420 mL). Il numero medio di linfonodi recuperati per paziente era 30,4 (range 16-66). I margini di resezione prossimale e distale medi erano 4,9 cm (range, 2-10 cm) e 5,0 cm (range, 2-11 cm), rispettivamente. Il tempo medio alla prima flatus era 3,7 giorni (range 2-7 giorni). I tempi medi di iniziare diete liquide e analcoliche erano 4,9 giorni (range 3-22 giorni) e 6,6 giorni (range 4-24 giorni), rispettivamente. Infine, la degenza media post-operatoria è stata del 9,8 giorni (range 6-42 giorni). La distanza media margine prossimale TLDG era più lungo di quello LADG (5,1 ± 1,4 cm rispetto 4.6 ± 1.2, P
< 0.01). Non ci sono state differenze significative in altri risultati operativi e recupero post-operatorio tra il gruppo e il gruppo LADG TLDG (P
> 0,05), anche se il tempo di funzionamento media, la perdita di sangue e il tempo per primi flatus sono stati leggermente inferiori nel gruppo TLDG che nei LADG group.Table 2 risultati operativi e il decorso clinico
variabili postoperatorie
totale (n = 240)
LADG (n = 93)
TLDG ( n = 147)
P
valore
ricostruzione (Billroth I /Billroth II)
18/222
11/82
7/140
0.075
tempo di funzionamento (min)
231,1 ± 48,1
238,0 ± 43,9
226,8 ± 50,2
0,080
perdita di sangue (ml)
136,3 ± 78,6
146,0 ± 70,5
130.1 ± 83.0
0,126
numero di linfonodi recuperati
30.4 ± 8.6
29.5 ± 8.4
30,9 ± 8,8
0,228
margine di resezione prossimale (cm)
4.9 ± 1.5
4.6 ± 1.2
5.1 ± 1.4
0.002
distale margine di resezione (cm)
5.0 ± 1.4
4.9 ± 1.6
5.1 ± 1.4
0,393
Tempo alla prima flatus (giorni)
3,7 ± 1,1
3.9 ± 1.2
3,6 ± 1,1
0,085
tempo di iniziare la dieta liquida (giorni)
4.9 ± 1.8
4.9 ± 2.1
4.8 ± 1.6
0,794
tempo di iniziare la dieta morbida (giorni)
6.6 ± 2.4
6.7 ± 2.6
6.6 ± 2.2
0,958
degenza post-operatoria (giorni)
9.8 ± 3.7
9.9 ± 3.1
9.8 ± 4.0
0,837
complicazioni postoperatorie
26 10
16
0.974
anastomotica perdite 2
1
1 emorragia post-operatoria 3
1 2
ascesso addominale
5 Pagina 3 2
infezione polmonare
5 Pagina 2 3
ritardato svuotamento gastrico Pagina 6 Pagina 2 4
pancreas fistola
1
0
1 ileo
1 0
1 Lymphorrhea 3
1 2
Il tasso di morbilità post-operatoria è stata del 10,8% ( 26/240 pazienti), e non vi era alcuna mortalità perioperatoria. Morbilità comprendeva due casi di perdita anastomotica al sito gastrodigiunostomia (richiedono correzione chirurgica) e tre casi di emorragia (due dalla arteria gastroduodenale e uno da un ramo della arteria splenica), due delle quali richiedono una seconda operazione per fermare l'emorragia. Altre complicazioni inclusi ascesso addominale (n = 5), infezione polmonare (n = 5), in ritardo di svuotamento gastrico (n = 6), fistola pancreatica (n = 1), ileo (n = 1), e Lymphorrhea (n = 3) . Queste complicazioni sono state controllate dal trattamento conservativo. Un confronto di morbidità nel gruppo LADG e gruppo TLDG e il tipo di complicazioni non ha mostrato alcuna differenza, e l'incidenza di questi eventi non è sostanzialmente diversa tra i due gruppi (P
> 0,05)
recidiva e di sopravvivenza.
La media e follow-up mediano è stato 39,7 e 31,5 mesi, rispettivamente (range: 4-106 mesi). Tra i 240 pazienti, i dati di sopravvivenza erano disponibili per 232 pazienti. Otto pazienti sono stati persi al follow-up di valutazione, dando un tasso di follow-up di 96,7% (232/240) per la valutazione. Quaranta pazienti hanno sviluppato recidiva del tumore, 18 (45,0%) recidiva peritoneale, 11 (27,5%) recidiva a distanza o ematogena, 7 (17,5%) recidive linfatico e 4 (10,0%) recidive loco-regionale. Di questi pazienti, 33 sono morti di ricorrenza del cancro gastrico, e 7 pazienti sono ancora in vita con la malattia alla data di chiusura. altri quattro pazienti sono deceduti per cause diverse dal cancro gastrico.
La DFS a 5 anni e OS in tutta la coorte erano 72,3% e 75,9%, rispettivamente. Secondo stadio del tumore, a 5 anni DFS e OS erano 90,3% e il 93,1% in stadio I, 72,7% e 67,6% in stadio II, e il 34,8% e il 41,5% in stadio III, rispettivamente (Figura 1). Per quanto riguarda la profondità del tumore, 5 anni DFS era 90,6% in T1, 81,2% in T2, 67,6% in T3, e 33,9% in T4a e OS era 92,1%, 84,6%, 65,9% e 40,7%, rispettivamente (Figura 2). Figura 1 di Kaplan-Meier curve di sopravvivenza in base alle diverse fasi del tumore. (A) cumulativo DFS. (B) del sistema operativo cumulativo.
Figura 2 curve di sopravvivenza di Kaplan-Meier in base alla profondità di invasione (T). (A) cumulativo DFS. (B) del sistema operativo cumulativo
. Discussione
grazie ai vantaggi ovvi oltre gastrectomia tradizionale, il numero di pazienti sottoposti a LDG è in rapida crescita, soprattutto in Asia orientale, dove il cancro gastrico è una delle neoplasie più comuni. Lo scopo della LDG in pazienti affetti da cancro gastrico è quello di soddisfare le esigenze oncologiche e non influenzare la sopravvivenza, riducendo al minimo gli insulti operative.
Tuttavia, l'uso di LDG nel cancro gastrico non ha ancora incontrato con l'accettazione diffusa a causa della mancanza di dati che riguardano l'oncologico adeguatezza delle procedure laparoscopiche ed i risultati a lungo termine [18]. Le opinioni differiscono ancora sul fatto che si può ottenere lo stesso effetto in D chirurgia 2 linfoadenectomia più aperto e se la procedura è sicura. E 'ben noto che l'adeguatezza della resezione radicale deve essere valutato il grado di linfadenectomia effettuato nonché il numero di linfonodi recuperati (RLNs). Laparoscopica D 2 linfadenectomia è un'operazione complessa e richiede abbondante competenze tecniche dovuti ai vasi complicate, numerosi strati anatomici e complesso metastasi linfonodali percorso intorno allo stomaco. Pertanto, molti studiosi dubitano ancora LDG può ottenere lo stesso effetto radicale come chirurgia a cielo aperto. Tuttavia, alcune pubblicazioni hanno già descritto il numero di RLNs in LDG con D 2 dissezione come simile a quello in gastrectomia aperta [19, 20]. Inoltre, alcuni ricercatori hanno riportato non solo un numero simile di RLNs globali tra laparoscopia e laparotomia, ma anche un numero simile di specifici linfonodi, come il gruppo 7, 8a, 9, 11p, 12a e 14v, che sono state considerate difficile dissezione laparoscopica [21, 22]. Nel nostro studio, il numero medio di RLNs per paziente era 30.4 ± 8.6, che è stato sufficiente per curabilità e per determinare metastasi linfonodali. Park ed altri. [23] hanno valutato i risultati a lungo termine di 239 pazienti sottoposti a LDG per il trattamento del carcinoma gastrico avanzato (AGC). Essi hanno scoperto che la maggior recidiva era metastasi a distanza, mentre le recidive linfonodali sono stati più frequenti nel para-aortica o lontano metastasi linfonodali. Pertanto, essi ritengono che la dissezione dei linfonodi intorno allo stomaco può essere eseguita in modo efficiente LDG. Questi studi ed i nostri dati suggeriscono che oncologicamente appropriato D 2 linfoadenectomia può essere effettuata con la chirurgia laparoscopica.
Cancro recidiva e tasso di sopravvivenza a lungo termine sono due risultati critici per la valutazione degli interventi chirurgici nella terapia oncologica. In questo studio, il tasso di DFS a 5 anni e il tasso di OS dopo LDG erano 72,3% e 75,9%, rispettivamente, che era simile a quella in studi precedenti [24]. Inoltre, i risultati di sopravvivenza stratificati in base alla messa in scena in questo studio sono stati paragonabili ai dati storici [25]. Per quanto riguarda il criterio di ricorrenza, le recidive peritoneali erano più comuni nel nostro studio. Tuttavia, alcuni studi hanno dimostrato che il modello ematogena era più comune [26, 27]. Hao et al. [28] cellule tumorali rispetto seguente esfoliante lavaggio peritoneale tra laparoscopica e gastrectomia aperto per sierosa-invaso AGC. I tassi positivi di cellule tumorali erano liberi 39.68% e 44.26% nel gruppo laparoscopica e aperto, rispettivamente, che non era significativamente differente. Pertanto, riteniamo che la differenza di criterio di ricorrenza può a causa della elevata percentuale di tumori T4a nella nostra coorte. Port-site metastasi causata da pneumoperitoneo intraoperatoria è un'altra questione controversa. Shoup et al. [29] hanno riportato i risultati di sopravvivenza a lungo termine di 449 casi di cancro gastrico che hanno ricevuto laparoscopia diagnostica, e solo tre casi sviluppati porta-site metastasi. Essi hanno concluso che la porta-sito di impianto dopo laparoscopia era raro, e non era diverso dal sito di incisione aperta recidiva. Questo tipo di metastasi non è stato segnalato nel nostro studio, simile alla maggior parte degli altri studi, quindi riteniamo che pneumoperitoneo non contribuisce ad un più alto rischio di Port-site metastasi.
Diversi studi precedenti [11, 12, 30, 31] riportato alcuni vantaggi di TLDG oltre LADG, come la ridotta perdita di sangue e il recupero più veloce. Tuttavia, nel nostro studio, non abbiamo potuto confermare la superiorità del TLDG nel recupero post-operatorio. Poiché LADG viene eseguita utilizzando un minilaparotomica nella parte superiore, richiede un'incisione più lungo TLDG. Di conseguenza, alcuni ricercatori hanno sostenuto che LADG può essere associata ad un maggiore uso di analgesici e più dolore che TLDG. Tuttavia, Kim et al. [13] ei nostri dati hanno dimostrato che la piccola incisione utilizzato per LADG non sembra essere associato con più dolore, una maggiore risposta infiammatoria, o recupero ritardato. Inoltre, il margine prossimale LADG era inferiore al periodo nel TLDG nel nostro studio. Questi risultati possono essere correlati alla natura di LADG quanto è difficile tirare stomaco prossimale mediante un'incisione stretta, che può influenzare la distanza del margine prossimale. È interessante notare che i nostri dati non riflettono l'effetto di TLDG in pazienti con un alto indice di massa corporea. Alcuni ricercatori [32] hanno riferito che la frequenza di utilizzo antidolorifico era più alta nei pazienti obesi sottoposti a LADG. Ciò significa che TLDG può essere più favorevole di LADG nei pazienti obesi. Nella nostra pratica, tuttavia, abbiamo scoperto che TLDG ha alcuni vantaggi durante la manipolazione intraoperatoria. Innanzitutto, TLDG è in funzione situ che evita eccessivo tirando organi interni. Nell'effettuare LADG, il moncone gastrico deve essere tirato fuori dal corpo. Questo posti che tirano stress tremendo sul ceppo gastrica e può anche portare alla lacerazione della busta milza, provocando emorragie. Inoltre, i brevi vasi sanguigni gastrici devono essere suddivisi, in particolare in pazienti con tumori in una posizione elevata. Al contrario, anastomosi intracorporea potrebbe ridurre lo stress sul moncone gastrico e mantenere il suo apporto di sangue e la funzione. In secondo luogo, TLDG è più adatto per un'operazione "no touch tumore". Nell'effettuare LADG, l'operatore si limita a lavorare attraverso una piccola incisione, che porta alla inevitabile spremitura del tumore. Vi è una maggiore possibilità che il tumore entrerà in contatto diretto con l'incisione. Nell'effettuare TLDG, il chirurgo può ottenere un "estrusione zero". Infine, nei pazienti in sovrappeso, l'incisione ausiliare di LADG può avere bisogno di essere esteso a 8-10 cm. Tuttavia, nell'ambito TLDG, il chirurgo può semplicemente ampliare l'incisione del trocar 10 mm al di sotto dell'ombelico ad un semicerchio cm un'incisione 3-4 intorno l'ombelico per consentire al campione di essere rimosso come la parete dell'ipogastrio ha più duttilità.
Conclusioni
l'attuale studio ha dimostrato che LDG accompagnato da D 2 linfoadenectomia per il cancro gastrico ha fornito una prognosi accettabile e il numero di linfonodi recuperati sono stati considerati oncologicamente accettabile. Sia LADG e TLDG possono essere eseguite in modo sicuro ed i loro risultati chirurgici a breve termine sono stati simili. Tuttavia, i risultati di cui sopra richiedono la verifica da parte rigorosamente progettato, grande campione, multicentrico, studi prospettici randomizzati
Abbreviazioni
LDG:.
Laparoscopica gastrectomia distale
LADG:
Laparoscopia-assistita gastrectomia distale
TLDG:
Totally laparoscopica gastrectomia distale
TNM:
tumore-node-metastasi
SD:
deviazioni standard
DFS:
la sopravvivenza libera da malattia
OS:
sopravvivenza globale
BMI:
indice di massa corporea
RLNs:
linfonodi Estratto.
dichiarazioni
Ringraziamenti
Questo lavoro è stato supportato dal progetto di sovvenzione chiave dal Dipartimento di Scienze e tecnologie della provincia di Zhejiang, Cina (grant No. 2011C13036-2) e il Dipartimento della Salute della provincia di Zhejiang, Cina (concessione n 2012ZDA024).
autori fascicoli presentati originali per
di seguito sono riportati i link ai degli autori fascicoli presentati originali per immagini. 'file originale per la figura 1 12876_2013_1069_MOESM2_ESM.jpeg Autori 12876_2013_1069_MOESM1_ESM.tiff autori file originale per la figura 2 12876_2013_1069_MOESM3_ESM.jpeg Autori file originale per la figura 3 interessi in competizione
Gli autori dichiarano di non avere interessi in gioco.
Autori' contributi
CK e CJQ concepito e progettato lo studio; MYP, XXW e CK eseguite le operazioni; PY, WD e ZRC dati raccolti; CK ha scritto il manoscritto; e MYP rivisto il manoscritto. Tutti gli autori hanno letto e approvato il manoscritto finale.
 Infezione da Clostridioides difficile
Infezione da Clostridioides difficile
 Come mangiare fuori senza glutine e non avere mai più glutei
Come mangiare fuori senza glutine e non avere mai più glutei
 come fare il burro chiarificato – da a a ghee
come fare il burro chiarificato – da a a ghee
 Voglia di cibo SCD:sei pazzo o il tuo corpo sta cercando di dirti qualcosa?
Voglia di cibo SCD:sei pazzo o il tuo corpo sta cercando di dirti qualcosa?
 Perché Paleo FX ha riacceso il mio impegno per la salute
Perché Paleo FX ha riacceso il mio impegno per la salute
 Polvere di proteine a basso contenuto di FODMAP
Polvere di proteine a basso contenuto di FODMAP
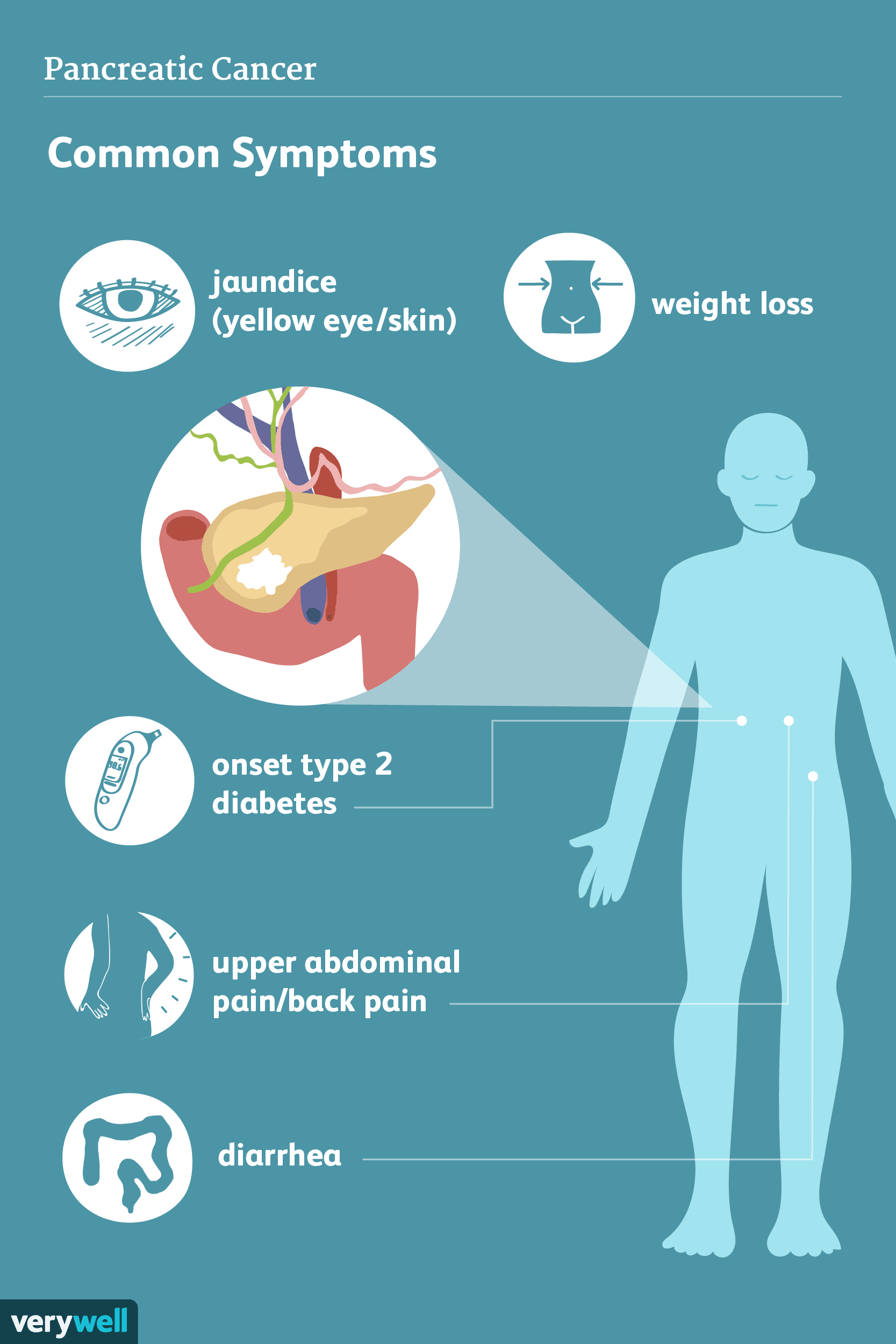 Sintomi del cancro al pancreas
I sintomi del cancro del pancreas possono includere ittero, dolore nella parte superiore delladdome che si irradia nella parte posteriore, linsorgere inaspettato del diabete, un nodulo duro nella part
Sintomi del cancro al pancreas
I sintomi del cancro del pancreas possono includere ittero, dolore nella parte superiore delladdome che si irradia nella parte posteriore, linsorgere inaspettato del diabete, un nodulo duro nella part
 Sei potente oltre ogni misura
“ La nostra paura più profonda non è quella di essere inadeguati. La nostra paura più profonda è che siamo potenti oltre misura”. ~Marianne Williamson Mi sono svegliato pensando a questa citazione og
Sei potente oltre ogni misura
“ La nostra paura più profonda non è quella di essere inadeguati. La nostra paura più profonda è che siamo potenti oltre misura”. ~Marianne Williamson Mi sono svegliato pensando a questa citazione og
 Chirurgia per la colite ulcerosa
Centro chirurgico per la colite ulcerosa Immagini di presentazione di colite ulcerosa Presentazione di malattie infiammatorie intestinali Rispondi al quiz sulla colite ulcerosa Trova un medico locale
Chirurgia per la colite ulcerosa
Centro chirurgico per la colite ulcerosa Immagini di presentazione di colite ulcerosa Presentazione di malattie infiammatorie intestinali Rispondi al quiz sulla colite ulcerosa Trova un medico locale