 10 % af patienterne med GERD udvikler Barretts esophagus, en risikofaktor for kræft i spiserøret.
10 % af patienterne med GERD udvikler Barretts esophagus, en risikofaktor for kræft i spiserøret.

Barretts spiserør har ingen unikke symptomer. Patienter med Barretts har symptomer på GERD eller sure opstød omfatter følgende:
Barretts esophagus er en komplikation af kronisk gastroøsofageal reflukssygdom (GERD), primært hos hvide mænd. GERD er en sygdom, hvor der er tilbagesvaling af sur væske fra maven til spiserøret (synkeslangen). GERD forårsager oftest halsbrand.
Der er to krav til diagnosticering af Barretts esophagus. Kravene nødvendiggør en endoskopi af spiserøret. Under endoskopi føres et langt fleksibelt rør med et lys og kamera i spidsen (et endoskop) gennem munden og ned i spiserøret for at se og biopsi (prøvevæv fra) slimhinden i spiserøret. De to krav er:
Barretts esophagus er officielt kodet af Library of Congress til elektroniske søgninger i litteraturen som Barrett esophagus, men Barretts esophagus (med apostrof "s") er det navn, der bruges universelt. Tilstanden er opkaldt efter en kirurg, Norman Barrett, som beskrev tilstanden. Det viser sig dog, at hans fortolkning af resultaterne ikke var korrekt. I 1953 beskrev Doctors' Allison og Johnstone faktisk denne tilstand, som vi nu forstår den, nemlig at metaplasi opstod. (Metaplasi, som diskuteres nedenfor, er det udtryk, der bruges, når et voksent væv erstatter et andet.) Ikke desto mindre er tilstanden blevet udødeliggjort med Barretts navn.
Til at begynde med troede man, at Barretts spiserør bestod af mavevæv (mavevæv), der erstattede det sædvanlige pladevæv, der beklædte spiserøret. Men i midten af 70'erne udgav Dr. Paull og hans kolleger et papir, hvori de beskrev slimhinden (den indre slimhinde) i Barretts spiserør mere detaljeret end tidligere. De påpegede, at Barretts spiserør bestod af en metaplasi, hvor de normale celler, der beklæder spiserøret, blev erstattet af en blanding af mave- og tarmslimhindeceller. Foringscellerne af tarmtypen kaldes også specialiserede søjleceller, som omfatter bægerceller. I en årrække troede nogle videnskabsmænd, at der var to typer af Barretts; den ene, hvor den normale slimhinde kun blev erstattet med celler af mave-typen, og den anden, hvor tarmceller var til stede. Den nuværende overbevisning er dog, at kun tilstedeværelsen af bægerceller af tarmtypen etablerer diagnosen Barretts esophagus, uanset hvilke andre celletyper der er til stede.
Årsagen til den store interesse for Barretts spiserør er, at det er forbundet med en øget risiko for kræft i spiserøret. Den type kræft, der opstår hos patienter med Barretts, er adenocarcinom, som opstår fra det metaplastiske tarmvæv. Den sædvanlige kræft i spiserøret, der ikke er forbundet med Barretts, er pladecellekræft, som opstår fra den pladecellecelleforing, der normalt er til stede i spiserøret. Forbindelsen mellem adenokarcinom i spiserøret og Barretts esophagus er nu klar, og adenokarcinom i spiserøret er stigende i hyppighed i de fleste lande på den vestlige halvkugle.
Den gode nyhed er dog, at kræften opstår hos relativt få patienter med Barretts spiserør. Alligevel er den største udfordring i denne tilstand at holde øje med tidlige advarselstegn på kræft ved at tage biopsier med jævne mellemrum under endoskopi. Denne praksis kaldes overvågning og svarer i princippet til overvågning hos kvinder for kræft i livmoderhalsen, hvor PAP-udstrygninger tages med jævne mellemrum.
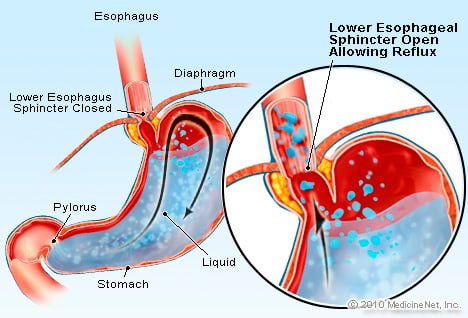
 GERD er en tilstand, hvor for store syreholdige væsketilbageløb (strømmer) tilbage i spiserøret, delvist pga. den nedre esophageal sphincter er svag.
GERD er en tilstand, hvor for store syreholdige væsketilbageløb (strømmer) tilbage i spiserøret, delvist pga. den nedre esophageal sphincter er svag. GERD forårsager Barretts spiserør. Spiserøret er et muskelrør, der er placeret i brystet og tjener til at overføre mad fra munden til maven. Den nedre esophageal sphincter (LES) er en ventil, der er placeret i forbindelsen mellem maven og spiserøret. Dens funktion er at forhindre syre og andet indhold i maven i at komme tilbage i spiserøret. GERD er en tilstand, hvor overdreven syreholdig væske tilbagesvaler (strømmer) tilbage i spiserøret, delvis fordi den nedre esophageal sphincter er svag. Svagheden ved LES kan til dels være relateret til det faktum, at stort set alle GERD-patienter har hiatal brok. Hos patienter med hiatal brok glider de øverste få centimeter af maven frem og tilbage mellem maven og brystet gennem mellemgulvet. Denne glidning kan forstyrre, hvordan lukkemusklen fungerer som en barriere mod refluks fra maven til spiserøret.
Tidligere blev udtrykket brok brugt i stedet for GERD til at forklare patienterne grundlaget for deres symptomer (normalt halsbrand), fordi stort set alle GERD-patienter har hiatal brok. GERD er dog det mere præcise udtryk. Mens hiatal brok er ekstremt almindelig i befolkningen, udvikler kun et lille antal mennesker med hiatal brok GERD. Med andre ord betyder tilstedeværelsen af et hiatal brok ikke, at personen vil udvikle GERD. På den anden side, hvis en person har GERD, er hiatal brok næsten altid til stede.
Barretts spiserør er således forårsaget af kronisk (af mange års varighed) og sædvanligvis svær sure opstød. Hos nogle patienter med GERD reagerer spiserøret på den gentagne skade fra den sure væske ved at ændre den type celler, der beklæder den fra pladecelle (normale celler) til søjleformede (tarm-type celler). Denne transformation, kaldet metaplasi, menes at være en beskyttende reaktion, fordi det specialiserede søjleepitel (epithel betyder foring) i Barretts spiserør er mere modstandsdygtig over for skader fra syre end pladeepitel.
Væsken i maven indeholder syre, der produceres af maven. Derudover kan væsken dog indeholde galdesyrer (fra galde produceret af leveren) og enzymer (fremstillet af bugspytkirtlen), der er tilbagesvalet fra tolvfingertarmen og ind i maven. (Tolvfingertarmen er den første del af tyndtarmen lige ud over maven.) Syren, der tilbagesvaler fra maven til spiserøret, er skadelig for spiserøret. Der er dog nogle beviser for, at galde- og bugspytkirtelenzymer kombineret med syren kan være mere skadelige end syre alene.
En betydelig procentdel af personer med kroniske symptomer på GERD udvikler Barretts esophagus, og det er mest almindeligt i kaukasiske mandlige populationer. Ikke alle med GERD har dog symptomer på GERD. Derfor er nogle mennesker med Barrett ikke klar over, at de har Barretts, fordi de har GERD uden nogen symptomer overhovedet eller har meget milde og sjældne symptomer.
Det er uklart, hvorfor Barretts spiserør er så overvældende mere almindelig hos hvide mænd end i nogen anden gruppe. For eksempel, selvom kvinder og afroamerikanere ikke ser ud til at være beskyttet mod at udvikle GERD, er de stort set beskyttet (især afroamerikanere) mod at udvikle Barretts spiserør og Barretts cancer (adenocarcinom). Der er tegn på, at på den vestlige halvkugle er kræft i spiserøret og kræft i det gastroøsofageale kryds (kaldet hjertekræft) stigende i hyppighed, måske mere end nogen anden kræft i mave-tarmkanalen. (Men tyktarmskræft er stadig meget mere almindelig end kræft i spiserøret.)
Barretts spiserør kan forekomme i nogle familier og være genetisk bestemt. Undersøgelser er i gang for at afgøre, om der kan findes gener eller markører i disse familier, som ville forudsige udviklingen af Barretts spiserør i den generelle befolkning. I disse familier med Barretts såvel som med Barretts i den almindelige befolkning er GERD fællesnævneren. Spørgsmålet er imidlertid, hvorfor Barrett's forekommer mere almindeligt i disse familier end i andre med sammenlignelig svær GERD, men uden familiesammenhæng.
For at gentage, det første kriterium for diagnosen af Barretts spiserør er fundet ved endoskopi af en lyserød slimhinde i spiserøret, hvor den normalt ikke ses. Denne unormale foring kan se ud i omkredsen som et bånd, tungelignende eller som øer. Det andet kriterium er, at biopsier fra den lyserøde slimhinde afslører den karakteristiske intestinaliserede slimhinde (den slimhinde, der normalt ses i tarmene) med de typiske bægerceller. De esophageal biopsier er opnået under en endoskopi. En øvre gastrointestinal endoskopi er en procedure, hvor lægen indsætter et langt fleksibelt rør (endoskop) gennem munden og ned i spiserøret for direkte at visualisere slimhinden i spiserøret. Under den samme endoskopiske undersøgelse kan maven og tolvfingertarmen også visualiseres. Flere små prøver (biopsier) af foringsepitelvævet kan opnås gennem endoskopet.
Som tidligere nævnt kaldes processen med udskiftning af en type vævsforing med en anden metaplasi. I maven og tarmene er metaplasi en almindelig reaktion på visse typer skader. Som Henry Appelman, en patolog, udtalte:"Når tarmen er under stress, vil den gerne være noget andet." Andre eksempler på metaplasi, hvor en slimhinde erstatter en anden, er:(1) i maven, hvor kronisk betændelse (gastritis) kan resultere i, at en slimhinde af tarmtypen erstatter dele af den normale maveslimhinde; og (2) i tolvfingertarmen (lige ud over maven i tarmen), hvor mavesår opstår, og tarmslimhinden, der omgiver såret, omdannes til mavesækken.
Vi mener, at processen med metaplasi er en beskyttende eller adaptiv reaktion på skader i slimhinden. Ulempen ved metaplasi er dog, at den i Barretts spiserør medfører en lille, men klar stigning i risikoen for at blive kræft. Ikke alle metaplasier har en øget risiko for kræft. For eksempel, af de to metaplasier, der er nævnt i det foregående afsnit, kan tarmmetaplasi i maven føre til kræft, men intestinal metaplasi i tolvfingertarmen gør det ikke.
Processen med at udvikle Barrett's begynder ved krydset mellem maven og spiserøret. Spiserøret er normalt foret med et pladeepitel eller foringslag. Dette pladeepitel har et perlehvidt udseende, hvorimod slimhinden i maven og tarmene har en mere lakselyserød farve, fordi det er et søjleepitel i stedet for et pladeepitel. Pladeepitel er opbygget af flade pladeceller, som ligner hudceller. Mavesækken eller maveslimhinden består af højere søjleformede celler set under mikroskopet. Sammenføjningen mellem spiserørets pladeepitel og mavesøjleepitelet opstår i krydset mellem spiserøret og maven, hvor, som du husker, den nedre esophageal sphincter er placeret. Den fælles grænse (grænseflade) af disse to foringer omtales ofte som Z-linjen, fordi den, når den undersøges under en endoskopi, har et zig-zag-udseende.
Med progressiv skade på spiserøret opstår metaplasi, og det metaplastiske væv bevæger sig op i spiserøret i en afstand, som varierer fra person til person, normalt fra omkring 0,5 til 2,5 tommer (ca. 1 til 6 centimeter). Den type celle, der giver anledning til det metaplastiske væv, kendes ikke.
Barretts spiserør er ofte kategoriseret i kort- eller langsegment Barretts, baseret på længden af spiserøret, der er påvirket. Kort segment Barretts refererer generelt til involvering af 3 centimeter eller mindre, mens langt segment betyder involvering af mere end 3 centimeter af spiserøret. Interessant nok, når først Barretts spiserør er diagnosticeret hos en patient, ser den metaplastiske foring ikke ud til at udvikle sig længere op i spiserøret, hvis patienten behandles for GERD. Over tid forbliver varigheden af involvering med Barrett's generelt den samme.
Hvis der tages biopsier fra patienter med GERD, som har en normal Z-linje (ingen synlige tegn på Barretts esophagus), vil op til 30 % vise den samme tarmtypemetaplasi med bægerceller som dem, der ses i Barretts esophagus. Vi biopsier dog ikke rutinemæssigt normale Z-linjer for at se efter denne ændring, og vi foretager heller ikke overvågning, når vi finder den der. Årsagen er, at begrænset intestinal metaplasi af den gastroøsofageale forbindelsesregion i GERD synes at forekomme med samme hyppighed hos kvinder og afroamerikanere som hos hvide mænd, men risikoen for åbenlys Barretts spiserør er meget mindre end hos hvide mænd.
Derfor bør tilstedeværelsen af metaplasi på en rutinebiopsi af en normal forekommende Z-linje i GERD ikke føre til nogen ændring i behandlingen. Hvad mere er, bør fundet af bægerceller i denne sammenhæng ikke mærkes, som nogle har foreslået, som ultrakort segment Barretts. Hovedårsagen til ikke at betegne det som Barretts er, at udtrykket Barretts indebærer en øget risiko for kræft, og der er ingen beviser for, at dette fund er forbundet med en øget kræftrisiko.
Den type kræft, der opstår med Barretts esophagus, er adenocarcinom. Kræft, der opstår fra pladebeholderen i spiserøret, kaldes pladecellekræft eller karcinom. Blandt kaukasiere er frekvensen (hyppigheden over tid) af pladecellekræft faldende i forhold til Barretts-associeret adenocarcinom. Andre racegrupper (f.eks. afroamerikanere) har dog ikke oplevet den samme nedgang i pladecellekræft i forhold til adenocarcinom.
Rygning og overdreven alkoholindtagelse er klare risikofaktorer for pladecellekræft. De er også risikofaktorer for adenocarcinom set i Barretts spiserør. I denne situation er det dog ikke klart, om rygning og alkohol øger risikoen for adenocarcinom ved at gøre GERD mere alvorlig, eller om rygning og alkohol har en mere direkte kræftfremkaldende effekt, som det sker ved pladecellekræft. Planocellulær kræft er blevet stadig mindre almindelige, mens adenokarcinomdiagnoser er steget. Adenocarcinomforekomsten hos hvide mænd er steget mere stejlt end hos andre etniske grupper.
I resten af dette afsnit vil udtrykket esophageal cancer referere til adenocarcinom, der opstår fra Barretts esophagus.
Kræft i det gastroøsofageale kryds kaldes også hjertekræft, fordi området, hvor spiserøret møder mavesækken, kaldes cardia. Denne cancer, ligesom Barretts-associerede adenocarcinom, findes overvejende hos hvide mænd, er tilsyneladende stigende i hyppighed i samme hastighed som kræft i spiserøret og er forbundet med kronisk GERD. Derfor er det blevet spekuleret i, at hjertekræft starter fra korte segmenter (f.eks. 1-2 cm) af Barretts. På det tidspunkt, hvor diagnosen kræft stilles, kan tumoren dog have spredt sig ud over det korte segment af Barretts og kan se ud til at være i cardia. Denne spekulation om oprindelsen af kræft i cardia mangler dog at blive bevist.
En stigning i hyppigheden af esophageal adenocarcinom er blevet observeret i mindst 20 år, primært hos hvide mænd. Et fingerpeg om årsagen til denne tendens kan være relateret til et fald i frekvensen af H. pylori infektion i maven. Med andre ord synes personer med Barretts kræft, herunder hjertekræft, at have lavere H. pylori infektion end andre af samme alder og køn i samme befolkning.
H. pylori er en type bakterier, der er en væsentlig årsag til sår. Det er en meget almindelig infektion på verdensplan og forårsager ingen symptomer hos langt de fleste berørte mennesker. Nogle mennesker med H. pylori udvikle mavesår i maven og tolvfingertarmen. Disse sår behandles ved at fjerne bakterierne, som igen forhindrer tilbagefald af sårene.
Hvis H. pylori går ubehandlet, forårsager det fremadskridende betændelse i maven (gastritis), som er forbundet med reduktion i syresekretion og muligvis mindre refluks af syre i spiserøret. I mange områder af verden er denne infektion faldende i hyppighed, formentlig på grund af bedre folkesundhedsforanstaltninger. Derfor er det muligt, at den beskyttende virkning (såsom nedsat syreproduktion) af kronisk H. pylori infektionen er faldet. Med andre ord, med mindre H. pylori gastritis, producerer maven mere syre, og der er mere syre til at tilbagesvale i spiserøret. Samtidig er vi mere disponerede for refluks i vores seniorår. Selvom dette ikke er et afgjort problem, er den faldende frekvens af H. pylori infektion kan være en årsag til den stigende hyppighed af Barretts-associeret adenocarcinom.
Dysplasi er en ændring i cellerne i spiserøret, hvor cellerne faktisk viser unormale ændringer i deres struktur og udseende. Når disse ændringer bliver alvorlige nok (går fra lavgradig til højgradig dysplasi) begynder cellerne at fremstå ondartede (ligesom kræftceller). Men i modsætning til kræft forbliver disse celler på plads og invaderer ikke væv uden for slimhinden. Dysplasi opstår som en række celleforandringer, efterhånden som Barretts spiserør udvikler sig til Barretts-associeret cancer. Patienter med Barretts overvåges med endoskopi og biopsier (overvågning) for at opdage disse celleforandringer (dysplasien) eller i værste fald tidlig cancer, så de kan behandles. I øjeblikket er der ingen måde at forudsige, hvilke patienter med Barretts esophagus der vil udvikle dysplasi.
Dysplasi er også blevet identificeret ved siden af andre tumorer i mave-tarmkanalen end esophageal adenocarcinom. For eksempel findes dysplasi i halvdelen af tilfældene af mavekræft og ved tyktarmskræft, hvor dysplasien er synlig som såkaldte adenomatøse polypper. Derudover er dysplasi den samme tidlige advarselscelleændring, som patologer leder efter i PAP-udstrygninger af livmoderhalsen, der forudsiger livmoderhalskræft.
Dysplasi betragtes som præmalign. Det betyder, at hvis dysplasi er påvist ved flere lejligheder, mener man, at patienten vil udvikle kræft, hvis han eller hun lever længe nok. Dysplasi er kategoriseret som værende høj grad eller lav grad. Når højgradig dysplasi er diagnosticeret, kan kræft allerede være til stede, og hvis ikke, er risikoen for at udvikle kræft hurtigere større end med de lavere grader af dysplasi.
I opfølgningsbiopsier af patienter med dysplasi kan tilstanden muligvis ikke opdages igen hos nogle patienter, hvorimod der hos andre findes lave grader af dysplasi. Dette fravær eller fald i dysplasi kan skyldes faktorer såsom prøveudtagningsvariationer, fjernelse af bittesmå foci (cellegrupper) af dysplasi med den indledende biopsi eller faktisk biologisk reversering. Den/de nøjagtige årsag(er) er ukendte.
Ved hjælp af molekylære teknikker kan nogle ændringer, kaldet biomarkører, påvises i biopsiprøver, før dysplasi udvikler sig. Disse ændringer ligner dem, der observeres i andre kræftformer. Biomarkører omfatter ændringer i DNA-indholdet i celler, i gener og kromosomer og i vækstfaktorer. En række af disse biomarkører kan påvises at dukke op før og under forekomsten af dysplasi. Det ultimative mål er at finde en magisk markør, der kan fortælle os, hvilke patienter blandt dem uden dysplasi eller lavgradig dysplasi, der er mere tilbøjelige til at udvikle højgradig dysplasi eller cancer. Sådanne patienter kan derefter følges af overvågning tættere end andre.
På nuværende tidspunkt behandles alle patienter med Barretts øsofagus, set fra overvågningssynspunktet, på samme måde. Tilgængeligheden af biomarkører vil adskille (stratificere) Barretts patienter baseret på deres risiko for kræft. En sådan stratificering ville gøre det muligt for læger at udføre overvågningsendoskopi og biopsier hyppigere hos mindretallet af patienter, der har større risiko for kræft, og sjældnere hos dem, der forventes at have en lavere risiko for kræft.
En anden anvendelse af dokumenterede biomarkører ville være at hjælpe med at bekræfte patologens fortolkning af dysplasi på biopsier.
Når patienter med Barretts spiserør vurderes som en gruppe, er risikoen for kræft blevet fundet at være så lav som én ud af 300 patienter årligt. Det betyder, at hvis vi undersøgte 300 patienter årligt, ville en patient vise sig at have kræft hvert år. Det, vi virkelig har brug for at vide, er risikoen for kræft, hvis der ikke findes dysplasi efter et eller to års overvågning. Vores overbevisning er, at denne risiko ville være meget mindre end de tidligere citerede tal på én ud af 300 patienter årligt.
Patienter med høj grad af dysplasi kan ofte vise sig at have kræft. Derfor er den første behandlingsorden, når der konstateres dysplasi af høj grad, at udelukke tilstedeværelsen af et adenocarcinom.
Lav grad dysplasi er meget mindre truende end høj grad dysplasi, men vi ved ikke lige hvor meget mindre. Faktisk har vi ikke præcise data til at indikere, hvad kræftrisikoen er hos patienter med Barretts og lavgradig dysplasi.
Diagnosen dysplasi bør være så præcis som muligt, fordi denne diagnose kan medføre en ændring i behandlingen eller intensiteten af opfølgningen af patienter med Barretts spiserør. Det kræver stor erfaring at kunne stille en præcis diagnose af tilstedeværelse og grad af dysplasi. Derfor er det en almindelig og nyttig praksis at bede en anden patolog (eller endda en tredje, hvis det er nødvendigt) om at gennemgå biopsierne. Tanken er at se, om der er enighed mellem patologerne og/eller at få en mere erfaren mening om tilstedeværelsen og graden af dysplasi.
Hvis en person har længere segment Barretts, ville man gætte på, at kræftrisikoen er større end ved kortere segment Barretts. Dataene er dog kontroversielle i denne henseende. Af den grund er den nuværende praksis at udføre endoskopisk biopsiovervågning med lignende hyppighed hos patienter med kort og langt segment af Barretts øsofagus.
Barretts spiserør har ingen unikke symptomer. Patienter med Barretts har symptomer på GERD (for eksempel halsbrand, opstød, kvalme osv.). Den generelle tendens er, at Barretts patienter har mere alvorlig GERD. Imidlertid har ikke alle Barrett's markante symptomer på GERD, og nogle patienter opdages ved et uheld med minimale eller ingen symptomer på GERD.
Halsbrand er en brændende fornemmelse bag brystbenet, normalt i den nederste halvdel, men kan strække sig helt op til halsen. Nogle gange er det ledsaget af svie eller smerter i mavehulen lige under, hvor brystbenet slutter. Det næstmest almindelige symptom er regurgitation (backup) af bittert smagende væske. GERD-symptomer er ofte værre efter måltider og når de ligger fladt.
Den tilbagesvalede, regurgiterede væske kan lejlighedsvis trænge ind i lungerne eller stemmeboksen (strubehovedet), hvilket resulterer i, hvad der kaldes ekstraøsofageale (uden for spiserøret) symptomer (manifestationer) af GERD. Disse symptomer omfatter:
Af årsager, der ikke er fuldt ud forstået, har nogle GERD-patienter minimal halsbrand, men oplever andre GERD-symptomer, for eksempel ekstraøsofageale symptomer.
GERD kan resultere i forsnævringer og sårdannelse i spiserøret. En forsnævring eller forsnævring skyldes ardannelse (fibrose) i spiserøret, der kan forårsage synkebesvær (dysfagi). Dysfagien fornemmes som en fastklæbning (stop) af fast føde i brystet (i spiserøret) og væsker, når forsnævringen er alvorlig. Forsnævringer kan behandles ved at strække dem med dilatatorer under endoskopi. Ubehandlet kan strikturer fremme mere spild af mad og/eller mavevæsker i lungerne. Ikke almindeligt kan der forekomme massiv gastrointestinal (GI) blødning forårsaget af betændelse i spiserøret. Sådan blødning resulterer i opkastning af blod eller passage af sort eller rødbrun afføring. Mere almindeligt er det dog, at en betændt spiserør kan forårsage langsom blødning, der opdages, når der konstateres anæmi (et lavt antal røde blodlegemer) og/eller afføring testes for blod.
De medicinske behandlinger for symptomerne på Barretts esophagus er de samme som dem for GERD.
Undertrykkelsen af syre er rygraden i behandlingen af GERD. Til milde reflukssymptomer er håndkøbsmedicin almindeligvis brugt, lige fra antacida til lave doser af lægemidler kaldet H-2-receptorantagonister eller H2-blokkere. Eksempler på håndkøbs H2-blokkere er cimetidin (Tagamet) og famotidin (Pepcid, Zantac 360). For mere vedvarende symptomer kan højere (receptpligtige) doser af H-2-receptorantagonistlægemidler anvendes, for eksempel:
Til vedvarende symptomer, der kræver vedligeholdelsesbehandling (igangværende) eller til kompliceret GERD med forsnævringer eller blødning, anvendes protonpumpehæmmere (PPI'er). Eksempler på PPI'er er:
Nogle patienter behøver kun at tage én pille dagligt, mens andre har brug for to piller (en dobbelt dosis) for at kontrollere symptomerne. Den dobbelte dosis kan tages som én pille to gange dagligt eller 2 piller én gang dagligt.
PPI'er er potente hæmmere af syresekretion fra maven. De er effektive til at lindre halsbrand og helbrede esophageal betændelse (esophagitis) og esophageal ulcera, der er induceret af sur refluks. PPI'erne tolereres godt med få bivirkninger. Efter at have stoppet disse medikamenter kommer symptomer på sure opstød normalt igen, nogle gange med øget intensitet. Denne stigning i symptomer opstår til dels på grund af en rebound-sekretion af syre (syrehypersekretion), som er en reaktion foranlediget af genopretning fra inhiberingen af sekretion af syre af PPI.
PPI'ernes langsigtede sikkerhed er en vigtig overvejelse. Selvom visse mavetumorer (carcinoider) blev rapporteret i forsøg med ældre hunrotter, er lignende tumorer ikke blevet observeret hos mennesker efter mere end 15 års PPI-brug. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Disse omfatter:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Hvad forårsager dine mavesmerter?
Hvad er mavesmerter? Maven er et anatomisk område, der er afgrænset af den nedre kant af ribbenene og mellemgulvet over, bækkenbenet (skambensramus) forneden og flankerne på hver side. Selvom mavesm
Hvad forårsager dine mavesmerter?
Hvad er mavesmerter? Maven er et anatomisk område, der er afgrænset af den nedre kant af ribbenene og mellemgulvet over, bækkenbenet (skambensramus) forneden og flankerne på hver side. Selvom mavesm
 Sådan behandler og forebygger man naturligt opblussen af colitis ulcerosa
Forbindelsen mellem vores fysiske og mentale tilstand er stærk - så stærk, at eksperter faktisk klassificerede Colitis Ulcerosa som en psykosomatisk sygdom i 1930erne. Det er grunden til, at dem med
Sådan behandler og forebygger man naturligt opblussen af colitis ulcerosa
Forbindelsen mellem vores fysiske og mentale tilstand er stærk - så stærk, at eksperter faktisk klassificerede Colitis Ulcerosa som en psykosomatisk sygdom i 1930erne. Det er grunden til, at dem med
 Hvad er esophageal pH-overvågning?
Esophageal pH-overvågning bruges til at måle refluks (regurgitation eller tilbageskylning) af syre fra maven til spiserøret og at diagnosticere gastroøsofageal reflukssygdom (GERD). Bivirkninger af pr
Hvad er esophageal pH-overvågning?
Esophageal pH-overvågning bruges til at måle refluks (regurgitation eller tilbageskylning) af syre fra maven til spiserøret og at diagnosticere gastroøsofageal reflukssygdom (GERD). Bivirkninger af pr