 У 10% пациентов с ГЭРБ развивается пищевод Барретта, фактор риска рака пищевода.
У 10% пациентов с ГЭРБ развивается пищевод Барретта, фактор риска рака пищевода.

Пищевод Барретта не имеет уникальных симптомов. Пациенты с болезнью Барретта имеют следующие симптомы ГЭРБ или кислотного рефлюкса:
Пищевод Барретта является осложнением хронической гастроэзофагеальной рефлюксной болезни (ГЭРБ), преимущественно у белых мужчин. ГЭРБ — это заболевание, при котором происходит рефлюкс кислой жидкости из желудка в пищевод (глотательную трубку). ГЭРБ чаще всего вызывает изжогу.
Есть два требования для диагностики пищевода Барретта. Требования требуют эндоскопии пищевода. Во время эндоскопии длинная гибкая трубка со светом и камерой на конце (эндоскоп) вводится через рот и вниз в пищевод для осмотра и биопсии (взятия образца ткани) слизистой оболочки пищевода. Два требования:
Пищевод Барретта официально кодируется Библиотекой Конгресса для электронного поиска литературы как пищевод Барретта, но название пищевода Барретта (с апострофом «s») используется повсеместно. Заболевание названо в честь хирурга Нормана Барретта, описавшего это состояние. Однако оказывается, что его интерпретация результатов неверна. В 1953 году доктора Эллисон и Джонстон фактически описали это состояние, как мы его понимаем сейчас, а именно, что имела место метаплазия. (Метаплазия, которая обсуждается ниже, — это термин, используемый, когда одна взрослая ткань заменяет другую.) Тем не менее, это состояние было увековечено именем Барретта.
Первоначально считалось, что пищевод Барретта состоит из ткани желудка (желудочной), заменяющей обычную плоскоклеточную ткань, выстилающую пищевод. Однако в середине 70-х д-р Полл и его коллеги опубликовали статью, в которой описали слизистую оболочку (внутреннюю оболочку) пищевода Барретта более подробно, чем это было сделано ранее. Они указали, что пищевод Барретта состоит из метаплазии, при которой нормальные клетки, выстилающие пищевод, были заменены смесью клеток выстилки желудка и кишечника. Клетки выстилки кишечного типа также называются специализированными столбчатыми клетками, которые включают бокаловидные клетки. В течение ряда лет некоторые ученые считали, что существует два типа болезни Барретта; один, в котором нормальная выстилка была заменена только клетками желудочного (желудочного) типа, и второй, в котором присутствовали кишечные клетки. Однако в настоящее время считается, что только наличие бокаловидных клеток кишечного типа позволяет установить диагноз пищевода Барретта, независимо от того, какие другие типы клеток присутствуют.
Причина большого интереса к пищеводу Барретта заключается в том, что он связан с повышенным риском развития рака пищевода. Тип рака, который возникает у пациентов с болезнью Барретта, представляет собой аденокарциному, которая возникает из метапластической ткани кишечника. Обычный рак пищевода, не связанный с болезнью Барретта, представляет собой плоскоклеточный рак, который возникает из плоскоклеточной выстилки, обычно присутствующей в пищеводе. Связь между аденокарциномой пищевода и пищеводом Барретта в настоящее время ясна, и частота аденокарциномы пищевода увеличивается в большинстве стран Западного полушария.
Хорошая новость, однако, заключается в том, что рак встречается у относительно небольшого числа пациентов с пищеводом Барретта. Тем не менее, основная проблема в этом состоянии состоит в том, чтобы следить за ранними предупреждающими признаками рака, проводя биопсию через регулярные промежутки времени во время эндоскопии. Эта практика называется наблюдением и в принципе аналогична наблюдению за раком шейки матки у женщин, при котором мазки Папаниколау берутся через равные промежутки времени.
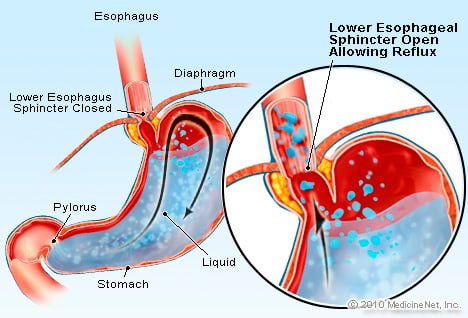
 ГЭРБ — это состояние, при котором избыток кислотосодержащей жидкости забрасывается (затекает) обратно в пищевод, отчасти из-за нижний пищеводный сфинктер ослаблен.
ГЭРБ — это состояние, при котором избыток кислотосодержащей жидкости забрасывается (затекает) обратно в пищевод, отчасти из-за нижний пищеводный сфинктер ослаблен. ГЭРБ вызывает пищевод Барретта. Пищевод представляет собой мышечную трубку, расположенную в грудной клетке и служащую для перемещения пищи изо рта в желудок. Нижний пищеводный сфинктер (НПС) представляет собой клапан, расположенный в месте соединения желудка с пищеводом. Его функция заключается в предотвращении попадания кислоты и другого содержимого желудка обратно в пищевод. ГЭРБ — это состояние, при котором избыток кислотосодержащей жидкости рефлюксирует (затекает) обратно в пищевод, отчасти из-за слабости нижнего пищеводного сфинктера. Слабость НПС может быть отчасти связана с тем фактом, что практически у всех пациентов с ГЭРБ имеется грыжа пищеводного отверстия диафрагмы. У пациентов с грыжей пищеводного отверстия несколько верхних сантиметров желудка скользят вперед и назад между брюшной полостью и грудной клеткой через диафрагму. Это скольжение может мешать работе сфинктера в качестве барьера для рефлюкса из желудка в пищевод.
Ранее термин «грыжа» использовался вместо ГЭРБ при объяснении пациентам основы их симптомов (обычно изжоги), поскольку практически у всех пациентов с ГЭРБ имеются грыжи пищеводного отверстия диафрагмы. ГЭРБ, однако, является более точным термином. Хотя грыжи пищеводного отверстия диафрагмы чрезвычайно распространены среди населения, лишь у небольшого числа людей с грыжей пищеводного отверстия диафрагмы развивается ГЭРБ. Другими словами, наличие грыжи пищеводного отверстия диафрагмы не означает, что у человека разовьется ГЭРБ. С другой стороны, если у человека ГЭРБ, почти всегда присутствует грыжа пищеводного отверстия диафрагмы.
Таким образом, причиной пищевода Барретта является хронический (многолетний) и обычно тяжелый кислотный рефлюкс. У некоторых пациентов с ГЭРБ пищевод реагирует на повторное повреждение кислой жидкостью изменением типа выстилающих его клеток с плоскоклеточных (нормальные клетки) на столбчатые (клетки кишечного типа). Эта трансформация, называемая метаплазией, считается защитной реакцией, поскольку специализированный столбчатый эпителий (эпителий означает выстилку) в пищеводе Барретта более устойчив к кислотному повреждению, чем плоский эпителий.
Жидкость в желудке содержит кислоту, вырабатываемую желудком. Кроме того, жидкость может содержать желчные кислоты (из желчи, вырабатываемой печенью) и ферменты (вырабатываемые поджелудочной железой), которые рефлюксировали из двенадцатиперстной кишки в желудок. (Дуоденум — это первая часть тонкой кишки сразу за желудком.) Кислота, рефлюксирующая из желудка в пищевод, вредна для пищевода. Однако есть некоторые свидетельства того, что желчные и панкреатические ферменты в сочетании с кислотой могут быть более вредными, чем одна кислота.
У значительного процента людей с хроническими симптомами ГЭРБ развивается пищевод Барретта, и это наиболее распространено среди мужчин европеоидной расы. Однако не у всех с ГЭРБ есть симптомы ГЭРБ. Таким образом, некоторые люди с болезнью Барретта не подозревают, что у них болезнь Барретта, потому что у них ГЭРБ вообще без каких-либо симптомов или симптомы проявляются очень слабо и нечасто.
Непонятно, почему пищевод Барретта в подавляющем большинстве случаев встречается у белых мужчин чаще, чем в любой другой группе. Например, хотя женщины и афроамериканцы, кажется, не защищены от развития ГЭРБ, они в значительной степени защищены (особенно афроамериканцы) от развития пищевода Барретта и рака Барретта (аденокарциномы). Имеются данные о том, что в западном полушарии частота рака пищевода и рака желудочно-пищеводного перехода (называемого раком кардии) возрастает, возможно, больше, чем любой другой рак желудочно-кишечного тракта. (Однако рак толстой кишки по-прежнему встречается гораздо чаще, чем рак пищевода.)
Пищевод Барретта может встречаться в некоторых семьях и быть генетически обусловленным. В настоящее время проводятся исследования, чтобы определить, можно ли найти в этих семьях какие-либо гены или маркеры, которые могли бы предсказать развитие пищевода Барретта в общей популяции. В этих семьях с болезнью Барретта, а также с болезнью Барретта в общей популяции ГЭРБ является общим знаменателем. Однако возникает вопрос, почему синдром Барретта чаще встречается в этих семьях, чем в других семьях со сравнительно тяжелой ГЭРБ, но без семейной ассоциации.
Повторим еще раз:первым критерием диагностики пищевода Барретта является обнаружение при эндоскопии розовой слизистой оболочки пищевода там, где ее обычно не видно. Эта аномальная выстилка может выглядеть по окружности в виде полосы, языка или островков. Второй критерий заключается в том, что при биопсии розовой слизистой оболочки обнаруживается характерная интестинальная слизистая оболочка (слизистая оболочка, обычно видимая в кишечнике) с типичными бокаловидными клетками. Биоптаты пищевода получают во время эндоскопии. Эндоскопия верхних отделов желудочно-кишечного тракта — это процедура, при которой врач вводит длинную гибкую трубку (эндоскоп) через рот и вниз в пищевод, чтобы непосредственно визуализировать слизистую оболочку пищевода. Во время того же эндоскопического исследования также можно визуализировать желудок и двенадцатиперстную кишку. Множественные небольшие образцы (биопсии) эпителиальной ткани выстилки могут быть получены через эндоскоп.
Как упоминалось ранее, процесс замены одного типа ткани на другой называется метаплазией. В желудке и кишечнике метаплазия является обычной реакцией на определенные виды повреждений. Как сказал патологоанатом Генри Аппельман:«Когда кишечник находится в состоянии стресса, он хочет быть чем-то другим». Другими примерами метаплазии, при которой одна слизистая оболочка заменяет другую, являются:(1) в желудке, где хроническое воспаление (гастрит) может привести к тому, что слизистая оболочка кишечного типа заменяет части нормальной слизистой оболочки желудка; и (2) в двенадцатиперстной кишке (сразу за желудком в кишечнике), где возникают пептические язвы, а слизистая оболочка кишечника, окружающая язву, превращается в слизистую оболочку желудка.
Мы полагаем, что процесс метаплазии представляет собой защитную или приспособительную реакцию на повреждение слизистой оболочки. Однако недостатком метаплазии является то, что при пищеводе Барретта она несет небольшое, но определенное увеличение риска развития рака. Не все метаплазии имеют повышенный риск развития рака. Например, из двух метаплазий, упомянутых в предыдущем абзаце, кишечная метаплазия в желудке может привести к раку, а кишечная метаплазия в двенадцатиперстной кишке — нет.
Процесс развития болезни Барретта начинается в месте соединения слизистой оболочки желудка и пищевода. Пищевод в норме выстлан плоским эпителием или выстилающим слоем. Этот плоский эпителий имеет жемчужно-белый вид, в то время как слизистая оболочка желудка и кишечника имеет более лососево-розовый цвет, потому что это столбчатый эпителий, а не плоский эпителий. Плоский эпителий состоит из плоских клеток плоского эпителия, похожих на клетки кожи. Желудок или слизистая оболочка желудка состоят из более высоких столбчатых клеток, как видно под микроскопом. Соединение плоского эпителия пищевода и цилиндрического эпителия желудка происходит в месте перехода пищевода в желудок, где, как вы помните, находится нижний пищеводный сфинктер. Общую границу (интерфейс) этих двух прокладок часто называют линией Z, поскольку при осмотре во время эндоскопии она имеет зигзагообразный вид.
При прогрессирующем повреждении пищевода возникает метаплазия, и метаплазированная ткань перемещается вверх по пищеводу на расстояние, которое варьируется от человека к человеку, обычно от 0,5 до 2,5 дюймов (от 1 до 6 сантиметров). Тип клеток, дающих начало метапластической ткани, неизвестен.
Пищевод Барретта часто подразделяют на короткий или длинный сегмент Барретта в зависимости от длины пораженного пищевода. Короткий сегмент Барретта обычно относится к поражению 3 сантиметров или менее, в то время как длинный сегмент означает поражение более 3 сантиметров пищевода. Интересно, что после того, как у пациента диагностирован пищевод Барретта, метапластическая выстилка, по-видимому, не продвигается дальше в пищевод, если пациент лечится от ГЭРБ. Таким образом, с течением времени продолжительность участия в Barrett's обычно остается неизменной.
Если биопсии берутся у пациентов с ГЭРБ, у которых есть нормальная линия Z (без видимых признаков пищевода Барретта), до 30% будут показывать ту же метаплазию кишечного типа с бокаловидными клетками, что и при пищеводе Барретта. Тем не менее, мы не проводим рутинную биопсию нормально выглядящих Z-линий, чтобы найти это изменение, и не проводим наблюдения, когда находим его там. Причина в том, что ограниченная кишечная метаплазия области желудочно-пищеводного соединения при ГЭРБ, по-видимому, встречается с одинаковой частотой у женщин и афроамериканцев, как и у белых мужчин, однако риск явного пищевода Барретта намного меньше, чем у белых мужчин.
Таким образом, наличие метаплазии при обычной биопсии нормальной линии Z при ГЭРБ не должно приводить к каким-либо изменениям в лечении. Более того, обнаружение бокаловидных клеток в этом контексте не следует маркировать, как предполагают некоторые, как ультракороткий сегмент Барретта. Основная причина, по которой его не называют болезнью Барретта, заключается в том, что термин «болезнь Барретта» подразумевает повышенный риск развития рака, и нет никаких доказательств того, что это открытие связано с повышенным риском развития рака.
Тип рака, который возникает при пищеводе Барретта, — аденокарцинома. Рак, возникающий из плоскоклеточной оболочки пищевода, называется плоскоклеточным раком или карциномой. Среди представителей европеоидной расы частота (частота с течением времени) плоскоклеточного рака снижается по сравнению с аденокарциномой, ассоциированной с болезнью Барретта. Однако в других расовых группах (например, афроамериканцы) темпы снижения заболеваемости плоскоклеточным раком не такие, как у аденокарциномы.
Курение и чрезмерное употребление алкоголя являются определенными факторами риска плоскоклеточного рака. Они также являются факторами риска развития аденокарциномы пищевода Барретта. В этой ситуации, однако, неясно, увеличивают ли курение и алкоголь риск развития аденокарциномы, делая ГЭРБ более тяжелой, или же курение и алкоголь оказывают более прямое канцерогенное воздействие, как это происходит при плоскоклеточном раке. Плоскоклеточный рак становится все менее распространенным, в то время как число диагнозов аденокарциномы растет. Заболеваемость аденокарциномой у белых мужчин возросла более резко, чем в других этнических группах.
В оставшейся части этого раздела термин «рак пищевода» будет относиться к аденокарциноме, возникающей из пищевода Барретта.
Рак желудочно-пищеводного перехода также называют раком кардии, потому что область, где пищевод встречается с желудком, называется кардией. Этот рак, как и ассоциированная с болезнью Барретта аденокарцинома, обнаруживается преимущественно у белых мужчин, его частота, по-видимому, увеличивается с той же скоростью, что и рак пищевода, и связана с хронической ГЭРБ. Поэтому было высказано предположение, что рак кардии начинается с коротких сегментов (например, 1-2 см) кардиального отдела Барретта. Однако к тому времени, когда будет поставлен диагноз рака, опухоль может распространиться за пределы короткого сегмента опухоли Барретта и может оказаться в кардии. Однако это предположение о происхождении рака кардии еще предстоит доказать.
Увеличение частоты аденокарциномы пищевода наблюдается не менее 20 лет, преимущественно у белых мужчин. Один ключ к разгадке причины этой тенденции может быть связан с уменьшением частоты H. пилори инфицирование желудка. Другими словами, у людей с раком Барретта, включая рак кардии, частота H. пилори инфекции, чем другие лица того же возраста и пола в той же популяции.
Х. пилори это тип бактерий, который является основной причиной язв. Это очень распространенная инфекция во всем мире, которая не вызывает никаких симптомов у подавляющего большинства больных. Однако некоторые люди с H. пилори развивается язвенная болезнь желудка и двенадцатиперстной кишки. Эти язвы лечатся путем уничтожения бактерий, что, в свою очередь, предотвращает рецидив язвы.
Если Х. пилори Если его не лечить, он вызывает прогрессирующее воспаление желудка (гастрит), которое связано со снижением секреции кислоты и, возможно, меньшим рефлюксом кислоты в пищевод. Во многих регионах мира частота этой инфекции снижается, предположительно, из-за более эффективных мер общественного здравоохранения. Следовательно, возможно, что защитный эффект (например, снижение выработки кислоты) хронической H. пилори инфекции стало меньше. Другими словами, с меньшим H. пилори гастрита, желудок вырабатывает больше кислоты, и больше кислоты попадает в пищевод. В то же время мы более предрасположены к рефлюксу в старшем возрасте. Хотя это не решенный вопрос, снижение частоты H. пилори инфекция может быть одной из причин увеличения частоты аденокарциномы, ассоциированной с болезнью Барретта.
Дисплазия — это изменение клеток, выстилающих пищевод, при котором клетки действительно демонстрируют аномальные изменения в своей структуре и внешнем виде. Когда эти изменения становятся достаточно серьезными (переход от дисплазии низкой степени к высокой степени), клетки начинают казаться злокачественными (как раковые клетки). Однако, в отличие от рака, эти клетки остаются на месте и не проникают в ткани за пределы слизистой оболочки. Дисплазия возникает как серия клеточных изменений по мере прогрессирования пищевода Барретта в рак, ассоциированный с болезнью Барретта. Пациенты с болезнью Барретта находятся под наблюдением с помощью эндоскопии и биопсии (наблюдение) для выявления этих клеточных изменений (дисплазии) или, в худшем случае, раннего рака, чтобы их можно было лечить. В настоящее время невозможно предсказать, у каких пациентов с пищеводом Барретта разовьется дисплазия.
Дисплазия также была выявлена рядом с опухолями желудочно-кишечного тракта, кроме аденокарциномы пищевода. Например, дисплазия встречается в половине случаев рака желудка и рака толстой кишки, при которых дисплазия видна в виде так называемых аденоматозных полипов. Кроме того, дисплазия является тем же ранним предупреждающим изменением клеток, которое патологоанатомы ищут в мазках Папаниколау шейки матки, которые предсказывают рак шейки матки.
Дисплазию считают предраковым состоянием. Это означает, что если дисплазия была продемонстрирована несколько раз, считается, что у пациента разовьется рак, если он или она проживет достаточно долго. Дисплазия классифицируется как высокая или низкая степень. Когда диагностирована дисплазия высокой степени, рак может уже присутствовать, а если нет, то риск развития рака раньше выше, чем при более низкой степени дисплазии.
При последующем биопсии пациентов с дисплазией состояние может не обнаруживаться снова у некоторых пациентов, тогда как у других обнаруживаются низкие степени дисплазии. Это отсутствие или уменьшение дисплазии может быть связано с такими факторами, как вариации образцов, удаление крошечных очагов (групп клеток) дисплазии при первоначальной биопсии или фактическая биологическая реверсия. Точные причины неизвестны.
Используя молекулярные методы, некоторые изменения, называемые биомаркерами, могут быть обнаружены в образцах биопсии до того, как разовьется дисплазия. Эти изменения аналогичны тем, которые наблюдаются при других видах рака. Биомаркеры включают изменения в составе ДНК клеток, в генах и хромосомах, а также в факторах роста. Можно показать, что ряд этих биомаркеров появляется до и во время возникновения дисплазии. Конечная цель состоит в том, чтобы найти волшебный маркер, который может сказать нам, у каких пациентов из тех, у кого нет дисплазии или дисплазии низкой степени, с большей вероятностью разовьется дисплазия высокой степени или рак. Затем за такими пациентами можно наблюдать более тщательно, чем за другими.
В настоящее время все больные с пищеводом Барретта с точки зрения наблюдения лечатся одинаково. Наличие биомаркеров позволило бы разделить (стратифицировать) пациентов с болезнью Барретта в зависимости от риска развития у них рака. Такая стратификация позволила бы врачам чаще проводить контрольную эндоскопию и биопсию у меньшинства пациентов с повышенным риском развития рака и реже у пациентов с более низким риском развития рака.
Другое использование проверенных биомаркеров может помочь подтвердить интерпретацию патологоанатомом дисплазии при биопсии.
Когда пациентов с пищеводом Барретта оценивают как группу, было обнаружено, что риск развития рака составляет всего один из 300 пациентов в год. Это означает, что если бы мы ежегодно обследовали 300 пациентов, то каждый год у одного пациента обнаруживали бы рак. Что нам действительно нужно знать, так это риск развития рака, если дисплазия не будет обнаружена после одного или двух лет наблюдения. Мы считаем, что этот риск будет намного меньше, чем ранее приводившиеся цифры:один случай на 300 пациентов в год.
У пациентов с дисплазией высокой степени часто обнаруживается рак. Таким образом, в первую очередь при обнаружении дисплазии высокой степени необходимо исключить наличие аденокарциномы.
Дисплазия низкой степени представляет гораздо меньшую угрозу, чем дисплазия высокой степени, но мы не знаем, насколько менее. На самом деле, у нас нет точных данных, чтобы указать, каков риск рака у пациентов с дисплазией Барретта и дисплазией низкой степени.
Диагноз дисплазии должен быть максимально точным, поскольку этот диагноз может потребовать изменения лечения или интенсивности наблюдения за пациентами с пищеводом Барретта. Требуется большой опыт, чтобы поставить точный диагноз наличия и степени дисплазии. Таким образом, является обычной и полезной практикой просить второго патологоанатома (или даже третьего, если необходимо) просмотреть результаты биопсии. Идея состоит в том, чтобы увидеть, есть ли согласие между патологоанатомами, и/или получить более опытное мнение о наличии и степени дисплазии.
Если у человека более длинный сегмент Барретта, можно предположить, что риск рака выше, чем при более коротком сегменте Барретта. Однако данные в этом отношении противоречивы. По этой причине текущая практика заключается в проведении эндоскопической биопсии с одинаковой частотой у пациентов с коротким и длинным сегментом пищевода Барретта.
Пищевод Барретта не имеет уникальных симптомов. У больных с синдромом Барретта наблюдаются симптомы ГЭРБ (например, изжога, регургитация, тошнота и др.). Общая тенденция состоит в том, что пациенты с болезнью Барретта имеют более тяжелую ГЭРБ. Однако не у всех пациентов с болезнью Барретта есть выраженные симптомы ГЭРБ, а у некоторых пациентов выявляют случайно с минимальными симптомами ГЭРБ или без них.
Изжога — это ощущение жжения за грудиной, обычно в нижней половине, но может распространяться и на горло. Иногда это сопровождается жжением или болью в подложечной области чуть ниже конца грудины. Вторым наиболее частым симптомом является срыгивание (регургитация) горькой на вкус жидкостью. Симптомы ГЭРБ часто ухудшаются после еды и в положении лежа.
Рефлюксная, срыгиваемая жидкость иногда может попадать в легкие или голосовой аппарат (гортань), что приводит к так называемым экстраэзофагеальным (вне пищевода) симптомам (проявлениям) ГЭРБ. Эти симптомы включают:
По не совсем понятным причинам у некоторых пациентов с ГЭРБ изжога минимальна, но наблюдаются другие симптомы ГЭРБ, например внепищеводные симптомы.
ГЭРБ может привести к стриктурам и изъязвлениям пищевода. Стриктура или сужение возникают из-за рубцевания (фиброза) пищевода, что может вызывать затруднения при глотании (дисфагия). Дисфагия ощущается как застревание (застревание) твердой пищи в груди (в пищеводе) и жидкости при сильном сужении. Стриктуры можно лечить, растягивая их расширителями во время эндоскопии. При отсутствии лечения стриктуры могут способствовать большему попаданию пищи и/или желудочного сока в легкие. В редких случаях может возникнуть массивное желудочно-кишечное (ЖК) кровотечение, вызванное воспалением пищевода. Такое кровотечение приводит к рвоте кровью или стулу черного или бордового цвета. Однако чаще воспаленный пищевод может вызывать медленное кровотечение, которое обнаруживается при обнаружении анемии (низкое количество эритроцитов) и/или анализе стула на наличие крови.
Медикаментозное лечение симптомов пищевода Барретта такое же, как и при ГЭРБ.
Подавление кислоты является основой лечения ГЭРБ. При легких симптомах рефлюкса обычно используются безрецептурные лекарства, начиная от антацидов и заканчивая низкими дозами препаратов, называемых антагонистами Н-2-рецепторов или блокаторами Н-2. Примерами безрецептурных Н2-блокаторов являются циметидин (Тагамет) и фамотидин (Пепцид, Зантак 360). Для более стойких симптомов можно использовать более высокие (рецептурные) дозы препаратов-антагонистов рецепторов Н-2, например:
Однако при стойких симптомах, требующих поддерживающей (постоянной) терапии, или при осложненной ГЭРБ со стриктурами или кровотечениями применяют ингибиторы протонной помпы (ИПП). Примеры ИЦП:
Некоторым пациентам необходимо принимать только одну таблетку в день, в то время как другим требуется две таблетки (двойная доза) для контроля симптомов. Двойную дозу можно принимать по одной таблетке два раза в день или по 2 таблетки один раз в день.
ИПП являются мощными ингибиторами секреции кислоты из желудка. Они эффективны для облегчения изжоги и лечения воспалений пищевода (эзофагита) и язв пищевода, вызванных кислотным рефлюксом. ИПП хорошо переносятся и имеют мало побочных эффектов. После прекращения приема этих препаратов симптомы кислотного рефлюкса обычно повторяются, иногда с повышенной интенсивностью. Это усиление симптомов происходит частично из-за рикошетной секреции кислоты (гиперсекреция кислоты), которая является реакцией, вызванной восстановлением после ингибирования секреции кислоты ИПП.
Долгосрочная безопасность ИПП является важным фактором. Хотя в экспериментах на старых крысах-самках сообщалось об определенных опухолях желудка (карциноидах), подобные опухоли не наблюдались у людей после более чем 15-летнего использования ИПП. У некоторых людей, получающих длительную терапию ИПП, в верхней половине желудка могут развиваться небольшие доброкачественные полипы (полипы фундальных желез). However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. These include:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Каковы 7 типов какашек? Бристольская таблица стула
Кала может различаться по цвету, запаху, количеству и текстуре. Узнайте, какие из 7 типов какашек полезны, а какие могут указывать на проблему Фекалии могут различаться по цвету, запаху, количеству и
Каковы 7 типов какашек? Бристольская таблица стула
Кала может различаться по цвету, запаху, количеству и текстуре. Узнайте, какие из 7 типов какашек полезны, а какие могут указывать на проблему Фекалии могут различаться по цвету, запаху, количеству и
 Синдром короткой кишки
На этой странице: Что такое синдром короткой кишки Что такое тонкий кишечник? Что такое толстая кишка? Что вызывает синдром короткой кишки? Насколько распространен синдром короткой кишки? Каковы при
Синдром короткой кишки
На этой странице: Что такое синдром короткой кишки Что такое тонкий кишечник? Что такое толстая кишка? Что вызывает синдром короткой кишки? Насколько распространен синдром короткой кишки? Каковы при
 Может ли СРК убить вас
На этой неделе (23 октября) серия прямых трансляций #AskADietitian в Facebook — я отвечаю на сообщения СМИ о смерти Майкла Найта — может ли IBS убить вас? Я также расскажу об определении пребиотиков и
Может ли СРК убить вас
На этой неделе (23 октября) серия прямых трансляций #AskADietitian в Facebook — я отвечаю на сообщения СМИ о смерти Майкла Найта — может ли IBS убить вас? Я также расскажу об определении пребиотиков и