 10% van de patiënten met GERD ontwikkelt Barrett-slokdarm, een risicofactor voor kanker van de slokdarm.
10% van de patiënten met GERD ontwikkelt Barrett-slokdarm, een risicofactor voor kanker van de slokdarm.

Barrett's slokdarm heeft geen unieke symptomen. Patiënten met de ziekte van Barrett hebben de volgende symptomen van GERD of zure reflux:
Barrett-slokdarm is een complicatie van chronische gastro-oesofageale refluxziekte (GERD), voornamelijk bij blanke mannen. GERD is een ziekte waarbij zure vloeistof uit de maag terugvloeit naar de slokdarm (de slikbuis). GERD veroorzaakt meestal brandend maagzuur.
Er zijn twee vereisten voor de diagnose van Barrett-slokdarm. De vereisten vereisen een endoscopie van de slokdarm. Tijdens endoscopie wordt een lange flexibele buis met een lamp en camera aan de punt (een endoscoop) door de mond en naar beneden in de slokdarm ingebracht om de bekleding van de slokdarm te bekijken en biopsie te nemen (weefselmonster). De twee vereisten zijn:
Barrett's slokdarm is officieel gecodeerd door de Library of Congress voor elektronische zoekopdrachten van de literatuur als Barrett-slokdarm, maar Barrett's slokdarm (met de apostrof "s") is de naam die universeel wordt gebruikt. De aandoening is vernoemd naar een chirurg, Norman Barrett, die de aandoening beschreef. Het blijkt echter dat zijn interpretatie van de bevindingen niet correct was. In 1953 beschreven de artsen Allison en Johnstone deze aandoening zoals we die nu begrijpen, namelijk dat er metaplasie plaatsvond. (Metaplasie, die hieronder wordt besproken, is de term die wordt gebruikt wanneer het ene volwassen weefsel het andere vervangt.) Desalniettemin is de aandoening vereeuwigd met de naam van Barrett.
Aanvankelijk werd gedacht dat de slokdarm van de Barrett bestond uit maagweefsel (maagweefsel) dat het gebruikelijke plaveiselweefsel langs de slokdarm verving. Halverwege de jaren 70 publiceerden Dr. Paull en collega's echter een paper waarin ze het slijmvlies (binnenbekleding) van Barrett's slokdarm gedetailleerder beschreven dan eerder was gedaan. Ze wezen erop dat de slokdarm van Barrett bestond uit een metaplasie waarin de normale cellen die de slokdarm bekleden, werden vervangen door een mengsel van maag- en darmwandcellen. De bekledingscellen van het darmtype worden ook gespecialiseerde kolomcellen genoemd, waaronder slijmbekercellen. Een aantal jaren lang dachten sommige wetenschappers dat er twee soorten Barrett's waren; een waarin de normale voering werd vervangen door alleen maag (maag) cellen, en de tweede waarin darmcellen aanwezig waren. De huidige overtuiging is echter dat alleen de aanwezigheid van slijmbekercellen van het darmtype de diagnose van Barrett's slokdarm stelt, ongeacht welke andere celtypen aanwezig zijn.
De reden voor de grote belangstelling voor Barrett's slokdarm is dat het geassocieerd is met een verhoogd risico op kanker van de slokdarm. Het type kanker dat optreedt bij patiënten met de ziekte van Barrett is adenocarcinoom, dat ontstaat uit het metaplastische darmweefsel. De gebruikelijke kanker van de slokdarm die niet geassocieerd is met Barrett's is plaveiselcarcinoom, dat ontstaat uit de plaveiselcelbekleding die normaal in de slokdarm aanwezig is. Het verband tussen adenocarcinoom van de slokdarm en Barrett-slokdarm is nu duidelijk en adenocarcinoom van de slokdarm neemt in de meeste landen van het westelijk halfrond in frequentie toe.
Het goede nieuws is echter dat de kanker bij relatief weinig patiënten met een Barrett-slokdarm voorkomt. Toch is de belangrijkste uitdaging bij deze aandoening om te letten op vroege waarschuwingssignalen van kanker door met regelmatige tussenpozen tijdens endoscopie biopsieën te nemen. Deze praktijk wordt surveillance genoemd en is in principe vergelijkbaar met de surveillance bij vrouwen voor baarmoederhalskanker, waarbij met regelmatige tussenpozen PAP-uitstrijkjes worden gemaakt.
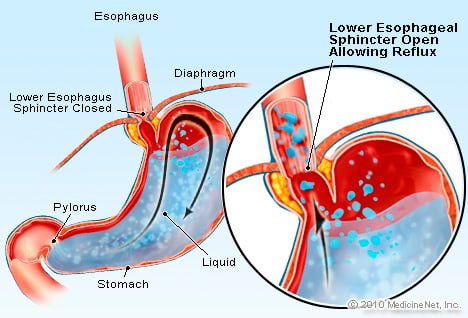
 GERD is een aandoening waarbij overmatige zuurbevattende vloeistof terugvloeit (vloeit) in de slokdarm, gedeeltelijk omdat de onderste slokdarmsfincter is zwak.
GERD is een aandoening waarbij overmatige zuurbevattende vloeistof terugvloeit (vloeit) in de slokdarm, gedeeltelijk omdat de onderste slokdarmsfincter is zwak. GERD veroorzaakt de slokdarm van Barrett. De slokdarm is een gespierde buis die zich in de borstkas bevindt en dient om voedsel van de mond naar de maag over te brengen. De onderste slokdarmsfincter (LES) is een klep die zich op de kruising van de maag met de slokdarm bevindt. Zijn functie is om te voorkomen dat zuur en andere maaginhoud terug in de slokdarm terechtkomt. GERD is een aandoening waarbij overmatige zuurbevattende vloeistof terugvloeit (vloeit) in de slokdarm, gedeeltelijk omdat de onderste slokdarmsfincter zwak is. De zwakte van de LES kan gedeeltelijk verband houden met het feit dat vrijwel alle GERD-patiënten een hiatale hernia hebben. Bij patiënten met hiatale hernia schuift de bovenste paar centimeter van de maag heen en weer tussen de buik en de borstkas door het middenrif. Dit glijden kan interfereren met hoe de sluitspier werkt als een barrière tegen reflux van de maag naar de slokdarm.
Voorheen werd de term hernia gebruikt in plaats van GERD om patiënten de basis van hun symptomen (meestal brandend maagzuur) uit te leggen, omdat vrijwel alle GERD-patiënten hiatale hernia's hebben. GERD is echter de nauwkeuriger term. Hoewel hiatale hernia's zeer vaak voorkomen bij de bevolking, ontwikkelt slechts een klein aantal mensen met hiatale hernia GERD. Met andere woorden, de aanwezigheid van een hiatale hernia betekent niet dat de persoon GERD zal ontwikkelen. Aan de andere kant, als een persoon GERD heeft, is hiatale hernia bijna altijd aanwezig.
Zo wordt de slokdarm van Barrett veroorzaakt door chronische (van vele jaren) en gewoonlijk ernstige zure reflux. Bij sommige patiënten met GORZ reageert de slokdarm op de herhaalde verwonding door de zure vloeistof door het type cellen dat het bekleedt te veranderen van plaveisel (normale cellen) in kolomvormig (intestinale cellen). Deze transformatie, metaplasie genaamd, wordt beschouwd als een beschermende reactie omdat het gespecialiseerde kolomepitheel (epitheel betekent voering) in de slokdarm van Barrett beter bestand is tegen schade door zuur dan het plaveiselepitheel.
De vloeistof in de maag bevat zuur dat door de maag wordt geproduceerd. Daarnaast kan de vloeistof echter galzuren (van gal geproduceerd door de lever) en enzymen (geproduceerd door de pancreas) bevatten die vanuit de twaalfvingerige darm in de maag zijn teruggevloeid. (De twaalfvingerige darm is het eerste deel van de dunne darm net voorbij de maag.) Het zuur dat terugvloeit van de maag naar de slokdarm is schadelijk voor de slokdarm. Er zijn echter aanwijzingen dat de gal- en pancreasenzymen in combinatie met het zuur schadelijker kunnen zijn dan zuur alleen.
Een aanzienlijk percentage van de personen met chronische symptomen van GERD ontwikkelt de Barrett-slokdarm en komt het meest voor bij blanke mannelijke populaties. Niet iedereen met GERD heeft echter symptomen van GERD. Daarom weten sommige mensen met Barrett's niet dat ze Barrett's hebben omdat ze GERD hebben zonder enige symptomen of zeer milde en zeldzame symptomen hebben.
Het is onduidelijk waarom de slokdarm van Barrett zo overweldigend vaker voorkomt bij blanke mannen dan bij welke andere groep dan ook. Hoewel vrouwen en Afro-Amerikanen bijvoorbeeld niet lijken te worden beschermd tegen het ontwikkelen van GERD, zijn ze grotendeels beschermd (vooral Afro-Amerikanen) tegen het ontwikkelen van Barrett-slokdarm en Barrett-kanker (adenocarcinoom). Er zijn aanwijzingen dat op het westelijk halfrond slokdarmkanker en kanker van de gastro-oesofageale overgang (cardia kanker genoemd) in frequentie toenemen, misschien meer dan enige andere kanker van het maagdarmkanaal. (Darmkanker komt echter nog steeds veel vaker voor dan slokdarmkanker.)
De slokdarm van Barrett kan in sommige families voorkomen en genetisch bepaald zijn. Er zijn onderzoeken aan de gang om te bepalen of er genen of markers in deze families kunnen worden gevonden die de ontwikkeling van Barrett's slokdarm in de algemene bevolking zouden kunnen voorspellen. In deze families met zowel Barrett's als Barrett's in de algemene bevolking is GERD de gemeenschappelijke noemer. De vraag is echter waarom de Barrett's vaker voorkomt in deze families dan in andere met vergelijkbare ernstige GERD, maar zonder familieverband.
Om te herhalen, het eerste criterium voor de diagnose van Barrett-slokdarm is de vondst bij endoscopie van een roze voering in de slokdarm waar het normaal niet wordt gezien. Deze abnormale voering kan in de omtrek lijken op een band, tongachtig of als eilanden. Het tweede criterium is dat biopsieën van het roze slijmvlies het karakteristieke ingewandsslijmvlies (het slijmvlies dat normaal in de darmen wordt gezien) met de typische slijmbekercellen onthullen. De slokdarmbiopten worden verkregen tijdens een endoscopie. Een bovenste gastro-intestinale endoscopie is een procedure waarbij de arts een lange flexibele buis (endoscoop) door de mond en naar beneden in de slokdarm steekt om de bekleding van de slokdarm direct te visualiseren. Tijdens hetzelfde endoscopisch onderzoek kunnen ook de maag en de twaalfvingerige darm worden gevisualiseerd. Via de endoscoop kunnen meerdere kleine monsters (biopsieën) van het voeringepitheelweefsel worden verkregen.
Zoals eerder vermeld, wordt het proces van vervanging van het ene type weefselbekleding door een ander metaplasie genoemd. In de maag en darmen is metaplasie een veel voorkomende reactie op bepaalde soorten letsel. Zoals Henry Appelman, een patholoog, zei:"Als de darm onder stress staat, wil het iets anders zijn." Andere voorbeelden van metaplasie waarbij het ene slijmvlies het andere vervangt, zijn:(1) in de maag waar chronische ontsteking (gastritis) kan resulteren in een slijmvlies van het darmtype dat delen van het normale maagslijmvlies vervangt; en (2) in de twaalfvingerige darm (net voorbij de maag in de darm) waar maagzweren optreden en de darmwand rond de zweer verandert in maagachtige bekleding.
Wij zijn van mening dat het proces van metaplasie een beschermende of adaptieve reactie is op verwonding van het slijmvlies. Het nadeel van metaplasie is echter dat het in de slokdarm van Barrett een kleine maar duidelijke toename van het risico op kanker met zich meebrengt. Niet alle metaplasieën hebben een verhoogd risico op kanker. Van de twee in de vorige paragraaf genoemde metaplasieën kan bijvoorbeeld darmmetaplasie in de maag leiden tot kanker, maar darmmetaplasie in de twaalfvingerige darm niet.
Het proces van het ontwikkelen van Barrett's begint op de kruising van de maag en de slokdarmvoering. De slokdarm is normaal gesproken bekleed met een plaveiselepitheel of voeringlaag. Dit plaveiselepitheel heeft een parelwit uiterlijk, terwijl de bekleding in de maag en darmen een meer zalmroze kleur heeft omdat het een zuilvormig epitheel is in plaats van een plaveiselepitheel. Het plaveiselepitheel bestaat uit platte plaveisele cellen, die lijken op huidcellen. Het maag- of maagslijmvlies bestaat uit grotere zuilvormige cellen zoals te zien onder de microscoop. De kruising van het plaveiselepitheel van de slokdarm en het maag-kolomepitheel vindt plaats op de kruising van de slokdarm en de maag waar, zoals u zich herinnert, de onderste slokdarmsfincter zich bevindt. De gemeenschappelijke grens (interface) van deze twee voeringen wordt vaak de Z-lijn genoemd, omdat deze er tijdens een endoscopie zigzag uitziet.
Bij progressieve beschadiging van de slokdarm treedt metaplasie op en beweegt het metaplastische weefsel omhoog in de slokdarm over een afstand die van persoon tot persoon varieert, gewoonlijk van ongeveer 0,5 tot 2,5 inch (ongeveer 1 tot 6 centimeter). Het type cel dat aanleiding geeft tot het metaplastische weefsel is niet bekend.
Barrett's slokdarm wordt vaak onderverdeeld in Barrett's met een kort of lang segment, op basis van de lengte van de slokdarm die is aangetast. Kort segment Barrett's verwijst over het algemeen naar betrokkenheid van 3 centimeter of minder, terwijl lang segment betrokkenheid van meer dan 3 centimeter van de slokdarm betekent. Interessant is dat als de Barrett-slokdarm eenmaal bij een patiënt is gediagnosticeerd, de metaplastische voering niet verder in de slokdarm lijkt te vorderen als de patiënt wordt behandeld voor GERD. Dus na verloop van tijd blijft de duur van de betrokkenheid bij Barrett's over het algemeen hetzelfde.
Als biopsieën worden genomen van patiënten met GERD die een normaal lijkende Z-lijn hebben (geen zichtbaar bewijs van Barrett's slokdarm), zal tot 30% dezelfde intestinale metaplasie met slijmbekercellen vertonen als die worden gezien in Barrett's slokdarm. We doen echter niet routinematig biopsie van normaal verschijnende Z-lijnen om naar deze verandering te zoeken, en we doen ook geen bewaking als we het daar vinden. De reden is dat beperkte intestinale metaplasie van de gastro-oesofageale overgangsregio in GERD met dezelfde frequentie lijkt voor te komen bij vrouwen en Afro-Amerikanen als bij blanke mannen, maar het risico op openlijke Barrett-slokdarm is veel minder dan bij blanke mannen.
Daarom mag de aanwezigheid van metaplasie op een routinebiopsie van een normaal verschijnende Z-lijn in GERD niet leiden tot enige verandering in het management. Bovendien moet de vondst van slijmbekercellen in deze context niet worden bestempeld als Barrett's met ultrakort segment, zoals sommigen hebben gesuggereerd. De belangrijkste reden om het niet als Barrett's te bestempelen, is dat de term Barrett's een verhoogd risico op kanker impliceert, en er is geen bewijs dat deze bevinding verband houdt met een verhoogd risico op kanker.
Het type kanker dat optreedt bij de slokdarm van Barrett is adenocarcinoom. Kanker die voortkomt uit de plaveiselbekleding van de slokdarm wordt plaveiselkanker of carcinoom genoemd. Bij blanken neemt de frequentie (frequentie in de tijd) van plaveiselkanker af ten opzichte van met Barrett geassocieerd adenocarcinoom. Andere raciale groepen (bijvoorbeeld Afro-Amerikanen) hebben echter niet dezelfde mate van achteruitgang van plaveiselkanker ervaren in vergelijking met adenocarcinoom.
Roken en overmatig alcoholgebruik zijn duidelijke risicofactoren voor plaveiselkanker. Ze zijn ook risicofactoren voor adenocarcinoom in de slokdarm van Barrett. In deze situatie is het echter niet duidelijk of roken en alcohol het risico op adenocarcinoom verhogen door GERD ernstiger te maken of dat roken en alcohol een directer kankerverwekkend effect hebben, zoals bij plaveiselkanker. Plaveiselcelcarcinomen komen steeds minder vaak voor, terwijl diagnoses van adenocarcinoom zijn gestegen. De incidentie van adenocarcinoom bij blanke mannen is sterker gestegen dan bij andere etnische groepen.
In de rest van deze sectie zal de term slokdarmkanker verwijzen naar adenocarcinoom dat voortkomt uit de Barrett-slokdarm.
Kanker van de gastro-oesofageale overgang wordt ook cardia-kanker genoemd omdat het gebied waar de slokdarm de maag ontmoet de cardia wordt genoemd. Deze vorm van kanker, zoals het met Barrett geassocieerde adenocarcinoom, komt voornamelijk voor bij blanke mannen, lijkt in frequentie toe te nemen in hetzelfde tempo als slokdarmkanker, en is geassocieerd met chronische GORZ. Daarom is gespeculeerd dat hartkanker begint bij korte segmenten (bijvoorbeeld 1-2 cm) van Barrett's. Tegen de tijd dat de diagnose kanker wordt gesteld, kan de tumor zich echter buiten het korte segment van Barrett's hebben verspreid en lijkt het alsof hij zich in de cardia bevindt. Deze speculatie over de oorsprong van kanker van de cardia moet echter nog worden bewezen.
Een toename van de frequentie van adenocarcinoom van de slokdarm is gedurende ten minste 20 jaar waargenomen, voornamelijk bij blanke mannen. Een aanwijzing voor de reden voor deze trend kan verband houden met een afname van de frequentie van H. pylori infectie van de maag. Met andere woorden, mensen met Barrett-kanker, waaronder hartkanker, lijken een lagere kans op H te hebben. pylori infectie dan anderen van dezelfde leeftijd en hetzelfde geslacht in dezelfde populatie.
H. pylori is een type bacterie dat een belangrijke oorzaak is van zweren. Het is wereldwijd een veel voorkomende infectie en veroorzaakt bij de overgrote meerderheid van de getroffen mensen geen symptomen. Sommige mensen met H. pylori een maagzweer van de maag en de twaalfvingerige darm ontwikkelen. Deze zweren worden behandeld door de bacteriën te elimineren, wat op zijn beurt terugval van de zweren voorkomt.
Als H. pylori onbehandeld blijft, veroorzaakt het een progressieve ontsteking van de maag (gastritis) die gepaard gaat met een verminderde zuursecretie en mogelijk minder terugvloeiing van zuur in de slokdarm. In veel delen van de wereld neemt deze infectie in frequentie af, vermoedelijk door betere volksgezondheidsmaatregelen. Daarom is het mogelijk dat het beschermende effect (zoals verminderde zuurproductie) van chronische H. pylori infectie is afgenomen. Met andere woorden, met minder H. pylori gastritis, de maag produceert meer zuur en er is meer zuur om terug te vloeien in de slokdarm. Tegelijkertijd zijn we meer vatbaar voor reflux in onze hogere jaren. Hoewel dit geen uitgemaakte zaak is, is de afnemende frequentie van H. pylori infectie kan een reden zijn voor de toenemende frequentie van Barrett-geassocieerd adenocarcinoom.
Dysplasie is een verandering in de cellen die de slokdarm bekleden, waarbij de cellen daadwerkelijk abnormale veranderingen in hun structuur en uiterlijk vertonen. Wanneer deze veranderingen ernstig genoeg worden (van laaggradige naar hooggradige dysplasie), beginnen de cellen kwaadaardig te lijken (zoals kankercellen). In tegenstelling tot kanker blijven deze cellen echter op hun plaats en dringen ze de weefsels buiten de voering niet binnen. Dysplasie treedt op als een reeks celveranderingen als Barrett's slokdarm vordert tot Barrett's-geassocieerde kanker. Patiënten met Barrett's worden gecontroleerd met endoscopie en biopsieën (surveillance) om deze cellulaire veranderingen (de dysplasie) of in het slechtste geval vroege kanker te detecteren, zodat ze kunnen worden behandeld. Momenteel is er geen manier om te voorspellen welke patiënten met Barrett-slokdarm dysplasie zullen ontwikkelen.
Dysplasie is ook geïdentificeerd naast tumoren van het maagdarmkanaal anders dan oesofageaal adenocarcinoom. Zo komt dysplasie voor bij de helft van de gevallen van maagkanker en bij darmkanker, waarbij de dysplasie zichtbaar is als zogenaamde adenomateuze poliepen. Bovendien is dysplasie dezelfde vroege waarschuwingscelverandering waar pathologen naar zoeken in PAP-uitstrijkjes van de baarmoederhals die baarmoederhalskanker voorspellen.
Dysplasie wordt als premaligne beschouwd. Dit betekent dat als dysplasie meermaals is aangetoond, wordt aangenomen dat de patiënt kanker zal krijgen als hij of zij lang genoeg leeft. Dysplasie wordt gecategoriseerd als hooggradig of laaggradig. Wanneer hooggradige dysplasie wordt gediagnosticeerd, kan kanker al aanwezig zijn, en als dat niet het geval is, is het risico om eerder kanker te ontwikkelen groter dan bij de lagere graden van dysplasie.
In vervolgbiopten van patiënten met dysplasie kan de aandoening bij sommige patiënten niet opnieuw worden gedetecteerd, terwijl bij andere lage gradaties van dysplasie worden gevonden. Deze afwezigheid of afname van dysplasie kan te wijten zijn aan factoren zoals variaties in de bemonstering, de verwijdering van kleine foci (groepen cellen) van dysplasie bij de initiële biopsie, of daadwerkelijke biologische omkering. De exacte reden(en) zijn niet bekend.
Met behulp van moleculaire technieken kunnen sommige veranderingen die biomarkers worden genoemd, worden gedetecteerd in biopsiespecimens voordat dysplasie zich ontwikkelt. Deze veranderingen zijn vergelijkbaar met de veranderingen die worden waargenomen bij andere vormen van kanker. Biomarkers omvatten veranderingen in het DNA-gehalte van cellen, in de genen en chromosomen, en in groeifactoren. Van een aantal van deze biomarkers kan worden aangetoond dat ze vóór en tijdens het optreden van dysplasie verschijnen. Het uiteindelijke doel is om een magische marker te vinden die ons kan vertellen welke patiënten zonder dysplasie of laaggradige dysplasie meer kans hebben om hooggradige dysplasie of kanker te ontwikkelen. Dergelijke patiënten kunnen dan nauwer gevolgd worden dan andere.
Op dit moment worden alle patiënten met een Barrett-slokdarm, vanuit het oogpunt van surveillance, op dezelfde manier behandeld. De beschikbaarheid van biomarkers zou Barrett-patiënten scheiden (stratificeren) op basis van hun risico op kanker. Een dergelijke stratificatie zou artsen in staat stellen vaker surveillance-endoscopie en biopsieën uit te voeren bij de minderheid van patiënten met een groter risico op kanker en minder vaak bij patiënten waarvan wordt voorspeld dat ze een lager risico op kanker hebben.
Een ander gebruik van bewezen biomarkers zou zijn om de interpretatie van dysplasie door de patholoog op biopsieën te helpen bevestigen.
Wanneer patiënten met Barrett-slokdarm als groep worden beoordeeld, blijkt het risico op kanker zo laag te zijn als één op de 300 patiënten per jaar. Dit betekent dat als we jaarlijks 300 patiënten zouden onderzoeken, er elk jaar één patiënt kanker zou hebben. Wat we echt moeten weten, is het risico op kanker als er na een of twee jaar toezicht geen dysplasie wordt gevonden. Wij zijn van mening dat dit risico veel kleiner zou zijn dan de eerder geciteerde cijfers van één op de 300 patiënten per jaar.
Patiënten met hooggradige dysplasie kunnen vaak kanker hebben. Daarom is het uitsluiten van de aanwezigheid van een adenocarcinoom de eerste orde van behandeling wanneer hooggradige dysplasie wordt gevonden.
Laaggradige dysplasie is veel minder bedreigend dan hooggradige dysplasie, maar we weten niet hoeveel minder. In feite hebben we geen precieze gegevens om aan te geven wat het kankerrisico precies is bij patiënten met Barrett's en laaggradige dysplasie.
De diagnose dysplasie moet zo nauwkeurig mogelijk zijn, omdat deze diagnose kan leiden tot een verandering in de behandeling of de intensiteit van de follow-up van patiënten met een Barrett-slokdarm. Het vereist veel ervaring om de aanwezigheid en graad van dysplasie nauwkeurig te kunnen diagnosticeren. Daarom is het een gebruikelijke en nuttige praktijk om een tweede patholoog (of zelfs een derde, indien nodig) te vragen de biopsieën te beoordelen. Het idee is om te kijken of er overeenstemming is tussen de pathologen en/of om een meer ervaren mening te krijgen over de aanwezigheid en graad van dysplasie.
Als een persoon Barrett's met een langer segment heeft, zou men kunnen vermoeden dat het kankerrisico groter is dan bij Barrett's met een korter segment. De gegevens zijn in dit opzicht echter controversieel. Om die reden is de huidige praktijk om endoscopische biopsiesurveillance met een vergelijkbare frequentie uit te voeren bij patiënten met een kort en lang segment Barrett-slokdarm.
Barrett's slokdarm heeft geen unieke symptomen. Patiënten met Barrett's hebben de symptomen van GERD (bijvoorbeeld brandend maagzuur, oprispingen, misselijkheid, enz.). De algemene trend is dat Barrett-patiënten ernstigere GERD hebben. Niet alle Barrett's hebben echter duidelijke symptomen van GERD en sommige patiënten worden per ongeluk gedetecteerd met minimale of geen symptomen van GERD.
Maagzuur is een branderig gevoel achter het borstbeen, meestal in de onderste helft, maar kan zich helemaal tot aan de keel uitstrekken. Soms gaat het gepaard met een branderig gevoel of pijn in de maagkuil net onder waar het borstbeen eindigt. Het tweede meest voorkomende symptoom is regurgitatie (back-up) van bitter smakende vloeistof. GERD-symptomen zijn vaak erger na de maaltijd en wanneer ze plat liggen.
De terugvloeiende, uitgebraakte vloeistof kan af en toe de longen of het strottenhoofd (strottenhoofd) binnendringen, wat resulteert in zogenaamde extra-oesofageale (buiten de slokdarm) symptomen (manifestaties) van GERD. Deze symptomen zijn onder meer:
Om redenen die niet volledig worden begrepen, hebben sommige GERD-patiënten minimaal brandend maagzuur, maar ervaren ze andere GERD-symptomen, bijvoorbeeld extra-oesofageale symptomen.
GERD kan leiden tot vernauwingen en ulceratie van de slokdarm. Een vernauwing of vernauwing wordt veroorzaakt door littekenvorming (fibrose) van de slokdarm die slikproblemen kan veroorzaken (dysfagie). De dysfagie wordt waargenomen als een kleven (stoppen) van vast voedsel in de borst (in de slokdarm) en vloeistoffen wanneer de vernauwing ernstig is. Stricturen kunnen worden behandeld door ze tijdens endoscopie op te rekken met dilatatoren. Onbehandelde vernauwingen kunnen leiden tot meer morsen van voedsel en/of maagvloeistoffen in de longen. Soms kunnen massieve gastro-intestinale (GI) bloedingen veroorzaakt door ontsteking van de slokdarm optreden. Een dergelijke bloeding resulteert in braken van bloed of passage van zwarte of kastanjebruine ontlasting. Vaker echter kan een ontstoken slokdarm een langzame bloeding veroorzaken die wordt gedetecteerd wanneer bloedarmoede (een laag aantal rode bloedcellen) wordt gevonden en/of de ontlasting wordt getest op bloed.
De medische behandelingen voor de symptomen van Barrett's slokdarm zijn dezelfde als die voor GERD.
De onderdrukking van zuur is de ruggengraat van de behandeling van GERD. Voor milde refluxsymptomen worden vaak vrij verkrijgbare medicijnen gebruikt, variërend van antacida tot lage doses geneesmiddelen die H-2-receptorantagonisten of H2-blokkers worden genoemd. Voorbeelden van vrij verkrijgbare H2-blokkers zijn cimetidine (Tagamet) en famotidine (Pepcid, Zantac 360). Voor meer aanhoudende symptomen kunnen hogere (voorgeschreven sterkte) doses van de H-2-receptorantagonisten worden gebruikt, bijvoorbeeld:
Voor aanhoudende symptomen die onderhoudstherapie (voortdurende therapie) vereisen of voor gecompliceerde GERD met stricturen of bloedingen, worden echter protonpompremmers (PPI's) gebruikt. Voorbeelden van PPI's zijn:
Sommige patiënten hoeven slechts één pil per dag in te nemen, terwijl anderen twee pillen (een dubbele dosis) nodig hebben om de symptomen onder controle te houden. De dubbele dosis kan worden ingenomen als één pil tweemaal per dag of als 2 pillen eenmaal per dag.
PPI's zijn krachtige remmers van de zuursecretie uit de maag. Ze zijn effectief bij het verlichten van brandend maagzuur en het genezen van slokdarmontsteking (oesofagitis) en slokdarmzweren die worden veroorzaakt door zure reflux. De PPI's worden goed verdragen met weinig bijwerkingen. Na het stoppen van deze medicijnen komen de symptomen van zure reflux meestal terug, soms met verhoogde intensiteit. Deze toename van symptomen treedt gedeeltelijk op vanwege een rebound-secretie van zuur (zuurhypersecretie), een reactie die wordt veroorzaakt door herstel van de remming van de secretie van zuur door de PPI.
De veiligheid van de PPI's op lange termijn is een belangrijke overweging. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. These include:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Kankerstof van gewone darmmicrobe
Veel voorkomende darmbacteriën dragen kankerverwekkende mutaties, zegt een nieuwe studie gepubliceerd in het tijdschrift Natuur op 27 februari 2020. De achtergrond Er leven biljoenen bacteriën i
Kankerstof van gewone darmmicrobe
Veel voorkomende darmbacteriën dragen kankerverwekkende mutaties, zegt een nieuwe studie gepubliceerd in het tijdschrift Natuur op 27 februari 2020. De achtergrond Er leven biljoenen bacteriën i
 Wat doe je als je maag echt pijn doet?
Als uw maagpijn te wijten is aan gasvorming, een opgeblazen gevoel of zure oprispingen, huismiddeltjes en vrij verkrijgbare medicijnen medicijnen kunnen helpen Het behandelen van maagpijn hangt af va
Wat doe je als je maag echt pijn doet?
Als uw maagpijn te wijten is aan gasvorming, een opgeblazen gevoel of zure oprispingen, huismiddeltjes en vrij verkrijgbare medicijnen medicijnen kunnen helpen Het behandelen van maagpijn hangt af va
 Vroege tekenen en symptomen van Hantavirus Pulmonary Syndrome (HPS)
Hantavirus en hantavirus pulmonair syndroom (HPS) feiten Figuur 1:Afbeelding van Sin Nombre hantavirusdeeltjes; BRON:CDC/D. Loren Ketai, MD Hantavirussen zijn RNA-virussen die door knaagdieren (door
Vroege tekenen en symptomen van Hantavirus Pulmonary Syndrome (HPS)
Hantavirus en hantavirus pulmonair syndroom (HPS) feiten Figuur 1:Afbeelding van Sin Nombre hantavirusdeeltjes; BRON:CDC/D. Loren Ketai, MD Hantavirussen zijn RNA-virussen die door knaagdieren (door